Инструментальные методы оценки функциональной способности почек DOI: 10.29188/2222-8543-2023-16-2-76-85
- Просянников М.Ю. – д.м.н., зав. отделом мочекаменной болезни НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России; Москва, Россия; РИНЦ Author ID 791050; https://orcid.org/0000‑0003‑3635‑5244
- Казаченко А.В. – д.м.н., заместитель директора по лечебной работе НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России, профессор кафедры урологии и оперативной нефрологии с курсом онкоурологии ФГАОУ ВО «Российский университет дружбы народов»; Москва, Россия; РИНЦ AuthorID 334714; https://orcid.org/0000‑0003‑3198‑5933
- Войтко Д.А. – к.м.н., старший научный сотрудник НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России; Москва, Россия; РИНЦ AuthorID 942353; https://orcid.org/0000‑0003‑1292‑1651
- Константинова О.В. – д.м.н., главный научный сотрудник отдела мочекаменной болезни НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России; Москва, Россия; РИНЦ AuthorID 67996; https://orcid.org/0000‑0002‑2214‑7543
- Анохин Н.В. – к.м.н., старший научный сотрудник отдела мочекаменной болезни НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России; Москва, Россия; РИНЦ AuthorID 8807749; https://orcid.org/0000‑0002‑4341‑4276
- Громов А.И. – д.м.н., профессор, руководитель группы лучевых методов диагностики и лечения отдела онкоурологии НИИ урологии и интервенционной радиологии имени Н.А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России; Москва, Россия; РИНЦ AuthorID 304475
- Сивков А.В. – к.м.н., заместитель директора по научной работе НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России; Москва, Россия; РИНЦ Author ID 622663; https://orcid.org/0000‑0001‑8852‑6485
- Аполихин О.И. – д.м.н., профессор, чл.-корр. РАН, директор НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России; Москва, Россия; РИНЦ Author ID 683661; https://orcid.org/0000‑0003‑0206‑043X
- Каприн А.Д. – академик РАН, д.м.н., профессор, заслуженный врач РФ, член-корреспондент РАО, генеральный директор ФГБУ «НМИЦ радиологии» Минздрава России; Обнинск, Россия; директор МНИОИ им. П. А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, заведующий кафедрой урологии и оперативной нефрологии с курсом онкоурологии медицинского факультета ФГАОУ ВО «Российский университет дружбы народов»; Москва, Россия; РИНЦ AuthorID 96775; https://orcid.org/0000-0001-8784-8415
 2660
2660 ВВЕДЕНИЕ
Хроническая болезнь почек (ХБП) является глобальной проблемой медицины [1]. Около 13% взрослого населения планеты страдают данным заболеванием, при этом ежегодно их количество увеличивается на 5–8% [2]. Длительное латентное течение заболевания, при котором большинство пациентов не знают о наличии у них нарушений функциональной способности почек, является основной причиной прогрессивного роста заболеваемости. К примеру, в США из 37 миллионов человек, имеющих ХБП, только каждый десятый знает о наличии у него заболевания [3].
Для развития ХБП требуется длительное воздействие неблагоприятных факторов, которыми могут выступать артериальная гипертензия, сахарный диабет, ожирение, курение и т. д.) и особенно их сочетание. Кроме того, развитие гломерулярной, капиллярной гипертензии, гиперфильтрации, воспаления мочевыделительной системы, гипоксии, фиброза и других патологических состояний приводят к развитию ХБП [4, 5].
Согласно клиническим рекомендациям Минздрава России по хронической болезни почек, наиболее ранними маркерами, отражающими субклиническое течение хронического нарушения функциональной способности почек, принято считать повышение уровня альбумина в моче и/или снижение скорости клубочковой фильтрации (СКФ) [6]. Между тем, в арсенале диагностической службы существуют инструментальные методы, позволяющие наряду с лабораторными методами обнаружить нарушение функциональной способности почек [7].
На сегодняшний день золотым стандартом инструментального определения функциональной способности почек принято считать динамическую нефросцинтиграфию. Данный метод позволяет определять перфузию и функциональный резерв почек посредством оценки их фильтрационной и экскреторной функции. Однако за счет того, что, как правило, оборудование для нефросцинтиграфии располагается в крупных медицинских центрах, доступность для населения данного метода низкая. В связи с этим, возникает вопрос поиска альтернативных способов, обладающих схожими с нефросцинтиграфией показателями точности, чувствительности и специфичности.
На сегодняшний момент для определения функции почек можно использовать ультразвуковые (УЗИ почек с использованием допплерографии) и рентгенологические (экскреторная урография, компьютерная и позитронно-эмиссионная томография) методы исследований. Также функцию почки можно оценить при помощи магнитно-резонансной томографии. Выбор метода – это не простая задача для клинициста, поскольку нужно учитывать ряд факторов: возможности лечебно-профилактического учреждения (ЛПУ), стоимость исследования, ионизирующее излучение, телосложение пациента и др.
Целью данной работы является обобщение материала исследований отечественных и зарубежных ученых, посвященных изучению возможности использования инструментальных методов исследований для определения функциональной способности почек.
МАТЕРИАЛЫ И МЕТОДЫ
Обзор проведен на основе данных, опубликованных в базах PubMed (https://www.ncbi.nlm.nih.gov/pubmed/) и Научной электронной библиотеки еLibrary.ru (https://elibrary.ru/), и был ограничен только статьями в научных рецензируемых журналах, опубликованными с января 2012 до января 2023 года, по следующим ключевым словам: функция почек (kidney function). УЗИ почек (kidney ultrasound), компьютерная томография (computed tomography), позитронноэмиссионная томография (positron emission tomography), магнитно-резонансная томография (magnetic resonance imaging).
Найдено 189 источников не старше 10 лет, которые имели отношение к теме обзора. Из них были исключены тезисы конференций, короткие сообщения, дублирующиеся публикации. После чего, исходя из актуальности данных, достоверности источников, импакт-факторов журналов и последовательности изложения материала в рукописи, непосредственно для цитирования в обзоре было отобраны 46 статей. Также при написании обзора использовались оригинальные статьи, опубликованные до 2012 года.
РЕЗУЛЬТАТЫ
МЕТОДЫ ОЦЕНКИ ФУНКЦИОНАЛЬНОЙ СПОСОБНОСТИ ПОЧЕК
Ультразвуковое исследование почек
Ультразвуковое исследование почек применяется урологами для диагностики заболеваний мочевыделительной системы давно. Данный метод хорошо себя зарекомендовал при первичном обследовании, поэтому он внедрен практически во всех ЛПУ, позволяет выполнять исследование, невзирая на телосложение пациента, при этом не требует больших финансовых затрат. Однако, несмотря на все вышеперечисленные преимущества, УЗИ имеет и недостатки: фрагментарность исследования и операторозависимость.
Как правило, стандартное ультразвуковое исследование включает в себя обязательное определение размеров почки, толщины паренхимы, эхогенности паренхимы, состояние полостной системы и другие параметры. В руководстве Американского колледжа радиологии указывается, что выявление отклонений в продольном диаметре почки, объеме почки, толщине паренхимы, гиперэхогенности паренхимы и индексе резистентности могут указывать на нарушение функциональной способности почки [8].
Толщина паренхимы – это расстояние между капсулой коры и верхушками пирамид синуса почки. В норме данный показатель составляет 15–25 мм [9]. У пожилых пациентов (старше 60 лет) этот показатель немного ниже – около 11 мм. При выявлении отклонений от референсных значений необходимо незамедлительно определить причину, поскольку такое изменение говорит о нарушении функциональной способности почки (табл. 1).
Таблица1. Причины изменений толщины паренхимы почек
Table 1. Causes of changes in the thickness of the renal parenchyma
| Утолщение паренхимы почек Thickening of the renal parenchyma |
Истончение паренхимы почек Thinning of the renal |
|---|---|
| Острые воспалительные процессы (например, при гломерулонефрите) Acute inflammatory processes (for example, with glomerulonephritis) |
Хронический гломерулонефрит Chronic glomerulonephritis |
| Острый нефротический синдром Acute nephrotic syndrome |
Инфекционные заболевания Infectious diseases |
| Острая почечная недостаточность Acute renal failure |
Хронические воспалительные поражения паренхимы Chronic inflammatory lesions of the parenchyma |
| Кисты почек Kidney cysts |
Новообразования, происходящие из эпителиальной ткани Neoplasms originating from epithelial tissue |
| Опухоли и другие новообразования, происходящие из паренхиматозной ткани Tumors and other neoplasms originating from parenchymal tissue |
Гидронефроз Hydronephrosis |
| Компенсаторная (викарная) гипертрофия почки Compensatory (vicar) hypertrophy of the kidney |
Изменение толщины паренхимы, также, как и общей длины почки, указывает на хронический характер почечной недостаточности. У некоторых пациентов с толщиной паренхимы от 1,5 до 1,0 см еще сохранен потенциал для улучшения функции почек, однако при толщине менее 1,0 см он практически потерян [10]. Толщина паренхимы сильнее, чем продольный размер, коррелирует со скоростью клубочковой фильтрации (СКФ) [11].
Но не только толщина, но и гиперэхогенность паренхимы может косвенно говорить о снижении функциональной способности почек. В работе M. Meola и соавт. продемонстрировано, что у пациентов с ХБП корковая эхогенность прогрессивно увеличивается с уменьшением толщины паренхимы. При этом эти два состояния сосуществуют даже в случае нормального продольного размера почки [12]. Несмотря на это, гиперэхогенность плохо коррелирует с характером заболевания почек, что не позволяет использовать этот ультразвуковой параметр в качестве доказательства снижения их функциональной способности [13].
УЗИ почки, проведенное в серошкальном режиме (В-режим), зачастую оказывается неполным или вводящим в заблуждение: отек паренхимы, расширение полостной системы почки могут быть обусловлены как обструктивным, так и не обструктивным компонентом, за счет остаточной дилатации при гидронефротической трансформации пиелонефрита или рефлюкса. В связи с этим, наряду с В-режимом, начиная с 90-х годов, состояние паренхимы почки исследуется с использованием допплеровского картирования.
Допплеровское картирование позволяет определить характер кровотока, т. е. его направление, скорость, сопротивление, проходимость сосудов, их диаметр и степень атеросклеротического процесса на внутренней стенке. Согласно мнению N. Lerolle и соавт., ультразвуковая допплерография является неинвазивным методом, выявляющим выраженные изменения кровотока на уровне микрососудов [14]. Допплеровское картирование информативно для исключения или подтверждения тромбозов, аневризм и других патологических изменений сосудистого русла. Спектральная допплерография анализирует изменение скорости кровотока в зависимости от времени прохождения крови в магистральной почечной артерии и внутрипочечных сосудах [15]. Допплерограмма позволяет не только оценить состояние почечных сосудов, но и, за счет определения индекса их резистентности, косвенно предположить снижение функциональной способности почек.
Расчет индекса резистентности (ИР) предложил L. Pourselot в 1974 году. Данный показатель является косвенным показателем импеданса микроциркуляции [16]. Он представляет собой сумму сил сопротивления, противодействующих пульсирующему току крови в артерии, т. е. гидравлического сопротивления, кинематической вязкости и эластичности стенки.
RI = (Vps - Vd)/ Vps
RI – индекс резистентности (resistance index)
Vps – пиковая систолическая скорость (peak systolic rate)
Vd – конечная диастолическая скорость (the final diastolic rate)
В настоящий момент ультразвуковые аппараты, способные выполнять допплеровское картирование, автоматически рассчитывают ИР. У молодых здоровых людей нормальный уровень ИР приближается к 0,60. ИР, равный 0,70, считается верхним пределом референсных значений. При ХБП прогрессирующая потеря почечной массы, гломерулярная атрофия и канальцево-интерстициальный фиброз ответственны за снижение почечного кровотока, что снижает амплитуду профиля спектральной волны. При поражении, преимущественно, мелких сосудов (300–100 мкм), как при нефроангиосклерозе, сахарном диабете и васкулите, уменьшается площадь поперечного сечения микроциркуляторного русла и его сосудистая растяжимость. За счет высокой жесткости артерий и атеросклеротического эутрофического ремоделирования мелких сосудов эти патологические состояния определяют повышеные значения ИР (больше 0,75–0,80) [17].
ИР более 0,70 является прогностическим признаком худшего варианта прогрессирования ХБП, независимо от исходной расчетной СКФ [18]. В работе P. Avramovski и соавт. показано, что почечный индекс резистентности имеет сильную обратную зависимость с толщиной паренхимы и СКФ [19]. Изменение ИР всегда связано с патологическим процессом. В таблице 2 представлены основные причины изменения кровотока по почечной артерии [20].
Таблица 2. Причины изменения Индекса резистентности почечной артерии
Table 2. Causes of changes in the Renal artery resistance index
| Состояния, сопровождающиеся изменением кровотока по почечной артерии Conditions accompanied by changes in blood flow through the renal artery |
Патофизиологические аспекты Pathophysiological aspects |
|---|---|
| Повышение ИР Increase of IR | |
| Внепочечное сдавление Extrarenal compression |
Повышение интерстициального давления из-за субкапсулярной гематомы или другого образования Increased interstitial pressure due to subcapsular hematoma or other formation |
| Острая почечная недостаточность Acute renal failure |
Увеличение почек вследствие интерстициального отека, тубулоюкстагломеруляр-ный обратный ток с сокращением мезангия и констрикцией приносящих сосудов Enlargement of the kidneys due to interstitial edema, tubuloyukstaglomerular reverse current with contraction of the mesangium and constriction of the bearing vessels |
| Обструкция почечной лоханки Obstruction of the renal pelvis |
Интерстициальный отек из-за обратной фильтрации жидкости внутри трубочек в интерстиций Interstitial edema due to reverse filtration of fluid inside the tubes into the interstitial |
| Интерстициальное рубцевание Interstitial scarring |
Интерстициальный фиброз или склероз мелких артерий, приводящий к разрежению терминальных артериальных ветвей с повышением сопротивления кровотоку Interstitial fibrosis or sclerosis of small arteries, leading to the resolution of terminal arterial branches with increased resistance to blood flow |
| Острое отторжение Acute rejection |
Интерстициальное отторжение: увеличение трансплантата за счет лимфоцитарного интерстициального инфильтрата. Сосудистое отторжение: увеличение сопротивления из-за сужения мелких внутрипочечных артерий Interstitial rejection: graft enlargement due to lymphocytic interstitial infiltration. Vascular rejection: increased resistance due to narrowing of small intrarenal arteries |
| Опухоль почки Kidney tumor |
Компрессия почечных сосудов растущей опухолью; увеличение гемодинамического обеспечения пораженной почки Compression of renal vessels by a growing tumor; increase in hemodynamic support of the affected kidney |
| Единственная почка The only kidney |
Увеличение гемодинамического обеспечения оставшейся почки, компенсаторная гипертрофия, гиперфильтрация, нефросклероз Increased hemodynamic support of the remaining kidney, compensatory hypertrophy, hyperfiltration, nephrosclerosis |
| Низкое диастолическое АД Low diastolic blood pressure |
Дефицит пропульсивной силы в диастолу (тяжелая недостаточность аортального клапана), открытый артериальный проток Lack of propulsive force in the diastole (severe aortic valve insufficiency), open ductus arteriosus |
| Брадикардия Bradycardia |
Недостаточный кровоток в конце удлиненной диастолы Insufficient blood flow at the end of an elongated diastole |
| Хроническая левожелудочковая недостаточность Chronic left ventricular failure |
Компенсаторная констрикция приносящих сосудов на фоне гипоперфузии Compensatory constriction of fetal vessels on the background of hypoperfusion |
| Стабильно высокое систолическое АД Consistently high systolic blood pressure |
Рефлекторная констрикция приносящих сосудов с последующим развитием интраренального атеросклероза Reflex constriction of fetal vessels with subsequent development of intrarenal atherosclerosis |
| Снижение ИР Reduction of IR | |
| Препятствие выхода из левого желудочка Obstruction of the exit from the left ventricle |
Системный дефицит пропульсивной силы в систолу (стенозы аорты) с рефлекторной релаксацией резистивных сосудов почки (коарктация аорты) Systemic deficiency of propulsive force in the systole (aortic stenosis) with reflex relaxation of the resistive vessels of the kidney (aortic coarctation) |
| Артериовенозная фистула и внутрипочечные шунты Arteriovenous fistula and intrahepatic shunts |
Усиление диастолического кровотока на фоне артериовенозного шунтирования Increased diastolic blood flow on the background of arteriovenous bypass surgery |
| Проксимальный локальный стеноз почечной артерии Proximal local renal artery stenosis |
Снижение систолической скорости кровотока в постстенотическом сегменте. Локальный дефицит пропульсивной способности в систоле Decreased systolic blood flow rate in the poststenotic segment. Local deficit of propulsive ability in systole |
У большинства пациентов с острым почечным повреждением (ОПП) при исследовании, как правило, выявляется нормальная ультразвуковая картина, однако в некоторых случаях, помимо обструктивной нефропатии, отмечаются патологические состояния. В работе C. Liu и соавт. показано, что размер почек у пациентов с ОПП значительно больше, чем у здоровых людей. Авторы сделали вывод, что размер почки в сочетании с другими ультразвуковыми показателями может иметь потенциал для оценки ОПП [21]. В таблице 3 представлены морфологические параметры почек в норме и при ХБП.
Таблица 3. Ультразвуковые морфологические показатели почек в норме и при ХБП
Table 3. Ultrasound morphological parameters of the kidneys in normal and CKD
| Кортикомедулярная толщина (мм) Cortical medullary thickness (mm) |
|
|---|---|
| Обычный Common | 16-18 |
| ХБП CKD | <13 |
| Острая почечная недостаточность Acute renal failure |
Хронические воспалительные поражения паренхимы Chronic inflammatory lesions of the parenchyma |
| Геометрический объем почек (V = 0,49 х A х B х C) (см3) Geometric volume of the kidneys |
|
| Правая почка Right kidney | 134 |
| Левая почка Left kidney | 146 |
| Объем почечного синуса (V = 0,49 х A х B х C) (см3) Renal sinus volume (V = 0,49 х A х B х C) (см3) |
21 (слева); 24 (справа) 21 (left); 24 (right) |
| Индекс резистентности Resistance index |
|
| Обычный Common | 0,60-0,70 |
| ХБП CKD | >0,70 |
Несмотря на вышеперечисленные положительные стороны ультразвукового исследования почек, данный метод позволяет предположить снижение функциональной способности, но не указать на сколько процентов произошло данное снижение. Кроме того, при наличии преренальной азотемии и острой паренхиматозной болезни почек у пациентов с почечной недостаточностью, показатели УЗИ почек могут быть в пределах референсных значений.
Компьютерная томография
Компьютерная томография (КТ) обладает показателями большей диагностической точности, чем ультразвуковое исследование почек, однако доступность данного метода исследования ниже, а стоимость значительно выше [22]. Благодаря современным возможностям оценки функции почек, КТ может выборочно выявить функциональные участки почечной ткани и исключить нефункциональные, а также измерить объем почечной паренхимы в режиме 3D [23, 24]. В работах K. Patankar и соавт., а также R Wahba и соавт. показано, что между объемом почечной паренхимы, определенной при помощи КТ-волюметрии, и показателями сцинтиграфии имеется сильная связь, а в работе Y. Mitsui и соавт. сообщается о связи между объемом паренхимы почек и показателем расчетной СКФ [25–27]. В работе M.M. Zheng и соавт. показано, что, основываясь на раздельном объеме почечной паренхимы (sRPV) и раздельном объеме почечных чашечек и лоханки (sRCPV), измеренных при помощи объемной трехмерной КТ, можно определять раздельную функцию почек [28]. В одной из последних работ китайских коллег показано, что по сравнению с общим объемом почек, снижение объема почечной паренхимы более тесно связано с нарушением функции почек и, тем самым, имеет более сильную прогностическую силу [29].
В работе Ю.Г. Аляева и соавт. показано, что применение компьютерной программы для получения трехмерных изображений мультиспиральной компьютерной томографии (МСКТ) с контрастированием позволяет получить данные перфузии, клубочковой фильтрации, а также ожидаемое количество выделенной мочи при имеющейся у данного конкретного пациента СКФ и другие параметры [30]. Ю.Г. Аляев и соавт. также показали, что указанные параметры можно рассчитать как суммарно, так и раздельно для каждой почки, в том числе для каждого сегмента почки [31] Подобные результаты получены китайскими коллегами из Шаньсийского медицинского университета, показавшие, что комбинация значений КТ с контрастным усилением и уровня креатинина в сыворотке крови (SCr) для расчета скорости клубочковой фильтрации (рСКФ), позволяет определить раздельную функцию почек, схожую с показателями динамической нефросцинтиграфии [32].
Позитронно-эмиссионная томография–КТ (ПЭТ-КТ)
ПЭТ КТ — это радионуклидный томографический метод, основанный на регистрации пары гаммаквантов, возникающих при аннигиляции позитронов с электронами, и предназначенный для одномоментного и детального обследования всего организма [33]. Позитронно-эмиссионная томография позволяет изучить распределение и накопление предварительно введенного радиофармпрепарата (РФП) во внутренних органах и тканях. Выбор необходимого РФП позволяет изучать с помощью ПЭТ-КТ метаболизм, транспорт веществ, лиганд-рецепторные взаимодействия, экспрессию генов и другие процессы. Использование РФП, относящихся к различным классам биологически активных соединений, делает ПЭТ достаточно универсальным инструментом современной медицины. На сегодняшний день в ПЭТ применяются позитрон-излучающие изотопы элементов второго периода периодической системы:
- углерод-11 (T½= 20,4 мин.);
- азот-13 (T½ = 9,96 мин.);
- кислород-15 (T½ = 2,03 мин.);
- фтор-18 (T½ = 109,8 мин.).
Наиболее часто применяются РФП на основе фтора, поскольку данное вещество обладает наибольшим периодом полураспада и наименьшей энергией излучения.
При помощи ПЭТ становится возможным неинвазивный расчет СКФ. С этой целью используют расчет клиренса плазмы этилендиаминтетрауксусной кислоты (ЭДТА), но это занимает много времени и требует технических навыков и оборудования, которое не всегда доступно в диагностических подразделениях лечебно-профилактических учреждений (ЛПУ). ПЭТ-КТ позволяет не только визуализировать функцию почек, но и точно ее измерить с помощью камеры клиренс активности. В работе M. Hofman и соавт. продемонстрировано, что 68Ga-EDTA PET/CT-СКФ хорошо коррелирует с результатами расчетной СКФ, полученной при помощи сывороточной концентрации креатинина крови, при этом динамическая визуализация ПЭТ обеспечивает метод оценки СКФ без забора крови [34].
Динамическая ПЭТ-визуализация с использованием отфильтрованного гломерулярного индикатора Ga-DOTA обладает потенциалом для неинвазивной оценки СКФ путем кинетического моделирования компартментов. Первой работой, посвященной сравнению почечной динамики человека при помощи ПЭТ-изображений Ga-DOTA с показателями сцинтиграфии почек, а также сравнение результатов ПЭТ с измерениями СКФ, полученными на основе концентрации креатинина сыворотки, является исследование немецких коллег под руководством D. Kersting. Согласно опубликованным результатам, авторы пришли к выводу, что ПЭТ Ga-DOTA почек может быть подходящей альтернативой традиционной сцинтиграфии, поскольку визуальная оценка ПЭТ-изображений и обычных ренограмм имеет сопоставимые результаты значения СКФ, полученные с помощью неинвазивного однокомпонентного моделирования данных ПЭТ. Для визуальной оценки и расчета СКФ достаточно сбора данных динамической ПЭТ в течение 15 минут [35].
Магнитно-резонансная томография
Большой потенциал для определения функциональной способности почек представляет магнитно-резонансная томография (МРТ). Благодаря использованию данной методики можно неинвазивно оценить патофизиологические процессы, связанные с острым и хроническим повреждением почечной ткани. МРТ выполняется как с контрастным веществом, так и без него. Наиболее часто для определения функциональной способности почек используются следующие параметры:
- объем почек;
- кровоток в почечной артерии и вене (фазовоконтрастная (ФК)-МРТ);
- оценка перфузии коры почек (маркировка артериального спина (ASL);
- количественная оценка перфузии ASL (время продольной релаксации T1). Позволяет оценить степень фиброза и воспаления;
- термически индуцированное броуновское движение воды в тканях (диффузионно-взвешенная визуализация (DWI);
- уровень оксигенации тканей (визуализация в зависимости от для оценки оксигенации тканей (BOLD).
Благодаря современным технологиям, за один сеанс МРТ, длящийся 45 минут, можно получить сразу несколько измерений, что позволяет достоверно оценить полную картину изменений морфологии, микроструктуры, гемодинамики и оксигенации почек, а также лучше понять патофизиологию изменений по сравнению со сбором информации при помощи только одного показателя МРТ [36].
Наиболее подробное описание методики многопараметрической МРТ для оценки функции почек представлено в работе E.F. Cox и соавт. [37]. Согласно представленному ими протоколу, в течение 45-минутного сеанса сканирования удается получить данные по структуре, уровню оксигенации и гемодинамике в почке (рис. 1). Наряду с этим, МРТ позволяет определить функцию почек путем проведения магнитнорезонансной гистологии.
![Рис. 1. Протокол мультипараметрической неинвазивной МРТ почек [37]](https://ecuro.ru/sites/default/files/issue/2023_2/76,1.jpg)
Рис. 1. Протокол мультипараметрической неинвазивной МРТ почек [37] BOLD – уровень оксигенации тканей, DWI - термически индуцированное броуновское движение воды в тканях, ASL – оценка перфузии коры почек, Phase contrast – фаза контрастирования, Structure – структура, Perfusion – перфузия, Velosity – скорость движения, Area – область, Flow – поток, Volume – объем, Oxygenation – оксигенация
Fig. 1. Protocol of multiparametric noninvasive MRI of the kidneys [37] BOLD – tissue oxygenation level, DWI - thermally induced Brownian motion of water in tissues, ASL – assessment of renal cortex perfusion, Phase contrast, Structure, Perfusion, Velocity, Area, Flow, Volume, Oxygenation
Магнитно-резонансная гистология
Магнитно-резонансная гистология — это метод, который дополняет традиционную гистологию, предоставляя микроскопические изображения интактных образцов. Магнитно-резонансная гистология позволяет неразрушающим образом оценивать целые органы в 3D-изображениях и использовать контраст, зависящий от воды в тканях. Этот метод применялся в патологии и токсикологии для количественной оценки тканевых структур. В почках он может оценить хроническое заболевание, воспаление и возрастную дегенерацию [38]. Кроме того, магнитно-резонансная гистология предлагает метод визуализации микроструктур. Магнитно-резонансная гистология включает транскардиальную перфузионную фиксацию. Контрастные вещества на основе гадолиния (Gd), такие как Magnevist (Gd-DTPA) или ProHance (Gd-HP-DO3A), используются во время перфузии для усиления сигнала МРТ [39].
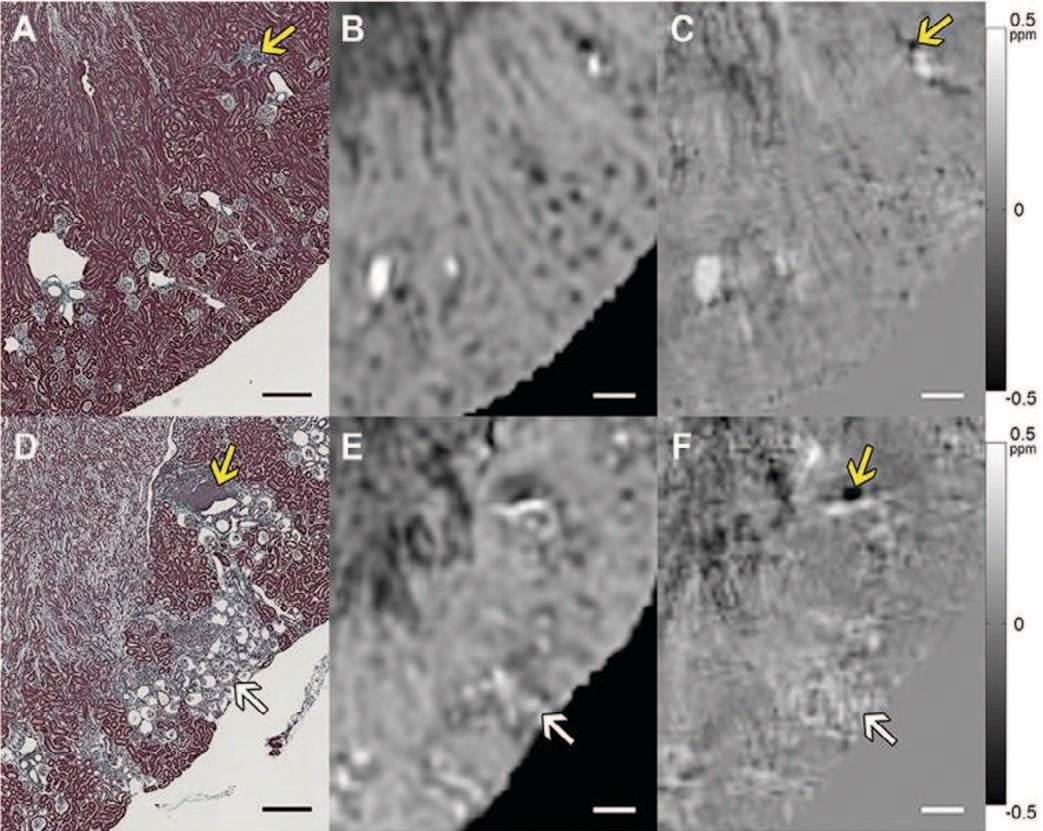
Рис. 2. Сравнение величины МРТ, QSM и трихромной гистологии Массона в корковом веществе почки мыши. Верх: дикий тип. Внизу: мыши с дефицитом рецептора ангиотензина (Agtr1a-/- Agtr1b-/-). A и D: гистологические изображения. B и E: Т 2 *-взвешенные (величина) изображения. C и F: изображения QSM. Белые стрелки указывают на скопления морщинистых клубочков на D - F. Изображение магнитуды показывает артефакты восприимчивости на границах кластера, которые удалены на изображении QSM. Желтые стрелки указывают на фокальные области кортикального интерстициального воспаления и фиброза (А, С, D и F). Шкала баров = 300 мкм. Цветная полоса: ppm B 0 [40]
Fig. 2. Comparison of the values of MRI, QSM and trichromic histology of Masson in the cortical substance of the mouse kidney. Top: Wild type. Bottom: mice with angiotensin receptor deficiency (Agtr1a-/- Agtr1b-/-). A and D: histological images. B and E: T 2 * are weighted (magnitude) images. C and F: QSM images. White arrows indicate clusters of wrinkled glomeruli on D - F. The magnitude image shows the susceptibility artifacts at the cluster boundaries that are removed in the QSM image. Yellow arrows indicate focal areas of cortical interstitial inflammation and fibrosis (A, C, D and F). Bar scale = 300 microns. Color band: ppm B 0 [40]
Благодаря возможности получения гистологических срезов возможно изучить целостность нефрона. Для этой цели используется диффузионно-тензорная визуализация (DTI). Данный инструмент МРТ позволяет оценить целостность и архитектуру почечных канальцев, а также исследовать ультраструктуру почек и определить изменения коэффициентов диффузии при паренхиматозных заболеваниях почек. DTI измеряет анизотропную диффузию воды внутри трубчатых структур или пространств между фиброзными тканями. DTI по своей сути основан на ослаблении МРсигнала из-за диффузионно-сенсибилизирующих градиентов [41]. Развитие нескольких методов МРТ сделало возможным измерение морфологии почечных клубочков на основе МРТ всей почки, включая измерение количества клубочков, объема клубочков, внутрипочечного распределения объема клубочков и локализации потери нефронов, связанной с заболеванием [42]. Основной подход заключается в использовании катионизированного ферритина (КФ) для маркировки базальной мембраны почечных клубочков в каждом клубочке после внутривенной инъекции. В настоящий момент такое исследование проведено только на животных (крысах) [43]. КФ является суперпарамагнитным из-за его ядра из оксида железа и может быть обнаружен с помощью традиционных последовательностей МРТ. Эта разработка создала метод с использование КФ (CFE MRI) для визуализации клубочков.
ОБСУЖДЕНИЕ
На сегодняшний день сцинтиграфия продолжает оставаться золотым стандартом определения функциональной способности почек. Методы диагностики, представленные в данном обзоре, также могут позволить определить функциональную способность почек. Учитывая распространенность ХБП, мы предлагаем выполнять исследования поэтапно, начиная с наиболее доступных. К примеру, ультразвуковая диагностика может применяться в рамках первичного обследования при диспансеризации. При выявлении изменений в паренхиме почки должно проводиться более углубленное исследование с использованием допплеровского картирования и расчета индекса резистентности.
УЗИ играет важную роль в диагностике хронической болезни почек, однако интерпретация изображений требует серьезной подготовки. В качестве помощи врачам диагностам ученые из Южной Кореи создали систему, созданную на основе нейронных сетей, позволяющую самостоятельно распознавать ультразвуковые изображения у пациентов с ХБП. С помощью машинного обучения автоматизированная система пошагово сегментирует модель, измеряет и классифицирует ультразвуковые изображения почек с высокой производительностью. Авторы пришли к выводу, что интеграция извлеченных компьютером измеримых признаков в модели машинного обучения может улучшить классификацию ХБП, тем самым предположить степень снижения функциональной способности почек [44]. Подобную работу провели коллеги из Китая, подтвердившие, что методы трансферного обучения для извлечения признаков изображений из ультразвуковых снимков для создания классификаторов, позволяют отличить детей с врожденными аномалиями развития мочевыделительной системы от здоровых [45]. При выявлении отклонений от референсных значений показателей ультразвукового исследования целесообразно направлять пациента на более углубленное исследование, которым может выступать компьютерная или магнитно-резонансная томография. Данные методы позволяют более углублено и точно исследовать не только строение почки, но и функциональную способность каждого её сегмента. В отличии от УЗИ, КТ позволяет оценить не только анатомическое строение почек, но и строить 3-мерное изображение, оценивать перфузию и неинвазивно рассчитывать скорость клубочковой фильтрации. МРТ в определении функции почек обладает еще большими функциями, чем УЗИ и КТ. Как показано выше, многопараметрическая МРТ позволяет в течение 45 минут оценить целый ряд параметров (объем почек, кровоток в почечной артерии, перфузию коры почек и т. д.), делающих возможным комплексное определение функциональной способности почек. МР-гистология — это еще одно перспективное направление в оценке функциональной способности почек. Применяемая в настоящий момент в патологической анатомии и токсикологии, МР-гистология позволяет неразрушающим образом оценивать целые органы в 3D и может использовать зависящий от воды контраст в тканях [38]. Полученные результаты говорят о том, что совершенствование такого подхода в будущем может позволить оценивать не только функциональную способность почки или ее сегментов, но и отдельно взятого нефрона.
В последнее время все больше работ посвящено изучению возможности применения искусственного интеллекта для анализа данных инструментальных исследований. В настоящий момент при помощи искусственного интеллекта возможно определение по КТ топики почек, их размеров, строения, а также предположительную функцию. К примеру, в работе B. Dhruv и соавт. показано, что алгоритм анализа изображений МСКТ, разработанный авторами, позволяет точно определить наличие кист, которые, в свою очередь, могут снижать функциональную способность почек [46].
Современные методы лучевой диагностики позволяют получить целый спектр показателей, которые косвенно или, в какой-то степени, прямо могут свидетельствовать о состоянии экскреторной функции почки. Последние из них, представляющие данные о скорости клубочковой фильтрации и характеризующие перфузию паренхимы почки, являются методически сложными и дорогостоящими исследованиями, приводящимися дополнительно к уже проведенным стандартных КТ- и МРТ-исследованиям. Используемые в широкой практике косвенные методы оценки функции почки, основанные на морфометрии и визуализации контрастированных мочевых путей, в настоящее время не могут полностью нас удовлетворять из-за низкой точности. Поэтому имеется необходимость разработки новых подходов к анализу данных стандартно выполняемых исследований, которые могли бы представить результаты, более точно свидетельствующие о функциональном состоянии почек.
ЗАКЛЮЧЕНИЕ
Имеющиеся современные инструментальные методы оценки почечной функции открывают широкие перспективы для их клинического применения и требуют продолжения исследования.
ЛИТЕРАТУРА
1. Eknoyan G, Lameire N, Barsoum R, Eckardt KU, Levin A, Levin N, et al. The burden of kidney disease: improving global outcomes. Kidney Int 2004;66(14):1310–4. https://doi.org/10.1111/ j.1523-1755.2004.00894.x.
2. Hamer R, Nahas E. The burden of chronic kidney disease. BMJ 2006;332(7541):563–4. https://doi.org/10.1136/bmj.332.7541.563.
3. Centers for Disease Control and Prevention. URL: https://nccd.cdc.gov/CKD.
4. Taal MW, Brenner BM. Adaptation of Specific Tubule Functions in Response to Nephron Loss. In: Brenner and Rector’s the Kidney 2011;790–793.
5. Venkatachalam MA, Griffin KA, Lan R, Geng H, Saikumar P, Bidani AK. Acute kidney injury: a springboard for progression in chronic kidney disease. Am J Physiol Renal Physiol 2010;298(5):1078–94. https://doi.org/10.1152/ajprenal.00017.2010.
6. Клинические рекомендации. Хроническая болезнь почек (ХБП). Разработчик – Ассоциация нефрологов. М., 2021. 233 с. [Clinical guidelines. Chronic kidney disease (CKD). Authors – Association of Nephrologists. M., 2021. 233 p. URL: https://cr.minzdrav.gov.ru/ recomend/469_2. (In Russian)].
7. Близнюк А.И., Мороз-Водолажская Н.Н. Методы исследования почек и мочевыводящих путей и их применение в общей врачебной практике: учебно-методическое пособие. Минск: БГМУ, 2021. 34 с. [Bliznyuk A.I., Moroz-Vodolazhskaya N.N. Methods for examining the kidneys and urinary tract and their application in general medical practice: a teaching aid. Minsk: BSMU, 2021. 34 p. (In Russian)].
8. ACR practice guideline for the performance of an ultrasound examination of the abdomen and/or retro-peritoneum (in collaboration with the American Institute of Ultrasound in Medicine AIUM). URL: http://www.acr.org/guidelines.
9. Eze C, Okoye J, Agwu K. Normative ultrasound values of renal parenchymal thickness among adults in Enugu, South-East Nigeria. Afr Health Sci 2014;14(3):689–97. https://doi.org/10.4314/ ahs.v14i3.27.
10. Roger SD, Beale AM, Cattell WR, Webb JA. What is the value of measuring renal parenchymal thickness before renal biopsy? Clin Radiol 1994;49(1):45–9. https://doi.org/10.1016/s0009- 9260(05)82913-7.
11. Beland MD, Walle NL, Machan JT, Cronan JJ. Renal cortical thickness measured at ultrasound: is it better than renal length as an indicator of renal function in chronic kidney disease? AJR Am J Roentgenol 2010;195(2):146–9. https://doi.org/10.2214/AJR.09.4104.
12. Meola M, Samoni S, Petrucci I. Imaging in chronic kidney disease. Contrib Nephrol 2016:188:69–80. https://doi.org/10.1159/000445469.
13. Hricak H, Cruz C, Romanski R, Uniewski MH, Levin NW, et al. Renal parenchymal disease: sonographic-histologic correlation. Radiology 1982;144(1):141–7. https://doi.org/10.1148/ radiology.144.1.7089245.
14. Lerolle N, Guérot E, Faisy C, Bornstain C, Diehl JL, Fagon JY. Renal failure in septic shock: Predictive value of Doppler-based renal arterial resistive index. Intensive Care Med 2006;32(10):1553–9. https://doi.org/10.1007/s00134-006-0360-x.
15. Ольхова Е.Б. Дуплексное сканирование почек у детей. SonoAceInternational 2000;(7):44–52. [Olkhova E.B. Duplex scanning of the kidneys in children. SonoAce-International 2000;(7):44–52. (In Russian)].
16. Bude RO, Rubin JM. Relationship between the resistive index and vascular compliance and resistance. Radiology 1999;211(2):411–7. https://doi.org/10.1148/radiology.211.2.r99ma48411.
17. Petrucci I, Clementi A, Sessa C, Torrisi I, Meola M. Ultrasound and color Doppler applications in chronic kidney disease. J Nephrol 2018;31(6):863–79. https://doi.org/10.1007/ s40620-018-0531-1.
18. Sugiura T, Wada A. Resistive index predicts renal prognosis in chronic kidney disease. Nephrol Dial Transplant 2009;24(9):2780–5. https://doi.org/10.1093/ndt/gfp121.
19. Avramovski P, Ilkovska B, Nikleski Z, Avramovska M, Sikole A. Which better determines the renal function and glomerular filtration rate: renal parenchymal thickness or renal resistive index? Saudi J Kidney Dis Transpl 2021;32(3):754–62. https://doi.org/10.4103/1319-2442.336771.
20. Бегун И.В., Папкевич И.И. Индекс резистентности в диагностике заболеваний почек – возможности и ограничения. Нефрология 2009;13(4):18-27. [Begun I.V., Papkevich I.I. Index of resistance in diagnosis of kidney disease-opportunities and limitations. Nefrologia = Nephrology 2009;13(4):18–27. (In Russian).
21. Liu C, Wang X. Clinical utility of ultrasonographic evaluation in acute kidney injury. Transl Androl Urol 2020;9(3):1345–55. https://doi.org/10.21037/tau-20-831.
22. Brisbane W, Bailey MR, Sorensen MD. An overview of kidney stone imaging techniques. Nat Rev Urol 2016;13(11):654–62. https://doi.org/10.1038/nrurol.2016.154.
23. Poggio ED, Wang X, Greene T, Van Lente F, Hall PM. Performance of the modification of diet in renal disease and Cockcroft–Gault equations in the estimation of GFR in health and in chronic kidney disease. J Am Soc Nephrol 2005;16(2):459–66. https://doi.org/10.1681/ ASN.2004060447.
24. Halleck F, Diederichs G, Koehlitz T, Slowinski T, Engelken F, Liefeldt L, et al. Volume matters: CT-based renal cortex volume measurement in the evaluation of living kidney donors. Transplant Int 2013;26(12):1208–16. https://doi.org/10.1111/tri.12195.
25. Patankar K, Low RS, Blakeway D, Ferrari P. Comparison of computer tomographic volumetry versus nuclear split renal function to determine residual renal function after living kidney donation. Acta Radiol 2014;55(6):753–60. https://doi.org/10.1177/0284185113504195.
26. Wahba R, Franke M, Hellmich M, Kleinert R, Cingöz T, Schmidt MC, et al. Computed tomography volumetry in preoperative living kidney donor assessment for prediction of split renal function. Transplantation 2016;100(6):1270–7. https://doi.org/10.1097/TP.0000000000000889.
27. Mitsui Y, Sadahira T, Araki M, Wada K, Tanimoto R, Ariyoshi Y, et al. The assessment of renal cortex and parenchymal volume using automated CT volumetry for predicting renal function after donor nephrectomy Clin Exper Nephrol 2018;22(2):453–8. https://doi.org/10.1007/ s10157-017-1454-1.
28. Zheng MM, Zhu YC, Shang LM, Du CK, Zhang L, Sun W, et al. Use of CT-based renal volumetry for the measurement of split renal function: a split glomerular filtration rate prediction model based on unilateral renal volume parameters. Clin Radiol 2022;77(10):759–66. https://doi.org/10.1016/j.crad.2022.05.023.
29. Xie Y, Xu M, Chen Y, Zhu X, Ju S, Li Y. The predictive value of renal parenchymal information for renal function impairment in patients with ADPKD: a multicenter prospective study. Abdom Radiol (NY) 2022;47(8):2845–57. https://doi.org/10.1007/s00261-022-03554-w.
30. Аляев Ю.Г., Хохлачев С.Б., Фиев Д.Н., Борисов В.В., Проскура А.В., Юрова М.В. Новый метод расчета клубочковой фильтрации, перфузии и плазматока на основании численного анализа трехмерных данных, полученных при МСКТ. Российский электронный журнал лучевой диагностики 2018;8(2):105–9. [Alyaev Yu.G., Khokhlachev S.B., Fiev D.N., Borisov V.V., Proskura A.V., Iurova M.V. A new approach for split renal function evaluation of glomerular filtration rate, perfusion and plasma flow by numerical analysis of 3D MSCT-based models. Rossiyskiy elektronnyy zhurnal luchevoy diagnostiki = Russian electronic journal of radiology 2018;8(2):105–9. (In Russian)]. https://doi.org/10.21569/2222-7415-2018-8-2-105-109.
31. Аляев Ю.Г., Дзеранов Н.К., Хохлачев С.Б., Борисов В.В., Фиев Д.Н., Демидко Ю.Л. и др. Новый метод оценки раздельной функции почек на основании данных мультиспиральной компьютерной томографии с контрастированием. Урология 2018;(2):26–33. [Alyaev Yu.G., Dzeranov N.K., Khokhlachev S.B., Borisov V.V., Fiev D.N., Demidko Yu.L., et al. A new method of evaluation of split renal function based on contrast-enhanced multislice spiral computed tomography. Urologiya = Urology 2018;(2):26–33. (In Russian)]. https://doi.org/10.18565/urology.2018.2.26-33/.
32. Shi W, Liang X, Wu N, Zhang H, Yuan X, Tan Y. Assessment of split renal function using a combination of contrast-enhanced ct and serum creatinine values for glomerular filtration rate estimation. AJR Am J Roentgenol 2020;215(1):142–7. https://doi.org/10.2214/AJR.19.22125.
33. Bailey DL, Townsend DV, Wolf PE, Maisie MN. Positron emission tomography: basic sciences. Secaucus, New Jersey: Springer-Verlag. 2005. 382 p.
34. Hofman M, Binns D, Johnston V, Siva S, Thompson M, Eu P, Collins M, Hicks RJ. 68GaEDTA PET/CT imaging and plasma clearance for glomerular filtration rate quantification: comparison to conventional 51Cr-EDTA. J Nucl Med 2015;56(3):405–9. https://doi.org/10.2967/ jnumed.114.147843.
35. Kersting D, Sraieb M, Seifert R, Costa PF, Kazek S, Kessler L, et al. First experiences with dynamic renal [68Ga] Ga-DOTA PET/CT: a comparison to renal scintigraphy and compartmental modelling to non-invasively estimate the glomerular filtration rate. Eur J Nucl Med Mol Imaging 2022; 49(10):3373–86. https://doi.org/10.1007/s00259-022-05781-1.
36. Artunc F, Yildiz S, Rossi C, Boss A, Dittmann H, Schlemmer HP, Risler T, Heyne N. Simultaneous evaluation of renal morphology and function in live kidney donors using dynamic magnetic resonance imaging. Nephrol Dial Transplant 2010;25(6):1986–91. https://doi.org/10.1093/ ndt/gfp772.
37. Cox EF, Buchanan CE, Bradley CR, Prestwich B, Mahmoud H, Taal M, et al. Multiparametric renal magnetic resonance imaging: Validation, interventions, and alterations in chronic kidney disease. Front Physiol 2017;(8):696. https://doi.org/10.3389/fphys.2017.00696.
38. Хie L, Cianciolo RE, Hulette B, Lee HW, Qi Y, Cofer G, Johnson GA. Magnetic resonance histology of age-related nephropathy in the Sprague Dawley rat. Toxicol Pathol 2012;40(5):764– 78. https://doi.org/10.1177/0192623312441408.
39. Johnson GA, Cofer GP, Fubara B, Gewalt SL, Hedlund LW, Maronpot RR. Magnetic resonance histology for morphologic phenotyping. J Magn Reson Imaging 2002;16(4):423–9.https://doi.org/10.1002/jmri.10175.
40. Xie L, Bennett KM, Liu C, Johnson GA, Zhang JL, Lee VS. MRI tools for assessment of microstructure and nephron function of the kidney. Am J Physiol Renal Physiol 2016;311(6):1109–24. https://doi.org/10.1152/ajprenal.00134.2016. 41. Li W, Liu C, Duong TQ, van Zijl PC, Li X. Susceptibility tensor imaging (STI) of the brain. NMR Biomed 2017;30(4):10. https://doi.org/10.1002/nbm.3540.
42. Bennett KM, Bertram JF, Beeman SC, Gretz N. The emerging role of MRI in quantitative renal glomerular morphology. Am J Physiol Renal Physiol 2013;304(10):1252–7. https://doi.org/10.1152/ajprenal.00714.2012.
43. Bennett KM, Zhou H, Sumner JP, Dodd SJ, Bouraoud N, Doi K, et al. MRI of the basement membrane using charged nanoparticles as contrast agents. Magn Reson Med 2008;60(3):564– 74. https://doi.org/10.1002/mrm.21684.
44. Lee S, Kang M, Byeon K, Lee SE, Lee IH, Kim YA, et al. Machine learning-aided chronic kidney disease diagnosis based on ultrasound imaging integrated with computer-extracted measurable features. J Digit Imaging 2022;35(5):1091–100. https://doi.org/10.1007/ s10278-022-00625-8.
45. Zheng Q, Furth SL, Tasian GE, Fan Y. Computer-aided diagnosis of congenital abnormalities of the kidney and urinary tract in children based on ultrasound imaging data by integrating texture image features and deep transfer learning image features. J Pediatr Urol 2019;15(1):75.e1–75.e7. https://doi.org/10.1016/j.jpurol.2018.10.020.
46. Dhruv B, Mittal N, Modi M. Artificial intelligence optimized image segmentation techniques for renal cyst detection. J Med Eng Technol 2022;46(5):415–23. https://doi.org/10.1080/03091902.2022.2080882.
| Прикрепленный файл | Размер |
|---|---|
| Скачать статью | 1.15 Мб |