ВВЕДЕНИЕ
Цистит является наиболее частым клиническим проявлением инфекции нижних мочевых путей, сопровождающимся расстройством мочеиспускания и тазовыми болями. В России ежегодно регистрируется не менее 26–36 млн случаев острого бактериального цистита [1]. Воспалительная реакция в мочевом пузыре может быть как инфекционной, так и неинфекционной этиологии. Различают острый и хронический инфекционный цистит, отдельно выделяют рецидивирующую инфекцию нижних мочевыводящих путей (ИМП). После впервые перенесенного острого неосложненного цистита в течение 6 мес. рецидив заболевания регистрируется у 27% женщин, в течение года – у 50%, при этом у 75% больных рецидивы возникают более 4 раз в год [2–4]. В обзорных зарубежных работах, в том числе в статье K. Naber от 2022 г., посвященных хроническим рецидивирующим циститам, приводятся похожие данные – независимо от схемы лечения острой фазы, рецидивы в течение последующих 6–12 месяцев регистрируются у 30–50% женщин с ИМП [5–7].
Хроническим рецидивирующим циститом считается воспалительное заболевание мочевого пузыря, возникающее не менее трех раз в год или два раза за полгода. Согласно действующим Клиническим Рекомендациям Минздрава России, основной линией терапии острого неосложненного цистита являются фосфомицина трометамол, нитрофурантоин и фуразидин. В качестве возможной альтернативы указан препарат цефиксим. Окончательно ушли из клинических рекомендаций антибактериальные препараты из группы фторхинолонов [8]. Установлено, что длительный прием антимикробных препаратов в субингибирующих дозах приводит к селекции резистентных штаммов микроорганизмов, способствует образованию биопленок, а после прекращения лечения отмечается высокая частота рецидивов, достигающая 60%. Основной упор в клинических рекомендациях сделан на лечение первого эпизода и обострений ИМП полными курсовыми дозами антимикробных препаратов.
В апреле 2021 года в г. Москва был проведен междисциплинарный Совет Экспертов, посвященный проблеме лечения инфекций мочевых путей [9]. Анализ причин неэффективности лечения рецидивирующих ИМП, в частности антибиотикорезистентности, неэффективности лечения смешанных инфекций урогенитального тракта у женщин и низкой частоты обращаемости к врачу, показал необходимость поиска альтернативных схем лечения. Особое внимание экспертов вызвал нифурател как один из антимикробных препаратов нитрофуранового ряда, оказывающий антимикробное действие на основные уропатогены и возбудители вагинальных инфекций. При этом нифурател не оказывает бактерицидного действия на «нормальную» микрофлору [9]. Важно отметить, что систематический обзор 2021 года эффективности и безопасности нифуратела для пациентов с инфекцией нижних мочевыводящих путей, включавший 9 исследований и 442 пациентки, показал высокую эффективность нифуратела, сопоставимую и в ряде случаев превосходящую эффективность других антибиотиков [10]. В приведенных сравнительных исследованиях нифурател продемонстрировал большую терапевтическую эффективность и лучшую переносимость, чем нитрофурантоин.
К числу факторов, обуславливающих широкое распространение и высокий риск рецидивов ИМП, помимо увеличивающейся антибиотикорезистентности, относят иммунологические нарушения и снижение локальной антимикробной защиты мочеполовой системы. Для достижения долгосрочного эффекта терапии рецидивирующих ИМП вместе с назначением адекватной антибактериальной терапии может быть рассмотрена возможность проведения курсов лечения иммуностимулирующими препаратами [9, 11]. В соответствии с рекомендациями иммунологов, показанием для назначения иммуномодулятора в составе комплексной терапии является клиническая картина вторичного иммунодефицита, характеризующаяся наличием у пациента хронического, часто рецидивирующего инфекционно-воспалительного процесса, например, рецидивирующей инфекции мочевыводящих путей [9].
В последнее время значительно расширились представления о роли иммунных механизмов в патогенезе ИМП. Проникая через слизистые оболочки, инфекционные агенты вызывают не только локальные деструктивные нарушения, но и оказывают влияние на функциональную активность факторов местного иммунитета, в частности, нарушение механизмов фагоцитоза [12]. Процесс протекает по типу незавершенной реакции, в которой преимущественно принимают участие гранулоциты, что приводит к затяжному течению инфекционно-воспалительного процесса. Кроме того, в случаях развития ИМП имеет место нарушение регуляторной функции интертейкина 2 (IL–2), снижение секреции IL–8, выступающего мощным хемоаттрактантом для нейтрофилов и секреторного IgA, блокирующего процесс фиксации бактерий на клетках эпителия [13].
Нарушения иммунологической реактивности, которые могут сопровождать течение инфекционно-воспалительного процесса мочевыводящих путей, не ограничиваются лишь зоной слизистой оболочки мочевого пузыря. В системном кровотоке отмечается снижение популяции естественных клеток-киллеров – NK-клеток (CD16), абсолютного количества Т-лимфоцитов (CD3) и Т-хелперов (CD4), сдвиг иммунорегуляторного индекса (CD4/CD8) в сторону цитотоксических Т-клеток [12, 14].При выборе иммунотропных лекарственных средств следует отдавать предпочтение иммуномодуляторам, нормализующим активность иммунной системы, способным корректировать основные ее механизмы в зависимости от исходных значений, не проявляя при этом избыточного стимулирующего или супрессорного воздействия на иммунитет [6]. Одним из перспективных препаратов в лечении ИМП является пидотимод – синтетический пептидный иммуномодулятор. Пидотимод – высокоочищенная субстанция, воздействующая одновременно на несколько звеньев иммунного ответа: активация фагоцитов, нейтрофилов, цитотоксической функции NК-клеток, стимуляция выработки Т и В-лимфоцитов, нормализация соотношения между Т-хелперами и Т-супрессорами, продукция лимфокинов (IL-2) и экспрессия специфических рецепторов лимфоцитами, образование антител (секреторного IgА), а также противовирусного цитокинаγ-интерферона [15, 16]. Препарат эффективен в острой фазе заболевания, в периоде реконвалесценции и между рецидивами заболеваний бактериальной или вирусной природы. Отсутствие лекарственного взаимодействия позволяет принимать пидотимод в составе комплексной терапии с антибиотиками, жаропонижающими и другими препаратами [17]. Препарат обладает хорошей биодоступностью при пероральном использовании, которая зависит от сопутствующего приема пищи, поэтому пидотимод следует принимать за 2 часа до или через 2 часа после еды [18]. С 1995 г. по настоящее время было проведено более 60 международных клинических исследований пидотимода. Препарат входит в официальный список иммуномодуляторов ВОЗ и уже более 30 лет активно используется в терапии и профилактике обострений инфекций дыхательных и мочевыводящих путей [19, 20]. Пидотимод усиливает клинический ответ на антибиотикотерапию и снижает риск развития антибиотикорезистентности, в связи с чем может использоваться в качестве адъюванта при антибиотикотерапии [21]. Важно отметить, что высокий профиль безопасности пидотимода сопоставим с плацебо [22]. Исходя из вышеизложенного, мы посчитали актуальным проведения клинического исследования эффективности и безопасности применения пидотимода в сочетании с антибактериальной терапией нифурателом при лечении обострений хронического рецидивирующего цистита у женщин.
МАТЕРИАЛЫ И МЕТОДЫ
Проспективная многоцентровая наблюдательная программа «ПИНЦЕТ» (PiNCET – Pidotimod Nifuratel Cystitis Efficient Therapy) была проведена в период с октября 2021 по апрель 2022 гг. в клинических центрах 19 городов Российской Федерации: Москва, Санкт-Петербург, Омск, Уфа, Екатеринбург, Челябинск, Новосибирск, Кунгур, Пермь, Волгоград, Ставрополь, Воронеж, Краснодар, Липецк, Самара, Ростов-на-Дону, Саратов, Симферополь, Казань.
Критериями включения являлись: женский пол, возраст от 25 до 45 лет на момент включения, наличие хронического рецидивирующего цистита в стадии обострения, решение врача о необходимости проведения медикаментозной терапии заболевания нифурателом и пидотимодом, подписание пациенткой информированного согласия на участие в наблюдательном исследовании. В исследование включались пациентки, обратившиеся с жалобами на дизурию, учащенное мочеиспускание, ургентные позывы к мочеиспусканию в течение 2-х дней и более при отсутствии патологических выделений из влагалища (за исключением менструальных). В программу не включались пациентки, у которых присутствовал любой из нижеследующих «критериев невключения»: 1) беременность; 2) лактация; 3) наличие жалоб на дискомфорт во влагалище или аномальные влагалищные выделения; 4) аллергические реакции к компонентам препарата в анамнезе; 5) одновременное применение другой иммунной терапии ИМП.
На визите скрининга проводился сбор социодемографических данных (возраст пациенток, рост, вес) и гинекологического анамнеза (число родов, наличие половой жизни в течение последнего года, наличие эпизода влагалищной инфекции (бактериального вагиноза, вагинита, кандидоза или инфекции, передаваемой половым путем (ИППП) за последний год, в том числе рецидивов), а также данных анамнеза заболевания (длительность, оценка факта наличия связи между появлением дизурии и половой жизнью, данные о предшествующей терапии заболевания за последний год с указанием использованных препаратов и анализом их клинической эффективности). Учитывались продолжительность безрецидивного промежутка и число рецидивов заболевания за последний год и полгода.
К факторам, которые позволяли определить случай в разряд «осложненных инфекций мочевыводящих путей», относились следующие: сахарный диабет, наблюдение онкологом в течение последнего года, факт приема в течение последнего года глюкокортикостероидов, цитостатиков, применение лучевой терапии, наличие аутоиммунных заболеваний (системная красная волчанка, ревматоидный артрит), нейрогенной дисфункции мочевого пузыря (в том числе остаточная моча более 100 мл), необходимости проведения катетеризации/дренирования мочевого пузыря, реконструктивных операций на мочевыводящих путях или аномалий развития мочевой системы в анамнезе, эпизода острого пиелонефрита или почечной колики за предшествующий месяц, почечная недостаточность.
Диагноз хронического цистита в стадии обострения устанавливался на основании результатов клинического обследования и данных анамнеза. Врач оценивал выраженность клинической картины заболевания с помощью шкалы опросника симптомов острого цистита – Acute Cystitis Symptom Score (ACSS).
Скрининг проведен у 700 женщин, обратившихся к урологам поликлиник и амбулаторных диагностических центров с жалобами на дизурию. В исследование включена 501 пациентка, соответствующая описанным выше критериям включения и невключения. Данным пациенткам по решению врача назначен курс терапии оригинальными препаратами – нифурателом (Макмирор®) в комбинации с пидотимодом (Имунорикс®), дозировки и продолжительность приема которых соответствовали инструкциям по медицинскому применению. Нифурател назначался по 400 мг (2 таблетки) внутрь 3 раза/сут в течение 7 дней. Одновременно с нифурателом пациентки начинали прием пидотимода, который назначался по 800 мг (2 флакона) внутрь 2 раза/сут на протяжении 14 дней с последующим переходом на поддерживающий режим лечения 800 мг (2 флакона) внутрь один раз в сутки еще в течение 60 дней.
Все включенные в исследование пациентки в рамках наблюдательной программы осуществляли 5 визитов к врачу: первый вышеописанный визит включения с назначением терапии (визит 1, день 0) и четыре визита наблюдения через 14 (визит 2), 30±7 (визит 3), 90±7 (визит 4) и 180±7 (визит 5) дней от первого визита. На каждом визите наблюдения проводилась оценка клинической эффективности и безопасности терапии, включая заполнение пациентками опросника Acute Cystitis Symptom Score (ACSS)), состоящего из 18 вопросов.
Первичной конечной точкой являлась оценка:
- доли пациенток с наличием симптомов рецидива хронического цистита к 1, 3 и 6 месяцу после назначения терапии. Вторичной конечной точкой являлась оценка:
- скорости разрешения симптомов обострения хронического цистита к 14-му и 30-му дням терапии;
- динамики суммы баллов по шкале ACSS на 2–5 визитах;
- динамики количества эпизодов обострений заболевания после терапии в течение 6 месяцев;
- времени возникновения первого рецидива (длительность безрецидивного промежутка) на фоне проведенной терапии;
- частоты возникновения нежелательных явлений (НЯ) во время проведения наблюдательной программы, а также доли пациенток с необходимостью отмены терапии вследствие НЯ.
Клиническая эффективность терапии обострения хронического цистита в нашем исследовании оценивалась врачом исходя из следующих категорий: «полное выздоровление» – полное исчезновение клинических признаков и симптомов, «частичное выздоровление» – частичное исчезновение клинических признаков и симптомов, «неэффективность терапии» – неадекватный ответ на терапию, требующий назначения дополнительных антибактериальных средств. Клиническую эффективность лечения врач оценивал на визитах 2 и 3 (14 и 30-й дни наблюдения) в рамках комплексной оценки, включая данные опросника симптомов острого цистита. В случаях, когда было отмечено полное разрешение симптомов обострения заболевания, регистрировалось на какой день от начала терапии это произошло. Анализ частоты клинических рецидивов проводился на 3–5 визитах, т.е. на 30±7, 90±7 (визит 4), 180±7 (визит 5) день наблюдения соответственно. Если было зафиксировано развитие рецидива заболевания, то врач отмечал на какой день от начала терапии он возник и вычислял длительность безрецидивного промежутка (количество дней между полным разрешением на фоне терапии и рецидивом). На визитах 2–4 врач отмечал факт приема пациентом поддерживающего курса пидотимода и, по завершению лечения, указывал его продолжительность. На 2–5 визитах пациентки оценивали переносимость применяемой терапии как хорошую, удовлетворительную или неудовлетворительную. Также фиксировалась частота возникающих в ходе программы НЯ и случаи отмены препарата вследствие их возникновения.
В соответствии с дизайном программы для анализа демографических и иных характеристик исследуемой популяции, применялись методы описательной и сравнительной статистики с использованием программы StatTech v. 2.8.8 (разработчик – ООО «Статтех», Россия). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро-Уилка (при числе исследуемых менее 50) или критерия Колмогорова-Смирнова (при числе исследуемых более 50). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Направление и теснота корреляционной связи между двумя количественными показателями оценивались с помощью коэффициента ранговой корреляции Спирмена (при распределении показателей, отличном от нормального). При сравнении количественных показателей, распределение которых отличалось от нормального, в двух связанных группах, использовался критерий Уилкоксона.
РЕЗУЛЬТАТЫ
Комбинированная терапия пидотимодом в сочетании с нифурателом на визите включения была назначена 501 пациентке. На втором визите (14 день) под наблюдением оставалось – 499 пациенток, на третьем (30 день) – 494, на четвертом (90 дней) – 457 и на заключительном пятом (180 дней) – 447 пациенток (89% от исходной выборки). Данные именно этих 447 пациенток были взяты за основу при проведении статистического анализа.
Средний возраст пациенток составлял 34±8 лет, индекс массы тела (23±3,54) соответствовал норме. В среднем каждая пациентка имела одни роды. Регулярную половую жизнь в течение последнего года вели 85% (378 из 447) пациенток. Наличие эпизодов влагалищной инфекции (бактериального вагиноза, вагинита, кандидоза или ИППП) за последний год отмечали 32,4% пациенток, среди них рецидивирующие вагинозы – 53,7% пациенток.
Длительность хронического цистита на момент первого визита составляла в среднем 4 года, при этом наличие связи между появлением симптомов цистита и половой жизнью отмечало 30% (134 из 447) женщин. В течение последнего года до включения в исследование пациенты получали фосфомицин в 43,2% (193 из 447) случаев с эффективностью в 77% (150 из 193), нитрофурантоин – в 8,5% (38 из 447) с эффективностью 71,1% (27 из 38), фуразидин – в 22,4% (100 из 447) случаев с эффективностью 77% (77 из 100). Согласно анамнестическим данным пациенток, после терапии фосфомицином рецидив возникал через 2,6±1,7 месяцев, нитрофурантоином – 2,7±2,3 месяца, фуразидином – 2,7±1,5 месяца. Напомним, что основным критерием включения было наличие не менее 3 рецидивов цистита в год или не менее 2 эпизодов в течение полугода. При этом в исследуемой выборке среднее число рецидивов за последние 6 месяцев до включения в исследование составляло 2,5±1,4. Безрецидивный промежуток составлял в среднем 2,49±1,43 месяцев. Оценка этих исходных показателей была необходима для сопоставления с результатами наблюдения после терапии.
Согласно данным шкалы ACSS, исходный средний балл раздела типичных симптомов цистита составлял 10,3 из 18 возможных. Влияние симптомов на качество жизни пациента оценивалось 6,4 балла из 9 возможных по данным соответствующего домена вопросника ACSS.
Наличие хотя бы одного фактора, соответствующего осложненному течению заболевания, наблюдалось в 7,8% случаев (35 из 447 пациенток). У остальных 412 пациенток диагностирован хронический неосложненный цистит.
При оценке первичной конечной точки доля пациенток с наличием хотя бы одного обострения хронического цистита к 1-му, 3-му и 6-му месяцам после назначения терапии выглядели следующим образом: 2%, 9% и 13,9% соответственно. Таким образом, более 86% пациенток были избавлены от рецидивов в течение 6 месяцев наблюдения (рис. 1).
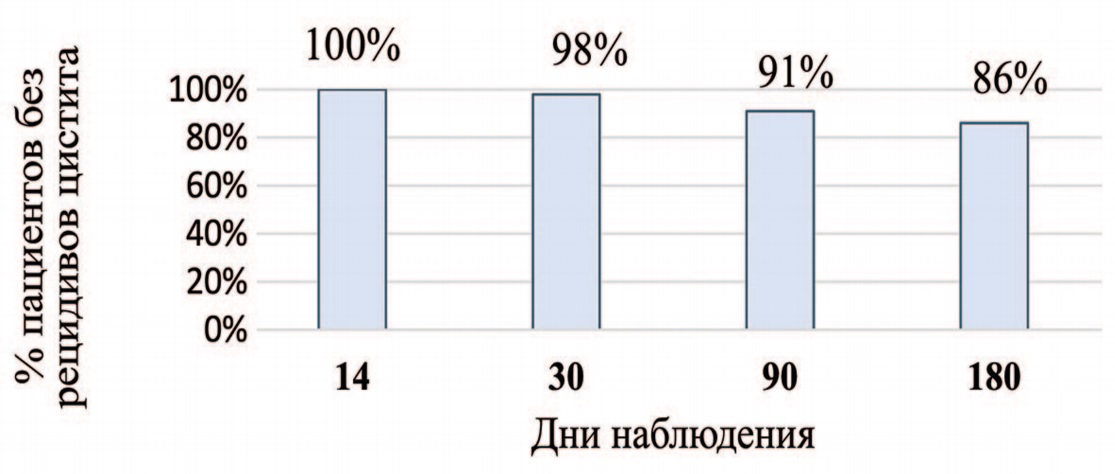
Рис. 1. Процент пациенток с безрецидивным течением хронического цистита с распределением по визитам
Fig. 1. Percentage of patients with a non-recurrent course of chronic cystitis with distribution by visits
Анализ частоты клинических рецидивов цистита в течение 6 месяцев наблюдения в зависимости от наличия осложняющих течение заболевания факторов выявил, что в подгруппе неосложненного течения цистита (n=412) рецидивы встречались достоверно реже в сравнении с показателями подгруппы осложненного хронического цистита (n=35) (табл. 1).
Таблица 1. Процент пациенток с рецидивом хронического цистита за 6 месяцев после назначения лечения в зависимости от наличия факторов, осложняющих течение заболевания
Table 1. Percentage of patients with chronic cystitis recurrence within 6 months after the treatment appointment, depending on the factors complicating the course of the disease
| Показатель Index |
Категории Categories |
Неосложненный хронический цистит Uncomplicated chronic cystitis |
Осложненный хронический цистит Complicated chronic cystitis |
p-value |
|---|---|---|---|---|
| Наличие рецидива за 6 месяцев наблюдения Presence of recurrence within 6 months of follow-up |
Нет No |
359 (87,1%) | 26 (74,3%) | 0,021 |
| Есть Yes |
53 (12,9%) | 9 (25,7%) |
Анализ исходов в подгруппе неосложненного цистита (n=412) показал схожие с общей выборкой результаты по первичной конечной точке – доля пациенток без рецидива к 1-му, 3-му и 6-му месяцам после назначения терапии наблюдения составляла 98% (403 из 412), 91% (376 из 412) и 87,1% (359 из 412). Вероятно, это обусловлено незначительным числом пациенток с осложненным циститом, вошедших в группу финального статистического анализа. Необходимо отметить, что все пациенты получили полный курс острой фазы (14 дней) и продолжали прием поддерживающего курса пидотимода в среднем 48±15 дней. При этом только 60% пациентов завершили полный курс поддерживающей фазы пидотимода (60 дней) (268/447).
Оценка вторичных конечных точек, в частности скорости разрешения симптомов обострения хронического цистита к 14-му и 30-му дням терапии, показала, что в группе неосложненного цистита на 14-й день полное выздоровление наблюдалось у 68% (305 из 447) пациентов, частичное – у 30% (137 из 447). Время разрешения клинической картины цистита для упомянутых выше 305 пациенток (оценивалось на Визите 2) составило в среднем 6,7 дней. К 30-му дню наблюдения (визит 3) отмечалась выраженная положительная динамика: полное выздоровление – у 87,5% (391 из 447) пациенток, частичное у 10% (45 из 447).
Динамика суммы баллов по шкале опросника ACSS на 14-й, 30-й, 90-й и 180-й день наблюдения показало достоверное улучшение всех показателей с сохранением результата в течение 6 месяцев во всей выборке (n=447) (рис. 2). Данные ответов на вопросы разделов ACSS на визитах 1, 2 и 3 представлены в таблице 2.
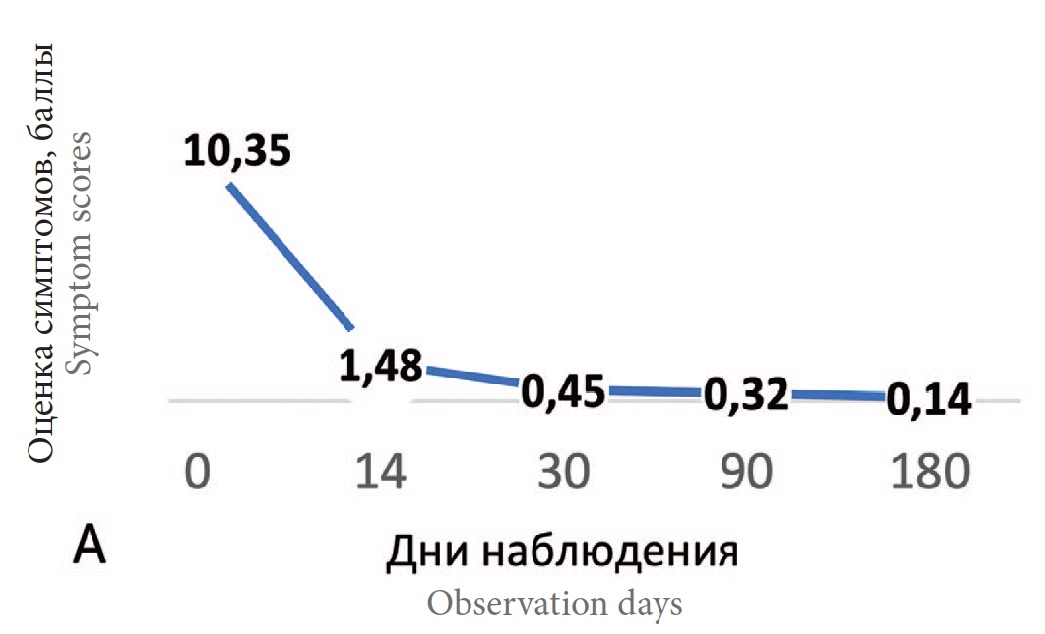
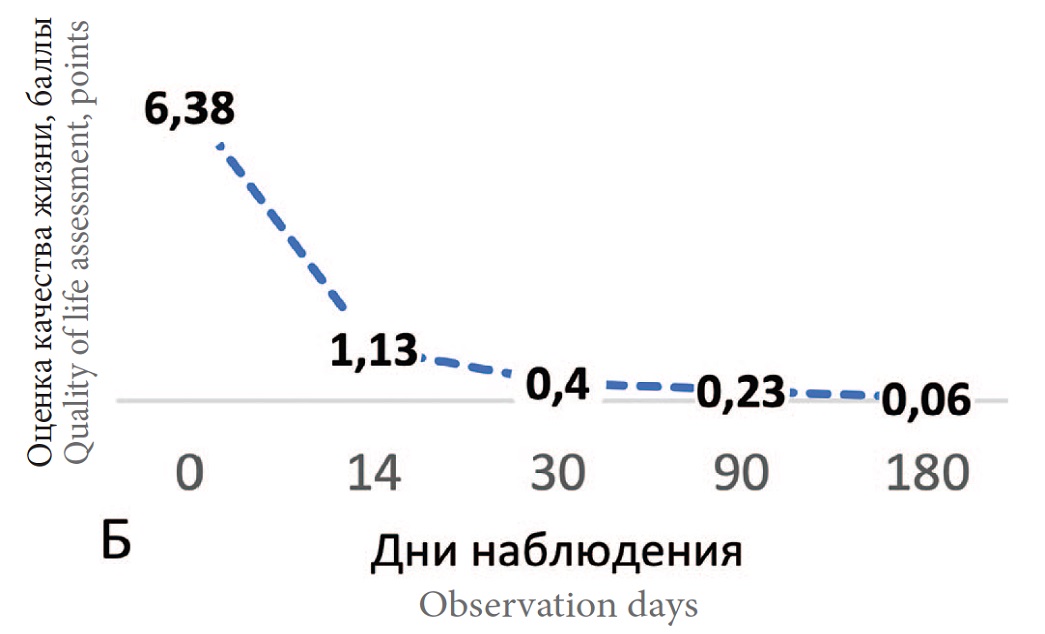
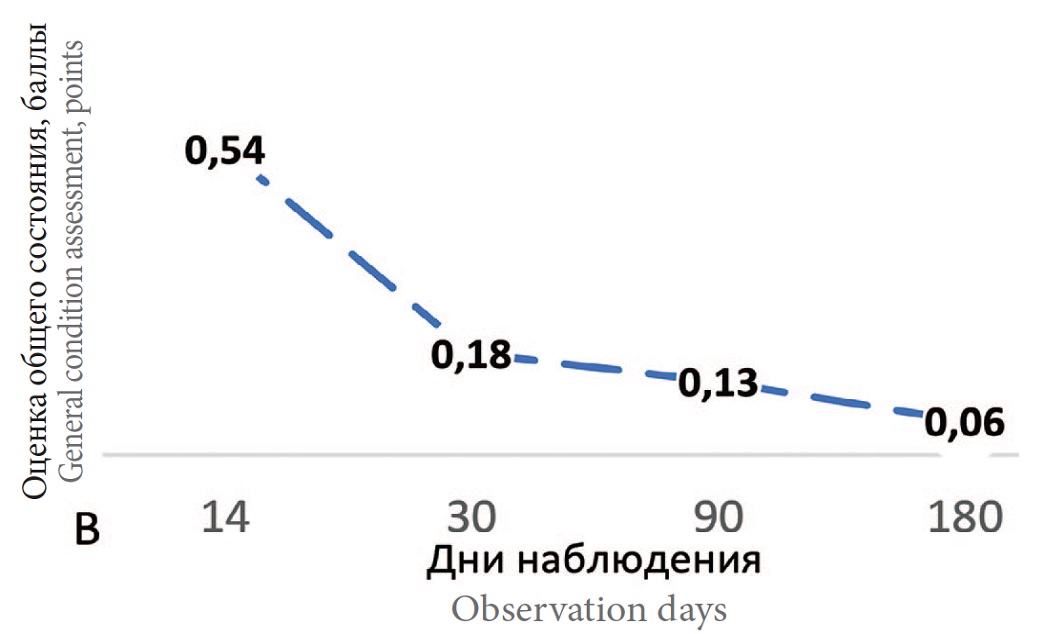
Рис. 2. Динамика показателей разделов опросника ACSS на фоне лечения.
А. Динамика клинических симптомов цистита (суммарный средний балл раздела Typical), средний балл
Б. Динамика качества жизни (суммарный средний балл раздела Quality of life), средний балл
В. Динамика общего состояния пациенток (средний балл раздела Dynamics), средний балл
Fig. 2. Dynamics of the indices of the ACSS sections during the treatment
A. Dynamics of clinical symptoms of cystitis (total average score of the Typical section), average score
Б. Dynamics of the quality of life (total average score of the Quality of life section), average score
В. Dynamics of the general condition of patients (average score of the Dynamics section), average score
Таблица 2. Данные ACSS на визитах «включения» и наблюдения
Table 2. ACSS data from the «inclusion» and follow-up visits
| Показатели ACSS, средние значения ACSS scores, mean values |
День 0 (Визит1) Day 0 (Visit 1) |
День 14 (Визит 2) Day 14 (Visit 2) |
День 30 (ВизитЗ) Day 30 (Visit 3) |
|---|---|---|---|
| Раздел типичные симптомы, средний балл (min - 0, max - 3) Section typical symptoms, average score (min - 0, max - 3) |
|||
| Q1 Учащенное мочеиспускание малыми объемами мочи Q1 Frequent urination with small volumes of urine |
2,35 | 0,51 | 0,2 |
| Q2 Срочные позывы к мочеиспусканию Q2 Urgent urge to urinate |
1,79 | 0,36 | 0,14 |
| Q3 Боль/жжение при мочеиспускании Q3 Pain/burning during urination |
2,21 | 0,3 | 0,1 |
| Q4 Чувство неполного опорожнения МП Q4 Feeling of incomplete emptying of the bladder |
1,88 | 0,36 | 0,1 |
| Q5 Боль или дискомфорт внизу живота Q5 Pain or discomfort in the lower abdomen |
1,90 | 0,28 | 0,09 |
| Q6 Наличие крови в моче Q6 Presence of blood in urine |
0,60 | 0,07 | 0,03 |
| Раздел качества жизни, средний балл (min - 0, max - 3) Quality of life section, average score (min - 0, max - 3) |
|||
| Q11 Выраженность чувства дискомфорта Q11 Severity of discomfort |
2,45 | 0,57 | 0,25 |
| Q12 Симптомы мешали повседневной активности Q12 Symptoms interfere with daily activities |
2,34 | 0,45 | 0,2 |
| Q13 Симптомы мешали общественной активности Q13 Symptoms interfered with social activities |
2,36 | 0,5 | 0,18 |
Сравнение числа эпизодов обострения заболевания до и после проведенной терапии течение 6 месяцев наблюдения показало достоверное снижение вероятности ИМП – примерно в 25 раз для общей выборки и пациенток с неосложненным циститом, для пациенток с осложненным циститом – в 9,6 раз (табл. 3). Примечательно, что среди пациенток с возникшим после лечения рецидивом хронического цистита (62 из 447) только у 1 пациентки (1,6%) отмечено 2 обострения за 6 месяцев наблюдения.
Таблица 3. Количество эпизодов обострения цистита на одного пациента в течение 6 месяцев, предшествующих включению в исследование, и на протяжении периода наблюдения после начала терапии
Table 3. The number of episodes of exacerbation of cystitis per one patient during the 6 months before inclusive in the study and during the follow-up period after the start of therapy
| Группа пациентов Group of patients |
Число обострений цистита на 1 пациента The number of exacerbations of cystitis for 1 patient |
||
|---|---|---|---|
| В течение 6 месяцев наблюдения до терапии Within 6 months before therapy |
К 3 месяцу после начала лечения By 3 months after starting treatment |
К 6 месяцу после начала лечения By 6 months after starting treatment |
|
| Вся выборка (n=447) All patients (n=447) |
2,5 | 0,06* | 0,1* |
| Группа пациентов с неосложненным циститом (n=412) Group of patients with uncomplicated cystitis (n=412) |
2,6 | 0,07* | 0,1* |
| Группа пациентов с осложненным циститом (n=35) Group of patients with complicated cystitis (n=35) |
2,6 | 0,06 | 0,27 |
Примечание: *р-value<0,05 при сравнении результатов с исходными значениями
Note: *p-value<0.05 when comparing results with baseline values
Оценка времени возникновения первого рецидива на фоне проведенной терапии (так называемого безрецидивного промежутка) проводилась только среди пациенток с рецидивами (n=62 из 447). Из этой выборки данные по времени возникновения рецидивов были доступны у 40 пациенток (среди них 32 женщины с неосложненным циститом и 8 – с осложненным).
По данным, представленным в таблице 4, очевидна тенденция к удлинению безрецидивного промежутка после проведенной терапии. Различие оказалось статистически не достоверным при анализе в общей выборке и в подгруппе неосложненных циститов. При этом числовые различия сравниваемых показателей остаются заметными. Такой статистический результат, вероятно, обусловлен малым число рецидивов в подгруппе пациенток с сложенным течением заболевания.
Таблица 4. Длительность безрецидивного периода у пациенток с рецидивами хронического цистита до и после включения в исследование
Table 4. Duration of the relapse-free period in patients with relapses of chronic cystitis before and after inclusion in the study
| Группа пациентов Group of patients |
Средняя длительность безрецидивного периода до терапии пидотимод + нифурател, месяцы (M ± SD) Mean relapse-free period before pidotimod + nifuratel therapy, months (M ± SD) |
Средняя длительность безрецидивного периода до терапии пидотимод + нифурател, месяцы (M ± SD) Mean relapse-free period before pidotimod + nifuratel therapy, months (M ± SD) |
p‑value |
|---|---|---|---|
| Пациенты с рецидивами из всей выборки (n=40) Relaps patients from all patients (n=40) |
2,49 ± 1,43 | 3,18 ± 1,79 | 0,055 |
| Пациенты из группы с неосложненными циститами (n=32) Patients with uncomplicated cystitis(n=32) |
2,50 ± 1,44 | 2,92 ± 1,71 | 0,225 |
В среднем, в 95% случаев отмечалась хорошая переносимость проведенной терапии на каждом визите наблюдения (2–4 визиты) (рис. 3). НЯ наблюдались в 6,7% случаев (30 из 447), и только у 2 пациентов потребовалась временная отмена терапии на 14-й и 30-й дни наблюдения в связи с обострением хронических заболеваний желудочно-кишечного тракта.
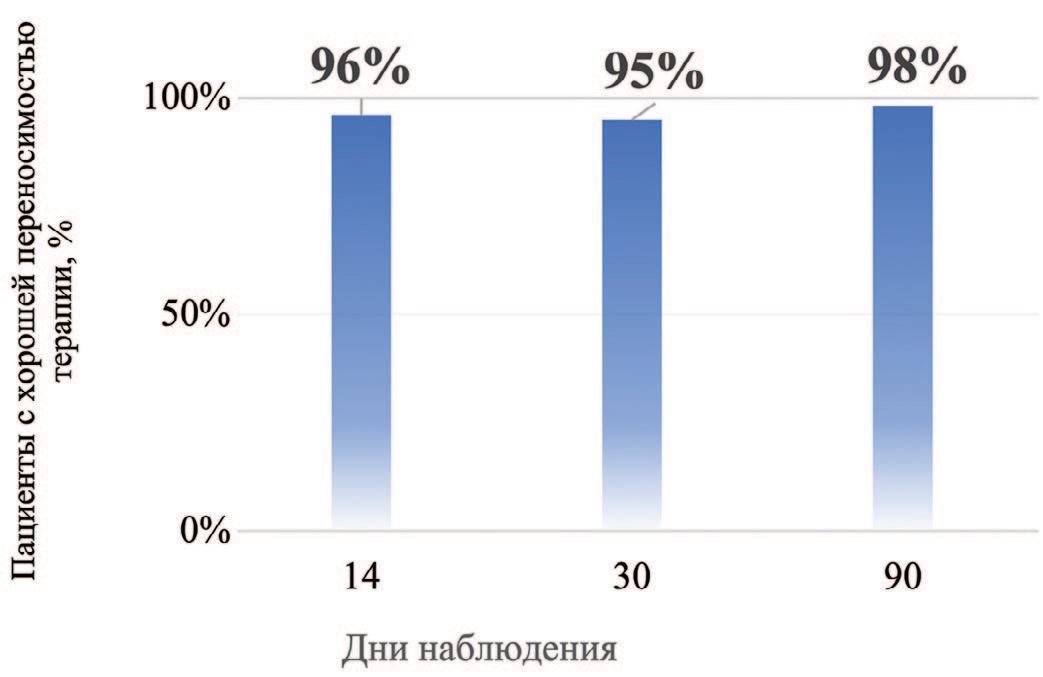
Рис. 3. Доля пациентов с хорошей переносимостью терапии в течение 3 месяцев наблюдения после терапии
Fig. 3 Proportion of patients with good tolerance to therapy during 3 months of follow-up after therapy
ОБСУЖДЕНИЕ
Данное исследование является первым масштабным опытом сочетанного назначения пидотимода (Имунорикс®) и нифуратела (Макмирор®) для лечения инфекций нижних мочевых путей, поэтому в обсуждении нам придется апеллировать к литературным ссылкам, описывающим раздельное использование этих препаратов или содержащим отчеты об их назначении в других комбинациях.
Нифурател – химиотерапевтический препарат из группы нитрофуранов, обладающий активностью в отношении целого ряда возбудителей (аэробных и анаэробных бактерий, грибов, простейших), в том числе в отношении E. coli, Klebsiella spp., Enterobacter spp, Enterococcus spp., Proteus mirabilis и других микроорганизмов, которые являются наиболее частыми возбудителями ИМП [23]. Нифурател отнесен Федеральными клиническими рекомендациями «Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов» 2022 г. к препаратам, которые могут применяться в лечении острых неосложненных циститов, а также для профилактики посткоитального цистита [24].
Нифурател обладает высокой эффективностью и низкой токсичностью, что обуславливает широкий спектр его клинического применения. R.N. Gruneberg в своем исследовании сравнивал бактериологические параметры нифуратела с нитрофурантоином в отношении 409 уропатогенов [25]. Минимально ингибирующие концентрации у нифуратела были ниже, чем у нитрофурантоина.
Важным свойством нифуратела является его активность в отношении возбудителей вагинальных инфекций, в том числе бактериального вагиноза, которые являются фактором риска развития обострения хронического цистита [8, 26].
Добавление к антибактериальным препаратам лекарственных средств с иммуномодулирующими свойствами является стандартной практикой на протяжении последних 15 лет. Пидотимод имеет более чем 30-летний опыт использования в лечении респираторных инфекций у детей и взрослых, в то время как публикаций о применении препарата в урологической практике встречается значительно меньше, что послужило поводом к проведению представленной выше работы.
В ходе похожего по дизайну с настоящей работой исследования оценивалась эффективность пидотимода в профилактике рецидивов хронической мочевой инфекции у детей на протяжении 6 месяцев наблюдения. Результаты показали, что в группе пациентов, получавших пидотимод в сочетании с антибактериальной терапией, рецидивы инфекций мочевой системы отсутствовали, в то время как в группе сравнения (монотерапия антибиотиками без иммуномодуляции) примерно в 30% случаев были отмечены обострения мочевой инфекции [27]. Эти данные полностью коррелируют с полученными нами результатами. Авторы описали снижение частоты эпизодов пиелонефрита в течение 6 месяцев в сравнении с исходными данными и группой контроля (р<0,01), сокращение длительности рецидивов (5,6 против 9,9 дней) и длительности применения антибактериальных средств для их купирования (10,6 против 14,7 дней) в сравнении с группой контроля (р<0,01). Также было отмечено увеличению безрецидивного промежутка (4,2 мес. против 2,6 мес.). В лабораторных показателях было зафиксировано снижение уровня провоспалительных цитокинов (IL-6 и IL-8) и нормализация гранулоцитарно-макрофагального колониестимулирующего фактора, что косвенно свидетельствует об уменьшении активности воспалительного процесса в паренхиме почек. За счет использования пидотимода удалось обеспечить стимуляцию клеточного иммунитета – отмечено достоверное снижение содержания IL-10 с тенденцией к повышению интерферона ϒ (ИФН ϒ), значительное нарастание соотношения ИФН ϒ/IL-10 [27].
Аналогичные закономерности описаны в статье Е. Clemente и соавт. Кроме снижения риска рецидивов ИМП на 69% у пациентов, получавших пидотимод, исследователи зафиксировали более быстрое исчезновение симптомов заболевания – 9,6 дней на фоне комбинированного лечения против 12,3 дней в группе стандартной антибактериальной терапии. На фоне иммуномодулирующей терапии продолжительность курса приема антибактериальных препаратов оказалась короче – 6,9 против 8,3 дней. При этом достигнутый терапевтический и симптоматический эффекты оказались тождественными. Серьезных побочных эффектов в ходе исследования не наблюдалось. Легкие реакции (4 эпизода тошноты/рвоты, 1 эритема) зафиксированы у 5 пациентов (2 пидотимода, 3 плацебо), и, по мнению авторов статьи, были связаны с сопутствующей антибактериальной терапией [28].
В проспективном наблюдательном исследовании А.В. Ануфриевой и соавт. сочетанное применение пидотимода с антибиотиком у детей при обострении хронического пиелонефрита сопровождалось более быстрым купированием основных симптомов заболевания в сравнении со стандартной терапией. Анализ лабораторных показателей иммунного ответа свидетельствовал о нормализации показателей. На фоне применения пидотимода зафиксировано снижение уровня IL-17 в моче в 3 раза, а иммуноглобулин А (sIgA) повысился в 16,9 раза, отмечено снижение активности щелочной фосфатазы лейкоцитов и уменьшение интенсивности свободнорадикального окисления на системном уровне [29].
Попытки применения других иммуномодуляторов для профилактики рецидивов хронической инфекции МВП не всегда были столь успешными. Так, A. Hattner и соавт. опубликовали данные об опыте применения вакцины, приготовленной из 4 серотипов ExPEC4V E.coli. С 20 января 2014 г. по 27 августа 2014 г. 93 женщины получали целевую дозу ExPEC4V, а 95 – получали плацебо. Вакцина хорошо переносилась: серьезных нежелательных явлений, связанных с вакциной, не было. Были получены значимые колебания иммуноглобулина G (IgG) для всех серотипов: на 30-й день по сравнению с исходными титрами конъюгатов антигенов полисахаридов E. coli O1A повысились в 4,6 раза, титры O2 – в 9,4 раза, O6A – в 4,9 раза и О25В – в 5,9 раз выше (суммарный р<0,0001). Иммунный ответ сохранялся через 270 дней. Лизинговая активность опсонофагоцитов показала функциональность антител, но при этом снижение заболеваемости ИМП в группе иммунотерапии по сравнению с плацебо-группой зафиксировано не было (p=0,522) [30].
В другом исследовании описан опыт использования препарата ОM-89S (лиофилизированный лизат E. coli), полученного с использованием модифицированного литического процесса, в рамках рандомизированного двойного слепого исследования с участием 451 женщины с рецидивирующими неосложненными ИМП. Препарат назначали курсом на 3 месяца с последующим 3-месячным наблюдением. Больным контрольной группы назначалось плацебо. В следующей фазе исследования лиофилизированный лизат E.coli назначался тремя последовательными месячными курсами, состоявшими из 10 дней активной терапии и последующими 20 днями приема плацебо. Группой сравнения для второй фазы исследования послужили пациенты, получавшие 50 мг нитрофурантоина ежедневно в течение 30 дней с последующим 3-месячным наблюдением. В обеих фазах исследования достоверных различий в полученных результатах между сравниваемыми группами не выявлено [31].
Следует отметить публикации о положительном опыте иммуноактивной профилактики ИМП с применением перорального бактериального лизата OM-89. В ходе 6-месячного проспективного обсервационного исследования, проведенного в семи странах (Египет, Германия, Ливан, Перу, Польша, Португалия и Швейцария) в 2005–2006 гг., из 575 участников 5% не получали профилактики, в то время как остальные (95%) получали OM-89 (QD в течение 90 дней), после чего следовал 3-месячный период без лечения. Оценка настроения с использованием Госпитальной шкалы тревоги и депрессии (HAD) показала, что у 32%, 28% и 2% пациентов в начале исследования наблюдалась легкая, умеренная и тяжелая степень депрессии соответственно. После 6-месячной профилактики отмечено снижение общего балла HAD на 32%. Число рецидивов ИМП сократилось на 59%, что было статистически значимым (p≤0,0001). Примечательно, что полученные нами данные демонстрируют большую эффективность пидотимода по этому показателю, хотя разница в дизайне исследований не позволяет проводить прямых сравнений [32].
Складывается впечатление, что синтетические иммуномодуляторы, к которым относится пидотимод, могут иметь хорошие перспективы в лечении рецидивирующей ИМП. Демонстрируемая клиническая результативность пидотимода объясняется его мультинаправленным механизмом действия. Препарат, модулируя активность врожденных и адаптивных компонентов иммунитета на разных этапах, позволяет обеспечить полноценную иммунную защиту организма от инфекционных агентов.
Полученные нами данные являются основанием для дальнейших исследований клинико-лабораторной эффективности применения пидотимода на фоне антибактериальной терапии нифурателом у пациентов с хроническими рецидивирующими ИМП.
ВЫВОДЫ
По итогам полученных результатов исследования, можно сделать следующее заключение.
1. Применение пидотимода на фоне антибактериальной терапии нифурателом позволяет достичь ремиссии хронического цистита у женщин в течение 6 месяцев наблюдения в 86% случаев: у пациенток с осложненным хроническим циститом – в 74,3%; у пациенток с неосложненным циститом – в 87,1%.
2. У пациенток с неосложненным хроническим циститом полное разрешение симптомов заболевания отмечено в среднем на 7-й день терапии.
3. На фоне терапии получено достоверное улучшение клинических симптомов цистита, а также качества жизни с сохранением результатов в течение 6 месяцев наблюдения.
4. Отмечено достоверное снижение числа рецидивов хронического цистита после терапии при наблюдении в течение 6 месяцев.
5. Наблюдается устойчивая тенденция к удлинению безрецидивного промежутка после терапии в сравнении с исходным данными при наблюдении в течение 6 месяцев.
6. Хорошая переносимость терапии зафиксирована у 95% пациентов на протяжении всего курса лечения.
Достигнутые в исследовании показатели позволяют рекомендовать описанную схему назначения этих препаратов к практическому использованию для лечения и профилактики хронической рецидивирующей ИМП у женщин.







