Применение ботулинического токсина А первого типа (БТА) — эффективный метод лечения пациентов как с нейрогенной (НДГ), так и с идиопатической (ИДГ) детрузорной гиперактивностью рефрактерной к медикаментозной терапии. По данным различных авторов эффективность ботулинотерапии превышает 70%, а частота неудовлетворительных результатов составляет менее 5% [1-6]. Эффективность лечения определяется уменьшением частоты императивных позывов, эпизодов недержания мочи, а у большинства больных с ИДГ удается полностью ликвидировать недержание мочи [2,3]. Качество жизни больных с НДГ, так и с ИДГ после ботулинотерапии достоверно улучшается [5,6].
С момента начала применения ботулинотерапии обсуждается вопрос об эффективной и безопасной дозе препарата. Первоначально для лечения гиперактивного мочевого пузыря (ГМП) применяли БТА в дозе 300 ЕД, разведенной в 30 мл физиологического раствора. Препарат (по 10 ЕД в 1 мл физиологического раствора) вводили в 30 точек мышечной стенки мочевого пузыря, исключая зону треугольника Льето [7,8]. Однако по мере накопления опыта появились данные о том, что положительный эффект может быть достигнут при меньшей дозе: 100 — 200 ЕД [9-11]. Мультицентровые исследования, проведенные в группе пациентов с гиперактивностью детрузора, которым вводили 100-300 ЕД БТА, показали, что клиническая эффективность метода достигает 80% независимо от дозы препарата [9,11,12]. Более того, имеются данные о возможности достижения терапевтического эффекта даже при введении 50 ЕД БТА [4,13], хотя не все авторы разделяют эту точку зрения [14].
Важным показателем эффективности ботулинотерапии является длительность сохранения нормального мочеиспускания после ботулинотерапии, которая значительно варьирует от 6 месяцев до 1-1,5 лет [3,6,14]. После возвращения симптомов дизурии требуются повторные инъекции БТА. Однако остается открытым вопрос, связаны ли эти различия с дозой БТА и видом гиперактивности (НДГ или ИДГ).
Стремление к уменьшению дозы ботулотоксина связано с возрастанием частоты развития задержки мочи при использовании высоких доз препарата [12,15-18].
Поскольку больные с НДГ, как правило, имеют более выраженные расстройства мочеиспускания, чем пациенты с ИДГ, то у этих пациентов рекомендуется использование более высоких доз БТА, в связи с чем у них возрастает риск развития обструктивных осложнений [19-22]. Однако до какой степени возможно безопасное увеличение дозы БТА у больных НДГ остается дискуссионным.
Учитывая эти факты, мы сочли целесообразным провести анализ эффективности применения БТА у больных с НДГ и ИДГ, рефрактерными к холинолитической терапии, и оценить вероятность развития задержки мочеиспускания в раннем периоде после лечения, в зависимости от использованной дозы токсина.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проведено на основании анализа историй болезни 97 больных ГМП, у которых при урологическом обследовании не было выявлено инфравезикальной обструкции. Среди больных, включенных в исследование, было 37 (38,1%) мужчин и 60 (61,9%) женщин. Средний возраст больных составил 41,9±2,3 лет (от 18 до 83 лет, (средний возраст женщин — 44,0±2,4 года (18-83 г.), а мужчин — 38,4±2,2 года (18-68 лет)).
Все больные ранее получали медикаментозную терапию холинолитиками, однако она оказалась неэффективна у 69 больных или сопровождалась выраженными побочными эффектами у 28 пациентов, что и явилось причиной отмены этих препаратов и проведения ботулинотерапии.
При отборе больных на данный вид лечения учитывали следующие факторы:
- отсутствие инфекции мочевых путей;
- отсутствие эпизодов острой
- задержки мочи в анамнезе;
- способность пациента проводить самокатетеризацию мочевого пузыря, если в ближайшем послеоперационном периоде в этом возникнет необходимость.
Всем больным проведено стандартизированное общеклиническое урологическое обследование, включающее сбор анамнеза; физикальный осмотр; лабораторные анализы (общий анализ крови и мочи, биохимический анализ крови, по показаниям — бактериологическое исследование мочи); рентгенографию грудной клетки; ультразвуковое исследование (УЗИ) органов брюшной полости, почек, мочевого пузыря (у мужчин — предстательной железы). При выявлении признаков мочевой инфекции проводили антибиотикотерапию в соответствии с результатами бактериологического исследования мочи до полной эрадикации возбудителя.
Для объективной оценки характера мочеиспускания, и исключения инфравезикальной обструкции выполняли урофлоуметрию. У всех больных максимальная скорость мочеиспускания (Qmax) превышала 15 мл/сек: средние значения — 21,8± 0,6 мл/сек; у женщин — 25,8±0,4 мл/сек; у мужчин — 18,2±0,3 мл/сек. Параметры функционального состояния мочевого пузыря и эффективность ботулинотерапии оценивали с помощью комбинированного уродинами-ческого исследования (КУДИ), проведенного до и после процедуры.
По данным комплексного обследования, НДГ выявлена у 53(55%) больных, ИДГ — у 44 (45%). У 33 (34%) больных, императивные позывы приводили к эпизодам недержания мочи: 19 пациентов с НДГ и 14 — с ИДГ.
Инъекции БТА в мочевой пузырь осуществляли под общей анестезией. Через цистоскоп мочевой пузырь наполняли 200-300 мл физраствора для обеспечения хорошей визуализации внутренней поверхности мочевого пузыря. В настоящем исследовании использовали ботулинический токсин А первого типа — Ботокс (Allergan). Препарат инъецировали в различные участки детрузора за исключением треугольника Льето (во избежание развития пузырно-мочеточникового рефлюкса), в 20-30 точек в зависимости от суммарной дозы препарата, которая колебалась от 100 до 300 ЕД. Препарат вводили по 0,5-1,0 мл на глубину 2-4 мм, чтобы исключить перфорацию стенки мочевого пузыря.
Через 1-2 недели больные проходили контрольное обследование для оценки их состояния, выявления мочевой инфекции, дизурии, задержки мочеиспускания, а также для определения остаточной мочи при ультразвуковом исследовании. При необходимости, проводили коррегирующую терапию. В дальнейшем, контроль состояния пациентов осуществляли с интервалом 3-6 месяцев.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
По данным обследования через 3 месяца у подавляющего числа пациентов практически нормализовалась частота мочеиспусканий: она уменьшилась с 14,5±0,2 до 6,9±0,1 в сутки (р<0,0 01). При этом доля лиц с имевшими место эпизодами императивного недержания мочи также достоверно уменьшилась с 34% до 6% (р<0,001). У 27 из 33 больных недержание мочи полностью исчезло. Все пациенты с сохранившимся недержанием мочи имели НДГ. У них до ботулинотерапии регистрировали более 30 случаев недержания мочи в неделю, тогда как после лечения их частота существенно уменьшилась, составив менее 20 случаев (в среднем, 9±2 эпизода в неделю). При ИДГ ботулинотерапия способствовала полной ликвидации недержания мочи у всех больных.
Данные КУДИ, проведенного до и после БТА-терапии, также выявили достоверное (р<0,001) улучшение всех показателей функционального состояния мочевого пузыря у всех пациентов (табл. 1):
- максимальная цистометрическая емкость (МСС) возросла в 2 раза;
- объем мочевого пузыря при возникновении ощущения его наполнения (FS) увеличился, примерно, в 2,5 раза;
- объем мочевого пузыря, превышение которого вело к возрастанию внутрипузырного давления (NDF) и развитию первого непроизвольного сокращения детрузора, увеличился в 1,5 раза, а амплитуда этого сокращения достоверно уменьшалась практически в 2 раза.
Таблица 1. Изменения параметров КУДИ с детрузорной гиперактивностью
| Показатель | Средние значения | Норма | |
|---|---|---|---|
| До лечения | После лечения | ||
| Объем мочевого пузыря при первом ощущении наполнения(FS)(мл) | 38,5±1,8 | 96,3±3,3*** | 150-200 |
| Объем мочевого пузыря при первом непроизвольном сокращении (мл) | 113±9 | 203±10*** | Нет |
| Амплитуда Pdet при первом непроизвольном сокращении (см. водн. ст.) | 38,8±2,7 | 18,5±1,3*** | Нет |
| Максимальная цистометрическая емкость мочевого пузыря (MCC) (мл) | 162±8 | 320±9*** | 400-600 |
| NDF (мл) | 136±12 | 224±9*** | |
Достоверность различий: *** p<0,001
Различий по степени улучшения таких параметров КУДИ, как MCC и NDF, между группами больных с нейрогенной и идиопатической гиперактивностью не выявили. Отмечен меньший прирост FS и объема мочевого пузыря при первом непроизвольном сокращении детрузора как и меньшее снижение его амплитуды у больных с НДГ. При этом у них значения этих показателей до лечения были достоверно хуже, чем при ИДГ.
Важный момент — это длительность эффекта БТА-терапии, поскольку со временем симптомы ГМП возвращаются. Длительность эффекта оценивали по интервалу времени между инъекцией БТА и возобновлением дизурии до уровня близкому к исходному, что заставляло больных вновь обращаться за лечением.
У всех пациентов продолжительность действия БТА составила не менее 6 месяцев; у 74% — 9 и более мес.; у 52% — более 1 года; у 17% — до 1,5 лет и у 9% — до 2,5 лет (рис. 1). То есть, у половины пациентов улучшение функции мочевого пузыря сохранялось более 1 года после ботулинотерапии. Достоверных различий по длительности терапевтического эффекта между исследуемыми группами не выявлено.
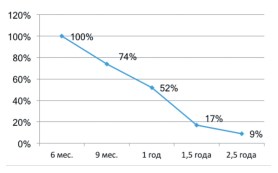
Рис. 1. Распределение больных по длительности эффекта ботулинотерапии (% от общего числа больных)
В соответствии с международными рекомендациями у больных с НДГ необходимо использовать более высокие дозы БТА – от 200 до 300 ЕД, тогда как при ИДГ назначают 100-200 ЕД [20-22]. В настоящем исследовании мы, в целом, придерживались этих рекомендаций, однако в зависимости от клинической ситуации варьировали вводимую дозу БТА. В среднем, при НДГ в мочевой пузырь вводили 256±8 ЕД токсина (200 – 300 ЕД), а при ИДГ – 185±7 ЕД (100 – 300 ЕД). Различия по вводимой дозе оказались статистически достоверными (p<0,05).
У больных с НДГ не удалось установить корреляции между дозой БТА и длительностью улучшения функции мочевого пузыря (коэффициент корреляции Пирсона r=-0,41; достоверность коррелятивных связей p=0,097). Независимо от дозы токсина длительность терапевтического эффекта колебалась от 6 до 14 месяцев, за исключением 1 больного, которому ввели 200 ЕД БТА с продолжительностью эффекта в 30 месяцев (рис. 2).
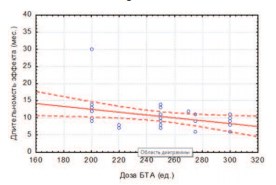
Рис. 2. Зависимость между дозой БТА (ед) и длительностью терапевтического эффекта у больных с НДГ (мес.)
В то же время в группе больных с ИДГ выявили достоверную негативную корреляцию между этими параметрами (рис. 3). При дозе БТА более 200 ЕД продолжительность терапевтического эффекта не только не возрастала, но даже уменьшалась. Если более чем у половины пациентов, которым ввели до 200 ЕД токсина, эффект лечения сохранился 1 год и более, то в случае высоких доз БТА – длительность эффекта не превысила 10 месяцев (коэффициент корреляции Пирсона r=-0,60 при достоверности коррелятивных связей р=0,038). Возможно, что выявленная негативная корреляция между дозой ботулотоксина и продолжительностью эффекта связана с тем, что высокие дозы препарата вводили пациентам с наиболее выраженными уродинамическими расстройствами. Это требует дополнительного анализа.
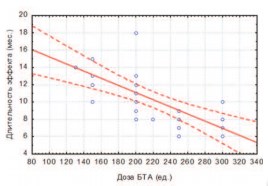
Рис. 3. Зависимость между дозой БТА (ед.) и длительностью терапевтического эффекта у больных с ИДГ (мес.)
Еще один важный вопрос связан с дозой БТА и вероятностью развития затруднения мочеиспускания. Проведенный анализ показал, что увеличение объема остаточной мочи более 200 мл, что считается признаком выраженного затруднения мочеиспускания [23], в первую неделю после БТА-терапии зарегистрировано у 16 пациентов (16%). До начала лечения у всех пациентов объем остаточной мочи не превышал 40 мл, поскольку в исследуемую группу отбирали только лиц без признаков инфравезикальной обструкции. У 12 больных после ботулинотерапии пришлось прибегнуть к периодической катетеризации мочевого пузыря (12%). Учитывая вероятность развития именно этого осложнения, пациентов до начала БТА-терапии обучили методике стерильной самокатетеризации мочевого пузыря. Во всех случаях необходимость в этой процедуре исчезла в течение 2 недель после введения токсина.
При сопоставлении частоты задержки мочи и вида детрузорной гиперактивности оказалось, что затруднение мочеиспускания развивалось значимо чаще у пациентов с НДГ, чем у больных с ИДГ: 23% и 9%, соответственно (p<0,05). Достоверно различалась и частота необходимости самокатетеризации мочевого пузыря: 7% и 17%, соответственно (p<0,05).
Учитывая, что больным с НДГ, как правило, вводили более высокую дозу ботулотоксина, чем больным с ИДГ, проанализировали влияние этого фактора на частоту развития задержки мочи. Мы не сравнивали эти показатели отдельно по группам НДГ и ИДГ, поскольку небольшое число больных с задержкой мочи делало этот анализ недостоверным, а оценили влияние дозы БТА на развитие задержки мочи в общей популяции.
Оказалось, что после введения препарата в дозе от 100 до 180 ЕД, ни у одного из 11 больных не появилось признаков выраженной задержки мочи с остаточным объемом более 200 мл. При введении 200 ЕД БТА это состояние развилось у 3 из 36 пациентов (8%), после введения 250 ЕД токсина — у 5 из 26 (19%), после 300 ЕД — у 5 из 18 (28%). То есть, выявлена выраженная тенденция к возрастанию риска развития задержки мочи при увеличении дозы ботулотоксина (рис. 4).
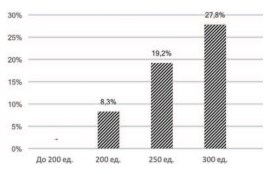
Рис. 4. Частота развития выраженной задержки мочеиспускания при различных дозах БТА
Важно отметить, что 4 из 5 больных, которым инъецировали 300 ЕД БТА, относились к группе НДГ. Тем не менее, более высокая частота развития задержки мочи при нейрогенной дисфункции может быть связана и с тем, что эти пациенты получили и более высокую дозу токсина.
Аналогичная динамика была выявлена при сопоставлении дозы БТА и необходимости в катетеризации мочевого пузыря. После введения менее 200 ЕД препарата таких случаев зарегистрировано не было, тогда как после инъекции 250 и 300 ЕД – катетеризация стала необходима у 15% и 28% соответственно (рис. 5).
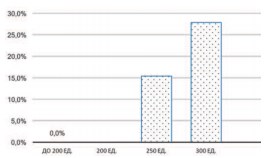
Рис. 5. Частота необходимости периодической катетеризации мочевого пузыря (% больных) при различных дозах БТА
Таким образом, превышение дозы в 200 ЕД БТА сопровождалось повышением необходимости в самокатетеризации мочевого пузыря в раннем периоде после ботулинотерапии. Обращает на себя внимание тот факт, что при дозе токсина в 200 ЕД, ни у одного из 3 пациентов, у которых объем остаточной мочи превысил 200 мл, проведения самокатетеризации мочевого пузыря не потребовалось, тогда как при дозе 250 ЕД и выше, в ней нуждались все пациенты.
Возникшая после БТА-терапии задержка мочи не вызвала необходимости проведения дополнительных вмешательств: у всех больных самостоятельное мочеиспускание восстановилось в течение 2 недель после инъекции токсина.
С учетом того, что не удалось получить убедительных доказательств увеличения эффективности ботулинотерапии на фоне применения высоких доз БТА и, принимая во внимание нарастание риска задержки мочи, предпочтительной выглядит тактика использования возможно меньших доз токсина при оптимальном соотношении «эффективность/безопасность», с которой также согласен ряд авторов [9-11,13].
ОБСУЖДЕНИЕ
Проведенный анализ показал, что высокие дозы БТА не гарантируют более длительного улучшения функции гиперактивного мочевого пузыря. У всех больных, вошедших в исследование, как при нейрогенной, так и при идиопатической формах гиперактивности, 200 ЕД токсина оказались, в целом, так же эффективны, что и более высокие дозы. У пациентов с ИДГ действенными оказались и более низкие дозы (100-150 ЕД), тогда как при дозе 250-300 ЕД даже проявилась тенденция к снижению эффективности.
Наряду с равной эффективностью, более низкие дозы ботулотоксина уменьшают риск развития затруднения мочеиспускания, характерного осложнения этого вида терапии. Проблема возрастания случаев задержки мочи при увеличении дозы БТА является актуальной и обсуждается в литературе [11,17-19,23,24]. Наш опыт показал, что с увеличением дозы от 200 до 300 ЕД достоверно возрастает частота случаев значительного увеличения объема остаточной мочи и необходимости в периодической катетеризации мочевого пузыря. Нередко, даже превышение дозы 150 ЕД ведет к затруднению мочеиспускания с увеличением объема остаточной мочи больше 200 мл [12,16]. X. Deffieux и соавт. даже рекомендуют у больных с ГМП без недержания мочи использовать минимальную дозу — 50 ЕД, а для ликвидации ургентного недержания мочи — 100 ЕД БТА, что по мнению авторов способствует профилактике задержки мочи [15]. В то же время, по данным других исследователей, доза 50 ЕД БТА является недостаточной, а результаты ее применения — не отличаются от группы плацебо [14].
ЗАКЛЮЧЕНИЕ
Полученные в ходе настоящего исследования данные позволяют рекомендовать использование возможно низких доз БТА, без снижения эффективности терапии и с меньшей вероятностью развития побочных эффектов в виде задержки мочи: 100 ЕД при ИДГ и 200 ЕД — при НДГ. С учетом разнообразия клинических и уро-динамических проявлений болезни, доза БТА должна зависеть от выраженности исходных показателей дисфункции мочевого пузыря и определяться в индивидуальном порядке.
ЛИТЕРАТУРА
1. Мазо Е.Б., Кривобородов Г.Г., Школьников М.Е., Ефремов Н.С. Применение ботулинического токсина в урологии. Фарматека 2006;(10): 125.
2. Cruz F, Nitti V. Chapter 5. Clinical data in neurogenic detrusor hyperactivity (NDO) and over-active bladder (OAB). Neurourol Urodyn 2014;33 (Suppl. 3):26-31. doi: 10.1002/nau.22630.
3. Henriet B, Roumeguere T. Botulinum toxin injection for refractory non-neurogenic overactive bladder. Systematic rewiew. Rev Med Brux 2015; 36(1): 29-37.
4. Chibelean C, Nechifor-Boila IA. Botulinum neurotoxin A for overactive bladder treatment: advantages and pitfalls. Can J Urol 2015;22(2): 7681-7689.
5. Drake MJ, Nitti VW, Ginsberg DA, Brucker BM, Hepp Z, McCool R, et al. Comparative assessment of the efficacy of onabotulinumtoxinA and oral therapies(anticholinergics and mirabegron) for overactive bladder: a systematic review and network metaanalysis. BJU Int 2017. doi: 10.1111/ bju.13945.
6. Tyagi P, Kashyap M, Yoshimura N, Chancellor M, Chermansky CJ. Past, present and future of chemodenervation with botulinum toxin in the treatment of overactive bladder. J Urol 2017;197(4):982-990. doi: 10.1016/ j.juro.2016.11.092.
7. Radziszewski P, Borkowski A. Botulinum toxin type A intravesical injections for intractable bladder overactivity. Eur Urol 2002; 1 (Suppl. 1):A526.
8. Reitz A, Stohrer M, Kramer G, Del Popolo G, Chartier-Kastler E, Pannek J. European experience of 200 cases treated with botulinum-A toxin injections into the detrusor muscle for urinary incontinence due to neurogenic detrusor overactivity. Eur Urol 2004;45(4);510-515.
9. Chancellor MB, Patel V, Leng WW, Shenot PJ, Lam W, Globe DR, et al. Onabotulinimtoxin A improves quality of life in patients with neurogenic detrusor overactivity. Neurourol 2013;81(9): 841-848. doi: WNL.0b013e3182a2ca4d.
10. Eldred-Evans D, Dasgupta P. Use of botulinum toxin for voiding dysfunction. Transl Androl Urol 2017;6(2):234-251. doi: 10.21037/tau.2016.12.05.
11. Moyson J, Legrand F, Vanden Bossche M, Quackels T, Roumeguere T. Efficacy and safety of available therapies in the management of idiopathic overactive bladder: A systematic review of the literature. Prog Urol 2017;27(4):203-228. doi: 10.1016/j.purol.2016.12.011.
12. Dmochowski R, Chapple C, Nitti VW, Chancellor M, Everaert K, Thompson C, et al. Efficacy and safety of onabotulinumtoxinA for idiopathic overactive bladder: a double-blind, placebo controlled, randomized, dose ranging trial. J Urol 2010;184:2416-22.
13. Irwin DE, Milsom I, Kopp Z, Abrams P. Symptom bother and health careseeking behavior among individuals with overactive bladder. Eur Urol 2008; 53: 1029-1037.
14. Denys P, Le Normand L, Ghout I, Costa P, Chartier-Kastler E, Grise P, et al. Efficacy and safety of low doses of onabotulinumtoxinA for the treatment of refractory idiopathic overactive bladder: a multicentre, double-blind, randomised, placebo-controlled doseranging study. Eur Urol 2012;61:520-9. doi: 10.1016/j.eururo.2011.10.028.
15. Deffieux X, Fatton B, Denys P, Chartier-Kastler E, Amarenco G, Haab F, Costa P, et al. Intradetrusor injection of botulinum toxin for female refractory idiopatic overactive bladder syndrome. J Gynecol Obstet Biol Reprod 2014; 43(8): 572-580. doi: 10.1016/j.jgyn.2014.06.011.
16. Christiansen FE, Pedersen TB, Juel J, Kirkeby HJ. Single-centre experience with intradetrusor injection of onabotulinumtoxinA: a retrospective study of the years 2003-2012 in a Danish population. Scand J Urol 2017 Jul 12:1-5. doi: 10.1080/21681805.2017.1329228.
17. Osborn DJ, Kaufman MR, Mock S, Guan MJ, Dmochowski RR, Reynolds WS. Urinary retention rates after intravesical onabotulinumtoxin A injection for idiopathic overactive bladder in clinical practice and predictors of this outcome. Neurourol Urodyn 2015; 34:675-8. doi: 10.1002/nau.22642.
18. Cox L, Cameron AP. Onabotulinumtoxin A for the treatment of overactive bladder. Res Rep Urol 2014;6:79-89. doi: 10.2147/RRU.S43125.
19. Martins da Silva C, Chancellor MB, Smith CP, Cruz F. Use of botulinum toxin for genitourinary conditions: what is the evidence? Toxicon 2015;107 (PtA):141-147. Doi: 10.1016/j.toxicon.2015.07.333.
20. Jimenez-Cidre MA, Arlandis-Guzman S; en representacion del Grupo Espanolpara el uso de Toxina Botullnica en Urologla (ALLURA). Onabotu-linumtoxin A in overactive bladder: Evidence-based consensus recommendations. Actas Urol Esp. 2015. pii: S0210-4806(15)00152-7. doi: 10.1016/ j.acuro.2015.04.001.
21. Bauer RM, Seif C, Bschleipfer T, Reitz A, Schultz-Lampel D. Use of botulinum toxin type A in non-neurogenic overactive bladder. Recommendations of the Working Group Urological Functional Diagnostics and Urology in Women. Urologe A 2015;54(3):368-72. doi: 10.1007/s00120-014-3658-2.
22. Nambiar A, Lucas M. Chapter 4: Guidelines for the diagnosis and treatment of overactive bladder (OAB) and neurogenic detrusor overactivity (NDO). Neurourol Urodyn 2014;33(Suppl )3:21-5. doi: 10.1002/nau.22631.
23. Collins L, Sathiananthamoorthy S, Fader M, Malone-Lee J. Intermittent catheterisation after botulinum toxin injections: the time to reassess our practice. Int Urogynecol J 2017 Jan 23. doi: 10.1007/s00192-017-3271-1.
24. Kim SH, Habashy D, Pathan S, Tse V, Collins R, Chan L. Eight year experience with botulinum toxin type-A injections for the treatment of non-neurogenic overactive bladder: are repeated injections worthwhile? Int Neurourol J. 2016;20(1):40-6. doi: 10.5213/inj.1630450.225.







