В мире ежегодно регистрируется более 15 тысяч новых случаев почечно-клеточного рака, что составляет 3% в структуре общей онкологической заболеваемости населения и выводит его на третье место среди онкоурологической патологии. Внедрение и разработка новых препаратов таргетной и иммунотерапии пока не обеспечивает продолжительного эффекта при диссеминированных формах болезни и не оправдано при ее локализованных вариантах. Раннее выявление и хирургическое лечение являются единственными эффективными способами сохранения жизни пациентов и дают шанс на получение длительного контроля над опухолью [1,2]. Немаловажным аспектом помощи этой категории больных является обеспечение высокого качества жизни, что, зачастую, заключается в обеспечении сохранности почечной функции. Эффективность и приоритет неф-рон-сберегающего лечения пациентов с почечно-клеточным раком и опухолями до 4 см последние пять лет не оспаривается и рекомендуется как метод выбора ведущими урологическими ассоциациями [3-5]. Эффективность резекции почки или, так называемой парциальной нефрэктомии, показана и при опухолях большего размера. Особым контингентом всегда были пациенты с единственной или единственной функционирующей почкой, которым данный вид лечения рассматривался как обязательный [1,6]. Это объяснимо тем, что в случае перевода пациента в ренопривное состояние, проведение любого вида заместительной почечной терапии повышает риск прогрессии опухоли. Так в обычной популяции наличие терминальной стадии хронической почечной недостаточности (ТХПН) повышает риск развития почечно-клеточного рака в 4 раза у пациентов, находящихся на диализе, и в 3,5 раза - после трансплантации почки.
Критическим моментом при резекции почки является эффективность и время закрытия почечной раны, т.е. обеспечение гемостаза, что наибее актуально при опухолях больших размеров и имеющих инвазивный рост [4-6]. Резекция почки у таких пациентов с одной стороны требует выключения органа из кровотока, а с другой - использования нефропротективных приемов. К последним стоит отнести локальную гипотермию ледяной крошкой [1], канюляцию и локальную перфузию кустадиолом 6,7], экстракорпоральную резекцию и ортотопическую трансплантацию [1,2], экстракорпоральную резекцию и гетеротопическую трансплантацию [1,9-11]. Каждый из перечисленных методов имеет свои преимущества и недостатки, и данное клиническое наблюдение не имеет цели их анализа. Учитывая преимущества при оценке радикальности, нами при рисках кровотечения, длительной ишемии почки, а так же в случае необходимости лимфаденэктомии или адреналэктомии используется последний вариант - экстра-корпоральная резекция и гетероскопическая трансплантация.
Клиническое наблюдение
Вашему вниманию представляем клиническое наблюдение: пациент У. 55 лет поступил с жалобами на интенсивные боли в левой поясничной области, которые развились внезапно после физической нагрузки за две недели до поступления в стационар.
В анамнезе инфаркт миокарда два года назад, страдает сахарным диабетом 2 типа, корригируется пероральными гипогликемическими препаратами. Ожирение третьей степени, при весе 140 кг индекс массы тела составлял 48,4. Лабораторно обращали на себя внимание нормохромная анемия: эритроциты - 3,1х1012/л, гемоглобин - 102 г/л, цветной показатель - 0,81; азотемия: повышение креатинина до 158 мкмоль/л, мочевины до 9,3 ммоль/л; микрогематурия до 40 в п/зрения. При ультразвуковом исследовании обнаружены опухоли верхнего (до 7 см) и нижнего (до 10 см) полюсов левой почки, правая почка уменьшена в размерах до 8х4х4 см, гидронефротически трансформирована, паренхима истончена до 3-5 мм, мочеточник не визуализируется. Спиральная компьютерная томография с болюсным усилением в ангиографическом режиме выявила терминальный гидронефроз слева с отсутствием отсроченной функции (рис. 1-1), разрыв верхнего полюса с подкапсульной гематомой 7х4 см (рис. 1-2), распространяющейся на опухоль нижнего полюса, последняя до 10 см компремирует чашечно-лоханочную систему (ЧЛС) с ампутацией нижней группы чашечек (рис. 1-3). Регионарные лимфатические узлы были увеличены до 1,5 см, четкого накопления контраста отмечено не было (рис. 1-4). В левом надпочечнике - образование до 2 см, не накапливающее активно контраст в артериальную фазу, но имеющее задержку выведения контраста в венозную (рис. 1-5). На основании проведенного обследования установлен диагноз: Разрыв, подкапсульная гематома верхнего сегмента, опухоль Т3а№М1 (mts в ипсилатеральный надпочечник) единственной функционирующей левой почки. Постгеморрагическая анемия легкой степени. Терминальный гидронефроз справа. Хронический пиелонефрит, ремиссия ХПН I. Сахарный диабет 2 тип, средней тяжести, компенсация. ИБС, постинфарктный кардиосклероз, ХСН 2а стадия, 3 функциональный класс. Конституциональное ожирение 3 стадия.
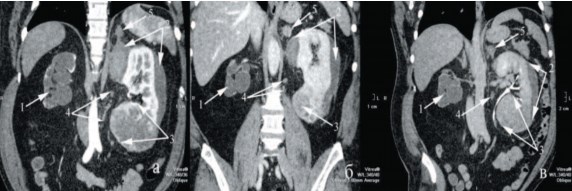
Рис. 1. СКТ а – артериальная, б – венозная и с – экскреторная фазы (пояснения в тексте)
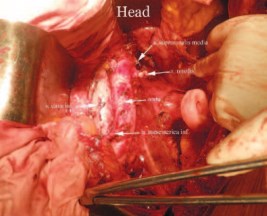
Рис. 2. Вид лапаратомной раны после нефрадреналэктомии
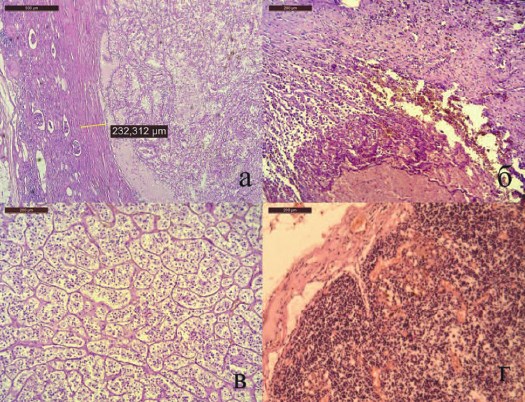
Рис. 3. Результаты морфологического исследования. Окраска гематоксилин и эозин. (пояснения в тексте)
Пациенту по абсолютным показаниям выполнено нефронсберегающее лечение в объеме радикальной нефрадреналэктомии, экстракорпоральной резекция опухоли нижнего сегмента, резекции некротизированных тканей и ушивания разрыва среднего сегмента левой почки и гетеротопической аутотрансплантация в правую подвздошную область (рис. 2). Выбор объема операции и отказ от резекции in situ был продиктован как тяжестью поражения единственно функционирующей почки (идиопатическим разрывом, инвазивной формой опухоли, которые увеличивали риски интраоперационного кровотечения и продолжительного периода тепловой ишемии), так и вероятностью лимфатического поражения и метастаза в ипсилатеральный надпочечник.
Визуально хирургический край был отрицателен, отступ от опухоли составил 3-7 мм. Время холодовой ишемии составило 45 минут, вторичной тепловой ишемии - 20 минут. Кровопотеря без учета подкапсульной гематомы не превысила 50 мл. Несмотря на это, в послеоперационном периоде на фоне сохранного диуреза до 1,5-2,5 л отмечался рост азотемии (креатинин 700 - 800 мкмоль/л), что потребовало 5 сеансов гемодиализа, азотовыделительная функция восстановлена, уровень креатинина стабилизировался на уровне 150 мкмоль/л. Морфологочески у пациента диагностированы светлоклеточная гипернефрома Fuhrman 2 с отрицательным хирургическим краем (рис. 3а), в тканях из области разрыва геморрагическое пропитывание без опухолевого роста (рис. 3б), удаленный надпочечник представлен аденомой (рис. 3в), в лимфоузлах воспалительные изменения (рис. 3г). Нужно отметить, что послеоперационное стадирование снизило прогноз прогрессии с высокого до промежуточного. Диагноз пациента после операции: Разрыв почки, подкапсульная гематома среднего сегмента, светлоклеточная гипернефрома pT2a№M0G2 Fuhrman 2 стадия 2 единственной функционирующей левой почки стадия 2. Постгеморрагическая анемия легкой степени. Светлоклеточная аденома левого надпочечника. Терминальный гидронефроз справа. Хронический пиелонефрит, ремиссия ХПН1. Сахарный диабет 2 тип, средней тяжести, компенсация. ИБС. Постинфарктный кардиосклероз, ХСН 2а стадия, 3 функциональный класс. Конституциональное ожирение 3 стадия.
На 14 сутки послеоперационного периода на фоне снижения азотемии у пациента сохранялась лихорадка. По данным УЗИ жидкостное образование в области аутотрансплантата 4х5 см, увеличение гидронефроза справа. Выполнена аспирационная биопсия жидкостного образования и пункционная нефростомия справа. По данным аспирационной биопсии жидкость в области трансплантата биохимически представляла лимфу с низким цитозом, результаты бактериологического исследования были отрицательными. Лихорадка купирована. Пациенту выполнено стентирование правого мочеточника, нефростомический дренаж удален, предложена отсроченная нефрэктомия справа через 1-2 месяца, на которую больной не явился.
Пациент обратился через 10 месяцев с клиникой синдрома системной воспалительной реакции в течении недели с неправильной гектической лихорадкой, нейтрофильным (85%) лейкоцитозом 20,5х109/л, неэффективной антибактериальной терапией. Ультразвуковые исследования, выполненные через 1, 3 и 6 месяцев после операции, не выявили патологии со стороны аутотрансплантата. Ультразвуковое исследование при обращении диагностировало гидронефроз с наличием стента в правой почке. В аутотрансплантате патологии не было выявлено. Учитывая септическое состояние больного с экстраренальной патологией в виде сахарного диабета, для исключения гнойно-деструктивного поражения легких и паранефрия выполнена спиральная компьютерная томография грудной клетки и брюшной полости в ангиографическом режиме. При этом отсутствовала патология со стороны органов грудной клетки, отмечена прогрессия гидронефроза с признаками паранефрита (рис. 4-1), в воротах правой почки определялся лимфоузел до 2 см без патологического накопления контраста (рис. 4-2). Очаговое образование аутотранплантата в области резекции до 4 см (рис. 4-3), метастаз в правые общие подвздошные лимфатические узлы 8х2 см.
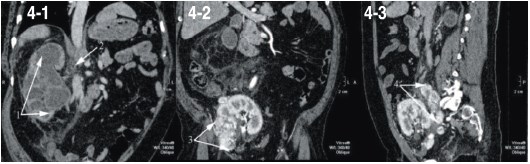
Рис. 4. СКТ (пояснения в тексте)
Учитывая септическое состояние пациента, от морфологической верификации поражения аутотрансплантата решено было отказаться. По жизненным показаниям пациенту выполнена нефрэктомия справа из люмботомического доступа, лимфодиссекция и подвздошная лимфаденэктомия . Гистологическое исследование выявило гнойный пиелонефрит (рис 5а) с неспецифической лимфоаденопатией в воротах почки (рис. 5б), метастаз светлоклеточного рака в подвздошные лимфатические узлы (рис. 5в). Лихорадка купирована со вторых суток, к концу недели послеоперационного периода пациент выписан.
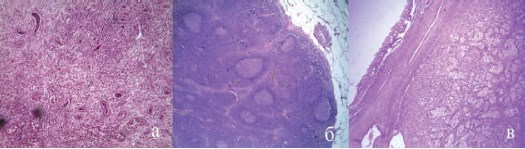
Рис. 5. Результаты морфологического исследования. Окраска гематоксилин и эозин. (пояснения в тексте)
На тот момент мы не могли объяснить ни стремительной прогрессии локального рецидива (до 4 см за 10 месяцев), ни области и объема лимфогенного метастазирования. К сожалению, провести лечение локального рецидива не удалось, пациент госпитализирован в экстренном порядке через 2 месяца после второй операции с анурией в течении 3 суток, клиникой синдрома системной воспалительной реакции в течении 10 дней с постоянной фебрильной лихорадкой, нейтрофильным (82%) лейкоцитозом 22,3х109/л и сдвигом до юных форм. При ультразвуковом исследовании отмечено увеличение объема аутотрансплантата, отек паренхимы до 25 мм, диффузное снижение перфузии с ростом индексов резистентности на дистальном русле до 0,95. После проведения диализа выполнена спиральная компьтерная томография с болюсным усилением в ангиографическом режиме, где отмечено увеличение объема, резкое снижение перфузии и выделительной функции аутотрансплантата (рис. 6-1), а так же лимфатическая прогрессия в бассейне наружных и внутренних подвздошных сосудов (рис. 6-2, 6-3). Учитывая наличие гнойного пиелонефрита аутотрансплантата, прогрессию опухоли, экстараренальной патологии в виде сахарного диабета, принято решение о нефрэктромии аутотрансплантата, лимфодиссекции. Интраоперационно был подтвержден апостематозный пиелонефрит, с техническими трудностями из экстра- и интраперитонеального доступа удален аутотрансплантат, ушито ранение наружной подвздошной артерии. В связи с выраженным рубцовым периартериитом выполнить лимфодиссекцию не удалось. В удаленной почке рецидива опухоли не обнаружено как при макроскопическом, так и при микроскопическом исследовании (рис. 7а). Опухолевый узел локализовался в послеоперационном рубце, узел был иссечен (рис. 7б).
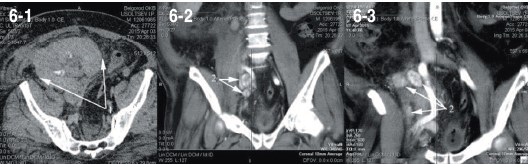
Рис. 6. СКТ (пояснения в тексте)
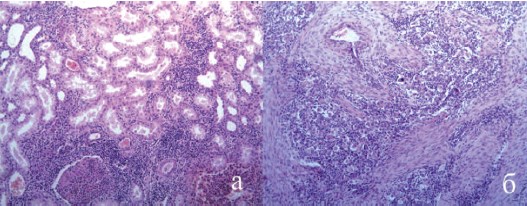
Рис. 7. Результаты морфологического исследования. Окраска гематоксилин и эозин. (пояснения в тексте)
В послеоперационном периоде воспалительный синдром купирован, пациент введен в программу диализа, сформирована артериовенозная фистула. На 4-й неделе послеоперационного периода отмечены четыре приступа отека легкого, требовавшие интубации и выполнения экстренной ультрафильтрации. В последнем случае клиническая смерть в течении 40 минут, что повлекло смерть мозга и стало причиной фатального исхода. При обследовании и на секции не выявлено легочного метастазирования и острого инфаркта миокарда.
ОБСУЖДЕНИЕ
Ретроспективно анализируя этот клинический случай нужно отметить, что, несмотря на радикальность выбранного подхода, мы столкнулись с ранней прогрессией опухоли за счет имплантационного метастазирования в послеоперационный рубец. Этим фактом можно объяснить нехарактерную для местного рецидива скорость прогрессии и пути метастазирования почечно-клеточного рака. Мы имеем опыт еще 5 экстракорпоральных резекций с медианой наблюдения 38 месяцев и 71 резекции in situ, где данный показатель составил 32 месяца. У данной категории пациентов не отмечено локальной и системной прогрессии заболевания. Поэтому, ориентируясь на отрицательный хирургический край резекции, промежуточный риск прогрессии, данный рецидив мы связываем с сопутствующей травмой почки и, возможно, наличием опухолевых клеток в гематоме. Если рассматривать С возможные варианты лечения, считаем, что выполнение резекции in situ повысило бы вероятность имлантационного метастазирования, риск утраты почечной функции, интраоперационную кровопотерю и не обеспечило адекватного объема лимфодиссекции. Хотя проведенный нами анализ доступной литературы не обнаружил публикаций, посвященных изучению травмы почки и рисков прогрессии опухоли. Возможно, в данном случае удалось бы избежать прогрессии при выполнении радикальной нефрэктомии и переводе на заместительную почечную терапию, но у этого пациента именно сердечнолегочные осложнения на гемодиализе стали причиной летального исхода. Мы должны отметить, что ультразвуковое исследование не помогло в раннем выявлении рецидива опухоли, результаты, полученные при спиральной компьютерной томографии, дали исчерпывающую картину заболевания. К сожалению, мы не имели «терапевтического окна» для использования дистанционной высокодозной радиохирургии системой Кибер-нож (CyberKnife®) на область рецидива, что, на наш взгляд, могло обеспечить локальный контроль.
ЗАКЛЮЧЕНИЕ
Взаимосвязь повреждения почки с вероятностью прогрессии почечно-клеточного рака и выбор тактики у этих пациентов требуют дальнейшего изучения. Данное клиническое наблюдение еще раз указывает на склонность почечноклеточного рака к имплантационному метастазированию с большей скоростью прогрессии, чем в случае первичной опухоли. Это является одной из причин нашего отказа от проведения биопсии при опухолях.
ЛИТЕРАТУРА
1. Микич, Д.Г.Д. Почечно-клеточный рак: экстракорпоральная резекция почки с последующей аутотрансплантацией при локализованной форме заболевания. Онкоурология 2007;(3):16-20.
2. van der Velden JJ, van Bockel JH, Zwartendijk J, van Krieken JH, Terpstra JL. Long-term results of surgical treatment of renal carcinoma in solitary kidneys by extracorporealresection and autotransplantation. Br J Urol 1992;69(5):486-90.
3. Акопян Г.Н., Алексеев Б.Я., Волкова М.И., Говоров А.В., Давыдов М.И., Матвеев В.Б., Носов Д.А., Шпоть Е.В. Рак паренхимы почки у взрослых: Российское Общество Урологов, Клинические рекомендации [Электронный ресурс]. Москва: Министерства здравоохранения Российской Федерации; 2016 [цитируется 2017 сентябрь 6]. Available from: http://cr.rosminzdrav.ru/schema.html?id=87#/text
4. Campbell S, Uzzo RG, Allaf ME, Bass EB, Cadeddu JA, Chang A, et al. Renal mass and localized renal cancer: American Urological Association Guideline [Internet]. Linthicum: American Urological Association; 2017 April [cited 2017 Sep 6]. 49 p. Available from: https://www.auanet.org/Documents/education/clinical-guidance/ Renal-Mass-Localized-Renal-Cancer.pdf
5. Ljungberg B, Albiges L, Bensalah K, Bex A, Giles RH, Hora M, et al. Renal cell carcinoma disease management: European Association of Urology, Oncology Guidelines [Internet]. Arnhem: European Association of Urology; 2017 [cited 2017 Sep 6]. Available from: http://uroweb.org/guideline/renal-cell-carcinoma/#7
6. Комяков Б.К., Замятнин С.А., Попов С.В., Шломин В.В., Цыганков А.В., Гончар И.С. Экстракорпоральное хирургическое лечение больных с почечно-клеточным раком. Вестник хирургии им. И.И. Грекова 2014;173(4):53-56.
7. Комяков Б.К., Шломин В.В., Гулиев Б.Г., Замятнин С.А., Гончар И.С., Товстуха Д.В. Резекция опухоли in situ в условиях ее длительной ишемии. Онкоурология 2014;(2):22-25.
8. Zincke H, Engen DE, Henning KM, McDonald MW. Treatment of renal cell carcinoma by in situ partial nephrectomy and extracorporeal operation with autotransplantation. Mayo Clin Proc 1985;60(10):651-62.
9. Nishida H, Kanno H, Hosoya N, Sakurai T, Mashima E, Naito S, et al. Extracorporeal partial nephrectomy and auto-transplantation after presurgical targeted therapy with tyrosine kinase inhibitors for renal cell cancer. Hinyokika Kiyo 201;59(8):507-11.
10. Шкодкин С.В., Татаринцев А.М., Идашкин Ю.Б., Любушкин А.В., Фиронов С.А. Экстракорпоральная резекция почки: а стоит ли? Урология 2016;(3):62-69.
11. Mitsuhata N., Ito S., Watanabe Y. Renal transplantation surgery is closely linked with treatment for bilateral synchronous renal cell carcinomas or renal tumors in solitary kidney. Gan To Kagaku Ryoho 2004;31(5):735-8.







