Представленная публикация преследовала решение следующей актуальной задачи — создание клинических рекомендаций лечения больных раком предстательной железы (РПЖ) источниками высокой мощности дозы, регламентирующих алгоритм диагностики, режимы фракционирования, показания и противопоказания к проведению данного метода лечения. Для осуществления поставленной задачи объединением брахитерапевтов России сформирована группа экспертов и практикующих врачей для создания клинических рекомендаций брахитерапии РПЖ с помощью источников высокой мощности дозы. В рамках «Всероссийской научно-практической конференции с международным участием «Брахитерапия в лечении злокачественных образований различных локализаций»», прошедшей 17 — 18 ноября 2016 года в Москве, было проведено совещание экспертов, посвященное интерстициальной лучевой терапии РПЖ, в ходе которого были обсуждены ключевые вопросы и актуальные проблемы исполнения данной методики лечения. По результатам совещания был составлен предварительный документ, который в режиме online был дополнен и расширен. После внесения исправлений каждая версия подвергалась совместному ревьюированию. Окончательный текст рекомендаций был скомпилирован и отредактирован. В результате этой деятельности было выработано соглашение о показаниях и противопоказаниях, стандартных процедурах исполнения методики лечения, допустимые дозы и способы фракционирования, а также методы профилактики осложнений. Данный материал является продолжением начатой работы по созданию клинических рекомендаций по проведению брахитерапии злокачественных новообразований различной локализации в виде публикации результатов совещания экспертной группы специалистов, имеющих собственный опыт применения данных методик в своей рутинной практике.
Наибольшее распространение получила брахитерапия источниками низкой мощности дозы, так называемая, низкодозная (низко-мощностная) брахитерапия (НМБТ), которая заключается в одномоментной перманентной имплантации в предстательную железу (ПЖ) источников, содержащих изотопы 125I или 103Pd, с низкой энергией излучения (от 27 до 34 кЭВ) и периодом полураспада от 9,7 (103Pd) до 59,4 (125I) суток, соответственно [1]. Также имеется ограниченный опыт применения имплантируемых источников 131Cs [2]. Важное достоинство НМБТ заключаются в отсутствии необходимости в дополнительной защите и специальном оборудовании, что позволяет использовать данный метод лечения в большинстве крупных урологических и онкологических отделений, и это способствовало широкому распространению методики. Кроме того, на сегодняшний день накоплен достаточно большой опыт проведения НМБТ, в деталях разработана техника выполнения процедуры, а многочисленные исследования подтверждают ее высокую эффективность. Вместе с тем, лучевая терапия РПЖ с помощью имплантируемых источников 125I и 103Pd не лишена некоторых ощутимых недостатков. Так, многие авторы указывают на существование ряда факторов, негативно влияющих на точность подведения запланированной дозы облучения [3,4]. Во-первых, различия реального и запланированного расположения источников излучения и их миграция могут влиять на распределение дозы. Во-вторых, причиной существенной вариабельности в окончательном распределении суммарной дозы облучения при НМБТ является изменение объема ПЖ после имплантации источников, что объясняется выраженным отеком. Наконец, существенным фактором, затрудняющим расчет суммарной дозы, поглощенной окружающими органами, в первую очередь, прямой кишкой и мочевым пузырем, является постоянные изменения взаимной топографии ПЖ, прямой кишки и мочевого пузыря, в силу их относительной подвижности, что становится значимым фактором с учетом длительного времени облучения.
Без преувеличения можно утверждать, что брахитерапия источниками высокой мощности дозы (высокомощностная, высокодозная) брахитерапия (ВМБТ) является результатом эволюции НМБТ и характеризует новый этап внутритканевой терапии злокачественных новообразований. С одной стороны, оба метода объединяет общая терапевтическая идеология, основанная на облучении злокачественных новообразований с помощью источников излучения введенных непосредственно в опухоль, что позволяет достигать эффективного воздействия на патологический очаг при минимальном повреждении окружающих нормальных тканей. С другой стороны, ВМБТ представляет собой совершенно иное технологическое решение и поэтому имеет значимые отличия клинического использования [3,5-7]. Наличие алгоритма проспективного планирования при выполнении ВМБТ и высокая плотность «активных позиций источника» (в 2 раза и более, чем при НМБТ), а также возможность моделирования времени облучения в каждой отдельной активной позиции с помощью алгоритма «обратного планирования», все вместе создают возможности для формирования дозного распределения любой конфигурации, в том числе, для асимметричного облучения мишени или подведения дополнительной дозы облучения («boost») на участки клинически значимого поражения. Перечисленные выше технологические особенности выполнения ВМБТ обеспечивают возможность эффективного лечения больных, в том числе с большим (60100 см3 и более) объемом ПЖ без проведения неоадъювантной андрогенной депривации. Использование онлайн-планирования до и после введения игл-интрастатов, короткое время облучения, обеспечивающее стабильность положения и объема ПЖ на протяжении всего времени подведения дозы, позволяют надежно прогнозировать распределение дозы и создавать высокий градиент между радиационной нагрузкой на мишень и окружающие ткани. Это создает благоприятные условия для лучевой терапии с программируемым снижением дозы на критические органы, например, формирование низкодозного «туннеля для уретры».
В подавляющем большинстве публикаций, посвященных результатам лучевого лечения РПЖ, указывается на низкую радиочувствительность аденокарциномы ПЖ, а показатель а/p характеризуется низким значением 1,5-3 [8,9]. В то же время окончательного консенсуса по этому вопросу не достигнуто и он разнится от экстремально низкого — 0,4 [10] до парадоксально высокого — 7,5 [11]. С радиобиологической точки зрения проведение брахитерапии с высокой мощностью дозы в режиме гипофракционирования рассматривается в качестве наиболее перспективного метода облучения злокачественных новообразований с низким коэффициентом а/р, в том числе, в силу возможности реализации «кислородного эффекта».
РЕЗУЛЬТАТЫ ВМБТ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
«Золотым стандартом» лечения больных РПЖ принято считать радикальную простатэктомию (РПЭ). Несмотря на совершенствование оперативной техники РПЭ остается сложным и достаточно травматичным вмешательством, требующим высокой квалификации хирурга. Выполнение РПЭ сопряжено с высокой частотой нежелательных явлений, в первую очередь, расстройств мочеиспускания (10-20%) и эректильной дисфункции (>50%) [12-15]. В качестве альтернативы РПЭ рассматривается лучевая терапия, и в настоящее время, согласно рекомендациям NCCN, ASTRO, ESTRO, AUA и ESOU, она входит в число основных методов лечения РПЖ [16]. Стандартом лучевой терапии РПЖ является 3D конформное дистанционное облучение, в качестве альтернативных режимов рассматриваются модулированное по интенсивности облучение, стереотаксическая лучевая терапия и брахитерапия с использованием источников как низкой, так и высокой мощностью дозы [17-19]. Брахитерапия с успехом реализует задачу высоких, тумороцидных доз (90-140 Гр) в область ПЖ при значительном снижении лучевой нагрузки на окружающие ткани [20-23]. При этом, принципиальным достоинством брахитерапии, по сравнению с РПЭ, является достаточно высокие показатели эффективности при достоверно низком риске серьезных осложнений лечения [6,7,24].
Оценивая клинические результаты ВМБТ, необходимо помнить, что данная методика в качестве самостоятельной имеет относительно небольшой срок применения, так как на протяжении практически 35 лет с момента внедрения в клиническую практику, она использовалась в качестве бустерного облучения в режиме сочетанной лучевой терапии [20,25]. По этой причине число публикаций, посвященных вопросу лечения больных методом ВМБТ, относительно невелико - всего около 700 за 35 лет (в среднем 20 в год). В то же время, по данным исследования RTOG 0321, ВМБТ в монорежиме, как метод радикального лечения больных РПЖ, имеет уровень эффективности, сопоставимый или превышающий уровень эффективности дистанционной лучевой терапии [26]. При сравнении РПЭ и ВМБТ последняя не уступает по эффективности хирургическому лечению [27].
В систематическом обзоре, посвященном вопросам эффективности и безопасности ВМБТ у больных РПЖ и представленном в Кокрановской библиотеке, авторами из Испании был отмечен заметный дефицит доказательного материала, в основном представленного неконтролируемыми исследованиями. Анализ 14 отобранных публикаций продемонстрировал наличие местного контроля в 6 исследованиях на уровне 97-100%, при этом биохимического рецидива не было выявлено в 85-100% случаев у пациентов низкого риска прогрессирования РПЖ и в 79-92% — в группе высокого риска. У более чем 95% пациентов за 8 лет наблюдения не было выявлено метастазов, исключая одно исследование, где пятилетняя выживаемость не превысила 87%. В 8 из 14 исследований зарегистрирована безрецидивная выживаемость на высоком уровне (>95%) [28]. Основной клинический материал представлен 7 исследованиями, посвященными оценке результатов лечения больных РПЖ с помощью ВМБТ в режиме монотерапии. Срок наблюдения за пациентами в данных исследованиях составляет от 2,7 до 8 лет (табл. 1).
Таблица 1. Результаты ВМБТ у больных РПЖ в режиме монотерапии
| № п/п | Авторы | Число, n | Наблюдение, лет | РОД, Гр | СОД, Гр | Безрецидивная выживаемость, % |
|---|---|---|---|---|---|---|
| 1 | N. Zamboglou и соавт. [4] | 141 | 4,4 | 950,00% | 38 | 95 (низкий риск) 93 (промежуточный) 93(высокий) |
| 2 | Y. Yoshioka и соавт. [5] | 112 | 5,4 | 6 | 54 | 85 (низкий риск) 93 (промежуточный) 79(высокий) |
| 3 | D.J. Demanes и соавт. [6] | 298 | 8 | 7 | 42 | 97 (низкий и промежуточный риск) |
| 4 | Y. Yamada и соавт. [7] | 284 | 2,7 | 6,5 | 39 | 94 (промежуточный риск) |
| 5 | P.J. Hoskin и соавт. [22] | 30 | 4,5 | 8,5 | 34 | 99 (промежуточный риск) 91 (высокий риск) |
| 6 | A.A. Martinez и соавт. [25] | 248 | 4,8 | 9,5 | 38 | 88 (низкий и промежуточный риск) |
| 7 | P. Ghadjar и соавт. [29 ] | 36 | 3 | 9,5 | 38 | 100 (низкий и промежуточный) |
Таким образом, методика ВМБТ демонстрирует высокую эффективность в лечении больных РПЖ.
СТАНДАРТНОЕ ОБСЛЕДОВАНИЕ ПЕРЕД ПРОВЕДЕНИЕМ ВЫСОКОДОЗНОЙ БРАХИТЕРАПИИ
Необходимый минимум обследования для принятия решения о проведении ВМБТ:
- пальцевое ректальное исследование (ПРИ) ПЖ;
- определение уровня простатоспецифического антигена (ПСА);
- данные морфологического исследования;
- трансректальное ультразвуковое исследование (ТРУЗИ) ПЖ;
- магнитно-резонансная (компьютерная) томография органов малого таза;
- остеосцинтиграфия при индексе Глисона выше 6 и/или ПСА выше 20 нг/мл;
- позитронно-эмиссионная томография (ПЭТ) с холином при индексе Глисона выше 6 и/или ПСА выше 20 нг/мл.
Предварительная оценка качества мочеиспускания и качества сексуальной функции имеет важное значение не только для определения показаний и противопоказаний к лучевому лечению, но и для дальнейшего наблюдения с целью своевременной диагностики и коррекции ранних и поздних осложнений, и включает в себя:
- заполнение опросников IPSS и МИЭФ;
- урофлоуметрию (максимальная, средняя скорость мочеиспускания);
- определение объема остаточной мочи.
По показаниям могут быть проведены дополнительные методы диагностики (комплексное уродинамическое исследование, интракавернозный тест и др.).
Гистологическая верификация диагноза является обязательной и осуществляется при помощи трансректальной или промежностной биопсии ПЖ, с обязательным указанием следующих параметров: локализация и объем поражения, наличие/отсутствие перивазальной/периневральной инвазии, определение индекса по шкале Глисона.
Проведение необходимого объема обследований и формулировка показаний и противопоказаний, а также определение лечебного плана внутритканевой лучевой терапии были соотнесены с опубликованными рекомендациями профессиональных ассоциаций: Американской ассоциации брахитерапевтов (ABS, 2012) и Европейской группы брахитерапии (Кюри-терапии) — Европейского общества терапевтической радиационной онкологии (GEC/ESTRO, 2013) [7,23].
ПОКАЗАНИЯ К ВМБТ У БОЛЬНЫХ РПЖ
Выбор ВМБТ в качестве радикального метода лечения пациентов с локализованными и местно-распространенными формами РПЖ основывается на прогнозе у больных с различной распространенностью и злокачественностью опухоли. Наиболее удобной для повседневной практики является классификация риска прогрессирования РПЖ, предложенная National Comprehensive Cancer Network (NCCN), представляющая собой упрощенную классификацию по D'Amico, в которой на основании уровня ПСА, индекса по шкале Глисона и клинической стадии осуществляется деление пациентов на три группы — низкого, промежуточного и высокого риска рецидива заболевания (табл. 2). Кроме того, некоторые авторы дополнительно выделяют подгруппы очень низкого и очень высокого риска. Определение в группу низкого риска прогрессирования требует обязательного наличия всех трех показателей в определенных для этой группы рангах, для высокого риска — достаточно наличия хотя бы одного из них. Группа промежуточного риска определяется при несоответствии группам низкого или высокого риска прогрессирования заболевания.
Таблица 2. Группы риска РПЖ по классификации NCCN
| Группа низкого риска | Группа промежуточного риска | Группа высокого риска |
|---|---|---|
| сТ2а или менее ПСА до 10 нг/мл Сумма баллов по шкале Глисона 6 | сТ2в – сТ2с ПСА 10-20 нг/мл сумма баллов по шкале Глисона 7 | сТ3а ПСА более 20 нг/мл сумма баллов шкале Глисона 8-10 |
В последние десятилетия отмечен рост интереса к использованию ВМБТ в качестве самостоятельного метода лечения РПЖ. Рекомендации по выбору метода применения ВМБТ в лечении больных РПЖ в рекомендациях ABS и GEC/ESTRO имеют некоторые различия (табл. 3).
Таблица 3. Рекомендации настоящего экспертного совета, Москва, 2016: критерии отбора пациентов для лечения при помощи ВБМТ (рекомендации ABS и GECESTRO представлены для сравнения)
| Показатель | ЭС1 | ABS | GECESTRO |
|---|---|---|---|
| В режиме монотерапии | |||
| Клиническая стадия | Т1а-Т2сШМ0 | Т1b-T2b | Т1 b-T2a |
| Морфологический индекс Глисона | < 7 | < 7 | < 6 |
| ПСА | < 20 | < 10 | < 10 |
| В режиме boost | |||
| Клиническая стадия | TXN0-1M0 | Т3-Т4 | Т1 b-T3b |
| Морфологический индекс Глисона | любой | 7-10 | любой |
| ПСА | любой | > 10 | любой |
| Отсутствие отдаленных метастазов | + | + | |
| Риск прогрессирования | промежуточный/высокий | ||
| Предположительная продолжительность предстоящей жизни | < 5 лет | ||
Одним из спорных моментов является выбор лечения у пациентов промежуточного риска с индексом Глисона 7, в этих случаях следует руководствоваться последними рекомендациями ВОЗ/ISUP, согласно которым ситуации с преобладанием менее дифференцированных морфологических признаков (4+3) следует отнести к агрессивным формам, в тоже время (3+4) может рассматриваться как состояние с относительно доброкачественным течением заболевания [30].
Принимая во внимание накопленный клинический опыт, в первую очередь, результаты ВМБТ в режиме монотерапии у больных РПЖ из группы низкого, промежуточного и некоторых пациентов из группы высокого риска, продемонстрированные в исследованиях ряда зарубежных специалистов, можно говорить о высокой эффективности ВМБТ в режиме монотерапии у широкой категории больных РПЖ. На сегодняшний день не имеется достаточных доказательств эффективности ВМБТ в режиме монотерапии у пациентов T3aN0M0, поэтому этот вариант лучевой терапии может выполняться только в экспертных центрах в рамках проспективных исследований. Для сочетанной терапии единственным ограничением является наличие отдаленных метастазов опухоли.
ПРОТИВОПОКАЗАНИЯ К ПРОВЕДЕНИЮ ВМБТ У БОЛЬНЫХ РПЖ
Все противопоказания можно разделить на общие и специальные (урологические). Абсолютные общие противопоказания к проведению ВМБТ:
- отсутствие доказательств злокачественности заболевания;
- наличие множественных отдаленных метастазов;
- наличие прямокишечных свищей любой этиологии;
- отсутствие прямой кишки (предшествующие оперативные вмешательства);
- невозможность поведения анестезиологического пособия;
- невозможность позиционирования пациента на лечебном столе в литотомическом положении.
К относительным противопоказаниям относятся случаи олиго-метастатического РПЖ (не более двух очагов), в этой ситуации ВМБТ рассматривается как элемент комбинированного, комплексного или сочетанного лечения. Также к относительным противопоказаниям относится высокий риск кровотечения (коагулопатии или прием антикоагулянтов по жизненным показаниям).
Урологическими относительными противопоказаниями для проведения брахитерапии являются серьезные нарушения мочеиспускания:
- индекс IPSS выше 20;
- максимальная скорость мочеиспускания менее 10 мл/сек;
- объем остаточной мочи выше 60 мл;
- предшествующая трансуретральная резекция тканей ПЖ при сроках проведения процедуры менее чем за 6 месяцев до планируемой ВМБТ.
Необходимо отметить, что большой объем ПЖ, имеющий значение при проведении низкодозной брахитерапии, практически не ограничивает возможность осуществления лечения в режиме ВМБТ. Однако при планировании и проведении ВМБТ у пациентов с объемом ПЖ более 60 см3 следует убедиться в технической возможности выполнения процедуры (отсутствие интерференции с лонной костью).
Наличие относительных противопоказаний требует понимания, что имеет место высокий риск осложнений, но этот риск может быть нивелирован другими обстоятельствами или смягчен дополнительными мерами. Такие противопоказания не являются препятствием для проведения ВМБТ, но требуют разъяснения пациенту всех рисков и преимуществ предстоящего лечения, в том числе вариантов, альтернативных ВМБТ.
ХАРАКТЕРИСТИКА ТЕХНИЧЕСКОГО ОСНАЩЕНИЯ ДЛЯ ПРОВЕДЕНИЯ ВМБТ
Разделение брахитерапии на НМБТ и ВМБТ основано на определении Международной Комиссии по радиационным частицам и измерениям в соответствии с величиной мощности поглощенной дозы:
- от 40 до 200 сГр/час на расстоянии 1 см — брахитерапия источниками с низкой мощностью дозы,
- свыше 1200 сГр/час на расстоянии 1 см — брахитерапия источниками с высокой мощностью дозы.
Для проведения ВМБТ наиболее часто применяются изотопы 192Ir, реже — 60Со (табл. 4).
Таблица 4. Основные физические характеристики изотопов для ВМБТ
| Название изотопа |
Период полураспада (день) | Средняя энергия |
|---|---|---|
| 192Ir | 74,4 дня | 0,40 МЭВ |
| 60Со | 5,3 года | 1,25 МЭВ |
Проведение ВМБТ предъявляет высокие требования к соблюдению норм радиационной безопасности и возможно только в условиях специализированных онкологических центров, имеющих в своем составе отделения для радиотерапии с операционными, планирование и оснащение которых жестко регламентировано рядом нормативных документов. Оснащение операционной должно включать:
- устройство подачи радиоактивного источника(с 18 и более каналами для проведения брахитерапии) с источниками 192Ir и/или 60Со;
- операционный стол с возможностью укладки пациента в положение для литотомии, предпочтительно с возможностью фиксации «за пятку»;
- анестезиологическое оборудование и монитор жизненных функций с возможностью дистанционного наблюдения вне каньона;
- ультразвуковой сканер с ректальным биплановым датчиком с возможностью построения решетки для брахитерапии на экране и абдоминального датчика (дополнительная опция), также необходимо предусмотреть возможность получения онлайн видеосигнала и подключения специального видеоадаптера для оцифровки полученных изображений, с последующей обработкой в планирующей дозиметрической системе;
- стабилизирующее устройство для установки пошагового устройства (степпера) с брахитерапевтической решеткой (шаблоном) с возможностью фиксации игл-интрастатов и треккера положения ультразвукового датчика;
- наличие операционной в радиозащитном каньоне;
- инструмент (иглы-интрастаты, стабилизирующие иглы (якорного типа), ректальные баллоны (брахибаллоны));
- дозиметрическая планирующая система (рис. 1).
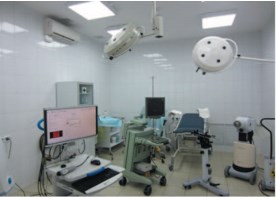
Рис. 1. Общий вид операционной для выполнения ВМБТ
На сегодняшний день существуют две основные технологии планирования и проведения ВМБТ РПЖ — под трансректальным ультразвуковым (ТРУЗ) контролем и с помощью рентгеновской компьютерной томографии (РКТ), как правило, в сочетании с магнитно-резонансной томографией (МРТ) с использованием фьюжн-технологий. Следует отметить, что в обоих случаях этап введения игл-интрастатов осуществляется в режиме реального времени под контролем ТРУЗИ. Принимая во внимание то, что проведение компьютерной томографии для планирования требует перемещения пациента и, как правило, сопряжено с повышенным риском смещения катетеров, а также, учитывая появившиеся возможности фьюжирования МРТ изображений и ТРУЗИ при планировании ВМБТ, последний метод находит все более широкое применение в рутинной клинической практике.
Процедура ВМБТ РПЖ под контролем ТРУЗИ может быть разделена на несколько основных этапов:
- выполнение анестезиологического пособия, катетеризация мочевого пузыря и укладка пациента на столе;
- проведение трехмерной визуализации ПЖ и создание лечебного плана;
- установка игл-интрастатов с их последующей регистрацией в планирующей системе и корректировкой лечебного плана;
- реализация лечебного плана (облучение).
Доставка источника облучения к тканям ПЖ осуществляется при помощи специальных полых игл-интрастатов. Точная навигация игл достигается за счет использования брахитерапевтической решетки (шаблон, англ. template), с возможностью фиксации игл-интрастатов, имеющей две оси координат — вертикальную (цифры) и горизонтальную (буквы) (рис. 2).
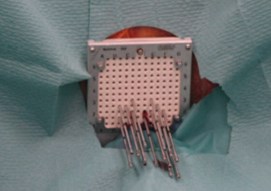
Рис. 2. Навигационная решетка с введенными иглами-интрастатами
Создание индивидуального плана облучения, как правило, основывается на использовании трансректального трехмерного (3D) ультразвукового изображения в режиме реального времени. Как уже указывалось выше, в качестве альтернативных или дополнительных источников визуальной информации могут быть использованы РКТ и МРТ. Однако применение современных ультразвуковых аппаратов экспертного класса предоставляет изображение исключительно высокого качества и технически значительно упрощает процедуру ВМБТ при полном исключении дополнительной лучевой нагрузки на пациента и персонал.
ТРУЗ датчик с возможностью поперечного и продольного автоматического сканирования закрепляется на специализированном пошаговом фиксирующем устройстве (степпере), который позволяет жестко фиксировать его и в любой момент времени определять координаты и направление пучка сканирования и топографию получаемых ультразвуковых срезов по отношению, к так называемой, нулевой точке, задающей систему координат. Система кронштейнов степпера дает возможность перемещать зафиксированный датчик в трех плоскостях и смещать под разными углами относительно продольной оси (рис. 3).

Рис. 3. Трансректальный ультразвуковой датчик, закрепленный на специальном фиксирующем устройстве «степпере»
Важным компонентом брахитерапевтического комплекса является брахитерапевтический аппарат с наличием не менее 20 каналов, обеспечивающий подачу и движение источника излучения в иглах-интрастатах в точном соответствии с лечебным планом (рис. 4).

Рис. 4. Аппараты для внутритканевой брахитерапии источниками с высокой мощностью дозы
Аппарат для ВМБТ предназначен для хранения и подачи источников 192Ir или 60Со в установленные в ПЖ полые иглы-интрастаты, соединенные с аппаратом с помощью гибких транспортировочных шлангов (рис. 5).
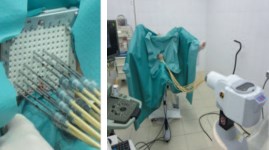
Рис. 5. Иглы-интрастаты соединены гибкими транспортировочными шлангами с аппаратом, содержащим источник 192Ir
Описанная технология носит название «afterloading», то есть облучение с помощью автоматической загрузки и выгрузки источника излучения в облучающие интрастаты. Впервые этот метод облучения был предложен в 1963 году N. K. Henschke и, по сути, создал основу для принципиально нового подхода к проведению внутритканевой лучевой терапии. К наиболее значимым преимуществам метода afterloading относятся:
- снижение дозы облучения персонала (доза, получаемая персоналом в десятки раз ниже, чем в случаях ручной загрузки источников),
- возможность формирования индивидуальных дозовых распределений практически любой пространственной формы и протяженности, что обеспечивает прецизионность, конформность и воспроизводимость облучения.
При использовании современных аппаратов для ВМБТ процесс облучения осуществляется при пошаговом (длина шага 2,5-5 мм) последовательном перемещении источников излучения (192Ir или 60Со) по введенным иглам-интрастатам. Траектория движения источников и время их остановки в активных позициях программируются при расчете окончательного дозиметрического плана, что, как уже отмечалось выше, обеспечивает высокую точность подведения дозы при облучении «мишени» любой геометрической формы.
МЕТОДИКА ВМБТ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Подготовка пациентов к выполнению ВМБТ предусматривает выполнение следующих стандартных мероприятий:
- разъяснительная беседа и получение информированного письменного согласия;
- отказ от приема антикоагулянтов, не менее чем за 5 дней до предполагаемой процедуры, за исключением ацетилсалициловой кислоты;
- стандартное лабораторно-инструментальное обследование, включающее в себя общеклинические анализы крови и мочи, биохимический анализ крови, коагулограмму, посев мочи на флору, электрокардиографию. По показаниям выполняются дополнительные методы диагностики;
- предоперационный осмотр анестезиолога и получение информированного письменного согласия на проведение спинальной (эпидуральной) анестезии;
- очистительные клизмы (накануне вечером и утром в день операции) для оптимальной визуализации при ТРУЗИ;
- бритье операционного поля (мошонка, промежность, перианальная область) утром в день проведения операции;
- голод в течение 12 часов до предполагаемой операции.
Брахитерапия выполняется под спинномозговой анестезией по стандартной методике. Возможно осуществление процедуры под общим наркозом. После выполнения анестезии пациент укладывается на операционный стол в литотомическую позицию. Осуществляется катетеризация мочевого пузыря с помощью уретрального двухходового баллонного катетера. Заполнение баллона катетера осуществляется при помощи вспененного уретрального анестезирующего геля, что позволяет более четко визуализировать базальные отделы железы и топографию простатического отдела уретры. Выполняется сгибание и максимальное разведение нижних конечностей. Этому этапу необходимо уделять особое внимание, так как при неправильной укладке пациента введение игл-интрастатов в периферические отделы ПЖ может быть затруднено из-за препятствия, создаваемого ветвями лобковых костей. В прямую кишку вводится трансректальный ультразвуковой датчик. Область операции (промежность, мошонку и заднюю поверхность бедер) обрабатывают раствором антисептика и обкладывания стерильным материалом. Решетка-шаблон устанавливается и фиксируется на степпере. При этом необходимо достигнуть тесного прилегания решетки к промежности, что обеспечивает точность и воспроизводимость получаемой топографо-анатомической информации. Введение игл в ПЖ может сопровождаться значительным смещением органа, следовательно, и существенным изменением его первоначальной топографии. С целью снижения смещения ПЖ в ходе имплантации перед ее началом устанавливаются фиксирующие иглы (рис. 6).
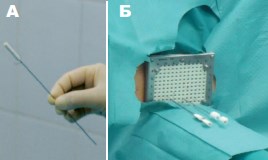
Рис. 6. Фиксирующая игла (а), две иглы введены в ткань предстательной железы через брахитерапевтическую решетку (б)
Изображение, полученное при трансректальном сканировании, передается на планирующую систему (рис. 7).
Рис. 7. Интерфейс планирующий системы
Принципиальная особенность системы планирования ВМБТ заключается в том, что после получения информации с УЗИ-аппарата и механизма перемещения УЗ детектора, с помощью специального треккера установленного на степпере, позволяющего передавать координаты датчика в программное обеспечение системы планирования, выполняется восстановление трехмерных УЗ-изображений ПЖ и окружающих ее нормальных тканей. Определение клинического объема облучения (CTV) является первым этапом процесса планирования ВМБТ. CTV включает в себя ПЖ, ограниченную капсулой. Увеличение CTV на 1-3 мм может быть продиктовано клинической ситуацией или особенностями используемой методики ВМБТ, в некоторых случаях в объем включается проксимальная треть семенных пузырьков, в особенности у пациентов из группы промежуточного и высокого риска. Последнее не приводит к заметному увеличению лучевой нагрузки на мочевой пузырь, уретру и прямую кишку. При наличии подозрения на экстракапсулярное распространение опухоли и/или поражение семенных пузырьков оправдано расширение области CTV на 3-5 мм от определяемого края опухоли за пределы ПЖ. Кроме того, в этом случае возможна попытка включения в CTV всего объема семенных пузырьков. После завершения сканирования выполняется оконтуривание CTV (ПЖ и семенных пузырьков с учетом запланированных отступов) и формирование контуров органов риска: мочевого пузыря, уретры, прямой кишки, сосудисто-нервных сплетений. В некоторых случаях целесообразно выделение в качестве отдельного органа риска треугольника мочевого пузыря. При оконтуривании уретры в качестве основного ориентира используется изображение уретрального катетера. Начальной точкой для оконтуривания уретры является основание мочевого пузыря, а конечная точка располагается на 5-10 мм дистальнее апикального края ПЖ. При формировании контуров прямой кишки используется граница наружной стенки кишки на всем протяжении зоны сканирования.
На следующем этапе выполняется расчет дозиметрического плана. Важным достоинством системы планирования ВМБТ РПЖ является возможность корректировки основных параметров, используемых при расчете дозиметрического плана (топографии игл-интрастатов, контуров ПЖ и окружающих ее органов риска), в режиме реального времени. Это позволяет провести повторное планирование непосредственно перед сеансом облучения с учетом изменившихся после введения игл-интрастатов анатомо-топографических показателей. При создании дозиметрического плана возможно использование нескольких алгоритмов для определения оптимального расположения игл, включая алгоритм обратного планирования («inverse planning»).
КЛИНИЧЕСКАЯ ДОЗИМЕТРИЯ И РЕЖИМЫ ФРАКЦИОНИРОВАНИЯ ВМБТ
С точки зрения реализации клинической стратегии существуют следующие два подхода: использование ВМБТ в качестве самостоятельного метода в виде монотерапии больных РПЖ из группы низкого и промежуточного риска и в составе сочетанного лечения с дистанционной лучевой терапией у пациентов локализованным РПЖ из группы высокого риска, а также пациентов с местнораспространенной формой РПЖ.
После каждой имплантации (процедуре) может осуществляться одна или несколько фракций облучения (гиперфракционирования). Использование технологии подведения одной фракции лучевой терапии после одной имплантации игл-интрастатов обеспечивает высокую точность подведения дозы и является предпочтительной. Важно помнить, что при выполнении облучения после одного введения интрастатов в две и более фракций необходимо обеспечить перерыв между фракциями не менее 6 часов с обязательным контролем положения игл перед каждым сеансом облучения. При изменении топографии игл-интрастатов и/или изменении формы и объема ПЖ необходимо в обязательном порядке повторно выполнить процедуру планирования сеанса ВМБТ. Основное преимущество ВМБТ с использованием одной имплантации заключается в существенном сокращении времени лечения, которое ограничивается сроками одной госпитализации. Недостатком технологии с использованием одной имплантации и нескольких фракций облучения является возможность смещения игл-интрастатов в межфракционный период времени. Кроме того, такая высокая «плотность» подведения дозы может уменьшить терапевтический интервал. Интересным вариантом ВМБТ с одной имплантацией представляет собой облучение за одну фракцию 19 Гр, но из-за недостаточности данных его применения он может быть рекомендован только в рамках исследовательских протоколов [31-33]. В клинической практике при проведении ВМБТ в режиме монотерапии наиболее часто используются различные режимы подведения дозы, представленные в таблице 5.
Таблица 5. Рекомендованные варианты выбора режима фракционирования
| Показатель | 1 имплантация | 2 имплантации | 3 имплантации |
|---|---|---|---|
| 2 фракции | 12,0-15,0 Гр | 12,0-15,0 Гр | |
| 3 фракции | 10,0-11,5 Гр | 10,0-11,5 Гр | |
| 4 фракции | 8,5-9,5 Гр | ||
| 6 фракции | 6,5-7,0 Гр | 6,5-7,0 Гр |
Решением экспертного совещания предпочтительными режимами фракционирования дозы при выполнении ВМБТ в режиме монотерапии РПЖ являются:
- 2 фракции (2 имплантации) по 10 Гр-15 Гр каждая;
- 3 фракции (3 имплантации) по 10-11,5 Гр каждая.
Во всех случаях суммарная доза для ПЖ (а/р=1,5-3,0) должна быть не менее дозы, эквивалентной 100 Гр в режиме обычного (2 Гр) фракционирования. Технология ВМБТ с использованием двух и более имплантаций характеризуется высокой эффективностью и хорошей переносимостью. Принципиальным достоинством этого варианта ВМБТ является высокая точность подведения дозы, так как за короткое время сеанса облучения минимизируется риск смещения стратостатов и возможность изменения объема и формы ПЖ. При осуществлении этой технологии ВМБТ стандартный интервал между имплантациями составляет 1-3 недели.
При проведении ВМБТ в качестве компонента сочетанного лучевого лечения больных РПЖ чаще всего используются следующие режимы подведения дозы:
- 16 Гр за 3 фракции;
- 11-22 Гр за 2 фракции;
- 12-15 Гр за 1 фракцию [34,35].
Решением экспертного совещания рекомендованы режимы фракционирования дозы ВМБТ при сочетанном лечении:
- 1 фракция 15 Гр;
- 2 фракции по 10 Гр.
Эти режимы обладают эквивалентной эффективностью и сопоставимой низкой токсичностью. Важным моментом является отсутствие необходимости исключения ПЖ из дозиметрического плана сочетанного лучевого лечения на этапе дистанционного лечения.
Учет и представление основных дозиметрических показателей осуществляется в соответствии с рекомендациями ICRU4 1997 года [36]. Регистрируются следующие показатели:
- поглощенная доза (Гр);
- биологическая эквивалентная доза (BED) и доза, эквивалентная облучению в режиме обычного фракционирования (EQD), рассчитанные согласно линейно-квадратической модели (исходя из показателя а/р — 1,5-3).
При необходимости могут учитываться и другие показатели, характеризующие равномерность распределения дозы и лучевую нагрузку на орган-мишень и прилегающие критические органы.
Обязательными условиями удовлетворительного лечебного плана является сохранение установленных ограничений радиационной нагрузки на критические органы, то есть на органы, повреждение которых в ходе ВМБТ определяет частоту и структуру осложнений (табл. 6,7).
Таблица 6. Контролируемые дозиметрические показатели
| Дозиметрические показатели для органа-мишени (предстательная железа) | |
|---|---|
| D90 | доза, которую получает 90 % объема мишени |
| V100 | объем ПЖ, получающий не менее 100 % запланированной дозы |
| Дозиметрические показатели для органов риска | |
| D10 уретры | максимальная доза, которую получает 10 % от объема уретры |
| D30 уретры | максимальная доза, которую получает 30 % от объема уретры |
| D0.1a: уретры | максимальная доза, которую получает 0,1см3 уретры |
| V150 уретры | объем уретры, который получает 150% дозы, предписанной для ПЖ |
| V125 уретры | объем уретры, который получает 125% дозы, предписанной для ПЖ |
| Vcrit прямой кишки | относительный объем прямой кишки, который получает максимально допустимую дозу |
| D2a: прямой кишки | максимальная доза, которую получают 2 см3 прямой кишки |
| V75 мочевого пузыря | максимальный объем мочевого пузыря, который получает 75% дозы,предписанной для ПЖ |
Таблица 7. Оптимизация планирования сеанса ВМБТ с помощью алгоритма обратного планирования
| Переменные | % предписанной дозы | Вес |
|---|---|---|
| Минимальная доза на планируемый объем облучения (ПЖ и проксимальная треть семенных пузырьков) | 100% | 30-70 |
| Максимальная разрешенная доза на 10% от объема уретры (D10 уретры) | 100-115 % | 10-30 |
| Максимальная разрешенная доза, поглощенная в 2 см3 прямой кишки (D2cc прямой кишки) | менее 80 % 1 | 10-30 |
При проведении ВМБТ у больных РПЖ наиболее важными критическими органами являются: простатический отдел уретры, прямая кишка, мочевой пузырь.
У больных с сохраненной эректильной функцией в качестве дополнительных критических органов могут выделяться сосудисто-нервные пучки и луковица полового члена.
Дозиметрический план считается удовлетворительным в том случае, если объем ПЖ, получающий 100% предписанной дозы (V100), выше 90-94%, а доза, подводимая к 90% объема ПЖ (D90), превышает 100-104% предписанной дозы (табл. 8).
Таблица 8. Максимальная радиационная нагрузка на основные органы риска (уретру и прямую кишку)
| Уретра | |
|---|---|
| D10 | ≤ 105%-125% ≤ 120Гр EQD (2Гр) |
| D30 | < 105% ≤ 105Гр EQD (2Гр) |
| D0.1сс | ≤ 120%-125% ≤ 120Гр EQD (2Гр) |
| Прямая кишка | |
| D2сс | ≤ 70-80% ≤ 75Гр EQD (2Гр) |
| D0.1сс | ≤ 80% |
| V75 | < 1% |
После создания дозиметрического плана под УЗИ-контролем в режиме реального времени (продольное сканирование) с помощью решетки-шаблона выполняется введение полых игл-интрастатов (от 13 до 20, в среднем — 16). После введения игл-интрастатов на трехмерных (3D) УЗИ изображениях, реконструированных в планирующей системе в режиме реального времени устанавливаются координаты введенных игл по отношению к плоскости решетки. На следующем этапе выполняется повторное трехмерное сканирование, которое позволяет внести коррективы в изменившиеся контуры предстательной железы, уретры, прямой кишки и мочевого пузыря.
Таким образом, рассчет основных дозиметрических показателей проводится дважды: до введения игл-интрастатов и непосредственно после их введения (до начала облучения).
После расчета окончательного лечебного плана и проверки его дозиметрических параметров проводится сеанс ВМБТ.
По завершении облучения выполняется удаление интрастатов. Производится контроль наличия примеси крови в оттекающей по катетеру моче. В случае интенсивной гематурии (присутствие сгустков) производится промывание полости мочевого пузыря стерильным изотоническим раствором. При необходимости двухходовой катетер Foley может быть заменен на трехходовой с целью более эффективного промывания мочевого пузыря и предотвращения его тампонады сгустками крови. Для остановки кровотечения из шейки мочевого пузыря может быть также использован следующий прием: баллон катетера заполняется жидкостью до максимально допустимого объема (30-40 мл). После этого осуществляется тракция катетера для создания умеренного натяжения в течение 10-15 минут. В подавляющем большинстве случаев этого достаточно для эффективной остановки кровотечения. С целью профилактики поздних кровотечений могут назначаться парентеральные гемостатические препараты. Раны кожных покровов промежности покрываются давящей антисептической повязкой. Удаление уретрального катетера производится на следующие сутки. При отсутствии осложнений пациент может быть выписан на амбулаторное лечение. Диспансерное наблюдение осуществляется согласно порядкам оказания онкологической помощи.
Важным вопросом ведения пациентов РПЖ, получающих лучевое лечение с помощью ВМБТ, является проведения гормональной андро-гендепривационной терапии. Этот вопрос при лучевом лечении, был хорошо изучен еще в середине 90-х годов прошлого века, но не потерял своей актуальности и сегодня. Ряд исследований показали высокую эффективность адъювантной гормональной терапии при лучевом лечении. Так, в ранних рандомизированных исследованиях RTOG 86-10 и 85-31, а также EORTC 22863 продемонстрирована достоверная способность гормональной терапии снижать частоту локальных рецидивов и увеличивать выживаемость у пациентов РПЖ [37-39]. В более поздних исследованиях была продемонстрирована эффективность андрогенной депривации только у пациентов промежуточного и высокого риска прогрессирования. В исследовании RTOG 08-15 у пациентов промежуточного риска установлена достаточная эффективность коротких курсов адъювантной гормональной терапии [40]. Причем, в более позднем исследовании не было обнаружено различий применения коротких и длинных курсов адъювантной андрогенной блокады [41]. Позднее в исследовании RTOG 09-24 была подтверждена эта возможность у пациентов высокого риска прогрессирования РПЖ, получавших высокоэнергетическое лучевое лечение [42]. С другой стороны, неоадъювантная гормональная терапия, несмотря на некоторое улучшение локального контроля, не влияет на выживаемость [43]. В результате были сформулированы рекомендации проведения андроген-депривационной терапии у пациентов РПЖ, получающих лучевое лечение, в виде рекомендаций NCCN 2005 и EAU 2005 [44]. Таким образом, проведение андрогенной блокады у пациентов, получающих ВМБТ, в сочетанном режиме и режиме монотерапии имеет следующие показания:
- проведение неоадъювантной гормональной терапии не оправдано за исключением случаев, когда выполнение андрогенной депривации преследует цель уменьшение объема ПЖ при интерференции с лонной дугой, препятствующей выполнению брахитерапии;
- у пациентов РПЖ с высоким риском прогрессирования заболевания адъювантная гормональная терапия обязательна и должна иметь длительность не менее 24 месяцев;
- проведение адъювантной гормональной терапии длительностью
- 6 месяцев показано пациентам промежуточного риска прогрессирования РПЖ;
- на сегодняшний день не имеется веских доказательств необходимости проведения адъювантной гормональной терапии у пациентов РПЖ низкого риска прогрессирования.
ОСЛОЖНЕНИЯ И ПРОФИЛАКТИКА
В целом брахитерапия характеризуется низким уровнем ассоциированных с лечением осложнений и побочных реакций. Возможные неблагоприятные эффекты ВМБТ РПЖ включают в себя реакции со стороны нижних мочевых путей, прямой кишки, а также развитие эректильной дисфункции. Значимые осложнения (3 степени и выше по RTOG) со стороны органов мочеполовой системы при наблюдении в течение 5 и более лет после проведения брахитерапии регистрируются в 1-4% случаев [24]. Со стороны прямой кишки серьезные осложнения брахитерапии обнаруживаются реже, не более 1-2% [4,6,21]. В упомянутом выше систематическом обзоре, представленном в Кокрановской библиотеке, большинство исследований показали острую и отсроченную генитоуринарную и гастроинтестинальную токсичность, не превышающую степень II. Только в трех исследованиях были зарегистрированы случаи осложнений IV степени тяжести. Во всех исследованиях, за исключением одного, генитоуринарная токсичность превалировала над гастроинтестинальной. Два исследования установили, что происходит полное восстановление качества жизни пациентов в короткий срок после проведенного лечения, за исключением качества сексуальной жизни, наиболее подверженного негативному влиянию [28].
Лечение в режиме монотерапии является в достаточной степени безопасным. Уровень генитоуринарной токсичности заметно превалирует над гастроинтестинальной. Частота выраженных (III и больше степени) гастроинтестинальных осложнений носит единичный характер с частотой менее 1% случаев. С точки зрения ранних осложнений гипофракционированные режимы выглядят более предпочтительными (табл. 9).
Таблица 9. Сравнение генитoуринарной токсичности высокомощностной брахитерапии в монорежиме с различным количеством фракций [45]
| Режим фракционирования | Кол-во больных |
Острая генито- уринарная токсичность 2 ст., % |
Поздняя генито- уринарная токсичность 2 ст., % |
Острая генито- уринарная токсичность 3 ст., % |
Поздняя генито- уринарная токсичность 3 ст., % |
|---|---|---|---|---|---|
| 38 Гр х 4 фр | 319 | 27% | 31% | 4% | 5% |
| 24 Гр х 2 фр | 79 | 27% | 29% | 2% | 0% |
| 27 Гр х 2 фр | 96 | 18% | 34% | 1% | 6% |
| 19 Гр х 1 фр | 58 | 12% | 12% | 0% | 0% |
Сочетанная терапия имеет относительно монотерапии более высокий риск поздних осложнений. Так, участники американского мультицентрового ретроспективного исследования получили сочетанную лучевую терапию в дозе 2224 Гр за 4 фракции (от 5,5 до 6,0 Гр за фракцию) и дистанционную лучевую терапию (ДЛТ) в СОД=36 Гр. Полученные результаты свидетельствует, что частота поздних лучевых реакций III-IV степени со стороны мочеполовой системы составила 6,7% и 1% соответственно. Проявлений гастроинтестинальной токсичности III и IV степени не было отмечено, также удалось сохранить качество эрекции 67% пациентам с сохраненной эректильной функцией. Одним из недавних исследований, отражающих токсические проявления сочетанной лучевой терапии, является RTOG 0321. Пациентам проводилась ДЛТ на область ПЖ и семенных пузырьков либо на область таза в дозе 45 Гр и «буст» высокомощностной брахитерапии 19 Гр в 2 фракции. Согласно опубликованным в 2010 г. данным проведенного исследования в когорте 129 больных РПЖ сТ1с — Т3Ь со средним сроком наблюдения 29,6 месяцев частота ранних побочных реакций III-V степени RTOG со стороны мочеполовой и гастроинтестинальной системы составила 2,43%. Из них: два случая учащенного мочеиспускания 3 степени и один случай острой задержки мочеиспускания. Поздние лучевые реакции III-V степени RTOG отмечены в 2,56% (4 пациента) случаев и включали в себя: задержку мочеиспускания, лучевой цистит, и лучевой проктит и недержание мочи. В целом, в группе пролеченных больных зарегистрированы явления нарушения эректильной функции III степени у 5 пациентов [26]. Определенный позитивный эффект может быть достигнут при коррекции дизурии после лучевой терапии альфа-адреноблокаторами [46]. Таким образом, учитывая достаточно высокий уровень генитоуринарной токсичности, на первое место при сочетанной терапии выступает строгое следование показаниям к выполнению данного лечения.
Наконец, с точки зрения сохранения эректильной функции брахитерапия демонстрирует превосходный результат. Так, в мета-анализе 54 исследований вероятность сохранения эректильной функции при брахитерапии, как единственного метода лечения РПЖ, составила 76%, при сочетанной лучевой терапии — 60%, в то время как при дистанционной лучевой терапии — 55%, а при хирургическом лечении с сохранением нервных структур — 34%, после стандартной РПЭ только 25% [48]. Тем не менее, вопрос предотвращения эректильной дисфункции остается актуальным и требует дальнейшего изучения, в том числе, исследование допустимой нагрузки на область сосудисто-нервных пучков и луковицу полового члена.
ЛИТЕРАТУРА
1. Зырянов А.В., Ощепков В.Н., Свиридов П.В. и соавт. Рекомендации по лечению рака предстательной железы с помощью перманентной внутритканевой лучевой терапии (брахитерапии). Экспертное совещание Объединения брахитерапевтов (ОБР), 4.10.2014, Москва. Экспериментальная и клиническая урология 2015;(2):37-47.
2. Зырянов А.В., Ощепков В.Н., Пономарев А.В. и соавт. Опыт применения закрытых источников 131-Цезия для интерстициальной лучевой терапии (брахитерапии) для лечения больных локализованным раком предстательной железы. Уральский медицинский журнал 2016;134(1):5-9.
3. Новиков, С. Н., Канаев, С. В., Новиков Р.В., Ильин Н.Д., Готовчикова М.Ю. и соавт. Высокодозная брахитерапия рака предстательной железы в режиме реального времени с использованием источника 192IR (особенности дозиметрического планирования). Вопросы онкологии 2015; 61(1):130-136.
4. Zamboglou N, Tselis N, Baltas D, Buhleier T, Martin T, Milickovic N, et al. High-dose-rate interstitial brachytherapy as monotherapy for clinically localized prostate cancer: treatment evolution and mature results. Int J Radiat Oncol Biol Phys 2013;85(3):672-678. doi: 10.1016/j.ijrobp.2012.07.004.
5 . Yoshioka Y, Kotsuma T, Komiya A, Kariya S, Konishi K, Nonomura N, et al, Nationwide, multicenter, retrospective study on high-dose-rate brachytherapy as monotherapy for prostate cancer. Int J Radiat Oncol Biol Phys 2017;97(5):952-61. doi: 10.1016/j.ijrobp.2016.12.013.
6. Demanes DJ, Ghilezan MI. High-dose-rate brachytherapy as monotherapy for prostate cancer. Brachytherapy 2014;13(6):529-41. doi: 10.1016/j.brachy.2014.03.002.
7. Yamada Y, Rogers L, Demanes DJ, Morton G, Prestidge BR, Pouliot J, et al. American Brachytherapy Society consensus guidelines for high-dose-rate prostate brachytherapy. Brachytherahy 2012;11(1):20-32. doi: 10.1016/j.brachy.2011.09.008.
8. Williams MV, Denekamp J, Fowler JF. A review of alpha/beta ratios for experimental tumors: implications for clinical studies of altered fractionation. Int J Radiat Oncol Biol Phys 1985;11(1):87-96.
9. Claren A., Gautier M., Feuillade J, Falk AT, Levi JM. Second salvage treatment for local recurrence of prostate cancer using high-dose-rate brachytherapy: a case report. J Contemp Brachytherapy 2015;7(3):244-7. doi: 10.5114/jcb.2015.51852.
10. Vogelius IR, Bentzen SM. Meta-analysis of the alpha/beta ratio for prostate cancer in the presence of an overall time factor: bad news, good news, or no news? Int J Radiat Oncol Biol Phys 2013;85(1):89-94. doi: 10.1016/j.ijrobp.2012.03.004.
11. Boonstra PS., Taylor J.M., Smolska-Ciszewska B., Behrendt K., Dworzecki T., Gawkowska-Suwinska M., Bialas B., et al. Alpha/beta (a/p) ratio for prostate cancer derived from external beam radiotherapy and brachytherapy boost. Br J Radiol 2016;89(1061):20150957. doi:10.1259/bjr.20150957.
12. Аль-Шукри C.X., Невирович Е.С., Кузьмин И.В., Борискин А.Г. Ранние и поздние осложнения радикальной простатэктомии. Урологические ведомости 2012;2(2):10-4.
13. Кызласов П.С., Сокольщик М.М., Байкова Н.В., Самойлов А.С., Забелин М.В. Недержание мочи после радикальной простатэктомии. Экспериментальная и клиническая урология 2015;(3):38-41.
14. Benoit RM, Naslund MJ, Cohen JK. Complications after radical retropubic prostatectomy in the m.edicare population. Urology 2000;56(1):116-20.
15. Salonia A, Burnett AL, Graefen M, Hatzimouratidis K, Montorsi F, Mulhall JP, et al. Prevention and management of postprostatectomy sexual dysfunctions. Part 1: choosing the right patient at the right time for the right surgery. Eur Urol 2012;62(2):261-72. doi: 10.1016/j.eururo.2012.04.046.
16. Mohler J, Bahnson RR, Boston B, Busby JE, D’Amico A, Eastham JA, et al. NCCN clinical practice guidelines in oncology: prostate cancer. J Natl Compr Canc Netw 2010;8(2):162-200.
17. Канаев С.В., Новиков С.Н. Особенности высокодозной брахитерапии больных локализованным раком предстательной железы. Вопросы онкологии 2013;59(5): 645-50.
18. Mohammed N, Kestin L, Ghilezan M, Krauss D, Vicini F, Brabbins D, et al. Comparison of acute and late toxicities for three modern high-dose radiation treatment techniques for localized prostate cancer. Int J Radiat Oncol Biol Phys 2012;82(1):204-12. doi: 10.1016/j.ijrobp.2010.10.009.
19. Skowronek J. Low-dose-rate or high-dose-rate brachytherapy in treatment of prostate cancer — between options. J Contemp Brachytherapy 2013 Mar;5(1):33-41. doi: 10.5114/jcb.2013.34342.
20. Galalae RM, Zakikhany NH, Geiger F, Siebert FA, Bockelmann G, Schultze J, et al. The 15-year outcomes of high-dose-rate brachytherapy for radical dose escalation in patients with prostate cancer — a benchmark for high-tech external beam radiotherapy alone? Brachytherapy 2014;13(2):117-22. doi: 10.1016/j.brachy.2013.11.002.
21. Zaorsky NG, Palmer JD, Hurwitz MD, Keith SW, Dicker AP, Den RB. What is the ideal radiotherapy dose to treat prostate cancer? A metaanalysis of biologically equivalent dose escalation. Radiother Oncol 2015;115(3):295-300. doi: 10.1016/ j.radonc.2015.05.011.
22. Hoskin PJ, Colombo A, Henry A, Niehoff P, Paulsen Hellebust T, Siebert FA, et al. GEC/ESTRO recommendations on high dose rate afterloading brachytherapy for localised prostate cancer: an update. Radiother Oncol 2013;107(3):325-32. doi: 10.1016/j.radonc.2013.05.002.
23. Kovacs G, Melchert C, Sommerauer M, Walden O. Intensity modulated high-dose-rate brachytherapy boost complementary to external beam radiation for inter
mediate- and high-risk localized prostate cancer patients-how we do it in
Lubeck/Germany. Brachytherapy 2007;6(2):142-8.
24. Харченко В.П., Каприн А.Д., Паньшин Г.А., Хмелевский Е.В., Миленин К.Н., Егорова Е.В., и др. Высокодозная брахитерапия рака предстательной железы — технология будущего. Вопросы онкологии 2008;54(6): 765-7.
25. Martinez AA, Demanes J, Vargas C, Schour L, Ghilezan M, Gustafson GS. High-dose-rate prostate brachytherapy: an excellent accelerated-hypofractionated treatment for favorable prostate cancer. Am J Clin Oncol 2010;33(5):481-488. doi: 10.1097/COC.0b013e3181b9cd2f.
26. Hsu IC, Bae K, Shinohara K, Pouliot J, Purdy J, Ibbott G, et al, Phase II trial of combined high-dose-rate brachytherapy and external beam radiotherapy for adenocarcinoma of the prostate: preliminary results of RTOG 0321. Int JRadiat Oncol Biol Phys 2010;78(3):751-8. doi: 10.1016/j.ijrobp.2009.08.048.
27. Cendales R, Alwers E, Cifuentes J, Bobadilla I, Torres F, Arbelaez J, et al, High-dose-rate brachytherapy delivered in two fractions as monotherapy for low-risk prostate cancer. J Contemp Brachytherapy 2015;7(1):10-6. doi: 10.5114/jcb.2015
28. Sanchez-Gomez LM, Polo-deSantos M, Rodriguez-Melcon JI, Angulo JC, Lu-engo-Matos S.High-dose rate brachytherapy as monotherapy in prostate cancer: A systematic review of its safety and efficacy. Actas Urol Esp 2017;41(2):71-81. doi: 10.1016/j.acuro.2016.06.001.
29. Ghadjar P, Oesch SL, Rentsch CA, Isaak B, Cihoric N, Manser P, et al. Late toxicity and five year outcomes after high-dose-rate brachytherapy as a monotherapy for localized prostate cancer. Radiat Oncol 2014;28(9):122. doi: 10.1186/1748-717X-9-122.
30. Srigley JR, Delahunt B, Egevad L, Samaratunga H, Yaxley J, Evans AJ.One is the new six: The International Society of Urological Pathology (ISUP) patient-focused approach to Gleason grading. Can Urol Assoc J 2016;10(9-10):339-41.
31. Prada PJ, Cardenal J, Blanco AG, Anchuelo J, Ferri M, Fernandez G, et al. High-dose-rate interstitial brachytherapy as monotherapy in one fraction for the treatment of favorable stage prostate cancer: Toxicity and longterm biochemical results. Radiother Oncol 2016;119(3):.411-6. doi: 10.1016/j.radonc.2016.04.006.
32. Morton G, Chung HT, McGuffin M, Helou J, D’Alimonte L, Ravi A, et al. Prostate high dose-rate brachytherapy as monotherapy for low and intermediate risk prostate cancer: Early toxicity and quality-of life results from a randomized phase II clinical trial of one fraction of 19Gy or two fractions of 13.5 Gy. Radiother Oncol 2017;122(1):87-92. doi: 10.1016/j.radonc.2016.10.019.
33. Valero J, Cambeiro M, Galan C, Teijeira M, Romero P, Zudaire J, et al. Phase II trial of radiation dose escalation with conformal external beam radiotherapy and high-dose-rate brachytherapy combined with long-term androgen suppression in unfavorable prostate cancer: feasibility report. Int J Radiat Oncol Biol Phys 2010;76(2):386-92. doi: 10.1016/j.ijrobp.2009.01.059.
34. Moulton CR, House MJ, Lye V, Tang CI, Krawiec M, Joseph DJ, et al. Prostate external beam radiotherapy combined with high-dose-rate brachytherapy: dose-volume parameters from deformably-registered plans correlate with late gastrointestinal complications. Radiat Oncol 2016;11(1):144.
35. Morton GC. High-dose-rate brachytherapy boost for prostate cancer: rationale and technique. J Con-temp Brachytherapy 2014;6(3):323-30. doi: 10.5114/jcb.2014.45759.
36. Kukolowicz PF, Mijnheer BJ. Comparison between dose values specified at the ICRU reference point and the mean dose to the planning target volume. Radiother Oncol 1997;42(3):271-7.
37. Pilepich MV, Winter K, John MJ, Mesic JB, Sause W, Rubin P, et al. Phase III radiation therapy oncology group (RTOG) trial 86-10 of androgen deprivation adjuvant to definitive radiotherapy in locally advanced carcinoma of the prostate. Int J Radiat Oncol Biol Phys 2001;50(5):1243-52.
38. Lawton CA, Winter K, Murray K, Machtay M, Mesic JB, Hanks GE, et al. Updated results of the phase III Radiation Therapy Oncology Group (RTOG) trial 85-31 evaluating the potential benefit of androgen suppression following standard radiation therapy for unfavorable prognosis carcinoma of the prostate. Int J Radiat Oncol Biol Phys 2001;49(4):.937-46.
39. Ataman F, Zurlo A, Artignan X, van Tienhoven G, Blank LE, Warde P, et al. Late toxicity following conventional radiotherapy for prostate cancer: analysis of the EORTC trial 22863. Eur J Cancer 2004;40(11):1674-81.
40. Cheney MD, Chen MH, Zhang D, Phillips JG, Loffredo MJ, D’Amico AV Greatest percentage of involved core length and the risk of death from prostate cancer in men with highest Gleason score > 7. Clin Genitourin Cancer 2014;12(4):234-40. doi: 10.1016/j.clgc.2014.01.006.
41. Mirhadi AJ, Zhang Q, Hanks GE, Lepor H, Grignon DJ, Peters CA, et al. Effect of long-term hor-monal therapy (vs short-term hormonal therapy): a secondary analysis of intermediate-risk prostate cancer patients treated on NRG oncology RTOG 9202. Int J Radiat Oncol Biol Phys 2017;97(3):511-5. doi: 10.1016/j.ijrobp.2016.11.002.
42. Spratt DE, Vargas HA, Zumsteg ZS, Golia Pernicka JS, Osborne JR, et al. Patterns of lymph node failure after dose-escalated radiotherapy: implications for extended pelvic lymph node coverage. Eur Urol 2017;71(1):37-43. doi: 10.1016/ j.eururo.2016.07.043
43. Krauss DJ, Hu C, Bahary JP, Souhami L, Gore EM, Chafe SM, et al. Importance of Local Control in Early-Stage Prostate Cancer: Outcomes of Patients With Positive Post-Radiation Therapy Biopsy Results Treated in RTOG 9408. Int J Radiat Oncol Biol Phys 2015;92(4):863-73. doi: 10.1016/j.ijrobp.2015.03.017.
44. Milecki P, Kwias Z, Martenka DJ. Radiotherapy combined with hormonal therapy (RT-HT) in prostate cancer patients with low, intermediate, and high risk of biochemical recurrence: perspective and therapeutic gain analysis. Neoplasma 2007;54(1):7-15.
45. Tselis N, Hoskin P, Baltas D, Strnad V, Zamboglou N, Rodel C, et al. High Dose Rate Brachytherapy as Monotherapy for Localised Prostate Cancer: Review of the Current Status. Clin Oncol (R. Coll. Radiol.) 2017; 29(7):401-411. doi: 10.1016/j.clon.2017.02.015.
46. Сивков А.В., Ощепков В.Н., Кешишев Н.Г., Шкабко О.В. Об эффективности а1-адреноблокаторов при коррекции дизурии после лучевой терапии рака предстательной железы. Экспериментальная и клиническая урология 2010;(3):70-5.
47. Robinson JW, Moritz S, Fung T. Meta-analysis of rates of erectile function after treatment of local ized prostate carcinoma. Int J Radiat Oncol Biol Phys 2002;54(4):1063-8. 49. Marks LB, Yorke ED, Jackson A, Ten Haken RK, Constine LS, et al. Use of normal tissue complica-tion probability models in the clinic. Int J Radiat Oncol Biol Phys 2010;76(Suppl.3):10-9.







