ВВЕДЕНИЕ
Инфаркт почки (ИП) – сравнительно редкое состояние, вызывающее полную или частичную потерю функции органа. Чаще всего это заболевание встречается между 6 и 8 декадами жизни [1].
Как правило, ИП развивается на фоне острой окклюзии почечной артерии, в основе которой лежит тромбоэмболия, тромбоз артерии, диссекция ее стеноклибо травматическое или ятрогенное ее повреждение [2]. Среди этих причин доминирует эмболия, источником которой является сердце (аритмия, инфаркт миокарда, болезни клапанов сердца), и атеросклеротическое поражение сосудов [3, 4].
В литературе также описаны такие причины ИП как тромбофилия, фибромускулярная дисплазия почечной артерии, васкулиты, расслаивающая аневризма аорты и даже передозировка кокаина [3, 5-8].
Острая окклюзия почечной артерии диагностируется редко в первую очередь ввиду неспецифической клинической картины.
В 1940 году H.J. Hoxie и соавт. в исследовании, проведенном на основе данных 14000 аутопсий, продемонстрировали 205 (1,4%) случаев состоявшегося инфаркта почки, из которых только 2 (0,014%) были диагностированы прижизненно [9]. Исследование показывает истинную распространенность ИП и тот факт, что корректно диагностируется данное состояние крайне редко. Очевидно, что диагностика была значимо затруднена в то время по причине отсутствия точных методов визуализации, тем не менее и на сегодняшний день своевременная постановка диагноза ИП является непростой клинической задачей.
МАТЕРИАЛЫ И МЕТОДЫ
Проведен ретроспективный анализ 12 медицинских карт пациентов, находившихся на стационарном лечении в ГКБ им. В.М. Буянова с января 2018 по сентябрь 2021 года с диагнозом «инфаркт почки».
Всем пациентам было выполнено рутинное физикальное обследование, лабораторное обследование, включавшее оценку лейкоцитоза, уровня лактатдегидрогеназы (ЛДГ) и креатинина сыворотки крови, эритроцитурии и протеинурии. Инструментальное обследование включало электрокардиографию, ультразвуковое исследование (УЗИ), компьютерную томографию (КТ) почек с контрастным усилением, а в некоторых случаях ангиографию.
Условием постановки диагноза являлось одновременное наличие следующих критериев: клиническая картина болевого синдрома соответствующей локализации; одного или нескольких клиновидных дефектов контрастирования паренхимы в артериальную и паренхиматозную фазы, либо тотальное поражение паренхимы с отсутствием контрастирования всей почки; а также повышение уровня ЛДГ выше референсных значений. Помимо этого оценивались сроки от дебюта заболевания и от момента обращения в стационар до постановки диагноза.
В дальнейшем 5 пациентам из 12 после получения информированного согласия проведено контрольное обследование в срок от 2 до 34 месяцев с момента диагностирования ИП. Оно включало КТ почек с контрастированием, динамическую нефросцинтиграфию (ДНСГ), оценку уровня креатинина, тест на микрогематурию и протеинурию.
РЕЗУЛЬТАТЫ
Проанализированы данные 12 пациентов (7 мужчин и 5 женщин). Средний возраст пациентов – 60,4±16,4 лет.
Давность заболевания на момент постановки диагноза составила более 48 часов у 6 пациентов, от 24 до 48 часов – у 4 пациентов и только у двух ИП был диагностирован в первые сутки. При этом 5 пациентам диагноз поставлен в первые 12 часов от момента поступления, троим – на вторые сутки и 4 - более поздний срок.
У 5 пациентов имел место инфаркт правой почки, у 4 – левой и 3 больных имели двустороннее поражение.
Все больные, имевшие правостороннее поражение, были доставлены в стационар с подозрением на острую хирургическую патологию: холецистит (3) и аппендицит (2). Левосторонее поражение было расценено на догоспитальном этапе как почечная колика (2) и панкреатит (2). Двусторонее поражение развилось в стационаре у 2 пациентов, госпитализированных с фибрилляцией предсердий (ФП), и было диагностировано в первые сутки. Один больной был доставлен с подозрением на острую кишечную непроходимость. У двух пациентов с двусторонним поражением диагностирован также инфаркт селезенки.
КТ с контрастированием продемонстрировала тотальный ИП в 1 случае и сегментарные поражения – в 11 случаях.
Фибрилляцию предсердий (ФП) на ЭКГ на момент поступления имели 7 пациентов, у 5 из них нарушение ритма было в анамнезе, 4 получали антикоагулянтную терапию на постоянной основе.
У всех пациентов имело место повышение уровня креатинина, средний его уровень составил 149,5±32,9 мкмоль/л, при этом олигурия была у одного больного с мультиорганным поражением.
Средний уровень ЛДГ составил 1563,4±739,7 Ед/л. Микрогематурия отмечена в трех случаях, а протеинурия была у шести пациентов. Субфебрильную лихорадку, длительность которой составляла от 3 до 8 суток имели 10 больных из 12 .
Данные клинических параметров и результаты инструментальных и лабораторных исследований представлены в таблице 1.
Таблица 1. Характеристика пациентов
Table 1. Patients data
| Мужской пол, n Male, n |
7 |
| Женский пол, n Female, n |
5 |
| Средний возраст, лет Mean age, years |
60,36+16,36 |
| ФП на ЭКГ при поступлении, n Atrial fibrillation at admission, n |
7 |
| ФП в анамнезе, n Anamnesis of atrial fibrillation, n |
5 |
| Постоянный прием антикоагулянтов, n Regular anticoagulant use, n |
4 |
| Время от начала заболевания до постановки диагноза: Time from infarction onset until diagnosis: до 24 часов, n less than 12 hours, n 24 – 48 часов, n 24 – 48 hours, n более 48 часов, n more than 48 hours, n |
2 4 6 |
| Время от момента госпитализации до постановки диагноза: Time from admission to hospital until diagnosis: до 12 часов, n less than 12 hours, n 12 – 24 часа, n 12 – 24 hours, n более 24 часов, n more than 24 hours, n |
5 3 4 |
| Диагноз поставлен на основании: Most significant diagnostic tool: УЗИ почек, n Kidney sonography, n КТ с контрастированием, n Enhanced CT scan, n Ангиография, n Angiography, n |
0 12 1 |
| Макрогематурия, n Macrohaematuria, n |
0 |
| Микрогематурия, n Microhaematuria, n |
3 |
| Протеинурия, n Proteinuria, n |
5 |
| Лейкоцитоз, n Leucocytosis, n |
12 |
| Лихорадка, n Fever, n |
10 |
| Средний уровень ЛДГ, Ед/л Mean LDH level, U/l |
1563,4+739,7 |
| Средний уровень креатинина, мкмоль/л Mean level of creatinine, mmol/l |
149,5+32,9 |
Всем пациентам проводилась антикоагулянтная терапия гепарином в лечебной дозе и антибиотикопрофилактика при наличии лейкоцитурии или анамнеза хронической мочевой инфекции, а также симптоматическая терапия нестероидными противовоспалительными препаратами (НПВП). Клинических и лабораторных признаков повторных эпизодов тромбоэмболии за время пребывания пациентов в стационаре отмечено не было.
Одному из пациентов с острой окклюзией ветви почечной артерии первого порядка спустя 16 часов от начала заболевания выполнена ангиография и тромбоэкстракция с хорошим ангиографическим эффектом.
Контрольное обследование проведено в срок от 2 до 34 месяцев от развития ИП 5 пациентам. Контактные данные четверых пациентов оказались недействительны, один отказался от обследования и двое скончались после выписки из стационара. Причинами ухода из жизни были инфаркт миокарда и инфаркт мозга.
Изотопная нефросцинтиграфия продемонстрировала снижение массы функционирующих нефронов на стороне поражения и уменьшение вклада перенесшей инфаркт почки. Стоит отметить, что наряду со снижением секреции, эвакуаторная функция продемонстрировала отклонение от нормы, заключающееся в умеренной задержке радиофармпрепарата (РФП) на уровне чашечно-лоханочной системы.
КТ с контрастированием продемонстрировала уменьшение объема паренхимы на стороне поражения с наличием рубцовой деформации, соответствующей участкам инфаркта. Общий объем почечной ткани по сравнению с КТ, выполненной на фоне инфаркта, уменьшился во всех 5 случаях. При этом объем контрастируемой паренхимы при контрольном исследовании соответствовал ранее не вовлеченному в зону ишемии объему почечной ткани.
Уровень креатинина был повышен (127 мкмоль/л) у 1 пациента, у 4 данный показатель вернулся к норме. Анализ мочи также не продемонстрировал отклонений.
Клиническое наблюдение
Пациент К. 49 лет был госпитализирован в ГКБ им. В.М. Буянова с направительным диагнозом «острый аппендицит». За 20 часов до госпитализации после физической нагрузки отметил возникновение интенсивной боли в правых отделах живота. Болевой синдром регрессировал через несколько минут после возникновения, однако в течение нескольких часов боль рецидивировала, локализуясь в околопупочной области.
В клиническом анализе крови лейкоцитоз 14,4 х 109/л, количество тромбоцитов 310 х 109/л. В анализе мочи микрогематурии, протеинурии нет. Креатинин 111 мкмоль/л, ЛДГ – 852 Ед/л. Все показатели коагулограммы в пределах нормы.
ЭКГ: синусовый ритм; ЧСС – 66; горизонтальное положение электрической оси сердца (ЭОС).
Эхокардиография: скрытая диастолическая дисфункция левого желудочка гипертрофического типа; эукинетический тип кровообращения с тенденцией к гиперкинетическому. При КТ с контрастированием (рис. 1 и 2) визуализированы обширные зоны гипоперфузии по передней (а) и задней (б) поверхности правой почки. Указанные участки, соответствующие зонам инфаркта почечной паренхимы, имели общий объем 95,3 мл, при объеме контрастируемой паренхимы 173,4 мл. После постановки диагноза в течение 5 суток проводилась консервативная терапия.
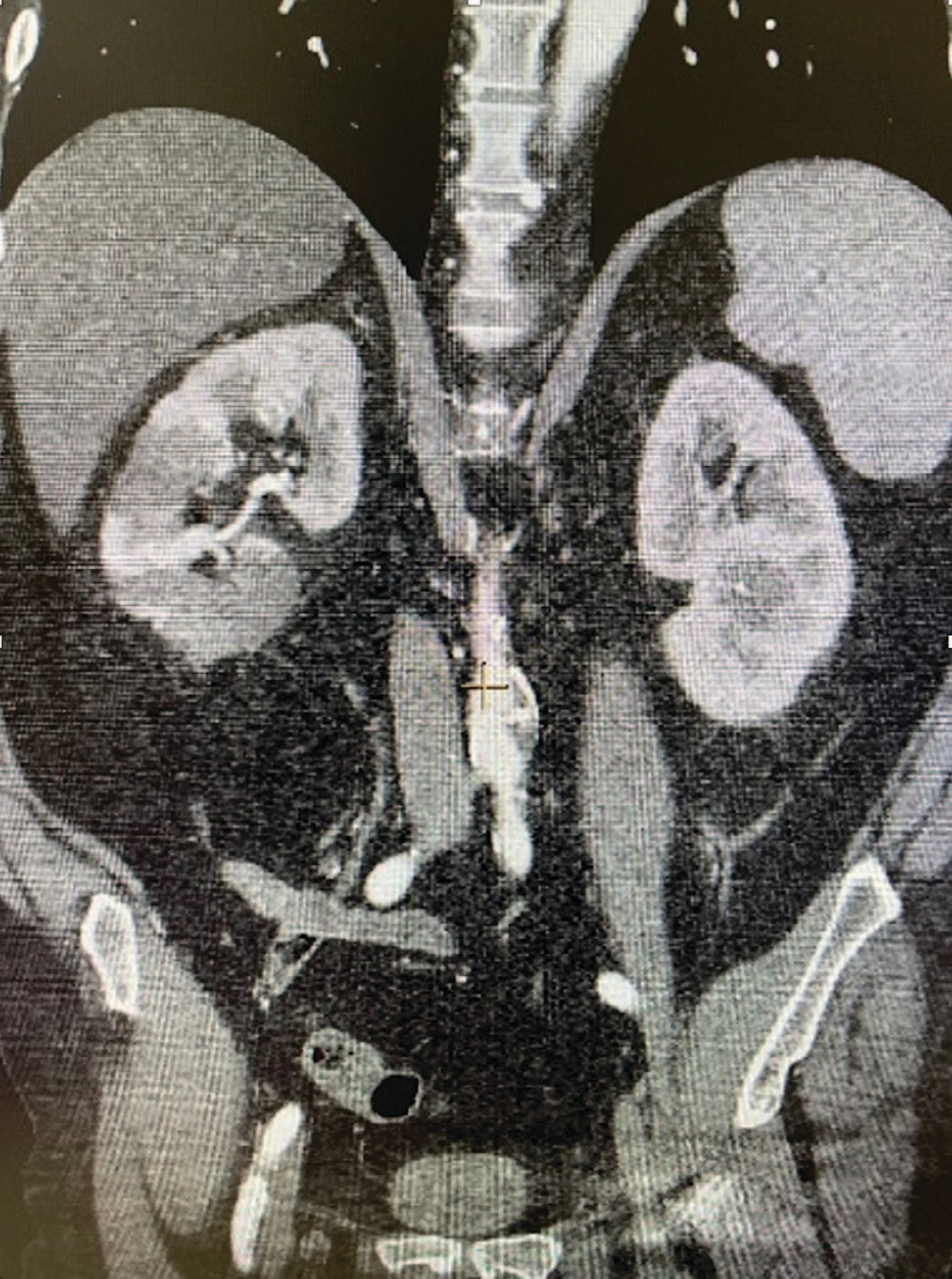
Рис. 1. КТ почек с контрастированием на 2 сутки после начала заболевания
Fig. 1. Renal CT scan on the second day after the clinical onset of the infarction
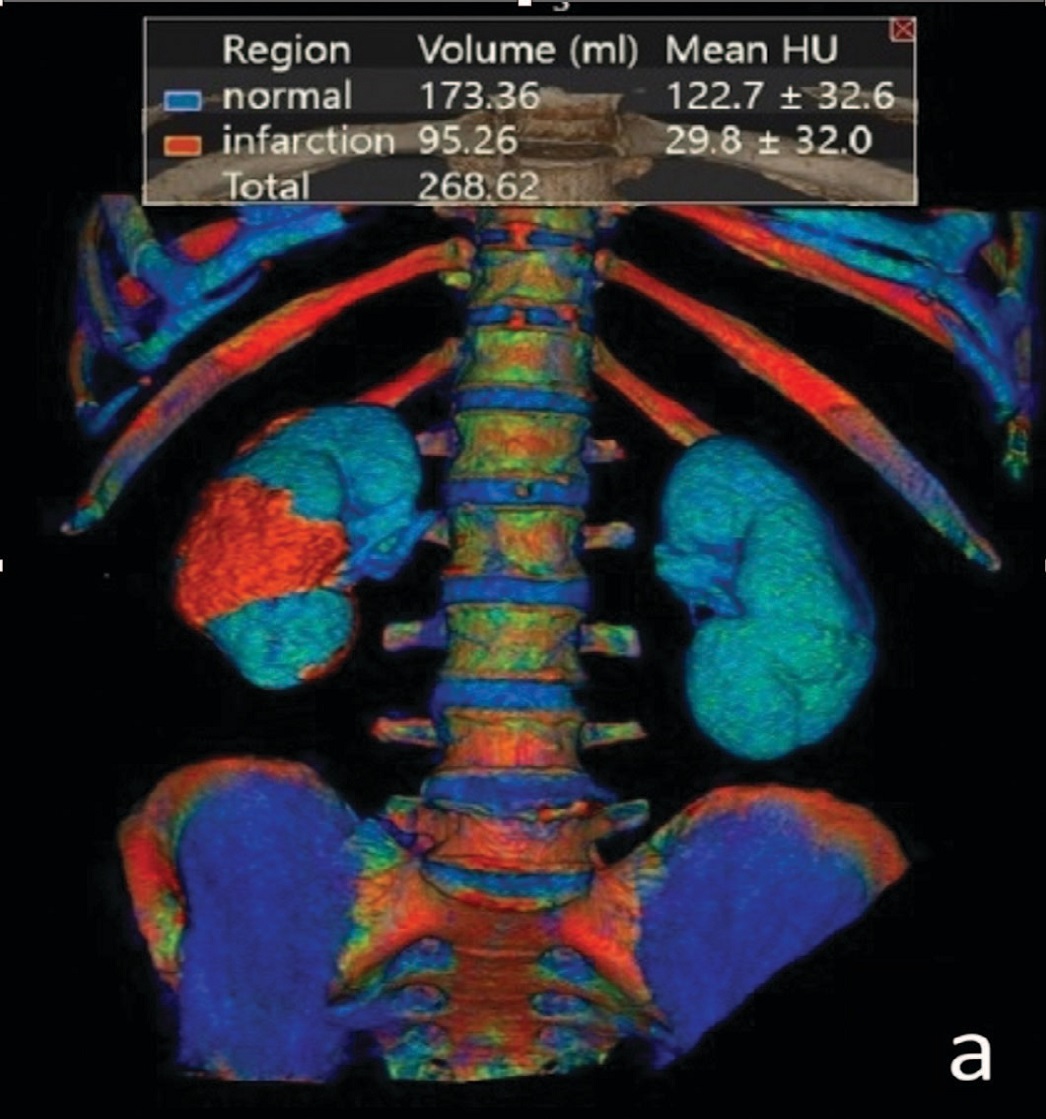
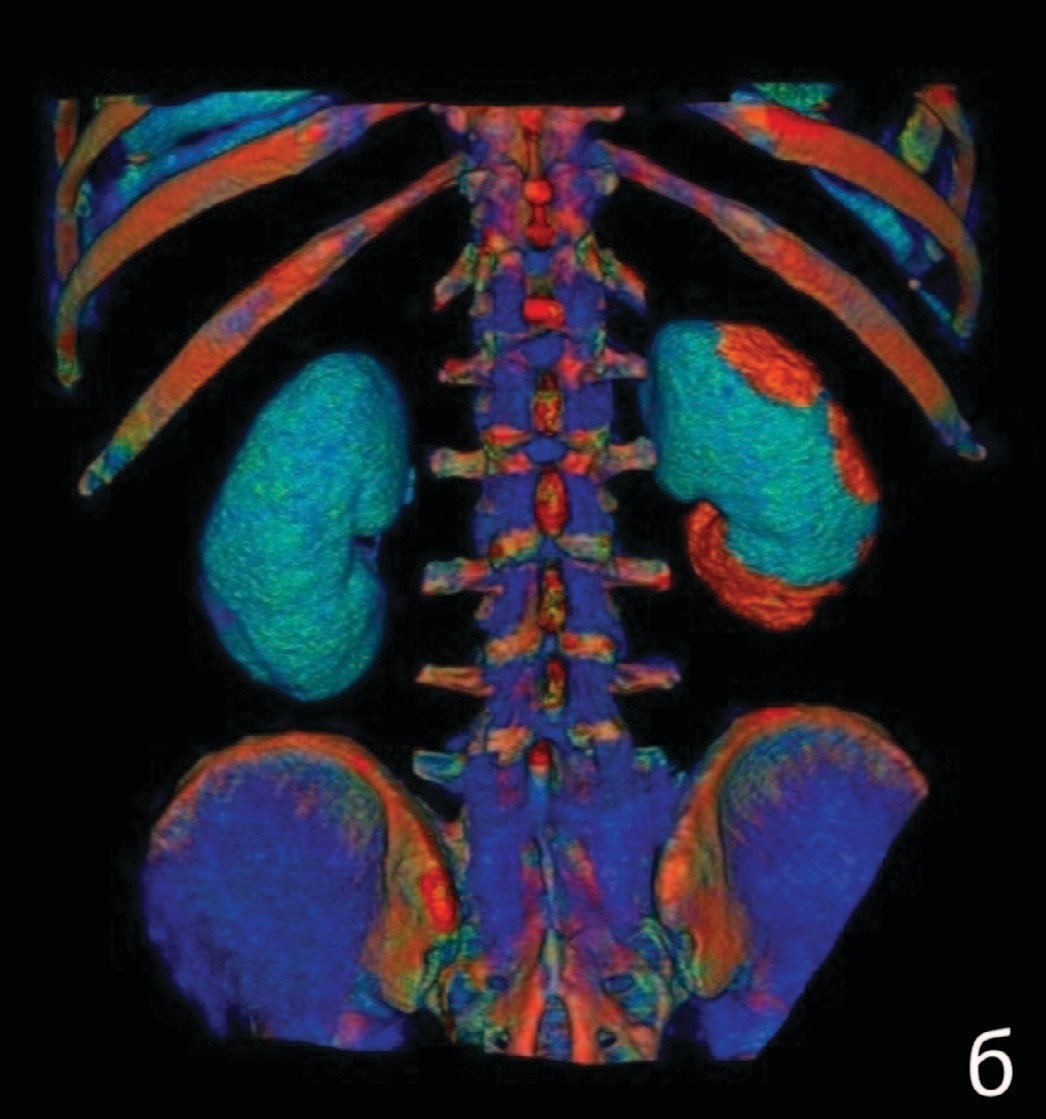
Рис. 2. КТ почек. Трехмерная реконструкция. Красным отмечены зоны инфаркта (а – вид спереди, б – вид сзади)
Fig. 2. Renal CT scan. 3D reconstruction. Infarction areas marked red (a – front view, б – rear view)
Последняя представляла собой сочетание гепарина в лечебной дозе и НПВП. На 5 сутки пребывания в стационаре субфебрильная лихорадка и болевой синдром купированы полностью, отмечено снижение лейкоцитоза и азотемии. Пациент выписан с рекомендацией продолжить наблюдение у кардиолога и нефролога.
По прошествии 34 месяцев проведено контрольное обследование, включавшее в себя общеклиническое анализы крови и мочи, оценку креатинина и ЛДГ, динамическую нефросцинтиграфию и КТ почек с контрастированием. Результаты всех оцениваемых анализов были в пределах референсных значений. ДНСГ: отношение функционирующей паренхимы почек - слева 55%, справа 45%; замедление выделительной функции правой почки.
КТ с контрастированием (рис. 3 и 4) продемонстрировала наличие грубой деформации почечной паренхимы с формированием рубцовых втяжений в участках соответствующих зонам некроза паренхимы как спереди (а), так и сзади (б). Общий объем почечной ткани через 34 месяца составил 170,6 мл, что, как видно, соответствует объему непораженной при инфаркте паренхимы.
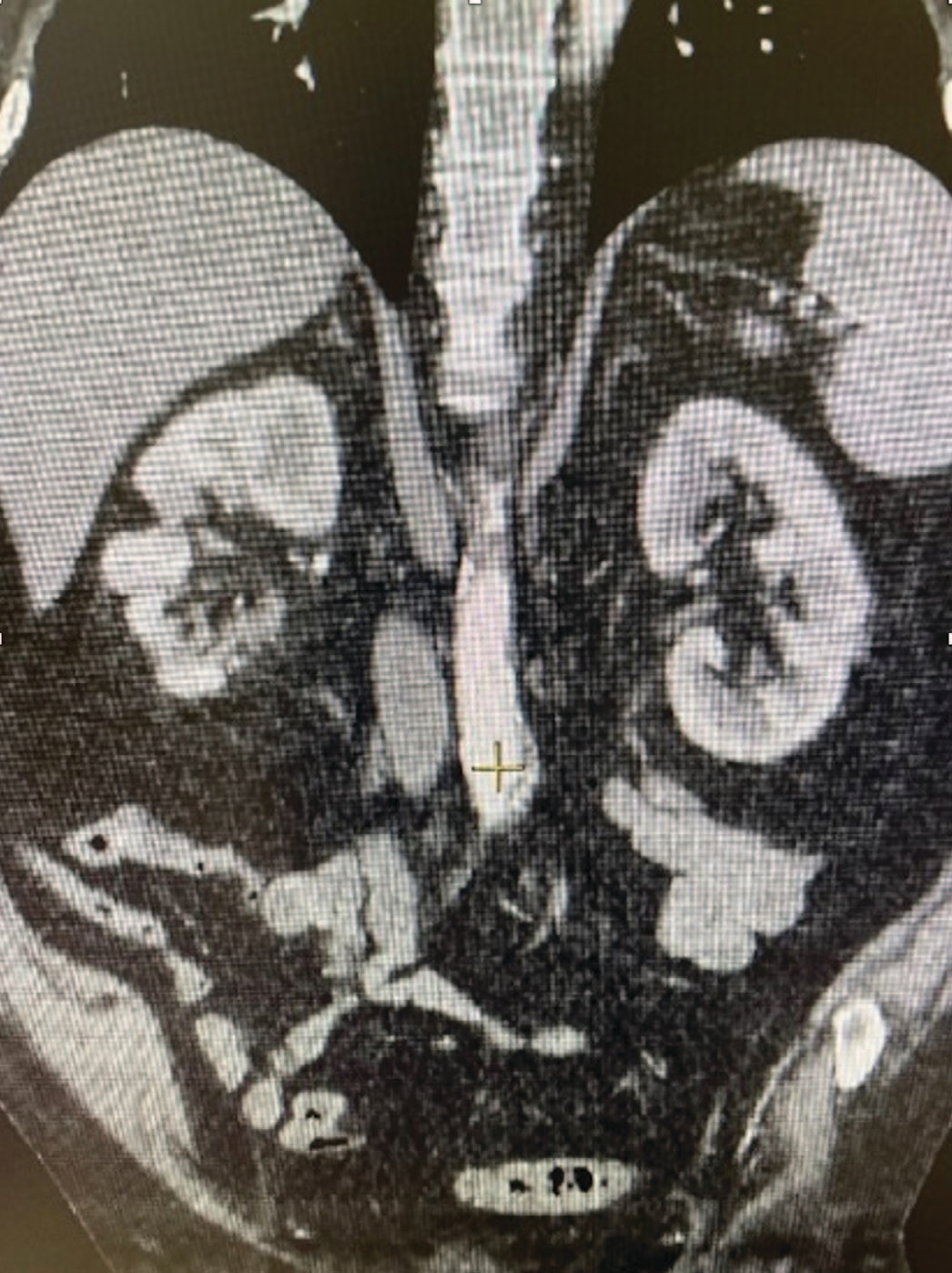
Рис. 3. КТ почек с контрастированием через 34 месяца
Fig. 3. Renal CT scan 34 months after infarction
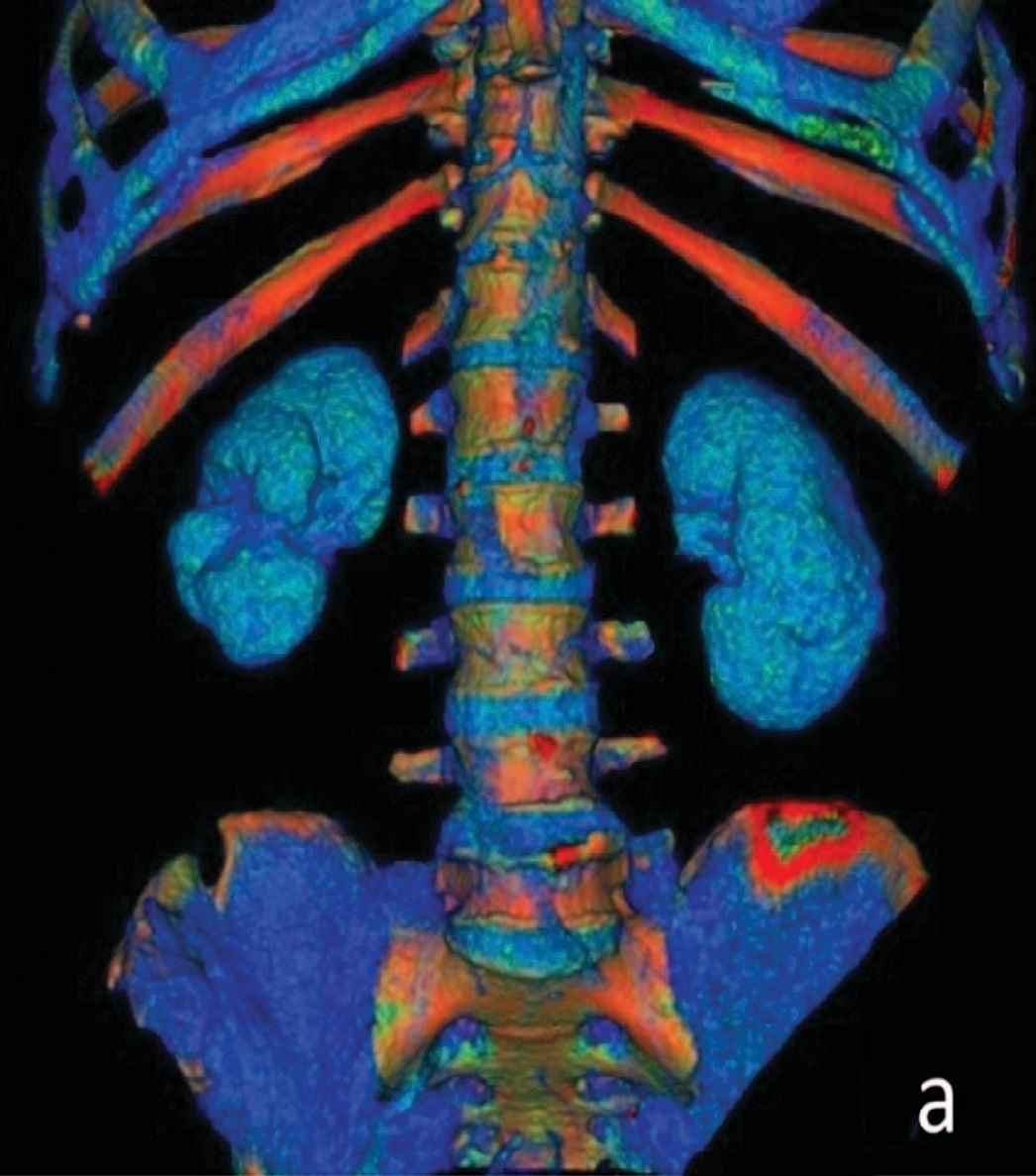
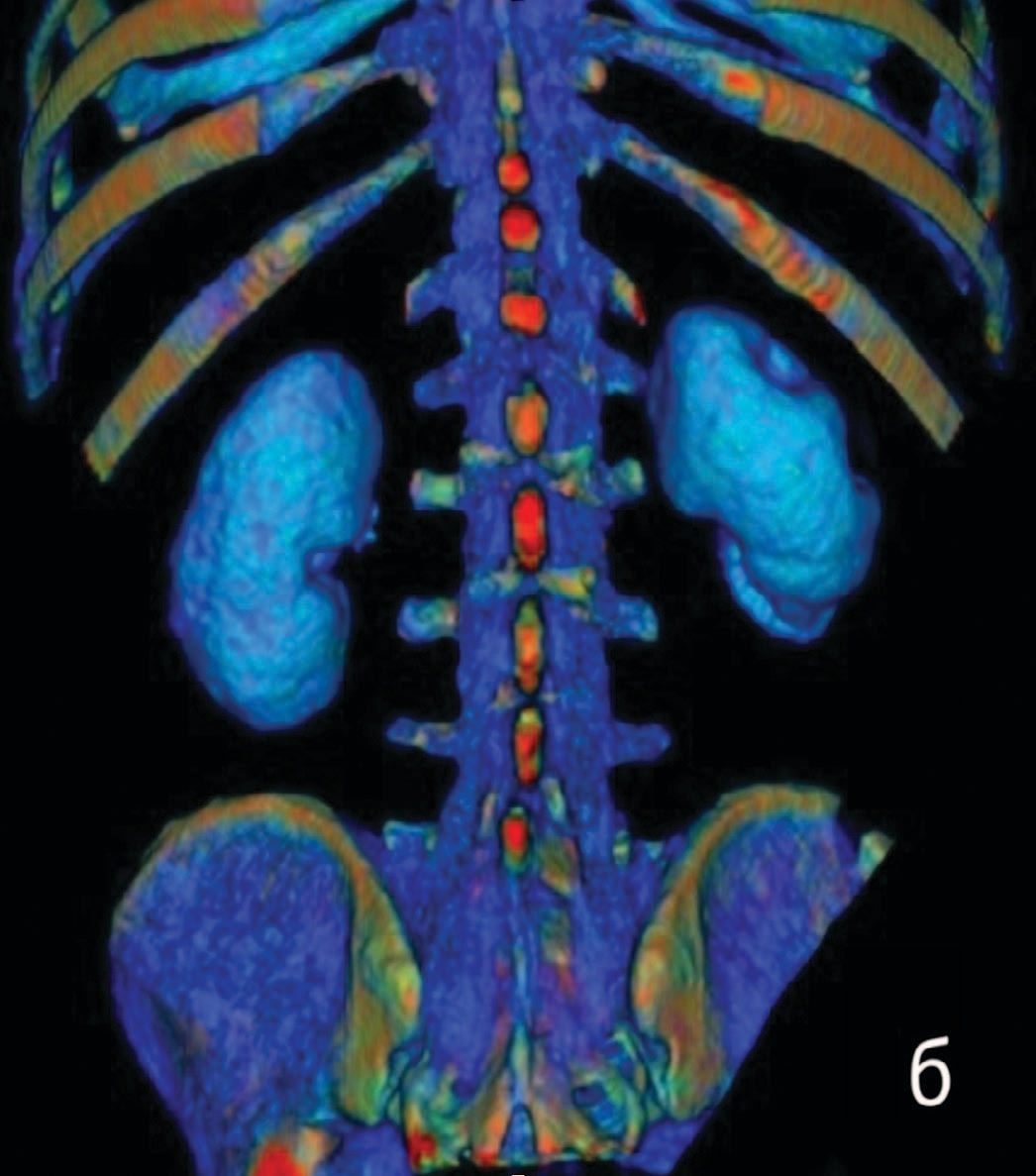
Рис. 4. КТ почек. Трехмерная реконструкция (а – вид спереди, б – вид сзади).
Fig. 4. Renal CT scan. 3D reconstruction (a – front view, б – rear view)
ОБСУЖДЕНИЕ
На сегодняшний день считается, что острая окклюзия почечной артерии должна быть заподозрена при наличии следующей триады: интенсивный болевой синдром в соответствующей половине живота; значимый рост уровня ЛДГ сыворотки крови; микрогематурия [10]. Следует отметить, что оценка ЛДГ не является компонентом рутинного обследования пациента с неотложными состояниями в хирургии и урологии. Микрогематурия встречается при ИП приблизительно у половины пациентов, однако в нашей группе пациентов была отмечена только у каждого четвертого [11, 12].
Характерные для ИП клинические проявления могут быть обусловлены гораздо более часто встречающейся патологией, этим и объясняется то, что правильный диагноз пациентам с острой окклюзией почечной артерии устанавливается не сразу.
В исследовании R.K. Lessman и соавт. показано, что у 17 пациентов диагноз установлен в срок от 3 до 6 суток, и лишь у 5 – в первые сутки [13].
Сложность ранней диагностики ИП подтверждает тот факт, что 7 из 12 пациентов были доставлены к нам с хирургическим диагнозом. Первичная постановка диагноза «острый аппендицит» при правостороннем поражении также не редкость, что подтверждает наблюдение J.P. Xu и соавт. [14]
Нарушения сердечного ритма диагностированы у 7 пациентов, при этом анамнез такого рода состояния был только у 5. В двух случаях имел место пароксизм, ФП как видим, его оказалось достаточно для развития эпизода эмболии. У 4 пациентов с постоянной формой ФП эпизод эмболии случился несмотря на проводимую, по их утверждению, антикоагулянтную терапию.
Фибрилляция предсердий является основным фактором риска ИП, это подтверждается исследованием N. Hazanov и соавт., включающим анализ более 40 случаев эмболии почечной артерии [11]. По данным A. García-García и соавт., проанализировавших результаты исследования 59 пациентов с ИП, наличие ФП отмечено у 29 (49,2%) [12].
По нашим данным, около половины пациентов, перенесших острую окклюзию почечной артерии, не имели диагностированных нарушений ритма сердца. Причины значимого количества случаев острой окклюзии почечной артерии в отсутствии кардиологической патологии остаются не вполне ясными. Есть предположение, что источником эмболии в таких ситуациях может быть стенка супраренального отдела аорты. Исследование 16 случаев идиопатического ИП продемонстрировало наличие у половины пациентов вариантов тромбофилии либо гипергомоцистеинемию [10].
Что касается диагностической ценности различных инструментальных методов, то в нашем исследовании ультразвуковое исследование не позволило заподозрить острую окклюзию почечной артерии ни в одном из случаев. N. Hazanov и соавт. указывают на то, что УЗИ оказалось способно повлиять на установление правильного диагноза у 3 из 27 пациентов (11%), однако авторы сами не рекомендуют использовать эхографическое исследование в качестве метода окончательной диагностики по причине низкой чувствительности [11].
Компьютерная томография с контрастированием и оценкой артериальной фазы оказалась ключевым методом диагностики в данном исследовании. КТ считается методом выбора при оценке острой окклюзии почечной артерии и сочетает в себе высокую информативность со сравнительно небольшой инвазивностью.
Типичной для ИП томографической картиной является наличие клиновидного сегмента паренхимы не накапливающего контрастное вещество [11].
Почечная ангиография считается золотым стандартом диагностики данной нозологии. Однако от ее рутинного применения все чаще воздерживаются, причина очевидна – это инвазивность процедуры [15]. Ангиография, будучи выполнена нами у одного пациента с лечебной целью, достоверно диагностировала сегментарную окклюзию.
Азотемия с повышением уровня креатинина выше референсных значений является характерной для ИП. Обычно уровень повышения коррелирует с объемом вовлеченной в инфаркт паренхимы [16]. Повышение креатинина может иметь транзиторный характер и у части больных показатель возвращается к норме [17]. Нами отмечено повышение уровня креатинина на высоте острой окклюзии у всех пациентов. В группе контроля азотемия сохранилась только у 1 из 5 пациентов. Однако мы не можем считать такое соотношение закономерным по причине того, что пациенты не прошедшие контрольное обследование в целом были старше и имели больше сопутствующих заболеваний, чем те, кого обследовать удалось.
Интересными оказались данные изотопной нефросцинтиграфии. При наличии закономерного снижения массы функционирующих нефронов на стороне поражения также отмечалась незначительная задержка эвакуации из чашечной-лоханочной системы (ЧЛС). В доступной литературе мы не нашли описания такого последствия ИП. И хотя количество проанализированных случаев не дает возможность делать достоверные выводы, замедление эвакуации у всех 5 пациентов группы контроля может свидетельствовать о нарушении моторной функции участков ЧЛС на фоне ишемии и инфаркта почки.
В одном случае нами была предпринята попытка реваскуляризации почки путем эндоваскулярной тромбоэкстракции из ветви почечной артерии первого порядка у пациента имевшего КТ–признаки сегментарного ИП. Последний занимал весь верхний сегмент левой почки. Вмешательство выполнено через 16 часов от начала заболевания. Несмотря на то, что был достигнут хороший ангиографический эффект, уровень креатинина за время пребывания в стационаре (8 суток) не имел тенденции к снижению. К сожалению, провести контрольное обследование этого пациента нам не удалось.
По данным литературы реваскуляризация, направленная на восстановление почечной функции, целесообразна в срок до 12 часов от начала ишемии [18, 19]. Анализ результатов эндоваскулярного восстановления почечного кровотока в исследовании, включавшем 16 пациентов, показал, что восстановления функции почки не произошло, однако сравнение с группой консервативной терапии продемонстрировало меньшую частоту развития нефрогенной гипертензии в группе с реваскуляризацией [20]. Исследование M.A. Corriere и соавт. показало, что ишемия, длящаяся более 2-х часов, приводит к потере почечной функции до 30- 50% от исходной [21].
Консервативная терапия у пациентов с ИП, как правило, представляет собой использование лечебной дозы гепарина с последующим переходом на пероральные антикоагулянты и дезагреганты [10]. Очевидно, что использование такой схемы продиктовано не столько желанием обеспечить лечебный эффект, сколько соображениями профилактики новых васкулогенных осложнений.
ЗАКЛЮЧЕНИЕ
Полученные нами данные в целом укладываются в сложившуюся картину представлений о диагностике, лечении и исходах инфаркта почки. По прежнему, проблемой остается ранняя диагностика, поскольку даже современные методы восстановления почечного кровотока не дают искомого результата за пределами определенного временного интервала. Наличие у врачей настороженности в отношении острой окклюзии почечной артерии способно увеличить долю пациентов, для которых реваскуляризация почки будет целесообразным вмешательством.
ЛИТЕРАТУРА
1. Hall SK. Acute renal vascular occlusion: an uncommon mimic. J Emerg Med 1993;11(6):691-700. https://doi.org/10.1016/0736-4679(93)90628-k.
. Silverberg D, Menes T, Rimon U, Salomon O, Halak M. Acute renal artery occlusion: Presentation, treatment, and outcome. J Vasc Surg 2016;64(4):1026-32. https://doi.org/10.1016/j.jvs.2016.04.043.
3. Tsai SH, Chu SJ, Chen SJ, Fan YM, Chang WC, Wu CP, et al. Acute renal infarction: a 10-year experience. Int J Clin Pract 2007;61(1):62-7. https://doi.org/10.1111/ j.1742-1241.2006.01136.x.
4. Lopez VM, Glauser J. A case of renal artery thrombosis with renal infarction. J Emerg Trauma Shock 2010;3(3):302. https://doi.org/10.4103/0974-2700.66569.
5. Javaid MM, Butt MA, Syed Y, Carr P. Acute renal infarction: an unusual cause of abdominal pain. Ren Fail 2009;31(5):406-8. https://doi.org/10.1080/08860220902839113.
6. Cabral Ribeiro J, Sousa L, Calaza C, Santos A. Acute segmental renal infarction due to factor V Leiden. Arch Esp Urol 2009;62(6):486-8.
7. Barbey F, Matthieu C, Nseir G, Burnier M, Teta D. A young man with a renal colic. J Intern Med 200;254(6):605-8. https://doi.org/10.1111/j.1365-2796.2003.01214.x.
8. Poux JM, Boudet R, Lacroix P, Jauberteau MO, Plouin PF, Aldigier JC, et al. Renal infarction and thrombosis of the infrarenal aorta in a 35-year-old man with primary antiphospholipid syndrome. Am J Kidney Dis 1996;27(5):721-5. https://doi.org/10.1016/s0272-6386(96)90109-2.
9. Hoxie HJ, Coggin CB. Renal infarction: statistical study of two hundred and five cases and detailed report of an unusual case. Arch Intern Med (Chic) 1940;65(3):587–94. https://doi.org/10.1001/archinte.1940.00190090124007.
10. Bolderman R, Oyen R, Verrijcken A, Knockaert D, Vanderschueren S. Idiopathic renal infarction. Am J Med 2006;119(4):356.e9-12. https://doi.org/10.1016/ j.amjmed.2005.06.049.
11. Hazanov N, Somin M, Attali M, Beilinson N, Thaler M, Mouallem M, Maor Y, Zaks N, Malnick S. Acute renal embolism. Forty-four cases of renal infarction in patients with atrial fibrillation. Medicine (Baltimore) 2004;83(5):292-9. https://doi.org/10.1097/01.md.0000141097.08000.99.
12. García-García A, Demelo-Rodríguez P, Ordieres-Ortega L, Cervilla-Muñoz E, García-Fernández-Bravo I, Pulfer MD, et al. Idiopathic versus provoked renal infarction: characteristics and long-term follow-up of a cohort of patients in a tertiary hospital. Kidney Blood Press Res 2019;44(6):1432-40. https://doi.org/10.1159/000503425.
13. Lessman RK, Johnson SF, Coburn JW, Kaufman JJ. Renal artery embolism: clinical features and long-term follow-up of 17 cases. Ann Intern Med 1978;89(4):477-82. https://doi.org/10.7326/0003-4819-89-4-477.
14. Xu JP, Tsai IT, Cheng FJ. Infarction of the lower pole of the right kidney mimicking acute appendicitis: a case report. J Acute Med 2012;2(4):114-6. https://doi.org/10.1016/ j.jacme.2012.08.005.
15. Rossio IL, Carvalho G, Fernandez A, Lobão MJ, Boquinhas AT. Suspecting renal artery thrombosis. EJCRIM 2014;1. https://doi.org/10.12890/2014_000155.
16. Chu PL, Wei YF, Huang JW, Chen SI, Chu TS, Wu KD. Clinical characteristics of patients with segmental renal infarction. Nephrology (Carlton) 2006;11(4):336-40. https://doi.org/10.1111/j.1440-1797.2006.00586.x.
17. Nagasawa T, Matsuda K, Takeuchi Y, Fukami H, Sato H, Saito A, et al. A case series of acute renal infarction at a single center in Japan. Clin Exp Nephrol 2016;20(3):411-5. https://doi.org/10.1007/s10157-015-1168-1.
18. Blum U, Billmann P, Krause T, Gabelmann A, Keller E, Moser E, Langer M. Effect of local low-dose thrombolysis on clinical outcome in acute embolic renal artery occlusion. Radiology 1993;189(2):549-54. https://doi.org/10.1148/radiology.189.2.8210388.
19. Yoshida T, Ikehara N, Miyabe H, Sakata S, Yajima K, Mukai S, et al. Two cases with renal infarction diagnosed in the early course using contrast-enhanced CT. Hypertens Res 2004;27(7):523-6. https://doi.org/10.1291/hypres.27.523.
20. Ouriel K, Andrus CH, Ricotta JJ, DeWeese JA, Green RM. Acute renal artery occlusion: when is revascularization justified? J Vasc Surg 1987;5(2):348-55. https://doi.org/10.1067/mva.1987.avs0050348.
21. Corriere MA. Renal vascular disease: acute ischemia. In: Cronenwett JL, Johnson W, editors. Ruthersford’s vascular surgery. 8th edition. Philadelphia: Saunders; 2014 2235-344 p.







