ВВЕДЕНИЕ
Инфекции нижних мочевыводящих путей (ИНМП) являются одними из наиболее частых причин расстройств мочеиспускания у женщин и обращений пациентов за медицинской помощью [1, 2]. Результаты эпидемиологических исследований показывают, что острый цистит переносят в течение жизни более 50% женщин [1]. Высокую частоту ИНМП у женщин, превышающую таковую у мужчин почти в 10 раз, связывают с анатомическими, физиологическими и гормональными особенностями женского организма [1, 2, 3]. Наибольшая заболеваемость ИНМП у женщин отмечается в возрасте 25-35 лет и постменопаузальном периоде [3]. При этом медицинская и социальная значимость ИНМП определяется не только их высокой распространенностью, но и склонностью к рецидивированию. Установлено, что после первого клинического проявления ИНМП у 25% женщин рецидив развивается в течение полугода, у 40% – в течение одного года, а примерно у половины женщин, оказавшихся на приеме у врача по поводу ИНМП, определяют уже рецидивирующую форму заболевания [4, 5]. Последнюю диагностируют при выявлении не менее трех эпизодов ИНМП в течение последних 12 месяцев или двух — в течение последних 6 месяцев [5, 6].
В этиологии ИНМП ведущая роль принадлежит микроорганизмам семейства Enterobacteriaceae, причем доля E. coli достигает 80% среди всех уропатогенов [7]. В качестве основных причин рецидивирования ИНМП рассматривают реинфекцию и бактериальную персистенцию. Реинфицирование нижних мочевыводящих путей у женщин связано с восходящей колонизацией фекальной и периуретральной флорой. Установлено, что уропатогенные штаммы E. coli способны колонизировать уротелий, проникать в эпителиальные клетки с формированием биопленок и внутриклеточных сообществ [8]. Появление резервуаров бактерий в слизистой мочевого пузыря в виде внутриклеточных сообществ и транслокация бактерий из желудочно-кишечного тракта и влагалища являются причинами персистирования инфекции и рецидивирующего течения цистита [9]. Чем больше нарушены местные и общие защитные механизмы макроорганизма, тем менее вирулентные бактерии способны вызывать ИНМП.
Основным направлением лечения ИНМП является антибактериальная терапия [5, 10]. Однако не всегда удовлетворительная эффективность, побочные эффекты антибиотикотерапии и нарастание проблемы антибиотикорезистентности основных уропатогенов определяют значимость альтернативных подходов к лечению ИНМП. В этой связи отмечается существенное повышение интереса к неантибактериальным методам лечения и профилактики ИНМП [11-14]. В настоящее время с этой целью уже нашли применение в широкой клинической практике фито- и иммунотерапия, пре- и пробиотики, средства для изменения рН мочи, ингибиторы адгезии бактерий и другие средства [15-17]. Эффективность неантибактериальных препаратов при лечении ИНМП подтверждена результатами многочисленных исследований, проведенных в нашей стране и за рубежом [13, 18-20]. При этом многие аспекты неантибактериальной терапии ИНМП остаются неясными. В первую очередь это относится непосредственно к механизму фармакологического действия применяемых средств, их фармакокинетике и фармакодинамике.
В последние годы для лечения и профилактики ИНМП широко используются D-манноза, экстракты клюквы и витамин D либо по отдельности, либо в составе комбинированных продуктов [13, 19-23]. К последним относится биологически активная добавка (БАД) «Уронекст», содержащим в своем составе все три указанные выше субстанции. Проведенные ранее исследования показали клиническую эффективность назначения Уронекста больным острым и рецидивирующим циститом [24, 25]. При этом остаются неясными ряд вопросов, связанных с механизмами реализации его эффектов. Это обстоятельство послужило основанием для проведения настоящего исследования.
Цель исследования: оценка клинических и микробиологических эффектов биологически активной добавки (БАД) «Уронекст», содержащий D-маннозу, витамин D и экстракт клюквы, у женщин с рецидивирующими ИНМП.
МАТЕРИАЛЫ И МЕТОДЫ
Под наблюдением находились 67 женщин в возрасте от 18 до 65 лет (в среднем 42,8±12,9 лет) с рецидивирующей ИНМП. В менопаузальном возрасте были 24 (35,8%) женщины. Количество рецидивов ИНМП за предшествующие началу исследования 12 месяцев в среднем составило 4,4±1,6.
Критериями включения в исследование были женский пол пациентов, возраст 18 лет и старше, давность заболевания не менее года и наличие обострения цистита к началу исследования. Последнее диагностировали на основании жалоб, клинической картины, а также результатов общего анализа мочи (более 10 лейкоцитов в 1 мкл мочи). Все наблюдаемые больные подписали информированное согласие на участие в исследовании. Критериями невключения было наличие признаков осложненной ИНМП (нарушения оттока мочи из мочевого пузыря, наличие конкрементов в мочевыводящих путях, аномалии мочевой системы, нейрогенные расстройства мочеиспускания и др.), острые или активные фазы хронического пиелонефрита, беременность или период лактации, полиурия, тяжелые сопутствующие соматические заболевания, прием антибактериальных препаратов в течение 4 недель до начала исследования, наличие непереносимости или аллергических реакций к составным частым Уронекста.
Настоящее исследование состояло из двух частей: клинической и лабораторной. В ходе выполнения первой части пациентам назначали Уронекст и изучали динамику клинических проявлений цистита. Лабораторная часть включала в себя оценку микробиологической эффективности и изучение фармакологических механизмов реализации клинических эффектов Уронекста.
Длительность исследования каждой больной составляла 7 дней, в течение которых она должна была трижды посетить врача-исследователя. На 1-м визите (день 1) всем пациентам проводили оценку жалоб и анамнеза заболевания, физикальное обследование, лабораторные исследования, в том числе бактериологическое исследование средней порции утренней мочи. Выраженность симптомов цистита оценивали с помощью опросника ACSS (Acute Cystitis Symptom Score – оценка симптомов острого цистита) [26]. При соответствии критериям включения в исследование пациентке назначали БАД «Уронекст» по 1 саше-пакету однократно в сутки и рекомендовали принимать его во время еды непосредственно после приготовления жидкой лекарственной формы. Пациентов инструктировали растворять содержимое сашепакета в 100 мл воды комнатной температуры. В одном саше-пакете Уронекста содержится 2000 мг D-маннозы, 500 мг экстракта клюквы и 1 мкг витамина D3. Продолжительность приема Уронекста составляла 7 дней. На 3-й день приема Уронекста (визит 2) оценивали выраженность симптомов острого цистита (анкета ACSS) и наличие нежелательных явлений. На заключительном 3-м визите (день 7) наряду с анкетированием больных, оценкой наличия нежелательных явлений выполняли общий анализ мочи. Объективные данные дополняли субъективной оценкой больными эффективности проводимой терапии по 5-балльной шкале: 1 балл – отсутствие эффекта, 2 – незначительное улучшение, 3 – умеренное улучшение, 4 – значительное улучшение, 5 баллов – излечение.
Бактериологическое исследование мочи, выполненное до начала приема Уронекста, позволило выявить бактериурию в титре ≥1000 КОЕ/мл у 50 (74,6%) находящихся под наблюдением пациенток. Выделенные у них уропатогены явились материалом для лабораторной части настоящей работы. С помощью микробиологических исследований мы изучали механизмы антибактериального эффекта Уронекста. Для реализации поставленной цели оценивали in vitro минимальную ингибирующую концентрацию (МИК), индекс адгезии, степень и продолжительность антимикробной активности исследуемого продукта в отношении основных выделенных уропатогенов (Esherichia coli, Klebsiella pneumoniae, Staphylococcus spp, Enterococcus faecalis).
Для оценки антибактериальной активности Уронекста на чашки Петри с мясопептонным агаром наносили культуры бактерий в концентрации 0,5 MF (McFarland Standard). После подсыхания инокулюма вносили по 1 капле исследуемого продукта Уронекст в трех вариантах: цельного, разведенного в 10 и в 100 раз. После подсыхания капель препаратов чашки помещали в термостат на 24 часа при 37ºС. Учет результата проводили визуально. МИК соответствовала наибольшему разведению исследуемого продукта, тормозящему рост исследуемой культуры микроорганизма в стандартных условиях опыта. МИК Уронекста определяли методом серийных разведений в 96-луночных планшетах в соответствии с действующими рекомендациями [27, 28].
Длительность антибактериального действия Уронекста в отношении выделенных уропатогенов оценивали путем определения количества жизнеспособных бактерий после их взаимодействия с исследуемым продуктом. Для этого готовили контрольный и опытный образцы. Контрольный образец представлял из себя суспензию бактерий в мясопептонном бульоне в концентрации 1·10² КОЕ/мл, а опытный образец – смесь из бактерий в такой же стартовой концентрации с добавлением Уронекста, приготовленного согласно инструкции по его применению. Высев на чашки Петри с мясопептонным агаром производили сразу после приготовления образцов, а далее – через каждый час. Чашки с посевами помещали в термостат при 37°С на 24 часа. После этого производили подсчет выросших колоний бактерий (КОЕ/мл) на каждой чашке опытных и контрольных образцов.
Для оценки выраженности адгезивного механизма действия Уронекста изучали показатель адгезии выделенных уропатогенов на клетках буккального эпителия в присутствии исследуемого продукта в терапевтической концентрации, контролем служили эпителиоциты с адгезированными бактериями в отсутствии Уронекста по методике, описанной А.С. Благонравовой и соавт. [29]. Индекс адгезии (ИА) рассчитывали по формуле: ИА = АКБ50 / 50Э, где АКБ50 – количество клеток бактерий, прикрепившихся к 50 эпителиоцитам, 50Э – 50 изученных эпителиоцитов.
Систематизацию, обработку и статистический анализ материалов исследования проводили с помощью компьютерной программы STATISTICA 10 En (StatSoft, Inc.). Различия считали достоверными при уровне значимости р≤0,05. Средние значения показателей в тексте указывали со средним квадратическим отклонением (M±σ).
РЕЗУЛЬТАТЫ
На фоне приема Уронекста большинство женщин отметили уменьшение выраженности симптомов острого цистита (табл. 1). Так, средний суммарный балл раздела «typical» анкеты ACSS снизился с исходных 8,27±2,05 в 1-й день исследования до 4,73±1,98 к 3-му дню (p<0,05) и до 4,16±2,03 к 7-му дню приема изучаемого продукта (p<0,05). Оценка пациентками эффективности приема исследуемого продукта по 5-балльной шкале подтвердила результаты анкетирования. К 3-му дню приема Уронекста данный показатель составил 3,03±1,13 баллов, а к 7-й дню – 3,57±1,00 (табл. 1). К моменту окончания 7- дневного курса приема Уронекста 37 (55,2%) женщин указали на значительное улучшение состояния, а 7 (10,4%) женщин – на полное исчезновение симптоматики. Данные субъективной оценки больными эффективности приема БАД подтверждались результатами лабораторных исследований. Если исходно у всех включенных в исследование женщин была выявлена лейкоцитурия, то к моменту окончания приема Уронекста лейкоцитурию обнаружили только у 21 (31,3%) из них.
Таблица 1. Динамика клинических и лабораторных показателей у больных рецидивирующей ИНМП при приеме Уронекста (n=67)
Table 1. Dynamics of clinical and laboratory parameters in patients with recurrent UTI while taking Uronext (n=67)
| Показатель Indicator |
День 1 Day 1 |
День 3 Day 3 |
День 7 Day 7 |
|---|---|---|---|
| Оценка симптомов острого цистита ACSS, баллы (M±σ) Assessment of symptoms of acute cystitis ACSS, scores (M±σ) |
8,27±2,05 | 4,73±1,98* | 4,16±2,03* |
| Оценка эффективности лечения по 5-балльной шкале, баллы (M±σ) Evaluation of the effectiveness of treatment on a 5-point scale, points (M±σ) |
— | 3,03±1,13 | 3,57±1,00 |
| Количество больных с лейкоцитурией, n (%) Number of patients with leukocyturia, n (%) |
67 (100%) | — | 21 (31,3%) |
*p<0,05 по сравнению с исходным значением
*p<0.05 compared to baseline
Переносимость Уронекста была удовлетворительной. В течение семи дней приема исследуемого препарата нежелательные явления, связанные с его приемом, были отмечены только у 5 (7,5%) человек: у 3 (4,5 %) – изжога, у 1 (1,5%) – тошнота и еще у 1 (1,5%) – кожная сыпь. По степени выраженности все случаи зарегистрированных нежелательных явлений соответствовали легкой степени и не требовали отмены приема Уронекста.
В соответствии с задачами исследования у всех больных на визите 1 были взяты образцы мочи для микробиологического анализа. Бактериурия в титре ≥1000 КОЕ/мл была обнаружена у 50 (74,6%) пациенток. Чаще всего выявляли E. coli (28 больных, 56% от всех пациентов с бактериурией), значительно реже определяли Klebsiella pneumoniae – 7 (14%) больных и грамположительные кокки – 12 (24%) больных. В последующем эти уропатогены явились материалом для лабораторной части исследования. После выделения и идентификации возбудителей проводили определение их чувствительности к Уронексту. Как видно из таблицы 2, исследуемый препарат показал антимикробную активность в отношении 50% штаммов E. coli, 28,6% – штаммов Klebsiella pneumoniae, 20% – штаммов Enteroccocus faecalis. Неферментирующие грамотрицательные микроорганизмы, такие как Acinetobacter spp., обычно характеризуются полирезистентностью. В этой связи весьма важным представляется выявление антибактериальной активности Уронекста в отношении обоих выделенных штаммов Acinetobacter spp. Полученные результаты свидетельствуют о наличии антимикробной активности Уронекста как в отношении грамположительных, так и грамотрицательных микроорганизмов. При этом наибольшая активность отмечена для последних, являющихся наиболее частыми возбудителями ИНМП.
Таблица 2. Антибактериальная активность Уронекста в отношении выделенных уропатогенов
Table 2. Antibacterial activity of Uronext against isolated uropathogens
| Микроорганизм Microorganism |
Чувствительность, n (%) Sensitivity, n (%) |
Резистентность, n (%) Resistance, n (%) |
|---|---|---|
| E. coli (28 штаммов) | 14 (50%) | 14 (50%) |
| Klebsiella pneumoniae (7 штаммов) | 2 (28,6%) | 5 (71,4%) |
| Enteroccocus faecalis (5 штаммов) | 1 (20%) | 4 (80%) |
| Staphylococcus spp. (4 штамма) | 2 (50%) | 2 (50%) |
| Streptococcus spp. (3 штамма) | 2 (66,7%) | 1 (32,3%) |
| Acinetobacter spp. (2 штамма) | 2 (100%) | 0 |
| Corynebacterium spp. (1 штамм) | 1 (100%) | 0 |
| Всего 50 штаммов | 24 (48%) | 26 (52%) |
Культуры уропатогенов, чувствительные к Уронексту, явились материалом для проведения дальнейшего исследования – определения МИК изучаемого продукта. Значения данного показателя определяли визуально по наличию ингибирования роста штаммов уропатогенов по сравнению с контролем. Результаты исследования МИК Уронекста к выделенным уропатогенам представлены в таблице 3. Оказалось, что в отношении грамположительных бактерий МИК исследуемого БАД в 10 раз выше по сравнению с грамотрицательными микроорганизмами.
Таблица 3. Значения МИК Уронекста в отношении основных уропатогенов
Table 3. Uronext MIC values for major uropathogens
| Микроорганизм Microorganism |
МИК90 Уронекста, мг/мл МИК90, mg/ml |
|---|---|
| E. coli | 20 |
| Klebsiella pneumoniae | 20 |
| Staphylococcus spp. | 200 |
| Enterococcus faecalis | 200 |
Примечание: МИК90– минимальная ингибирующая концентрация продукта, к которой чувствительно 90% исследуемых штаммов
Note: MIC90 is the minimum inhibitory concentration of the product, to which 90% of the studied strains are sensitive
На следующем этапе микробиологического исследования определяли длительность антимикробной активности Уронекста в отношении выделенных у пациенток с ИНМП уропатогенов – Esherichia coli, Klebsiella pneumoniae, Staphylococcus epidermidis и Enterococcus faecalis. Результаты исследования представлены на рис. 1-4. Установлено, что в отношении всех изучаемых микроорганизмов антибактериальная активность Уронекста in vitro развивалась уже через 1 час, достигала максимуму через 2 часа и сохранялась на протяжении по крайней мере 8 часов исследования.
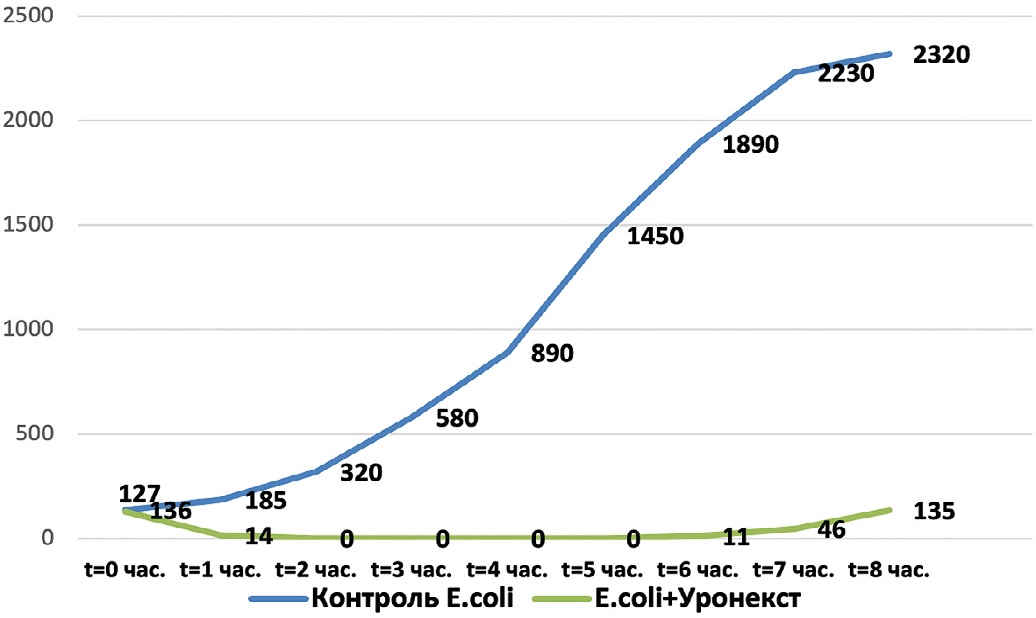
Рис. 1. Антибактериальная активность Уронекста в отношении чувствительных штаммов E. сoli. По оси абсцисс – время после начала исследования, часы; по оси ординат – концентрация микроорганизмов, КОЕ/мл
Fig. 1. Antibacterial activity of Uronext against sensitive strains of E. coli. On the abscissa axis – time after the start of the study, hours; along the y-axis, the concentration of microorganisms, CFU/ml
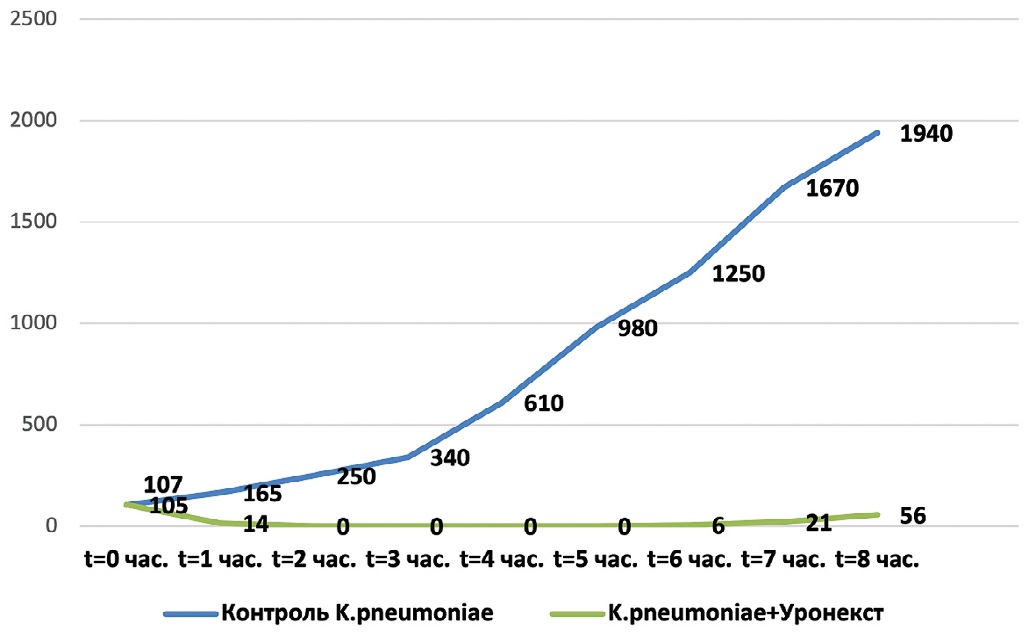
Рис. 2. Антибактериальная активность Уронекста в отношении чувствительных штаммов K. pneumoniae. По оси абсцисс – время после начала исследования, часы; по оси ординат – концентрация микроорганизмов, КОЕ/мл
Fig. 2. Antibacterial activity of Uronext against susceptible strains of K. pneumoniae. On the abscissa axis – time after the start of the study, hours; along the y-axis, the concentration of microorganisms, CFU/ml
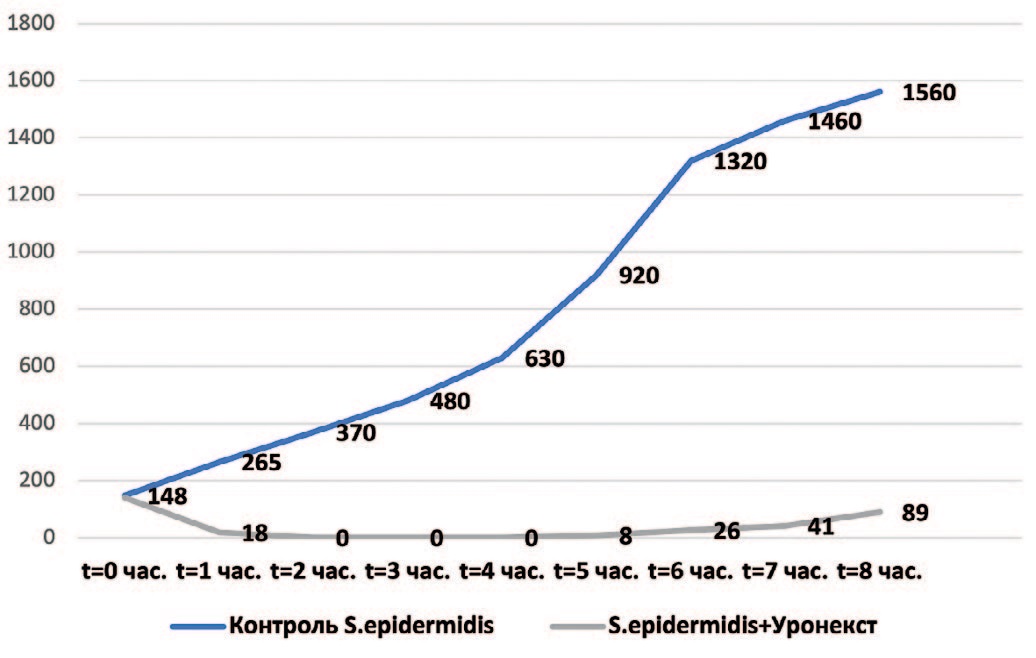
Рис. 3. Антибактериальная активность Уронекста в отношении чувствительных штаммов S. epidermidis. По оси абсцисс – время после начала исследования, часы; по оси ординат – концентрация микроорганизмов, КОЕ/мл
Fig. 3. Antibacterial activity of Uronext against susceptible strains of S. epidermidis. On the abscissa axis – time after the start of the study, hours; along the y-axis – the concentration of microorganisms, CFU / ml
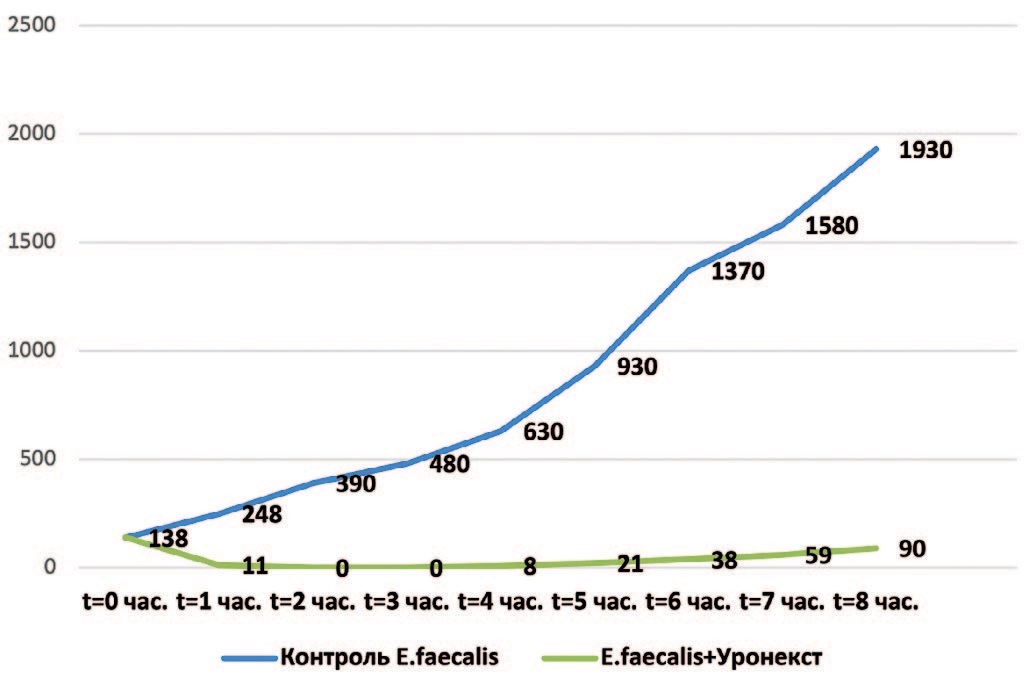
Рис. 4. Антибактериальная активность Уронекста в отношении чувствительных штаммов E. faecalis. По оси абсцисс – время после начала исследования, часы; по оси ординат – концентрация микроорганизмов, КОЕ/мл
Fig. 4. Antibacterial activity of Uronext against susceptible strains of E. faecalis. On the abscissa axis – time after the start of the study, hours; along the y-axis – the concentration of microorganisms, CFU / ml
Для изучения механизма фармакологического действия Уронекста при ИНМП было проведено изучение его антиадгезивных свойств в отношении основных уропатогенов. Исследование проводили на клетках буккального эпителия. Для этого по специальной методике производили подсчет количества микробных клеток, адгезированных на одном буккальном эпителиоците и рассчитывали индекс адгезии (ИА) по формуле, приведенной в разделе «Материалы и методы». Расчеты проводили отдельно в контрольных и опытных образцах. Для E. coli в контрольном образце ИА составил 24±4, а при внесении в бактериальную культуру Уронекст он снизился до значения 5±2. После добавления Уронекста значимое снижение ИА выявлено и для других изучаемых уропатогенных микроорганизмов. Результаты исследования антиадгезивного действия Уронекста представлены в таблице 4. При внесении Уронекста в культуру бактерий ИА K. pneumoniae к эпителию снизился в 4,5 раза, ИА E. faecalis – в 3,2 раза, ИА S. epidermidis – в 3,1 раза.
Таблица 4. Значения индекса адгезии уропатогенных микроорганизмов к клеткам буккального эпителия
Table 4. Values of the adhesion index of uropathogenic microorganisms to buccal epithelial cells
| Микроорганизмы Microorganism |
Индекс адгезии / Adhesion index | |
|---|---|---|
| Контроль / Control | С Уронекстом / With Uronext | |
| E. coli | 24±4 | 5±2 |
| K. pneumoniae | 18±3 | 4±2 |
| S. epidermidis | 22±5 | 7±2 |
| E. faecalis | 19±5 | 6±4 |
ОБСУЖДЕНИЕ
Результаты проведенного исследования свидетельствуют о клинической эффективности назначения БАД «Уронекст» больным ИНМП с обострением цистита. Исчезновение симптомов острого цистита или существенное улучшение достигнуто у большинства больных, принимавших исследуемый продукт. Полагаем, что Уронекст можно использовать у пациентов с рецидивирующими ИНМП до получения результатов микробиологического исследования мочи. Результаты бактериологического исследования показали наличие антимикробной активности Уронекста в отношении 48% штаммов выделенных уропатогенных микроорганизмов. In vitro исследуемый продукт оказывал антибактериальное действие как на грамотрицательные, так и на грамположительные микроорганизмы. При изучении МИК Уронекста было показано, что их значения для грамотрицательных бактерий оказались в 10 раз меньше, чем для грамположительных. Данное наблюдение представляется весьма важным, поскольку именно грамотрицательные уропатогенные микроорганизмы являются основными возбудителями ИНМП. В этой связи низкая МИК Уронекста для указанных бактерий безусловно является важным преимуществом исследуемого продукта. Выявленный in vitro бактерицидный эффект Уронекста достигает максимум уже через 2 часа после добавления данного продукта в культуру микроорганизмов. Полученные нами результаты позволили доказать наличие у Уронекста выраженного антиадгезивного эффекта, что обуславливает возможность его применения в комплексном лечении больных с рецидивирующими ИНМП.
По нашему мнению, высокая антибиотическая активность Уронекста и обусловленная ею клиническая эффективность в значительной степени связана с синергетическим действием входящих в его состав субстанций – D-маннозы, экстракта клюквы и витамина D3.
Моносахарид D-манноза является антиадгезином – конкурентным блокатором бактериальной адгезии [30]. Известно, что адгезию уропатогенов к эпителию мочевых путей обеспечивают спиралевидные белковые органгеллы, расположенные на поверхности микроорганизмов – фимбрии. В зависимости от характера серологической реакции гемагглютинации и специфичности рецепторов выделяют фимбрии I типа и P-фимбрии. Фимбрии 1 типа обнаруживают у 90% всех известных уропатогенных штаммов E. сoli и многих других бактерий [31]. По всей протяженности фимбрий располагаются сегменты fimA, а дистальный участок содержит протеин FimH – бактериальный адгезин, обладающий сродством к терминальной маннозе гликопротеинов на поверхности зонтичных клеток уротелия [32]. При наличии в моче высоких концентраций свободной D-маннозы она прикрепляется к адгезивным белкам FimH фимбрий бактерий, что препятствует их адгезии к уроэпителиальным клеткам. Благодаря такому фармакологическому механизму действия D-манноза не влияет на жизнеспособность бактерий, не приводит к мутациям FimH, модифицирующим бактериальную адгезивность, и не приводит к развитию резистентности бактерий [8]. Эффективность D-маннозы как средства лечения и профилактики острого и рецидивирующего цистита подтверждена результатами многих клинических исследований [13, 19, 20, 33-35].
В состав Уронекста входит брендированный концентрат экстракта клюквы Cran-Max. Продукты из клюквы являются одними из самых популярных и эффективных альтернативных средств профилактики и лечения ИНМП. Длительное время механизм лечебного действия клюквы оставался предметом дискуссий. Только в 1980-х годах результаты изучения патогенетических механизмов, лежащих в основе развития ИНМП, позволили объяснить лечебные эффекты клюквы. В 1984 году A.E. Sobota впервые предположил, что «зарегистрированные преимущества, полученные от употребления сока клюквы, могут быть связаны с его способностью ингибировать бактериальную адгезию» [36]. Дальнейшие исследования подтвердили антиадгезивную активность продуктов клюквы. В 1989 году D. Zafriri и соавт. идентифицировали в клюкве 2 субстанции, которые оказались способны ингибировать адгезины E. coli. Одной из них оказалась фруктоза, которая воздействует на адгезины, чувствительные к маннозе, а другой – высокомолекулярное соединение, подавляющее маннозорезистентные адгезины [37]. Хотя все фруктовые соки содержат фруктозу, только соки из ягод рода Vaccinium (т.е. клюква и черника) содержат это второе уникальное высокомолекулярное соединение, которое позднее было названо проантоцианидином [38]. Данное вещество состоит из растительных полифенольных флавоноидов, присутствующих в значительном количестве в овощах, ягодах, фруктах и орехах. В зависимости от структуры проантоцианидины подразделяют на два типа – А и В. При этом проантоцианидины всех вересковых (в том числе и клюквы) уникальны и отличаются от привычных для нашего организма проантоцианидинов винограда, яблок, чая и шоколада. Во всех перечисленных продуктах содержатся только проантоцианидины типа В [22]. Способность клюквенного сока ингибировать адгезию микроорганизмов обусловлена наличием проантоцианидинов типа А [39]. Прикрепление данных субстанций к фимбриям сопровождается уменьшением длины последних в 3 раза за счет «уплотнения» структуры входящих в их состав белков, вследствие этого ворсины микроорганизмов утрачивают способность к росту и соответственно свой адгезивный потенциал [40].
Многие из реализуемых в аптечной сети биологически активных добавок, содержащих клюкву, не стандартизированы. Они могут содержать как порошок высушенных цельных ягод, так и пропитанный клюквенным соком порошок мальтодекстрина. Один их стандартизированных экстрактов клюквы с коммерческим названием Cran-Max производится по запатентованной технологии, которая позволяет получать более концентрированную и стабильную форму экстракта клюквы. По этой технологии ягоды перерабатываются целиком — с семенами, мякотью, оболочкой, соком, и формируется целлюлозная матрица, защищающая биоактивные компоненты от разрушения в желудке. Экстракт клюквы, содержащийся в Уронексте, представлен высокоочищенным 100% натуральным продуктом, полученным по технологии BioShield.
Третий компонент, входящий в состав Уронекста – витамин D3. Клиническая эффективность витамина D3 у больных с ИНМП связана с наличием у него иммуномодулирующего эффекта и способности стимулировать выработку антимикробных пептидов, в том числе кателицидина [41, 42]. O. Hertting и соавт. в эксперименте выявили, что слизистая мочевого пузыря женщин, получавших витамин D3, вырабатывает большое количество кателицидина, оказывающего защитное иммунопротективное действие, предотвращающее развитие ИНМП [42]. Установлено, что у больных с дефицитом витамина D3 возрастает риск развития рецидивирующей ИНМП [23].
Результаты проведенного нами исследования показали, что Уронекст обладает выраженным антиадгезивным действием, cнижая индекс адгезии к эпителиальным клеткам в 3,1–4,8 раза в зависимости от вида микроорганизмов. Данный эффект обусловлен входящими в его состав D-маннозой и экстрактом клюквы, обладающими, по нашему мнению, синергическим действием. Выявленный непосредственно антибактериальный эффект связан, повидимому, с входящим в состав Уронекста экстрактом клюквы. Таким образом, состав БАД «Уронекст», содержащего 2000 мг D-маннозы, Cran-Max (36 мг проантоцианидинов) и 1 мкг витамина D3, представляется сбалансированным и патогенетически обоснованным, что позволяет рекомендовать исследуемый продукт больным с ИНМП. Значимым преимуществом Уронекста является простота приема. Пациенты принимают данный продукт во время еды по 1 саше-пакету 1 раз в сутки, предварительно растворив содержимое в стакане воды (100 мл) комнатной температуры.
ЗАКЛЮЧЕНИЕ
Результаты проведенного исследования свидетельствуют о клинической эффективности применения комбинированной БАД «Уронекст» у больных с рецидивирующими ИНМП в период обострения цистита. Назначение данного продукта представляется патогенетически обоснованной альтернативой использованию антибиотиков у данной категорией больных в качестве первого этапа до получения результатов микробиологического исследования мочи. Исследование in vitro позволило установить фармакологические механизмы и определить ряд важных количественных параметров его эффектов.
ЛИТЕРАТУРА
1. Foxman B. Urinary tract infection syndromes: occurrence, recurrence, bacteriology, risk factors, and disease burden. Infect Dis Clin North Am 2014;28(1):1-13. https://doi.org/10.1016/ j.idc.2013.09.003.
2. Слесаревская М.Н., Игнашов Ю.А., Кузьмин И.В., Аль-Шукри С.Х. Стойкая дизурия у женщин: этиологическая диагностика и лечение. Урологические ведомости 2021;11(3):195-204. [Slesarevskaya M.N., Ignashov Y.A., Kuzmin I.V., Al-Shukri S.K. Persistent dysuria in women: etiological diagnostics and treatment. Urologicheskie vedomosti = Urology reports (St. - Petersburg) 2021;11(3):195-204. https://doi.org/10.17816/uroved81948. (In Russian)].
3. Борисов В.В. Диагностика и терапия инфекций мочевыводящих путей. О чем следует помнить всегда (клиническая лекция). Часть 1. Урологические ведомости 2017;7(3):52–59. [Borisov V.V. Diagnosis and therapy of urinary tract infections. What should always be remembered (clinical lecture). Part 1. Urologicheskie vedomosti = Urology reports 2017;7(3):52–59. https://doi.org/10.17816/uroved7352-59. (In Russian)].
4. Gupta K, Trautner BW. Diagnosis and management of recurrent urinary tract infections in nonpregnant women. BMJ 2013;346:f3140. https://doi.org/10.1136/bmj.f3140.
5. Перепанова Т.С., Козлов Р.С., Руднов В.А., Синякова Л.А., Палагин И.С. Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов. Федеральные клинические рекомендации; М. 2022;126 с. [Perepanova T.S., Kozlov R.S., Rudnov V.A., Sinyakova L.A., Palagin I.S. Antimicrobial therapy and prevention of infections of the kidneys, urinary tract and male genital organs. Federal clinical guidelines; M., 2022;126 p. (in Russian)].
6. Bonkat G, Bartoletti R, Bruyere F, Cai T, Geerlings SE, Pradere B, et al. EAU guideline of urological infections. European Association of Urology 2022. http://uroweb.org/guideline/urologicalinfections.
7. Палагин И.С., Сухорукова М.В., Дехнич А.В., Эйдельштейн М.В., Перепанова Т.С., Козлов Р.С., исследовательская группа «ДАРМИС-2018». Антибиотикорезистентность возбудителей внебольничных инфекций мочевых путей в России: результаты многоцентрового исследования «ДАРМИС-2018». Клиническая микробиология и антимикробная химиотерапия 2019;21(2):134–146. [Palagin I.S., Sukhorukova M.V., Dekhnich A.V., Edelstein M.V., Perepanova T.S., Kozlov R.S., “DARMIS-2018” Study Group. Antimicrobial resistance of pathogens causing community-acquired urinary tract infections in Russia:results of the multicenter study «DARMIS-2018». Klinicheskaja mikrobiologija i antimikrobnaja himioterapija = Clinical Microbiology and Antimicrobial Chemotherapy 2019;21(2):134–146. https://doi.org/10.36488/ cmac.2019.2.134-146. (In Russian)].
8. Sarshar M, Behzadi P, Ambrosi C, Zagaglia C, Palamara AT, Scribano D. FimH and anti-adhesive therapeutics: a disarming strategy against uropathogens. Antibiotics (Basel) 2020;10;9(7):397. https://doi.org/10.3390/antibiotics9070397.
9. Thänert R, Reske KA, Hink T, Wallace MA, Wang B, Schwartz DJ, Seiler S, Cass C, Burnham CA, Dubberke ER, Kwon JH, Dantas G. Comparative genomics of antibiotic-resistant uropathogens implicates three routes for recurrence of urinary tract infections. mBio 2019;27;10(4):e01977-19. https://doi.org/10.1128/mBio.01977-19.
10. Кузьмин И.В., Аль-Шукри С.Х., Слесаревская М.Н. Лечение и профилактика рецидивирующей инфекции нижних мочевых путей у женщин. Урологические ведомости 2019;9(2):5-10. [Kuzmin I.V., Al-Shukri S.H., Slesarevskaya M.N. Treatment and prophylaxis of the lower urinary tract recurrent infections in women. Urologicheskie vedomosti = Urology reports 2019;9(2):5-10. https://doi.org/10.17816/uroved925-10. (In Russian)].
11. Гаджиева З.К., Казилов Ю.Б. Особенности подхода к профилактике рецидивирующей инфекции нижних мочевыводящих путей. Урология 2016(S3):65–76. [Gadzhieva Z.K., Kazilov Yu.B. Features of the approach to prevention of recurrent infections of the lower urinary tract. Urologiya = Urologiia 2016(S3):65–76. (In Russian)].
12. Красняк С.С. Неантибактериальная терапия и профилактика острого и рецидивирующего цистита: существующие варианты и перспективы. Экспериментальная и клиническая урология 2020(1):136-143. [Krasnyak S.S. Non-antibacterial therapy and prevention of acute and recurrent cystitis: existing options and future trends. Experimtntal and clinical urology = Eksperimentalnaya i klinicheskaya urologiya 2020(1):136-143. https://doi.org/10.29188/2222-8543-2020-12-1-136-143. (In Russian)].
13. Кузьмин И.В., Слесаревская М.Н., Аль-Шукри С.Х. Антиадгезивная стратегия неантибактериальной профилактики рецидивирующей инфекции нижних мочевыводящих путей. Урология 2021(3):5-12. [Kuz’min I.V., Slesarevskaya M.N., Al-Shukri S.H. Antiadhesive strategy for non-antibacterial prophylaxis of recurrent lower urinary tract infections. Urologiya = Urologiia 2021(3):5–12. https://dx.doi.org/10.18565/urology.2021.3:5–12. (In Russian)].
14. Loubet P, Ranfaing J, Dinh A, Dunyach-Remy С, Bernard L, Bruyère F, et al. Alternative therapeutic options to antibiotics for the treatment of urinary tract infections. Front Microbiol 2020(11):1509. https://doi.org/10.3389/fmicb.2020.01509.
15. Ибишев Х.С., Крахоткин Д.В., Мамедов Э.А., Манцов А.А., Мамедов В.К., Ибишева А.Х. Место иммунотерапии в лечении рецидивирующего цистита. Вестник урологии 2021;9(1):87-94. [Ibishev K.S., Krakhotkin D.V., Mamedov E.A., Mantsov A.A., Mamedov V.K., Ibisheva А.K. Importance of immunotherapy in the treatment of recurrent cystitis. Vestnik urologii = Urology Herald 2021;9(1):87-94. https://doi.org/10.21886/2308-6424-2021-9-1-87-94. (In Russian)].
16. Слесаревская М.Н., Кузьмин И.В., Аль-Шукри С.Х. Фитолизин nefroCAPS в комплексном лечении женщин с хроническим рецидивирующим циститом. Урология 2018(1):30-34. [Slesarevskaya M.N., Kuz’min I.V., Al’-Shukri S.Kh. NefroCAPS Phytolysin in complex management of women with chronic recurrent cystitis. Urologiia = Urologiya 2018(1):30-34. https://doi.org/10.18565/urology.2018.1.30-34. (In Russian)].
17. Слесаревская М.Н., Кузьмин И.В., Аль-Шукри С.Х. Инфекция нижних мочевыводящих путей: новые возможности фитотерапии. Урология 2022(2):103-112 [Slesarevskaya M.N., Kuz'min I.V., Al-Shukri S.H. Infection of the lower urinary tract: new possibilities of herbal medicine. Urologiya = Urologiia 2022(2):103-112. https://doi.org/10.18565/ urology.2022.2.103-112. (In Russian)].
18. Кузьменко А.В., Кузьменко В.В., Гяургиев Т.А. Эффективность применения комплексных фитопрепаратов в лечении неосложненной инфекции нижних мочевыводящих путей у женщин. Урология 2018(4):10-13. [Kuzmenko A.V., Kuzmenko V.V., Gyaurgiev T.A. The effectiveness of complex phytotherapeutic medications in the management of uncomplicated lower urinary tract infections in women. Urologiia = Urologiya 2018(4):10-13. https://doi.org/10.18565/ urology.2018.4.10-13. (In Russian)].
19. Тетерина Т.А., Ищук М.П., Аполихина И.А. Современные подходы к терапии и профилактике рецидивирующих циститов у беременных с применением D-маннозы: результаты проспективного рандомизированного клинического исследования. Эффективная фармакотерапия 2021;17(9):6-14. [Teterina TA, Ishchuk MP, Apolikhina IA Modern approaches to the recurrent cystitis treatment and prevention in pregnant women using d-mannose: results of a prospective randomized clinical trial. Effektivnaya farmakoterapiya = Effective Pharmacotherapy 2021;17(9):6-14. https://doi.org/10.33978/2307-3586-2021-17-9-6-14. (In Russian)].
20. Porru D, Parmigiani A, Tinelli C, Barletta D, Choussos D, Di Franco C, et al. Oral D-mannose in recurrent urinary tract infections in women: a pilot study. J ClinUrol 2014;7(3):208-213. https://doi.org/10.1177/2051415813518332.
21. Шорманов И.С., Соловьев А.С., Чирков И.А., Щедров Д.Н., Красняк С.С., Шадеркин И.А. Возможности препаратов на основе D-маннозы и растительных компонентов в лечении и профилактике рецидивирующих инфекций нижних мочевых путей у женщин. Урологические ведомости 2022;12(1):13-20. [Shormanov I.S., Solovyov A.S., Chirkov I.A., Shchedrov D.N., Krasnyak S.S., Shaderkin I.A. Opportunities of drugs based on D-mannose and herbal components in the treatment and prevention of recurrent lower urinary tract infections in women. Urologicheskie vedomosti = Urology reports (St.-Petersburg) 2022;12(1):13-20. https://doi.org/10.17816/uroved84084. (In Russian)].
22. Liu H, Howell AB, Zhang DJ, Khoo C. A randomized, double-blind, placebo-controlled pilot study to assess bacterial anti-adhesive activity in human urine following consumption of a cranberry supplement. Food Funct 2019 Dec 11;10(12):7645-7652. https://doi.org/10.1039/c9fo01198f.
23. Deng QF, Chu H, Wen Z, Cao YS. Vitamin D and urinary tract infection: a systematic review and meta-analysis. Ann Clin Lab Sci 2019 Jan;49(1):134-142.
24. Ибишев Х.С., Гаджиева З.К., Мамедов В.К. Эффективность биологически активной добавки Уронекст при хроническом рецидивирующем бактериально-вирусном цистите с множественной устойчивостью к антибактериальным препаратам. Урология 2022(2):90–94. [Ibishev Kh.S., Gadzhieva Z.K., Mamedov V.K. Efficacy of Uronext in chronic recurrent bacterialviral cystitis with multiple resistance to antibacterial drugs. Urologiya = Urologiia 2022(2):90–94. https://doi.org/10.18565/urology.2022.2.90-94. (In Russian)].
25. Тевлин К.П., Ханалиев Б.В., Тевлин Д.К. Свойства и безопасность комбинированной биологически активной добавки Уронекст в комплексном лечении острого (обострение хронического) цистита у женщин с бактериальным вагинозом. Consilium Medicum 2021;23(7):571-578. [Tevlin KP, Khanaliev BV, Tevlin DK. Properties and safety of combined dietary supplement Uronext in complex treatment of acute (recrudescence of chronic) cystitis in women with bacterial vaginosis. Consilium Medicum 2021;23(7):571–578. https://doi.org/10.26442/20751753.2021.7.201061. (In Russian)].
26. Alidjanov JF, Abdufattaev UA, Makhsudov SA, Pilatz A, Akilov FA, Naber KG, et al. New selfreporting questionnaire to assess urinary tract infections and differential diagnosis: acute cystitis symptom score. Urol Int 2014;92(2):230–236. https://doi.org/10.1159/000356177.
27. Определение чувствительности микроорганизмов к антибактериальным препаратам: Методические указания МУК 4.2.1890-04; М.: Федеральный центр госсанэпиднадзора Минздрава России 2004;91 с. [Determination of the sensitivity of microorganisms to antibacterial drugs: Guidelines MUK 4.2.1890-04; M.: Federal Center for State Sanitary and Epidemiological Surveillance of the Ministry of Health of Russia 2004;91 p. (in Russian)].
28. Определение чувствительности микроорганизмов к антимикробным препаратам. Версия 2021-01. Рекомендации Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии МАКМАХ;222 c. URL: https://www.antibiotic.ru/files/321/ clrec-dsma2021.pdf (дата обращения 10.05.2022). [Determination of the sensitivity of microorganisms to antimicrobial drugs. Version 2021-01. Recommendations of the Interregional аssociation for clinical microbiology and antimicrobial chemotherapy MAKMAKH;222 p. [Electronic resource]. URL: https://www.antibiotic.ru/files/321/clrec-dsma2021.pdf (accessed 10.05.2022). (in Russian)].
29. Благонравова А.С., Афонин А.Н., Воробьева О.Н., Широкова И.Ю. Сравнительный анализ адгезивности микроорганизмов, выделенных от больных и с объектов внешней среды лечебно-профилактических учреждений. Медицинский альманах 2011;5(18):215-218. [Blagonravova A.S., Afonin A.N., Vorobeva O.N., Shirokova I.Yu. Comparative analysis of the adhesiveness of microorganisms isolated from patients and from objects of the external environment of medical institutions. Meditsinskiy almanah = Medical Almanac 2011;5(18):215-218. (in Russian)].
30. Кузьмин И.В., Слесаревская М.Н., Аль-Шукри С.Х. D-манноза в профилактике и лечении инфекций нижних мочевыводящих путей: патогенетические основы и клинические результаты. Урология 2020(4):131–138. [Kuz'min I.V., Slesarevskaya M.N., Al-Shukri S.H. D-mannose for prevention and treatment of lower urinary tract infection: pathogenetic basics and clinical results. Urologiya = Urologiia 2020(4):131–138. https://doi.org/10.18565/ urology.2020.4.131-138. (in Russian)].
31. Wullt B, Bergsten G, Connell H, Röllano P, Gebretsadik N, Hull R, Svanborg C. P fimbriae enhance the early establishment of Escherichia coli in the human urinary tract. Mol Microbiol 2000;38(3):456-464. https://doi.org/10.1046/j.1365-2958.2000.02165.x.
32. Sauer MM, Jakob RP, Luber T, Canonica F, Navarra G, Ernst B, Unverzagt C, Maier T, Glockshuber R. Binding of the Bacterial Adhesin FimH to Its Natural, Multivalent High-Mannose Type Glycan Targets. J Am Chem Soc 2019 Jan 16;141(2):936-944. https://doi.org/10.1021/jacs.8b10736.
33. Кузьмин И.В., Слесаревская М.Н., Аль-Шукри С.Х. Неантибактериальная профилактика посткоитального цистита у женщин. РМЖ. Мать и дитя 2021;4(3):209–217. [Kuz’min I.V., Slesarevskaya M.N., Al’-Shukri S.Kh. Non-antibiotic prevention of postcoital cystitis in women. RJW Mat i Ditya = Russian Journal of Woman and Child Health 2021;4(3):209–217. https://doi.org/10.32364/2618-8430-2021-4-3-209-217. (in Russian)].
34. Kranjčec B, Papeš D, Altarac S. D-mannose powder for prophylaxis of recurrent urinary tract infections in women: a randomized clinical trial. World J Urol 2014 Feb;32(1):79-84. https://doi.org/10.1007/s00345-013-1091-6.
35. Кузьменко А.В., Кузьменко В.В., Гяургиев Т.А. Эффективность применения комбинированной антибактериально-пребиотической терапии в сочетании с D-маннозой у женщин с неосложненной инфекцией нижних мочевыводящих путей. Урология 2019(6):38–43. [Kuzmenko A.V., Kuzmenko V.V., Gyaurgiev T.A. Efficacy of combined antibacterial-prebiotic therapy in combination with d-mannose in women with uncomplicated lower urinary tract infection. Urologiya = Urologiia 2019(6):38–43. https://doi.org/10.18565/urology.2019.6.38–43. (in Russian)].
36. Sobota AE. Inhibition of bacterial adherence by cranberry juice: potential use for the treatment of urinary tract infections. J Urol 1984 May;131(5):1013-6. https://doi.org/10.1016/ s0022-5347(17)50751-x.
37. Zafriri D, Ofek I, Adar R, Pocino M, Sharon N. Inhibitory activity of cranberry juice on adherence of type 1 and type P fimbriated Escherichia coli to eucaryotic cells. Antimicrob Agents Chemother 1989 Jan;33(1):92-8. https://doi.org/10.1128/AAC.33.1.92.
38. Howell AB, Vorsa N, Der Marderosian A, Foo LY. Inhibition of the adherence of P-fimbriated Escherichia coli to uroepithelial-cell surfaces by proanthocyanidin extracts from cranberries. N Engl J Med 1998 Oct 8;339(15):1085-6. https://doi.org/10.1056/NEJM199810083391516.
39. Howell AB, Reed JD, Krueger CG, Winterbottom R, Cunningham DG, Leahy M. A-type cranberry proanthocyanidins and uropathogenic bacterial anti-adhesion activity. Phytochemistry 2005 Sep;66(18):2281-91. https://doi.org/10.1016/j.phytochem.2005.05.022.
40. Liu Y, Gallardo-Moreno AM, Pinzon-Arango PA, Reynolds Y, Rodriguez G, Camesano TA. Cranberry changes the physicochemical surface properties of E. coli and adhesion with uroepithelial cells. Colloids Surf B Biointerfaces 2008 Aug 1;65(1):35-42. https://doi.org/10.1016/ j.colsurfb.2008.02.012.
41. Ramos NL, Sekikubo M, Kironde F, Mirembe F, Sääf M, Brauner A. The impact of vitamin D on the innate immune response to uropathogenic Escherichia coli during pregnancy. Clin Microbiol Infect 2015 May;21(5):482.e1-7. https://doi.org/10.1016/j.cmi.2014.12.010.
42. Hertting O, Holm Å, Lüthje P, Brauner H, Dyrdak R, Jonasson AF, Wiklund P, Chromek M, Brauner A. Vitamin D induction of the human antimicrobial Peptide cathelicidin in the urinary bladder. PLoS One 2010 Dec 14;5(12):e15580. https://doi.org/10.1371/journal.pone.0015580.







