ВВЕДЕНИЕ
Инкрустирующий пиелит (ИП) — это воспалительное заболевание, вызываемое уреазопродуцирующей микрофлорой и характеризующееся инкрустацией слизистой оболочки чашечно-лоханочной системы (ЧЛС) почек. Поскольку неотъемлемым компонентом патогенеза заболевания является повышение pH мочи, в литературе часто встречается такое определение как «щелочной пиелит». Заболевание может поражать как одну, так и обе почки. При отсутствии соответствующего лечения ИП способен привести к терминальной стадии почечной недостаточности, требующей заместительной почечной терапии [1].
Предрасполагающими факторами для развития щелочного пиелита являются хроническая мочевая инфекция, перенесенные оперативные вмешательства на органах мочевой системы, иммуносупрессивные состояния, длительное нахождение дренажей в мочевых путях [2].
Клинические проявления заболевания неспецифичны и могут быть минимальными в течение длительного времени. К ним относятся боль в поясничной области, гематурия, лихорадка [3].
Диагностическими критериями заболевания являются: щелочная реакция мочи, уреазопродуцирующая микрофлора в бактериологическом посеве мочи, наиболее частым представителем которой при щелочном пиелите является Corynebacterium urealyticum, специфическая картина при компьютерной томографии (КТ) мочевой системы, наличие фосфата магния и аммония в составе камней, полученных во время операции или при самостоятельном их отхождении [1].
Лечение инкрустирующего пиелита включает антибактериальную терапию, чрескожный хемолиз и, при необходимости, хирургическое вмешательство. Также важным является динамическое наблюдение за пациентом для предотвращения или раннего выявления рецидива [4].
Чрескожный хемолиз используется в качестве метода растворения инфекционных мочевых камней на протяжении десятилетий [5]. Основным действующим веществом растворов, используемых для хемолитической терапии, является лимонная кислота в низких концентрациях, которая, окисляя мочу, ингибирует образование и способствует растворению фосфата кальция, карбоната кальция, фосфата магния и аммония. За счет этих процессов происходит уменьшение размеров конкрементов.
Высокий риск рецидива при наличии резидуальных конкрементов, содержащих бактерии, является серьезной проблемой, возникающей при хирургическом лечении по поводу крупных инфекционных камней [6]. В этих условиях роль чрескожного хемолиза значимо возрастает.
Среди осложнений хемолитической терапии описаны такие как грибковая инфекция мочевыделительной системы, сепсис и нарушения электролитного баланса [7].
С целью демонстрации особенностей клинического течения, диагностики и лечения инкрустирующего пиелита приводим наше наблюдение.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
Пациентка Б. 46 лет госпитализирована в отделение урологии ГКБ им. В.М. Буянова в мае 2021 года с жалобами на макрогематурию продолжительностью около месяца.
В течение трех лет до госпитализации у пациентки отмечались неоднократные атаки обструктивного пиелонефрита справа, проводились внутреннее и наружное дренирование, контактная уретеролитотрипсия и перкутанная нефролитолапаксия справа, а также лапароскопическая операция Боари по поводу сформировавшейся стриктуры нижней трети правого мочеточника.
В клиническом анализе мочи на момент поступления отмечена лейкоцитурия 500/мкл, рН мочи 8,0. В клиническом анализе крови лейкоцитоз 12,0х109/л. При цистоскопии объемных образований выявлено не было, отмечен выброс мочи с примесью крови из артифициального устья правого мочеточника.
По данным КТ с внутривенным контрастированием объемных образований органов мочевой системы и сосудистой патологии почек выявлено не было. Была обнаружена инкрустация слизистой ЧЛС правой почки по типу «ледяной корочки» (рис. 1), при трехмерной реконструкции создавалось впечатление о формировании полного коралловидного камня (рис. 2). Также имела место дилатации чашечно-лоханочной системы правой почки. Таким образом, учитывая болевой синдром в поясничной области справа, макрогематурию, щелочную реакцию мочи и данные КТ, пациентке был уставлен диагноз «инкрустирующий пиелит».
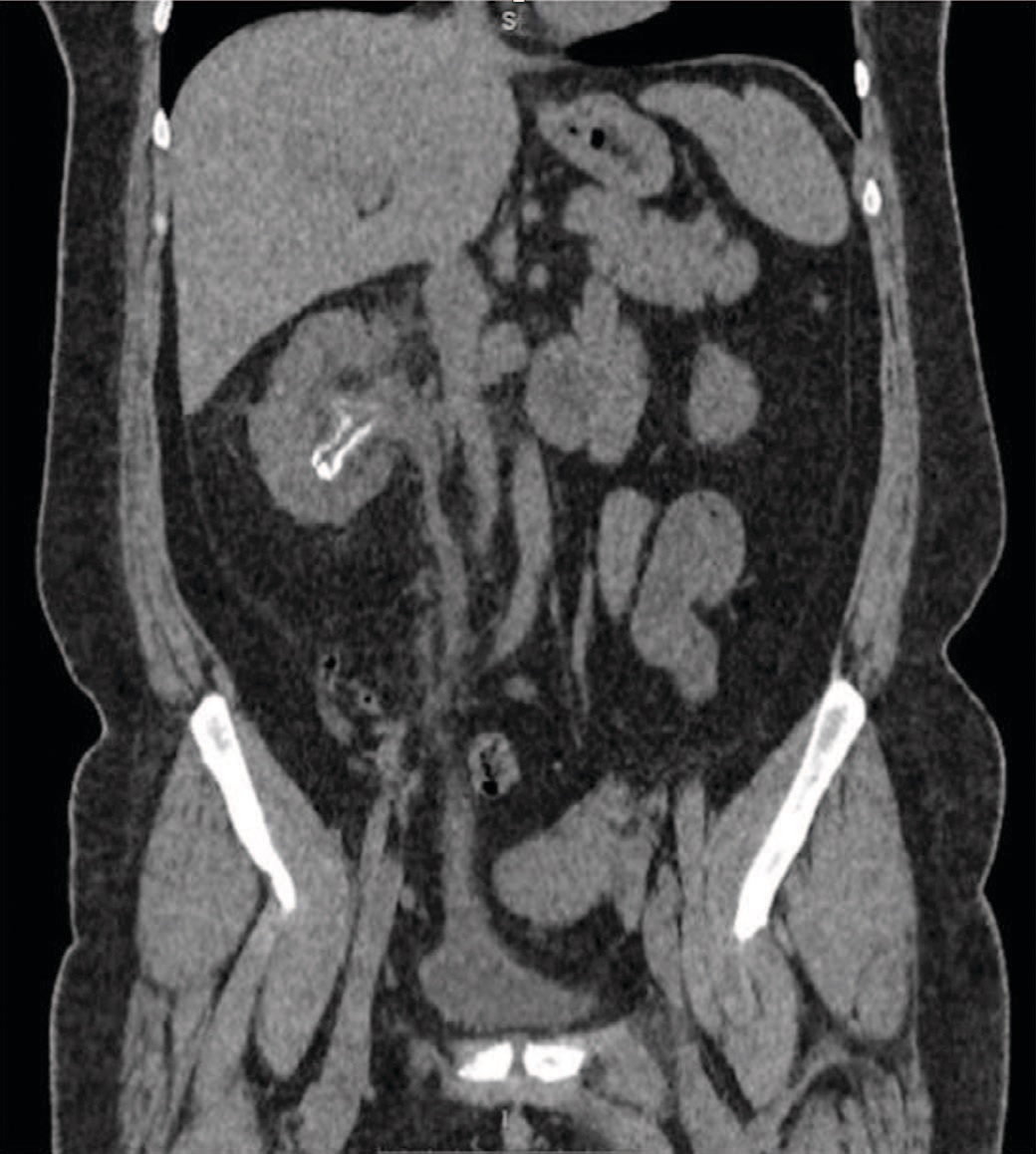
Рис. 1. Инкрустация слизистой чашечно-лоханочной системы по типу «ледяной корочки»
Fig. 1. Encrustation of the pelvicalyсeal mucosa similar to «ice crust»
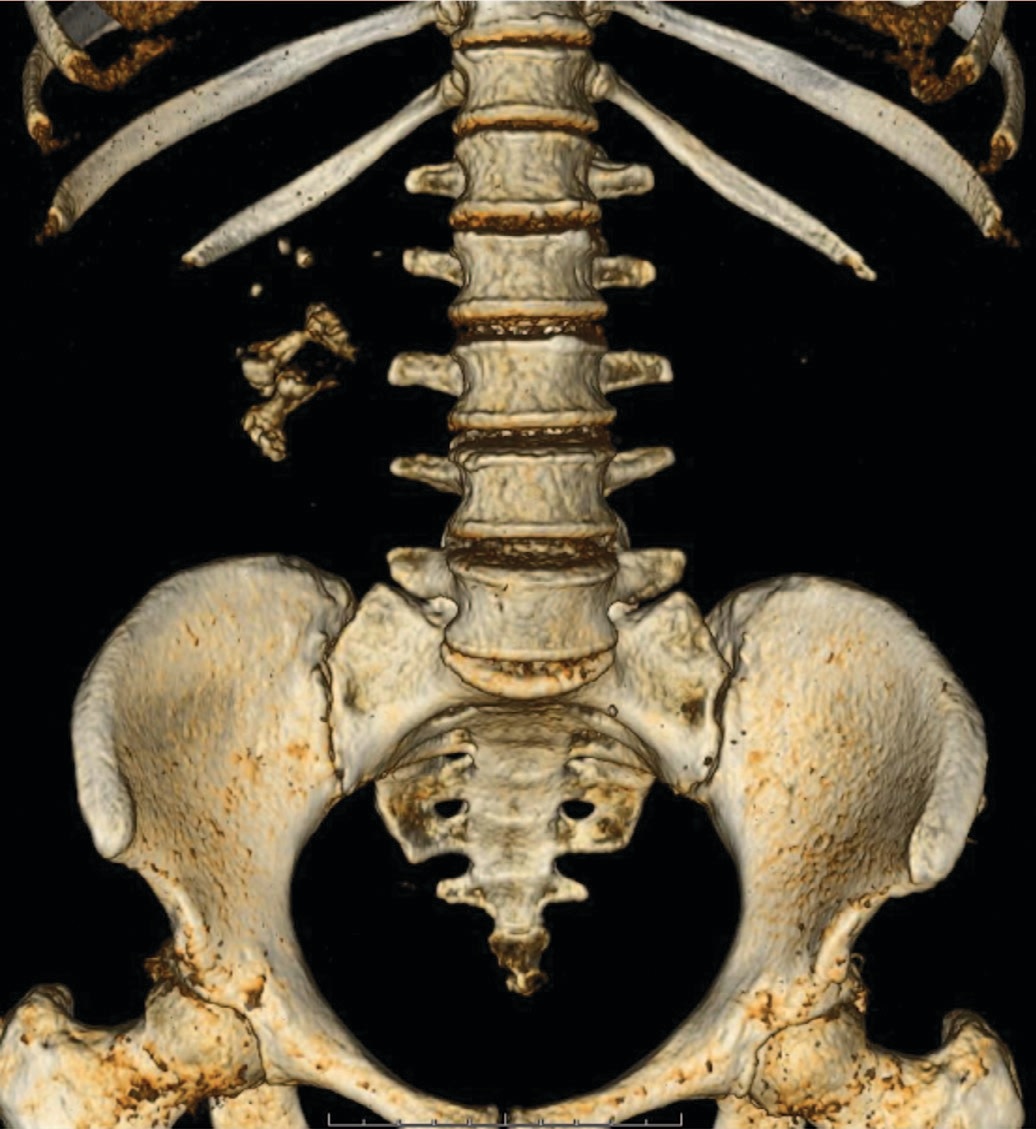
Рис. 2. 3D-реконструкция — инкруcтированная слизистая оболочка имитирует коралловидный камень.
Fig. 2. 3D-reconstruction — the encrusted mucosa imitates a staghorne calculus
Что касается культурального критерия диагноза, то при неоднократном бактериологическом исследовании мочи, мы ни разу не получили роста Corynebacterium urealyticum, однако определялся рост Klebsiella pneumoniae 106 КОЕ/мл. Последний микроорганизм также характеризуется высокой уреазной активностью [8].
Учитывая значительный объем инкрустации при сохраненном просвете ЧЛС, в качестве первой линии терапии был выбран чрескожный хемолиз.
Для проведения хемолиза была выполнена чрескожная пункционная нефростомия (ЧПНС) справа. В почку установлены два нефростомических дренажа — через нижнюю и через верхнюю группу чашечек. При пункции получена желеобразная моча с геморрагическим компонентом. Через верхнюю чашечку установлена нефростома типа «pigtail» № 8 Ch. Через нижнюю чашечку установлен дренаж баллонного типа № 12 Сh. В ходе установки нефростомического дренажа баллонного типа по кожуху отмечено отхождение незначительного количества мелких фрагментов камней. Был проведен анализ их химического состава методом инфракрасной спектрометрии: 40% — урат аммония, 40% — фосфат кальция, 20% — фосфат магния и аммония. Такой результат подтвердил диагноз и целесообразность запланированного хемолиза.
В течение 7 суток проводилась антибактериальная терапия ванкомицином в дозе 2 г/сут. Также проводилась гемостатическая и инфузионная терапия, макрогематурия и болевой синдром были купированы, воспалительные изменения в клиническом анализе крови регрессировали, рН мочи снизился с 8 до 7,5.
После снижения микробного числа и купирования макрогематурии проведена ирригация ЧЛС 250 мл физиологического раствора с постепенным повышением скорости его подачи с 20 до 100 мл/час. Для обеспечения постоянной низкой скорости подачи раствора в ЧЛС почки мы использовали линейный инфузомат.
Раствор вводился по нефростоме установленной через верхнюю чашечку. Нефростомический дренаж баллонного типа, установленный через нижнюю чашечку, обеспечивал адекватный отток ирригационной жидкости за счет большего диаметра — № 12 Сh (рис. 3). Болевого синдрома, повышения температуры тела как во время, так и после ирригации, не отмечено.
Рис. 3. Положение нефростомических дренажей
Fig. 3. Nephrostomy tubes position
После тестовой ирригации физиологическим раствором, в течение следующих 5 дней проведен первый курс чрескожной хемолитической терапии 3,23% раствором лимонной кислоты. Скорость ирригации составляла 70 мл/час, ежедневно вводилось 200 мл раствора. Общий объем ирригационного раствора за 5 дней составил 1000 мл.
С целью раннего выявления возможных септических осложнений и метаболических нарушений дважды в день (перед началом ирригации и через 1 час после ее завершения) контролировались показатели температуры тела, пульса, артериального давления, частоты дыхательных движения.
Контроль лабораторных показателей (клинический анализ крови, общий анализ мочи из нефростомы, электролиты крови) осуществлялся в первые два дня за час до окончания ирригации. Никаких значимых отклонений ни по одному из показателей зафиксировано не было.
После завершения первого этапа чрескожной хемолитической терапии выполнена контрольная КТ органов мочевыделительной системы (МВС), результаты которой были обнадеживающими — большая часть инкрустаций подверглась хемолизу.
Резидуальные камни располагались в лоханке под баллоном нефростомического дренажа, установленного через нижнюю чашечку, над завитком нефростомического дренажа, установленного через верхнюю чашечку, а также в средней чашечке (рис. 4).
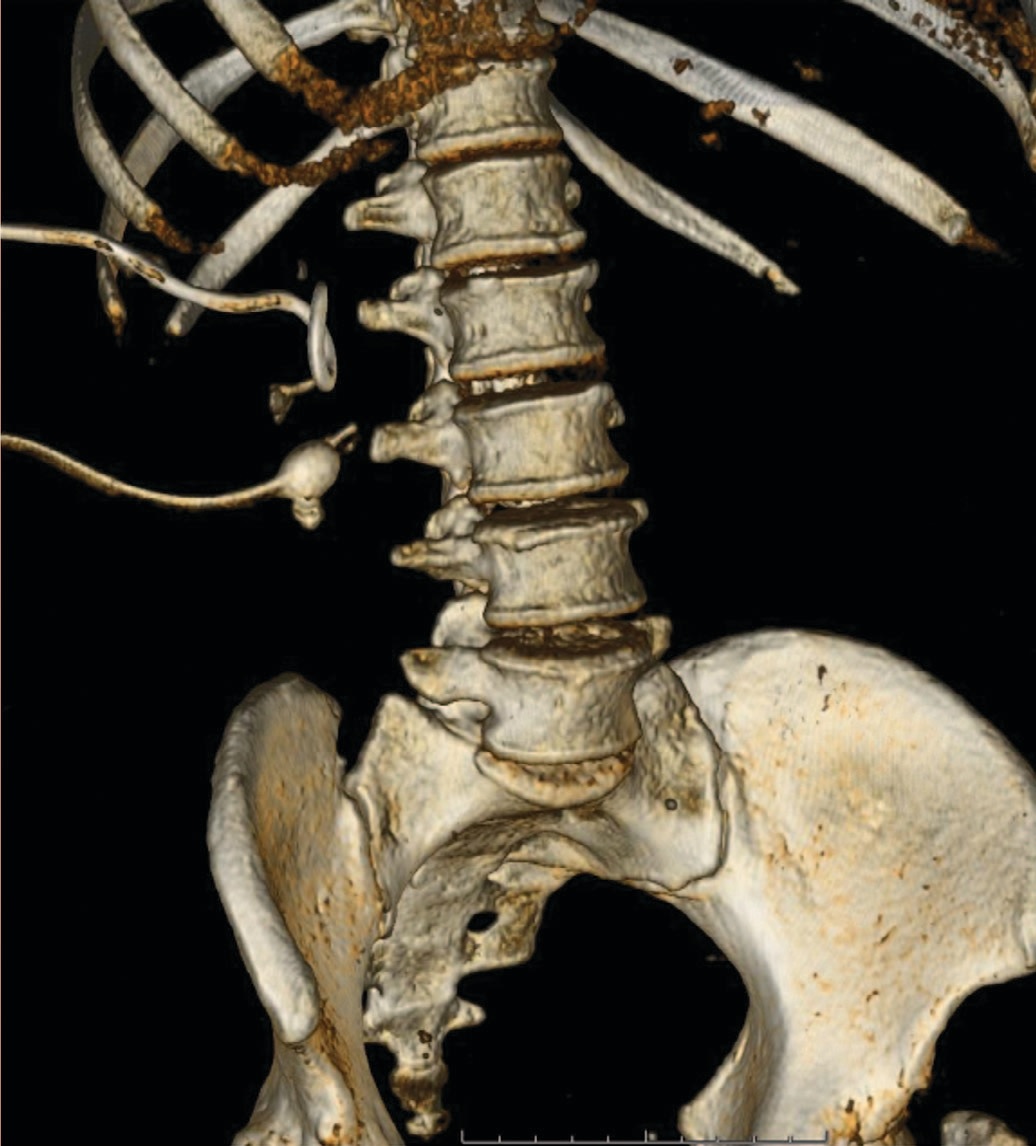
Рис. 4. Резидуальные камни после первого этапа хемолиза
Fig. 4. Residual stones after the first stage of chemolysis
Для обеспечения доступности камней орошению хемолитическим препаратом выполнена замена нефростомических дренажей. Через верхнюю чашечку установлен нефростомический дренаж типа «pig tail», при этом дистальный конец дренажа позиционирован верхнемедиальном отроге верхней чашечки. Нефростомический дренаж баллонного типа, установленный через нижнюю чашечку, был заменен на дренаж типа «pig tail», его завиток сформирован в лоханке (рис. 5).
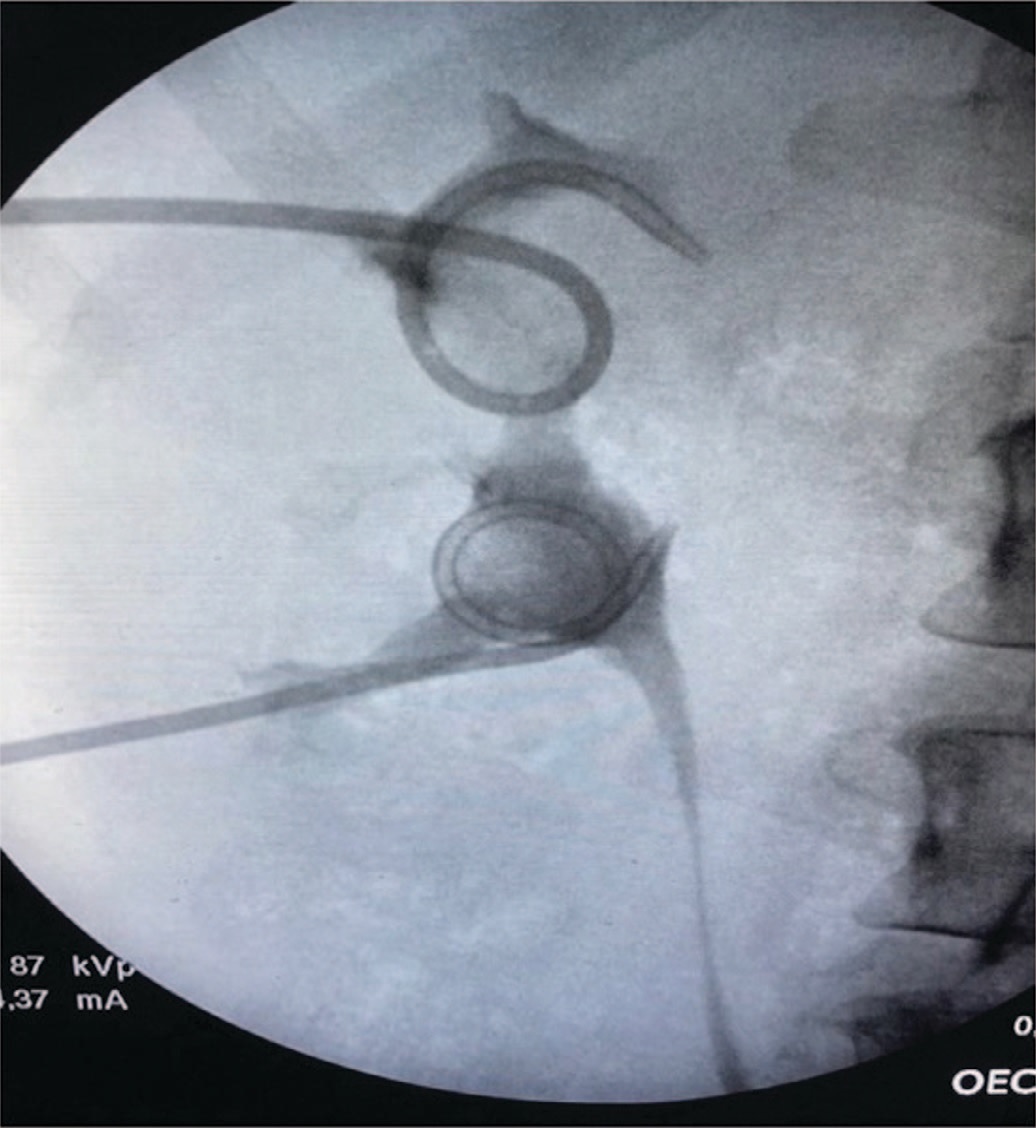
Рис. 5. Положение нефростомических дренажей после их замены
Fig. 5. The nephrostomy tubes position after their replacement
В контрольном посеве мочи помимо Klebsiella pneumoniae выявлен рост Candida albicans. В течение 10 дней проведен курс терапии флуконазолом в дозе 100 мг/сут. В последующих культуральных исследованиях грибковой инфекции не определялось.
Через две недели после первого, проведен второй курс чрескожного хемолиза. В ходе него ежедневно вводилось по 500 мл раствора, длительность курса составила 6 дней. Скорость ирригации постепенно повышалась с 70 до 110 мл/час.
По данным контрольной КТ камни средней чашечки не подверглись хемолизу, определялось незначительное количество резидуальных инкрустаций в нижней чашечке (рис. 6). Такой результат мог быть обусловлен как недоступностью средней чашечки для орошения раствором, так и химическим составом резидуальных камней, при котором дальнейшее продолжение хемолитической терапии было бы неэффективным, в связи с чем принято решение о выполнении миниперкутанной нефролитоэкстракции.
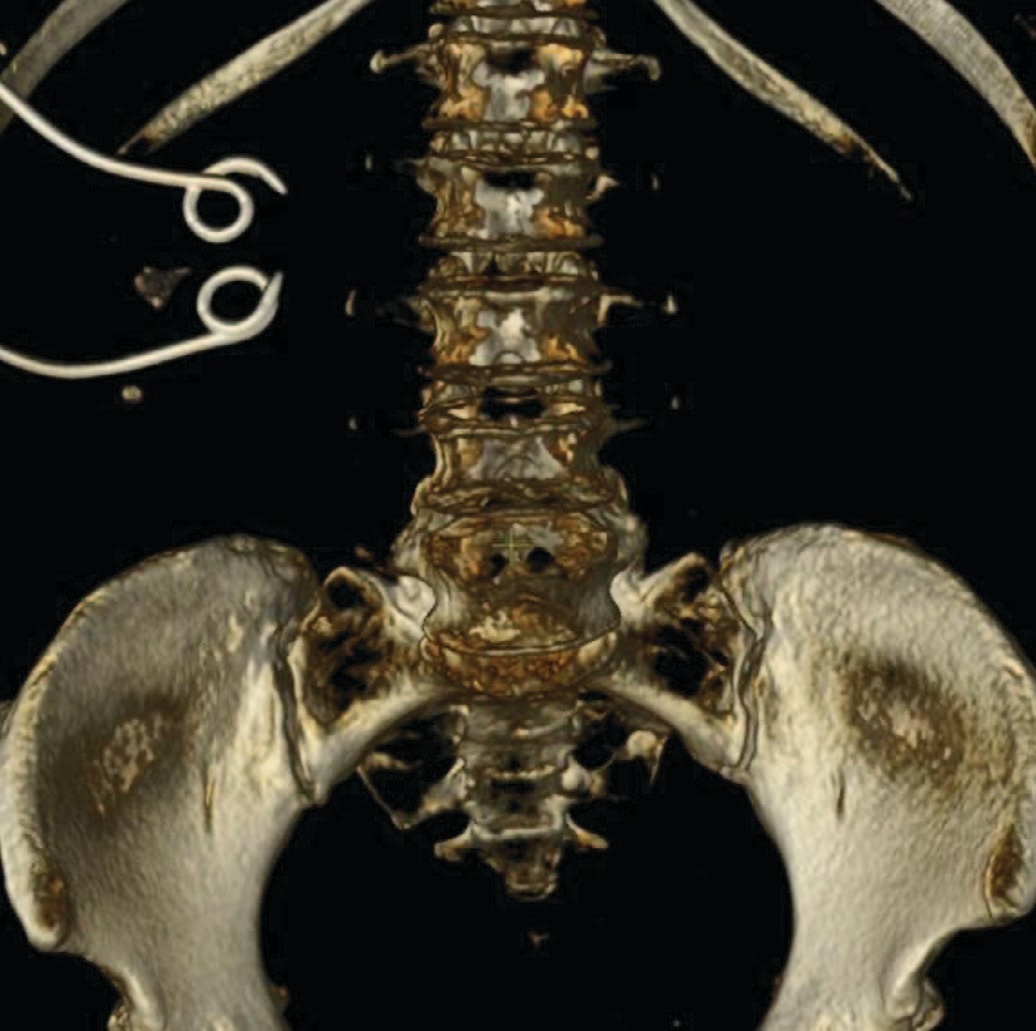
Рис. 6. Резидуальные инкрустации в нижней и средней чашечке
Fig. 6. Residual encrustation in the lower and middle calyces
Доступ в ЧЛС осуществлен через среднюю чашечку. С целью снижения внутрилоханочного давления нефростомические дренажи не удалялись. Интраоперационно отмечена значительная разница в состоянии слизистой чашечно-лоханочной системы, подвергшейся орошению хемолитическим препаратом, и слизистой средней чашечки, которая была недоступна для орошения. Немногие свободные от петрификации участки слизистой средней чашечки были отечны и гиперемированы, касание их инструментом приводило к кровотечению.
При попытке удаления инкрустации развивалось выраженное кровотечение, ввиду чего от дальнейших манипуляций в этой зоне было решено воздержаться. В среднюю чашечку установлен нефростомический дренаж типа «pig tail» № 8 Ch таким образом, что основная часть завитка сформирована в чашечке с выведением дистального конца завитка в лоханку (рис. 7).
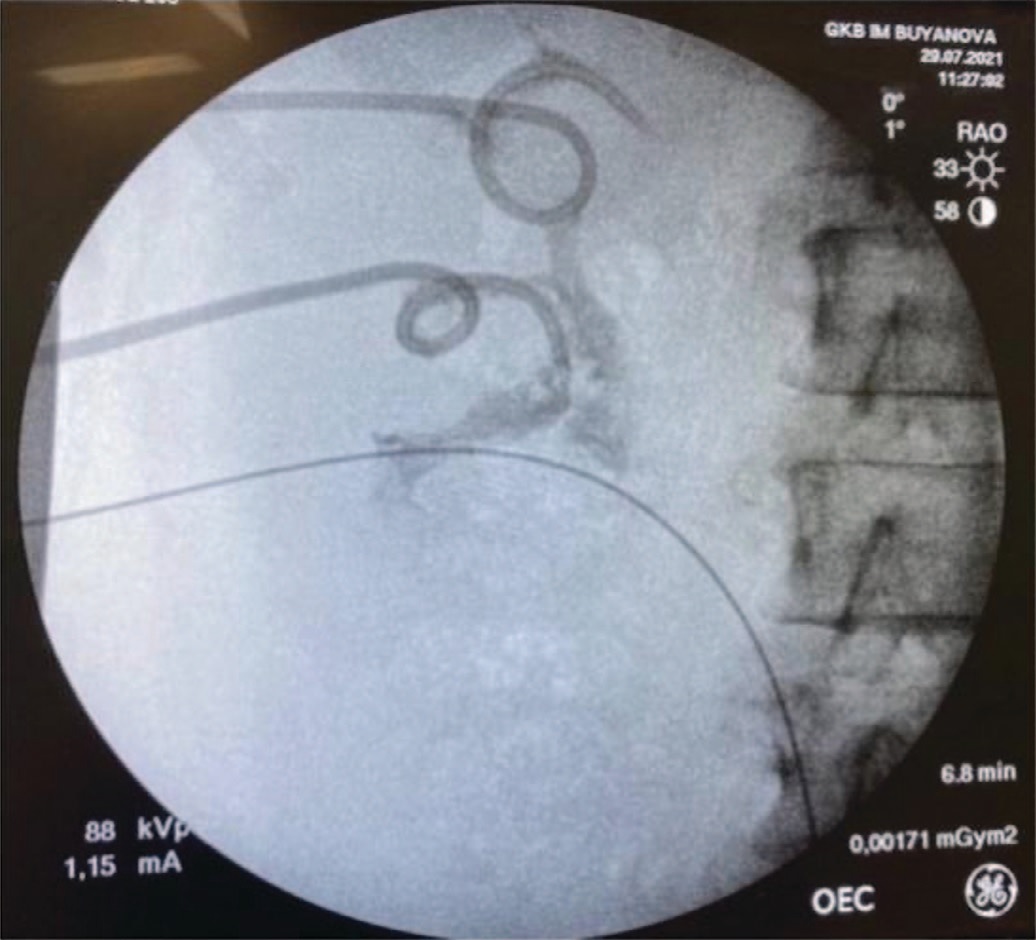
Рис. 7. Положение нефростомических дренажи в верхней и средней чашечках
Fig. 7. The position of nephrostomy drains in the upper and middle calyces
Выполнена чресфистульная экстракция камней нижней чашечки. В нижнюю чашечку установлен нефростомический дренаж баллонного типа № 12 Сh. Дренаж из верхней чашечки (инкрустации в этой зоне ЧЛС полностью подверглись хемолизу) был удален. Инфракрасная спектрометрия удаленных камней показала результат: 40% — урат аммония, 40% — фосфат кальция, 20% — фосфат магния и аммония, что дало основания провести завершающий курс чрескожной хемолитической терапии.
Спустя неделю после операции проведен третий курс хемолиза. В течение пяти дней ежедневно вводилось по 400 мл раствора при скорости ирригации 60 мл/час. По данным контрольной КТ достигнут статус «stone free» (рис. 8).
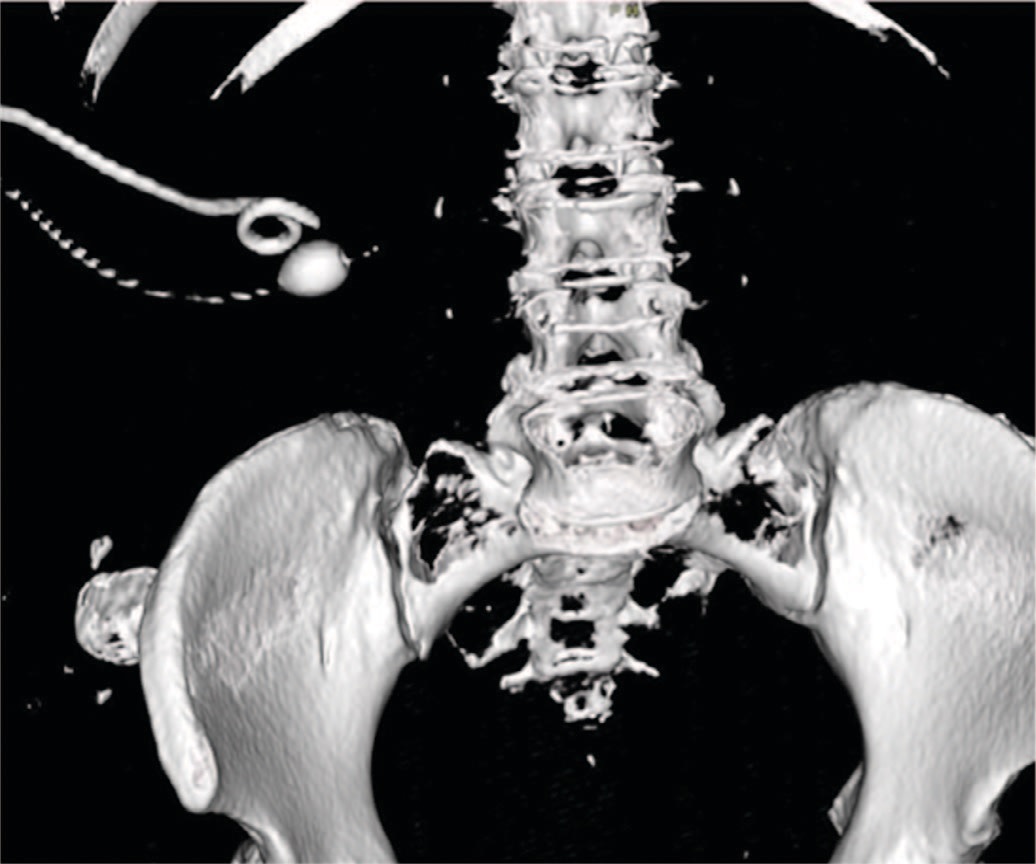
Рис. 8. Отсутствие резидуальных инкрустаций после третьего курса хемолиза
Fig. 8. The absence of residual encrustations after the third course of chemolysis
Перед удалением нефростомических дренажей выполнена антеградная пиелоуретеграфия, по результатам которой мочеточник был проходим на всем протяжении. Нефростомические дренажи поочередно удалены. Пациентке рекомендованы мероприятия по метафилактике мочекаменной болезни.
ОБСУЖДЕНИЕ
Инкрустирующий пиелит впервые был описан J. M. Morales в 1992 году [9]. При этом щелочной цистит, заболевание с той же патофизиологией, был описан еще в начале прошлого века [10].
Как было отмечено выше, предрасполагающими факторами для развития ИП являются хроническая инфекция мочевыделительной системы, перенесенные оперативные вмешательства на органах мочевой системы, иммуносупрессивные состояния. Особую группу риска представляют пациенты, перенесшие трансплантацию почки. Распространенность заболевания среди реципиентов почки составляет от 0,2 до 1% [11]. При этом заболевание может поражать как трансплантированную, так и собственную почку [12]. Также щелочной пиелит является достаточно частым осложнением реконструктивных операций с использованием петель кишечника. Интервал между оперативным вмешательством и развитием заболевания может составлять от нескольких дней до 3 лет [13].
Возбудителем инкрустирующего пиелита является микрофлора, обладающая высокой уреазной активностью. Данное свойство характерно для Proteus spp., Klebsiella spp., Ureaplasma urealyticum, Pseudomonas aeruginosa, Staphylococcus aureus [8]. Наиболее часто в литературе встречается описание Corynebacterium urealyticum, как этиологического фактора развития заболевания. Это грамположительный аэробный комменсальный неспорообразующий микроорганизм, обладает выраженной тропностью к уротелиальным клеткам, что объясняет его способность достигать верхних мочевых путей. Мощная способность гидролизовать мочевину и неспособность окислять глюкозу являются отличием Corynebacterium urealyticum от других видов коринебактерий [11]. Микроорганизм обладает устойчивостью к бета-лактамным антибактериальным препаратам и аминогликозидам, различной степенью чувствительностью к фторхинолонам, макролидам, рифампицину, тетрациклинам и высокой чувствительностью к гликопептидам — ванкомицину и тейкопланину. Частота встречаемости Corynebacterium urealyticum составляет от 0,016% до 0,32% среди всех образцов мочи, исследуемых в стандартных условиях. Сложность выявления микроорганизма состоит в том, что Corynebacterium urealyticum требует особых условий инкубации. Микроорганизм растет на кровяном агаре после 48 часов инкубации при температуре 35–37°C [14-15].
Ответить на вопрос, является ли отсутствие Corynebacterium urealyticum в бактериологическом анализе мочи в нашем клиническом случае истинным результатом, или же оно обусловлено особыми условиями, необходимыми для роста этого микроорганизма сложно. В связи с высоким риском ложноотрицательного результата, на начальных этапах лечения эмпирически был назначен ванкомицин. При повторных бактериологических исследованиях мы сделали запрос на более длительный период инкубации, но результат был прежний — в посеве мочи определялся рост Klebsiella pneumoniae. Учитывая тот факт, что Klebsiella pneumoniae также обладает высокой уреазной активностью и может являться возбудителем щелочного пиелита, в дальнейшем мы отказались от эмпирического применения ванкомицина и приступили к антибактериальной терапии согласно с чувствительностью выделенного микроорганизма. Стоит также отметить, что во всех предыдущих бактериологических анализах мочи нашей пациентки, последний из которых был выполнен за два месяца до развития клинической картины щелочного пиелита, определялся рост Escherichia coli 102 КОЕ/мл, а рH мочи был равен 6,0 Ед.
Повышение рН мочи играет ключевую роль в формировании инкрустации. Гидролизация мочевины бактериальной уреазой приводит к образованию аммиака (NH3), который увеличивает рН за счет связывания ионов H+ мочи, тем самым способствуя окислению растворенного CO2 в карбонат. Высокий рН способствует взаимодействию NH4+ с магнием и фосфатом, в результате чего образуется магний- аммоний-фосфат, стойкая щелочная реакция мочи также лежит в основе формирования кальций-фосфатных камней [3].
Результат инфракрасной спектрометрии удаленных у пациентки камней соответствовал характерному для щелочного пиелита составу. Следует отметить, что инфракрасная спектрометрия камней, полученных в результате операции, выполненной годом ранее демонстрировала следующий состав: 60% — кальция оксалат моногидрат, 20% — кальция оксалат дигидрат, 20% — фосфат кальция.
Клинические проявления ИП неспецифичны и могут быть минимальными в течение длительного времени. К ним относятся боль в поясничной области, гематурия, лихорадка [12].
В инструментальной диагностике ключевое место отводится компьютерной томографии, обзорная урография и УЗИ почек не обладают достаточной чувствительностью [2]. КТ–признаками инкрустирующего пиелита являются утолщение и линейная кальцификация стенок чашечно-лоханочной системы почек по типу «ледяной корочки». Кальцификаты могут различаться по размеру, варьируя от мелкой и линейной кальцификации ограниченной чашечками, до крупных кальцинированных бляшек, выполняющих всю ЧЛС [7].
Лечение представляет собой комбинацию этиотропной антибактериальной терапии, окисления мочи путем перорального или чрескожного хемолиза и, при необходимости, хирургического лечения [4].
Окисление мочи играет ключевую роль в патогенетическом лечении щелочного пиелита. Оно способствует растворению кальцинированных отложений (хемолизу) и предотвращает дальнейшее формирование инкрустаций.
Первый случай растворения камня при помощи хемолиза был описан в 1924 году [16]. На сегодня предложены различные методики выполнения чрескожного хемолиза: с использованием мочеточникового катетера, внутреннего мочеточникового стента, нефростомического дренажа. Выполняется как антеградная, так и ретроградная подача ирригационной жидкости [17-18]. Коаксиальный метод хемолиза, заключающийся в установке двух нефростомических дренажей, является наиболее надежным для обеспечения адекватного оттока ирригационной жидкости и предотвращения повышения внутрилоханочного давления. Для обеспечения низкой скорости подачи раствора используются инфузоматы. Для контроля внутрилоханочного давления применяют манометры центрального давления и компьютерный мониторинг внутрилоханочного давления. При использовании компьютерного мониторинга давления орошение прекращается, когда давление поднимается выше предварительно установленного предела в 15 см водного столба. Однако описанная мера увеличивает не только безопасность ирригационного хемолиза, но и его стоимость [19-20].
Промежуток времени между выполнением чрескожной пункционной нефростомии (ЧПНС) и началом антеградной ирригации должен составлять не менее суток, для обеспечения заживления нефростомического свища и, как следствие, предотвращения экстравазации хемолитического препарата [5].
В нашем клиническом наблюдении временной интервал между выполнением ЧПНС и началом первого хемолиза был значительно больше, в связи с необходимостью купирования атаки пиелонефрита перед началом ирригации.
Для чрескожного хемолиза применяется растворы, содержащие лимонную кислоту в низких концентрациях. Первым этапом должна быть выполнена ирригация в тестовом режиме с использованием физиологического раствора для определения оптимальной скорости введения раствора, при которой не возникает болевого синдрома, являющегося проявлением повышения внутрилоханочного давления [5].
Нет четких рекомендаций, регламентирующих время ирригации, скорость и объем вводимого раствора при проведении хемолитической терапии. Главным требованием является обеспечение низкого внутрилоханочного давления для предотвращения пиеловенозного рефлюкса. Для контроля за скоростью подачи раствора мы использовали линейный инфузомат.
Если во время хемолиза пациент отмечает болевой синдром в поясничной области, следует немедленно прекратить подачу раствора. Продолжение ирригации в этом случае может вызвать системную абсорбцию ирригационной жидкости с последующим развитием гипермагниемии, если в растворе присутствуют соли магния. Гипермагниемия клинически проявляется спутанностью сознания, тошнотой̆, снижением глубоких сухожильных рефлексов, снижением частоты дыхания, гипотонией и аритмией [21]. Системное всасывание ирриганта также может привести к сепсису, поскольку инфекционные камни колонизированы бактериями [22].
По мере растворения инкрустации образуют фрагменты небольших размеров способные вызвать обструкцию мочеточника [23]. Развитие обструктивного пиелонефрита в нашем клиническом наблюдении было предотвращено применением двух нефростомических дренажей и контролем проходимости мочеточника путем антеградной пиелоуретерографии перед удалением нефростомических дренажей.
Возможными осложнениями чрескожного хемолиза являются сепсис, метаболический ацидоз и грибковая инфекция мочевыводящих путей [6]. Достоверно сказать, является ли грибковая инфекция мочевой системы, диагностированная в нашем клиническом наблюдении, результатом окисления мочи или длительной антибактериальной терапии затруднительно.
По данным большинства литературных источников хирургическое удаление инкрустаций при щелочном пиелите является одним из компонентов лечения. Однако перкутанное удаление петрификатов оказалось очень непростой задачей ввиду формирования обширных раневых дефектов слизистой и кровотечений из описанных участков, затрудняющих видимость. Сообщалось даже о летальном исходе через два дня после перенесенного оперативного вмешательства по поводу инкрустирующего пиелита в результате почечного кровотечения [24].
Оперативное лечение в качестве монотерапии не показало себя как достаточно эффективный метод, что подчеркивает важность менее инвазивного подхода [24]. На примере нашего случая можно предположить, что хирургическое удаление инкрустаций и свободно лежащих камней целесообразно при недостаточной эффективности хемолиза и должно иметь ограниченный характер.
Также следует отметить, что для доступа в ЧЛС мы использовали методику, подразумевающую отсутствие контрастирования собирательной системы [25]. Как при первичной, так и при повторных пункциях ультразвукового наведения оказывалось достаточно для доступа в искомый отдел полостной системы почки.
ЗАКЛЮЧЕНИЕ
Эмпирическое применение ванкомицина в лечении щелочного пиелита может быть оправдано сложностью выявления Corynebacterium urealyticum и активностью препарата в условиях высокой pH, но является дискутабельным, учитывая его токсичность и растущую антибиотикорезистентность.
Недостатками чрескожного хемолиза являются его растянутость во времени, трудоемкость, длительная гиподинамия пациента в ходе инфузии и необходимость дренажей. При этом нужно отметить, что позиция дренажей в ЧЛС почки влияет на доступность камней орошению хемолитическим раствором. Поэтому во время чрескожной хемолитической терапии должен проводиться периодический КТ-контроль ее эффективности и, при необходимости, выполняться коррекция положения дренажей.
Основным требованием для обеспечения безопасности этого метода лечения является поддержание низкого внутрилоханочного давления. На наш взгляд, выбранный нами метод хемолиза с использованием двух нефростомических дренажей, имеет преимущества перед методиками с использованием мочеточникого катетера или стента за счет того, что при обструкции мочеточника фрагментами инкрустации, второй нефростомический дренаж предотвращает повышение внутрилоханочного давления. После завершения хемолитической терапии необходимо убедиться в проходимости мочеточника, и только после этого приступать к удалению дренажей.
Учитывая сложность хирургического удаления инкрустаций, обусловленную выраженным кровотечением из воспаленной слизистой чашечно-лоханочной системы и значимым повышением внутрилоханочного давления во время перкутанного вмешательства, чрескожный хемолиз является менее инвазивным и более безопасным методом лечения.
ЛИТЕРАТУРА
1. Lieten S, Schelfaut D, Wissing KM, Geers C, Tielemans C. Alkaline-encrusted pyelitis and cystitis: an easily missed and life-threatening urinary infection. BMJ Case Rep 2011;2011:bcr1220103613. https://doi.org/10.1136/bcr.12.2010.3613.
2. Meria P, Jungers P. Encrusted pyelitis: an underdiagnosed condition? Nephrol Dial transplant 2000;15(7):943-5. https://doi.org/10.1093/ndt/15.7.943.
3. Meria P, Desgrippes A, Arfi C, Le Duc A. Encrusted cystitis and pyelitis. J Urol 1998;160(1):3-9.
4. Lee R, Clement MR, Carr MC, Canning DA, Brayman KL. Successful treatment of encrusted cystitis and pyelitis with preservation of renal graft. Transplantation 2004;78(2):302-3. https://doi.org/10.1097/01.tp.0000135140.12454.f4.
5. Kachrilas S, Papatsoris A, Bach C, Bourdoumis A, Zaman F, Masood J, et al. The current role of percutaneous chemolysis in the management of urolithiasis: review and results. Urolithiasis 2013;41(4):323-6. https://doi.org/10.1007/s00240-013-0575-6.
6. Joshi HB, Kumar PV, Timoney AG. Citric acid (solution R) irrigation in the treatment of refractory infection (struvite) stone disease: is it useful? Eur Urol 2001;39(5):586-90. https://doi.org/10.1159/000052508.
7. Van Hooland, S, Vandooren AK, Lerut E, Oyen R, Maes B. Alkaline encrusted pyelitis. Acta Clinica Belgica 2005;60(6):369–72. https://doi.org/10.1179/acb.2005.055.
8. Thompson RB, Stamey TA. Bacteriology of infected stones. Urology 1973;2(6):627-33. https://doi.org/10.1016/0090-4295(73)90323-3.
9. Morales JM, Aguado JM, Diaz-Gonzalez R, Salto E, Andres A, Campo C, et al. Alkaline-encrusted pyelitis/cystitis and urinary tract infection due to corynebacterium urealyticum: a new severe complication after renal transplantation. Transplant Proc 1992;24(1):81-2.
10. Francois J. La cystite incrustee. J Urol Med Chir 1914;(5):35-52. [François J. Encrusted cys - titis. J Urol Med Chir 1914(5):35-52. (In French)].
11. Soriano F, Aguado JM, Ponte C, Fernández-Roblas R, Rodríguez-Tudela JL. Urinary tract infection caused by Corynebacterium group D2: report of 82 cases and review. Rev Infect Dis 1990;12(6):1019-34. https://doi.org/10.1093/clinids/12.6.1019.
12. Meria P, Desgrippes A, Fournier R, Arfi C, Antoine C, Martinat L, et al. The conservative management of Corynebacterium group D2 encrusted pyelitis. BJU Int 1999;84(3):270-5. https://doi.org/10.1046/j.1464-410x.1999.00156.x.
13. Gerharz EW, Turner WH, Kalble T, Woodhouse CRJ. Metabolic and functional conse - quences of urinary reconstruction with bowel. BJU Int 2003;91(2):143-9. https://doi.org/10.1046/j.1464-410x.2003.04000.x.
14. Marty N, Agueda L, Lapchine L, Clave D, Henry-Ferry S, Chabanon G. Adherence and hemagglutination of Corynebacterium group D2. Eur J Clin Microbiol Infect Dis 1991;10(1):20-4. https://doi.org/10.1007/BF01967092.
15. Meignin V, Blanchet P, Quillard J, Hiesse C, Groupy C, Beloit G, et al. Pyelo-ureterite et cystite incrustée a Corynebacterium D2 chez un transplant rénal. Ann Pathol 1996;16(1):45-8. [Meignin V, Blanchet P, Quillard J, Hiesse C, Groupy C, Beloit G, et al. Encrusted pyelo-ureteritis and cystitis by Corynebacterium D2 in a renal transplant. Ann Pathol 1996;16(1):45-8. (In French)].
16. Crowell A. Cystine nephrolithiasis. Surg Gynecol Obstet 1924;38:87–91.
17. Kuwahara M, Kambe K, Takahashi K, Orikasa S, Suzuki M. Intermittent irrigation system for dissolution of renal calculi monitored by computer. J Urol 1982;128(6):1379–81. https://doi.org/ 10.1016/s0022-5347(17)53512-0.
18. Angermeier K, Streem SB, Yost A. Simplified infusion method for 10% hemiacidrin irrigation of renal pelvis. Urology 1993;41(3):243–6. https://doi.org/10.1016/0090-4295(93)90566-s.
19. Dretler SP, Pfister RC, Newhouse JH. Renal-stone dissolution via percutaneous nephrostomy. N Engl J Med 1979;300(7):341–3. https://doi.org/10.1056/NEJM197902153000704.
20. Rodman JS, Reckler JM, Israel AR. Hemiacidrin irrigations to dissolve stone remnants after nephrolithotomy. Problems with solution flow. Urology 1981;18(2):127–30. https://doi.org/10.1016/0090-4295(81)90420-9.
21. Cato AR, Tulloch AG. Hypermagnesemia in a uremic patient during renal pelvis irrigation with renacidin. J Urol 1974;111(3):313-4. https://doi.org/10.1016/s0et022-5347(17)59955-3.
22. Collins S, Ortiz J, Maruffo F, Hruby GW, Pierorazio PM, Gupta M, et al. Expedited struvite-stone dissolution using a high-flow low-pressure irrigation system. J Endourol 2007;21(10):1153-8. https://doi.org/10.1089/end.2007.9916.
23. Bernardo NO, Smith AD. Chemolysis of urinary calculi. Urol Clin North Am 2000;27(2):355–65. https://doi.org/10.1016/s0094-0143(05)70264-0.
24. Aguado JM, Morales JM, Salto E, Lumbreras C, Lizasoain M, Diaz-Gonzales R. Encrusted pyelitis and cystitis by Corynebacterium urealyticum (CDC group D2): a new and threatening complication following renal transplant. Transplantation 1993;56(3):617-22. https://doi.org/10.1097/00007890-199309000-00023.
25. Мамаев И.Э., Ахмедов К.К., Доломанов К.А., Сайпулаев Г.Ш., Мануйлова О.О., Степаненко К.В., и др. Миниперкутанная нефролитотомия без катетеризации мочеточника. Сравнение со стандартной методикой. Экспериментальная и клиническая урология 2021;14(2):58-63. [Mamaev I.E., Akhmedov K.K., Dolomanov K.A., Saipulaev G.Sh., Manuilova O.O., Stepanenko K.V., et al. Minipercutaneous nephrolithotomy without ureter catheterization. Comparison with the standard methodology. Eksperimental’naya i klinicheskaya urologiya = Experimental and clinical urology 2021;14(2):58-63]. https://doi.org/10.29188/2222-8543-2021-14-2-58-63.







