Рак почки является одним из наиболее распространенных онкоурологических заболеваний. В структуре злокачественных новообразований у взрослого населения России рак почки (РП) составляет около 3% всех опухолей. Средний возраст пациентов при выявлении заболевания в России около 60 лет, при этом мужчины болеют в 1,5 раза чаще, чем женщины [1]. По данным Аполихина О.И. и соавт. в 2010 году злокачественные новообразования почки составляли 3,6% от всех злокачественных новообразований и занимали 10 ранговое место в структуре онкозаболеваемости среди обоих полов, среди мужского населения они составили 4,3% от всех злокачественных новообразований и заняли 9 ранговое место. Прирост заболеваемости за период 2005-2010 гг. составил +19,0% (+17,1% – у мужчин и +21,3% – у женщин) [2]. В США каждый год выявляется 30 000 новых случаев почечноклеточного рака, в Европейском союзе – 20 000 и ежегодный темп прироста равен 2-3%. Мужчины в возрасте 5070 лет вдвое чаще, чем женщины того же возраста, имеют рак почки. Увеличение частоты почечно-клеточного рака за последнее десятилетие произошло как вследствие ухудшения экологических факторов, так и за счет развития диагностической техники и улучшения диагностики опухоли [3].
Золотым стандартом лечения РП является радикальное оперативное лечение, однако в последние годы отмечается тенденция к расширению показаний к органосохраняющему лечения, что связано с увеличением частоты раннего выявления опухоли, когда размеры новообразования не превышают 35 см [4]. Ряд рандомизированных исследований последних лет показал, что резекция почки при РП имеет сопоставимые с нефрэктомией онкологические результаты, но при этом отмечены лучшие функциональные последствия [5]. Основными критериями оценки эффективности органосохраняющего лечения является частота местных рецидивов и отдаленная онкоспецифическая выживаемость. Одними из основных причин локального рецидива, частота которого по данным Schlichter H. et al. может достигать 17,2%, являются нерадикальность выполненной резекции почки и мультифокальный рост опухоли [6]. Экспресс-биопсия, выполненная в процессе органосохраняющего лечения РП, не может служить точным методом оценки хирургического края. Это связано с тем, что при ее выполнении отсутствует возможность четко визуализировать опухоль в крае резекции и местах, где производится биопсия, т.е. биопсия из различных участков области резекции берется случайным методом. Следовательно, разработка методики, позволяющей лучше визуализировать подозрительные на опухоль участки с последующей биопсией из таких зон, является актуальной задачей на современном этапе. К таким методам может быть отнесена флуоресцентная диагностика (ФД), которая в настоящее время применяется при опухолях различной локализации. В урологии метод флуоресцентной диагностики широко используется для увеличения радикальности трансуретральной резекции мочевого пузыря при раке мочевого пузыря и контроля рецидивирования после проведенного лечения, позволяя осуществлять прицельную биопсию очагов с патологической флуоресценцией. При этом чувствительность и специфичность диагностики нормальных и патологических тканей, по данным Sieron А. et al., равны 96% и 65% соответственно [7]. Установлена высокая диагностическая ценность метода ФД в работе Каллаева К.К. для интраоперационного контроля радикальности открытых и лапароскопических оперативных вмешательствах при раке предстательной железы [8].
В мировой литературе представлены только единичные работы, в которых проводилось изучение возможностей ФД при РП. При этом исследования, как правило, носили пилотный характер и включали крайне ограниченные когорты пациентов. Кроме того, в них отсутствуют четкие рекомендации о применении метода. Hoda MR., Popken G.
проанализировали результаты применения фотосенсибилизатора 5-ALA для определения характера хирургического края при лапароскопической парциальной нефрэктомии. При этом чувствительность метода составила 95%, специфичность – 94% и точность диагностики равнялась 98%. Авторы пришли к выводу, что ФД является надежным инструментом для оценки типа опухоли и статуса хирургического края во время лапароскопической органосохраняющей хирургии [9]. В отечественной литературе имеются отдельные публикации, в которых описан опыт ФД рака почки на базе ФГБУ «НИИ урологии» [10]. Таким образом, вышеуказанные обстоятельства обусловили актуальность настоящего исследования.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включены данные 56 больных РП, которым были проведены следующие операции: 20 (35,7%) больным выполнена открытая резекция почки, 36 (64,2%) – лапароскопическая резекция почки. Средний возраст больных составил 52,2 (28–74) года. В изучаемой группе пациентов было 33 мужчин (58,9%) и 23 женщин (41,07%). У 27 (48,2%) пациентов опухоль была локализована в левой почке, у 25 (44,6%) пациентов – в правой почке, двухстороннее поражение – у 4 (7,1%) пациентов. Размер опухоли составлял в среднем 3,2 (1,5-4,5) см. Больные в зависимости от стадии зараспределились следующим образом: рT1а – 52 (92,8%), pT1b – 2(3,5%), рТ2а – 2(3,5%) (табл. 1). Все оперативные вмешательства выполнялись в условиях тепловой ишемии 15,6 (10-3) мин.
В качестве фотосенсибилизатора был использован отечественный препарат Аласенс – 5-аминолевулиновая кислота, которая является предшественником протопорфирина IX в организме человека. Механизм ее действия основан на способности опухолевых клеток к повышенному накоплению в присутствии экзогенной 5-аминолевулиновой кислоты фотоактивного протопорфирина IX, наличие которого можно определить по специфической флуоресценции, вызываемой специальными источниками излучения. Протопорфирин IX накапливается и сохраняется в значительном количестве в опухоли в течение нескольких часов, в то время как в нормальных клетках он быстро превращается в фотонеактивный гем под действием феррохелатазы. Результатом этого служит высокий флуоресцентный контраст опухоли относительно окружающей ткани, достигающий 10-15-кратной величины для различных опухолей.
Препарат Аласенс назначали перрально (1,5 г разводили в 100 мл питьевой негазированной воды) за 4 часа до операции. Для возбуждения флуоресценции применяли специальное оборудование Karl Storz системы D-Light C. Спектроскопическое исследование флуоресценции проводили с использованием лазерной электронно-спектральной установки ЛЭСА-01-БИОСПЕК. Для возбуждения флуоресценции применяли гелий-неоновый лазер с длиной волны 630,8 нм и мощностью 25 мВт.
При резекции почки оценивалась зона хирургического края для выполнения наиболее радикального вмешательства, при флуоресцентном контроле регистрировалось наличие или отсутствие зон патологического свечения на резецированной поверхности. Анализ полученных спектров проводили с помощью компьютерной программы LESA-Soft 9.
Оценивали следующие показатели флуоресценции:
- обычное свечение (аутофлуоресценция) нормальной ткани почки без приема фотосенсибилизатора;
- фоновую флуоресценцию здоровых тканей почки с введением фотосенсибилизатора;
- флуоресценция опухоли почки без приема фотосенсибилизатора;
- флуоресценция опухолевой ткани с введением фотосенсебилизатора;
- интенсивность флуоресценции опухоли;
- индекс контрастности флуоресценции в ткани опухоли, равный отношению интенсивности флуоресценции в ткани опухоли к интенсивности флуоресценции непораженной ткани;
- динамика прироста флуоресценции в ткани опухоли.
На рис. 1 представлены спектры флуоресценции нормальной и опухолевой ткани почки. Видно, что линия нормальной ткани почки фиолетового, синего цветов, линии зеленого и красного цвета соответственно отражают интенсивность непосредственно самой опухоли (аутофлуоресценция и с введением сенсибилизатора), которая значительно выше, чем в интактной ткани почки.

Рис. 1. График полученных спектров. Фиолетовая и синяя линии на графике – нормальная ткань почки. Красная и зеленая линии – опухолевая ткань почки
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При выполнении резекции почек при ФД были получены изображения почек в белом и синем цвете. На рис. 2 представлено изображение почки в белом (нативном) свете, на рис. 3 – в синем свете. Видно, что при флуоресцентной диагностике отчетливо визуализируется ткань почки с участком ярко-красного свечения, четко видны локализация, размер и границы опухолевой ткани.
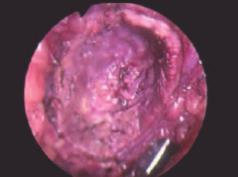
Рис. 2. Хирургический край при резекции почки без флуоресценции

Рис. 3. Хирургический край при резекции почки при флюоресценции
Таблица 1. Общая характеристика больных
| Вид операции | Открытая резекция почки | Лапароскопическая резекция почки |
|
|---|---|---|---|
| 20(35,7%) | 36(64,2%) | ||
| Пол | Мужчины | Женщины | |
| 33(58,9%) | 23(41,07%) | ||
| Стадия заболевания | pT1a | pT1b | pT2a |
| 52(92,8%) | 2(3,5%) | 2(3,%) | |
| Локализация опухоли |
Правая почка | Двухсторонний процесс | Левая почка |
| 25(44,6%) | 4(7,1%) | 27(48,2%) | |
У 47 пациентов (83,9%) не было обнаружено положительной флуоресценции хирургического края резекции, что было потверждено при гистологическом исследовании. У 9 (16%) пациентов (у 4 пациентов – открытая резекция почки, 5 – лапароскопическая резекция почки) ФД продемонстрировала позитивную флуоресценцию хирургического края, у 7 (12,5%) из них результат был подтвержден морфологически, выявлен почечно-клеточный рак, негативная контрольная флуоресценция хирургического края, подтвержденная гистологически. У двух пациентов после лапароскопической резекции почки имело место ложноположительная флуоресценция, гистологическое заключение – ангиомиолипома, негативная контрольная флуоресценция хирургического края подтверждена гистологически.
Чувствительность метода ФД в общей группе составила 78%, специфичность – 84% (табл. 2).
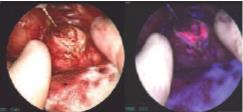
Рис. 4. Удаленная опухолевая ткань почки без флуоресценции, и с флуоресценцией
После удаления опухолевой ткани выполнялась оценка флуоресценции этой ткани. На рис. 4 представлена фотография опухоли после резекции почки в нативном свете и с флуоресценцией, на которой четко видна граница между опухолью и нормальной тканью. Опухолевая ткань приобретает розовый цвет, а нормальная ткань – синий.
Таблица 2. Результаты ФДД в зависимости от вида операции
| Общая группа N 56 |
Открытая резекция почки N 20 |
Лапароскопическая резекция почки N – 36 |
|
|---|---|---|---|
| Флюоресценция хирургического края |
9(16%) | 4(7,1%) | 5(8,9%) |
| Без флюоресценции | 47(83,9%) | 14(25%) | 33(59%) |
| Ложно положительный |
2(3,5%) | 0(0%) | 2(3,5%) |
| Ложно отрицательный |
1(1,8%) | 1(1,8%) | 0(0%) |
| Чувствительность | 78% | 100% | 60% |
| Специфичность | 84% | 70% | 89% |
ЗАКЛЮЧЕНИЕ
Полученные нами предварительные результаты свидетельствуют о том, что препарат Аласенс в значительно большей степени накапливается в опухолевой ткани по сравнению с нормальной почечной паренхимой, и интенсивность флуоресценции в опухолевой ткани существенно выше. Полученные результаты позволяют сделать вывод о высокой эффективности метода флуоресцентной диагностики в оценке радикальности оперативного вмешательства при органосохраняющем лечении почечно-клеточного рака. Это позволяет снизить риск местного рецидива заболевания и, следовательно, повысить продолжительность безрецидивного течения заболевания.
Окончательные выводы будут сделаны по мере накопления большего клинического материала и изучения отдаленных результатов оперативного лечения.
ЛИТЕРАТУРА
1. Злокачественные новообразования в России в 2010 году (заболеваемость и смертность). [Под ред. Чиссова В.И., Старинского В.В., Петровой Г.В.]. М.: ФГУ «МНИОИ им. П.А. Герцена Росмедтехнологий», 2011. 260 с.
2. Аполихин О.И., Чернышев И.В., Сивков А.В., Алтунин Д.В., Мельник К.К., Комарова В.А. Эффективность фотосенсибилизатора Аласенс для оценки радикальности операции по поводу рака почки. //Экспериментальная и клиническая урология. 2012. №2. С.58 – 60.
3. Murphy WM, Grignon DJ, Perlman EJ. Atlas of Tumour Pathology, 4-rd Ser., Fasc.l-Washington: Armed Forces Institute of Pathology. 2004. P. 124-137.
4. Dawson P, Peters AM. Dynamic contrast bolus computed tomography for the assessment of renal function. // Invest Radiol. 1993. Vol. 28. N 1 P. 10391042.
5. Rini BI, Campbell SC, Escudier B. Renal cell carcinoma. //Lancet. 2009. Vol. 28, N 373. P. 1119-1132.
6. Schlichter A, Wunderlich H, Junker K, Kosmehl H, Zermann DH, Schubert J. // Where are the limits of elective nephronsparing surgery in renal cell carcinoma? // Eur Urol. 2000. Vol. 37, N 5. P.517-520.
7. Sieron A, Szygula M, Wojciechowski B. Photodynamic vs. autofluorescent diagnosis of urinary bladde using Xillix LIFE system. // 9th World congress of the international photodynamic association. 2003. P.15-75.
8. Каллаев К.К. Интраоперационный фотодинамический контроль радикальности простатэктомии: Дисс. … канд. мед. наук. М., 2012. 148 с.
9. Hoda MR, Popken G. Surgical Outcomes of Fluorescence-Guided Laparoscopic Partial Nephrectomy Using 5-Aminolevulinic Acid-Induced Protoporphyrin IX. //J Surg Res. 2009. Vol.154, N.2. P. 220-225.
10. Чернышев И.В., Алтунин Д.В., Самсонов Ю.В., Каллаев К.К.. Новые возможности фотодинамической диагностики и лечения рака предстательной железы и почки. // Экспериментальная и клиническая урология. 2011. №2-3. С. 9294.







