Брахитерапия является высокотехнологичным и малоинвазивным методом лечения рака предстательной железы (РПЖ), входит в стандарты лечения и демонстрирует высокую эффективность, особенно на ранних стадиях заболевания. [1, 2]. Метод основан на перманентном размещении закрытых микроисточников 125I в ткани предстательной железы, а особенности излучения данного изотопа и современные способы расчета дозиметрических параметров позволяют подвести к органу-мишени летальную дозу, практически не повреждая близлежащие структуры: мочеиспускательный канал, прямую кишку, мочевой пузырь. [3]
Большое количество исследований, посвященных брахитерапии, говоо приемлемом профиле осложнений, что и обеспечило широкое признание метода [4]. Брахитерапия демонстрирует сопоставимые результаты по отношению к другим радикальным методам лечения (радикальная простатэктомия, дистанционная лучевая терапия) при условии правильного отбора пациентов, с точным морфологическим и клиническим стадированием РПЖ, учетом уровня сывороточного простат-специфического антигена (ПСА), а также размеров предстательной железы и степени выраженности инфравезикальной обструкции [5].
Совершенствование планирующих систем, а также улучшение ультразвуковой визуализации позволяли постепенно повышать дозу излучения, что явилось существенным фактором, определившим успех применения данного метода в лечении РПЖ [6].
Контроль эффективности брахитерапии зачастую производят только на основании послеоперационного контроля уровня ПСА по внутреннему протоколу конкретного медицинского учреждения, а объективная послеоперационная оценка качества имплантации не осуществляется. Это компенсируют эскалацией дозы при интраоперационном планировании, повышая риск лучевых осложнений. В то же время существует простой и доступный инструмент контроля качества – постимплантационный дозиметрический анализ (ПДА), основанная на данных послеоперационной компьютерной томографии (КТ), трансректального ультразвукового исследования (ТРУЗИ) или магнитно-резонансной томографии (МРТ). Проведение данной процедуры рекомендовано Американским Обществом Брахитерапевтов. Сопоставление результатов ПДА с показателями биохимической безрецидивной выживаемости (бБРВ) подвергло сомнению общепринятый постулат о зависимости эффективности лечения от дозы радиации. Увеличение дозы, влекущее за собой повышение частоты осложнений, вовсе не гарантирует лучшие результаты безрецидивной выживаемости [7, 8]. Причиной этому может быть целый комплекс факторов, однако ни один из них не является достаточно очевидным, чтобы объяснить возникшее противоречие в оценке связи бБРВ с полученной дозой облучения [9].
Исходя из вышесказанного представляется актуальной проблема комплексного изучения прогностических факторов для определения ожидаемой безрецидивной выживаемости больных локализованным РПЖ после проведения низкодозной брахитерапии на основе оценки показателей стандартного обследования больного до операции и критериев контроля качества лечения. Это позволит оптимизировать методику лечения и послеоперационного наблюдения пациентов.
МАТЕРИАЛЫ И МЕТОДЫ
В клинике ФГБУ «НИИ урологии» Минздрава России в период с 2000 по 2013 гг. брахитерапия с использованием радиоактивных источников 125I выполнена 281 мужчине с РПЖ в стадии T1T3a. Доза облучения варьировала от 120 до 160 Грей. В исследование включены 117 пациентов, соответствующих следующим критериям: стадия РПЖ T1-T2c, низкий или промежуточный риск прогрессирования заболевания по критериям D`Amico, срок наблюдения 5 и более лет.
Все пациенты прошли ПДА для оценки очаговой дозы. Анализ осуществляли на основании данных КТ, выполненной на 30-е сутки после имплантации. По результатам ПДА пациенты были разделены на 2 группы: в I группе (n=59) показатель D90 (доза, которую получает 90% объема предстательной железы) был равен или превышал 140 Грей, а в группе II (n=58) – был менее 140 Грей.
В зависимости от стадии РПЖ и степени дифференцировки опухоли по Глисону группы пациентов, включенных в исследование, были статистически симметричны (табл. 1). Средний объем предстательной железы по данным трансректального ультразвукового исследования перед имплантацией составил в I группе 34,1±4,1 (15-68) см3, а во II – 33,5±4,7 (13-61) см3. Средний уровень ПСА до начала лечения в I-ой группе был равен 7,3±2,6 (4,713,6) нг/мл, и во II – 7,9±2,4 (5,1-15,7) нг/мл. Урофлоуметрия была проведена всем пациентам, при этом средняя максимальная скорость мочеиспускания мочи (Qmax) составила у больных I группы 16,6±1,7 мл/сек и во II – 16,1±1,5 мл/сек. По всем вышеуказанным клиническим параметрам достоверных статистических различий между группами получено не было (p>0,05).
В качестве основного критерия оценки отдаленных результатов лечения принимали бБРВ, которую определяли для каждого пациента от даты констатации полной ремиссии до даты рецидива или даты последней явки больного, если рецидив не выявлен. Биохимический рецидив констатировали по критериям ASTRO. Оценка концентрации ПСА в сыворотке крови осуществляли через 3, 6, 12, 18 и 24 месяцев после брахитерапии и далее – каждый год жизни.
Таблица 1. Характеристика пациентов по исходным параметрам
| Показатель | I группа | II группа | p | |
|---|---|---|---|---|
| T1 N0 M0 | 6 (10,2%) | 7 (12,1%) | p>0,05 | |
| T2a-c No M0 | 53 (89,8%) | 51 (87,9%) | ||
| Показатель Глисона |
≤4 | 13 (22,0%) | 15 (25,9%) | |
| 5-6 | 38 (64,4%) | 38 (65,5%) | ||
| 7 | 8 (13,6%) | 5 (8,6%) | ||
Таблица 2. Безрецидивная выживаемость в зависимости от дозы облучения и уровня исходного ПСА
| I группа | II группа | p | |
|---|---|---|---|
| PSA ≤ 10 нг/мл | 94,7% | 86,2% | p>0,05 |
| 10 < PSA < 20 нг/мл | 81,6% | 72,4% | p<0,05 |
| p (внутри группы) | p<0,01 | p<0,05 |
РЕЗУЛЬТАТЫ
Общая 5-летняя бБРВ для обеих групп составила 83,8%, что сопоставимо с аналогичными результатами лучших мировых центров, работающих в области брахитерапии РПЖ [10]. Результаты сравнимы с другими радикальными методами, в том числе приближаются к показателям радикальной простатэктомии, описанными для групп с низким и промежуточным риском [11].
Средняя D90 по результатам ПДА в I группе составила 167,4 Гр, а во II – 134,4. Различия между группами – статистически достоверны. Одновременно, 5-летняя безрецидивная выживаемость после брахитерапии в группе больных, получивших D90 >140 Гр, была достоверно (р< 0,05) выше, чем в группе больных с дозой облучения < 140 Гр и составила 90,2% и 77,6% соответственно (рис. 1).
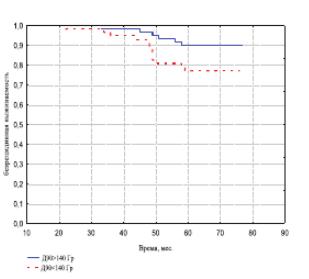
Рис. 1. Безрецидивная выживаемость больных РПЖ в зависимости от D90
Одним из наиболее значимых критериев оценки эффективности противоопухолевой терапии РПЖ, прогноза течения заболевания и доклинического выявления рецидивов является уровень ПСА. В нашем исследовании, как и ожидалось, 5-летняя бБРВ в обеих группах оказалась выше у больных с уровнем ПСА менее 10 нг/мл (табл. 2).
Стадия заболевания и показатель Глисона также оказали существенное влияние на отдаленные результаты лечения. Так, и в I и во II группах при стадии T1 бБРВ оказалась выше, чем при стадии T2 (рис. 2-3). Показатель 5летней бБРВ выживаемости в I группе составил при стадии Т1 96,4%, а при стадии Т2 – 82,9% (р< 0,01). Во II группе 85,2% и 71,9% соответственно. Различия показателей между стадиями Т1 и Т2 в обеих группах имеют статистически значимое отличие (р< 0,05).
При анализе влияния степени дифференцировки опухоли на бБРВ в настоящем исследовании удалось продемонстрировать высокую 5-летнюю безрецидивную выживаемость пациентов и с высокои с умереннодифференцированными опухолями. Так, у пациентов с показателем Глисона менее 5 баллов, 5-летняя бБРВ достигла 96,2%, а при показателе Глисона 5-6 баллов – 90,9%. Эти различия оказались статистически недостоверны (р>0,05). При этом была обнаружена достоверная разница в бБРВ (р< 0,05) у больных с умеренно дифференцированной карциномой и показателем Глисона 7 (81,8%) по сравнению с пациентами, имеющими 5-6 баллов по Глисону и меньше.
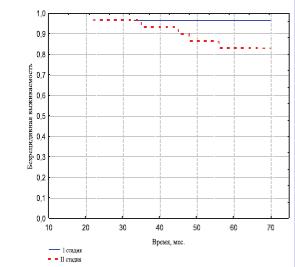
Рис. 2. Безрецидивная выживаемость больных I группы в зависимости от стадии РПЖ
Оценка осложнений лучевого лечения у 117 пациентов показала (табл. 3), что в раннем периоде к наиболее значимым симптомам со стороны нижних мочевых путей относится дизурия, которая в I группе отмечена у 34 (58,6%) больных, а во II – у 25 (42,4%) / При этом выявлены статистически значимые различия между группами (р<0,05).
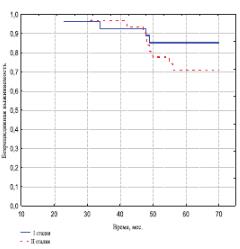
Рис. 3. Безрецидивная выживаемость больных II группы в зависимости от стадии РПЖ
ДИСКУССИЯ
В последние годы ведется оживленная дискуссия о наличии или отсутствии прямой зависимости бБРВ от фактической локальной дозы излучения. Причиной этому может стать любой из множества факторов, о которых мы упоминали ранее [9]. Для исключения влияния этих факторов мы постарались собрать максимально однородные по своему составу группы пациентов, прооперированных в одном центре одними и теми же специалистами, применив единое определение «биохимического рецидива» и различающихся, по сути, только величиной дозы. Как показывают зарубежные публикации из центров с большим количеством операций и отработанной методикой, D90 там не варьирует в широких пределах, что также затрудняет оценку влияния этого параметра на бБРВ. В нашем случае, включение в анализ данных за длительный срок позволило оценить результаты как ранних клинических случаев, когда методика только внедрялась, так и пациентов прооперированных относительно недавно и с хорошими показателями дозиметрии. При условии симметричности групп по исходным параметрам, данные ПДА значительно отличались, что и позволило доказать несомненное влияние показателя D90 на эффективность манипуляции. Одновременно считаем необходимым подчеркнуть важнейшую роль тщательного стадирования и правильного отбора больных, непосредственно влияющих на отдаленные результаты брахитерапии рака предстательной железы.
Таблица 3. Частота осложнений после брахитерапии
| Осложнение | Частота осложнений | p | |||
|---|---|---|---|---|---|
| 1 группа (D90 >140 Гр) | 2 группа (D90 < 140 Гр) | ||||
| абс. | % | абс. | % | ||
| Дизурия | 34 | 58,6 | 25 | 42,4 | р<0,05 |
| Гематурия | 3 | 5,2 | 2 | 3,4 | р<0,05 |
| Проктит | 7 | 12,1 | 4 | 6,8 | р<0,05 |
| Уретрит | 8 | 13,8 | 5 | 8,5 | р<0,05 |
| Простатит | 23 | 39,6 | 19 | 32,2 | р<0,05 |
| ОЗМ | 7 | 12,1 | 6 | 10,2 | р<0,05 |
ВЫВОДЫ
При прогнозировании послеоперационного течения заболевания необходимо учитывать не только исходные данные, отражающие стадию, дифференцировку опухоли, ее объем и степень инфравезикальной обструкции, но и важнейший параметр, характеризующий качество выполненной импланта(значительно специалиста к специалисту). Проведенное исследование показало достоверную зависимость 5-летних результатов бБРВ от D90 более и менее 140Гр в статистически больных локализованным РПЖ. Фактически полученная доза является значимым предиктором результата лечения. При этом, такие факторы, как исходный ПСА, индекс Глисона и стадия заболевания также имеют большое прогностическое позволяет не только прогнозировать онкологические результаты лечения, но является важным инструментом контроля качества работы операционной бригады и повышения ее квалификации путем анализа собственных ошибок.
ЛИТЕРАТУРА
1. Peinemann F, Grouven U, Bartel C, Sauerland S, Borchers H, Pinkawa M, Heidenreich A, Lange S. Permanent interstitial low-dose-rate brachytherapy for patients with localised prostate cancer: a systematic review of randomised and nonrandomised controlled clinical trials. // Eur Urol. 2011.Vol. 60, № 5. P. 881-93
2. Taira A.V., Merrick G.S., Galbreath R.W. Natural history of clinically staged lowand intermediate-risk prostate cancer treated with monotherapeutic permanent interstitial brachytherapy // Int J Radiat Oncol Biol Phys. 2010. Vol. 76. № 2. P. 349-354.
3. Панарина Н.Т., Свиридов П.В., Володина Т.В. Технология брахитерапии рака предстательной железы микроисточниками 125I // Мед. физика. 2006. № 4. С. 24-29.
4. Аполихин О.И., Катибов М.И., Осипов О.В. Качество жизни больных раком простаты после оперативного лечения // Медицинский совет. 2011. № 7-8. С. 86-88.
5. Kollmeier MA., Stock RG., Stone N. Biochemical outcomes after prostate brachytherapy with 5-year minimal follow-up: importance of patient selection and implant quality // Int J Radiat Oncol Biol Phys. 2003. Vol. 57. P. 645-653.
6. Stock RG., Stone NN., Cesaretti JA. Biologically effective dose values for prostate brachytherapy: effects on PSA failure and posttreatment biopsy results // Int J Radiat Oncol Biol Phys. 2006. Vol. 64. № 2. P. 527-533.
7. Gastaldi E., Chiono L., Gallo F. Dosimetry doesn't seem to predict the control of organ-confined prostate cancer aer I-125 brachytherapy. Evaluation in 150 patients // Arch Ital Urol Androl. 2009. Vol. 81. № 4. P. 215-217.
8. Wakil G., Gobaux V., Hajage D. Can intermediate-risk patients be safely treated with permanent implant prostate brachytherapy : long-term results of the first 1044 patients of the Paris Institut Curie // Brachytherapy. 2011. Vol. 10. P. 54.
9. Сивков А.В., Ощепков В.Н., Рощин Д.А., Корякин А.В.. Постимплантационная дозиметрия и зависимость доза-реакция при брахитерапии рака предстательной железы: все давно известно? // Экспериментальная и клиническая урология. 2013. №1. C.75-80
10. Hinnen KA, Battermann JJ, van Roermund JG, Moerland MA, Jürgenliemk-Schulz IM, Frank SJ, van Vulpen M. Long-term biochemical and survival outcome of 921 patients treated with I-125 permanent prostate brachytherapy. // Int J Radiat Oncol Biol Phys. 2010 Vol. 76, № 5. P. 1433-1438
11. Han M, Partin AW, Zahurak M, Piantadosi S, Epstein JI, Walsh PC. Biochemical (prostate specific antigen) recurrence probability following radical prostatectomy for clinically localized prostate cancer. // J Urol. 2003 Vol. 169, № 2. P. 517-523.







