ВВЕДЕНИЕ
В настоящее время выявление случаев мочекаменной болезни каждый год неуклонно увеличивается на 5-20%. Это связано с тем, что возможности диагностики постоянно расширяются. Тем самым на главное место выход вопрос метафилактики [1]. Как известно, в развитии нефролитиаза большое значение имеют эндокринные изменения в организме, приводящие к метаболическим расстройствам, что ведет к структурным и функциональным изменениям почек [2].
Помимо активного развития методов диагностики в последние несколько десятилетий большой прорыв произошел в методах лечения мочекаменной болезни. В хирургическом направлении заметен явный перевес в сторону применения видео-эндоскопических методов лечения. Данные технологии предполагают достижение условий минимальной инвазивности. К этим технологиям относятся перкутанная нефролитотрипсия (ПНЛ) и ретроградная интраренальная хирургия (РИРХ) [3]. В свою очередь данные методики приводят к низкому уровню осложнений, что особенно необходимо при лечении камней единственной почки. По всем данным ПНЛ является «золотым стандартом» лечения крупных и коралловидных камней почек с однозначно высоким уровнем эффективности. Цель ПНЛ – полное удаление камней полостной системы почки с минимальными осложнениями. В течение последних 20 лет технология чрескожных оперативных вмешательств активно развивалась в направлении миниатюризации инструментов и оптики, а также безопасности и эффективности методов дезинтеграции твердых тел. Все это в первую очередь привело к совершенствованию техники перкутанного доступа на основе разработок компьютерных программ предоперационной визуализации, что послужило основой для прогнозирования успешности операции и остается первостепенным интересом многих урологов до сих пор [4]. С течением времени доступность компьютерной визуализации обеспечила широкое внедрение технологии для детальной оценки топографии, скелетотопии, анатомии полостной системы почек, особенностей строения и ангиоархитектоники. Также было установлено, что такой параметр, как объем конкрементов является предиктором эффективности и связан с возможностью одномоментного их удаления при перкутанной нефролитотрипсии [5].
Несмотря на использование методов виртуальной реконструкции определение объема камня при крупных и коралловидных камнях имеет определенные трудности и требует применения специализированных программ [6]. На сегодняшний день существует ряд систем оценки морфометрии при калькулезном поражении почек перед планированием хирургического вмешательства. Данные методики используются для прогнозирования осложнений и успешности оперативного пособия. Наиболее известные среди них GSS, STONE и CROES, которые зарекомендовали себя простотой и результативностью [7].
Оценка биометрии собирательной системы почек и детальное исследование ее особенностей имеет огромное значение в планировании хирургической операции [8].
Цель исследования – улучшение эффективности и безопасности перкутанных вмешательств при использовании метода биометрического планирования.
МАТЕРИАЛЫ И МЕТОДЫ
В наше проспективное исследование включено 120 пациентов (48 мужчин и 72 женщины), которым в период с 2019 по 2021 гг. выполнены перкутанные вмешательства по поводу нефролитиаза.
Предоперационное обследование пациентов включало лабораторные, рентгенологические, функциональные методы исследования. В обязательном порядке также проводилась мультиспиральная компьютерная томография (МСКТ) с 3D реконструкцией и оценкой биометрических характеристик анатомических структур. Исследование проводилось в нативную фазу, а также после введения контрастного вещества. В нативной фазе изучалось расположение камней в полостной системе почек, а также размеры и плотность камней. В артериальную и венозную фазу оценивали толщину коркового слоя, артериальное и венозное кровоснабжение почки, размеры и положение почек. В выделительную фазу определяли размеры чашечек и лоханки, морфотип нижней группы чашечек (Brodel или Hodson), размер задненижней чашечки и ее шейки, фенотип строения по Sempaio FJB, шеечнофронтальный и сагиттальный углы. Далее технология получения виртуальной 3D модели состояла из следующих этапов:
1) загрузка данных томографии в формат DICOM;
2) сегментация паренхиматозных органов, их вен и артерий;
3) получение объемной полигональной 3D модели.
В результате дальнейших ручных и автоматических манипуляций формировали модель органа, как интегральное отображение всех фаз исследования, что позволило нам в каждом случае произвести пробную виртуальную операцию. Манипулируя изображением, на основе объемной модели (рис. 1A, 1B, 1C, 1D, 2А, 2В), мы просчитали варианты доступа, манипуляции инструментов, необходимость формирования дополнительных каналов, что определило план операции и интраоперационную тактику с учетом вероятных осложнений.
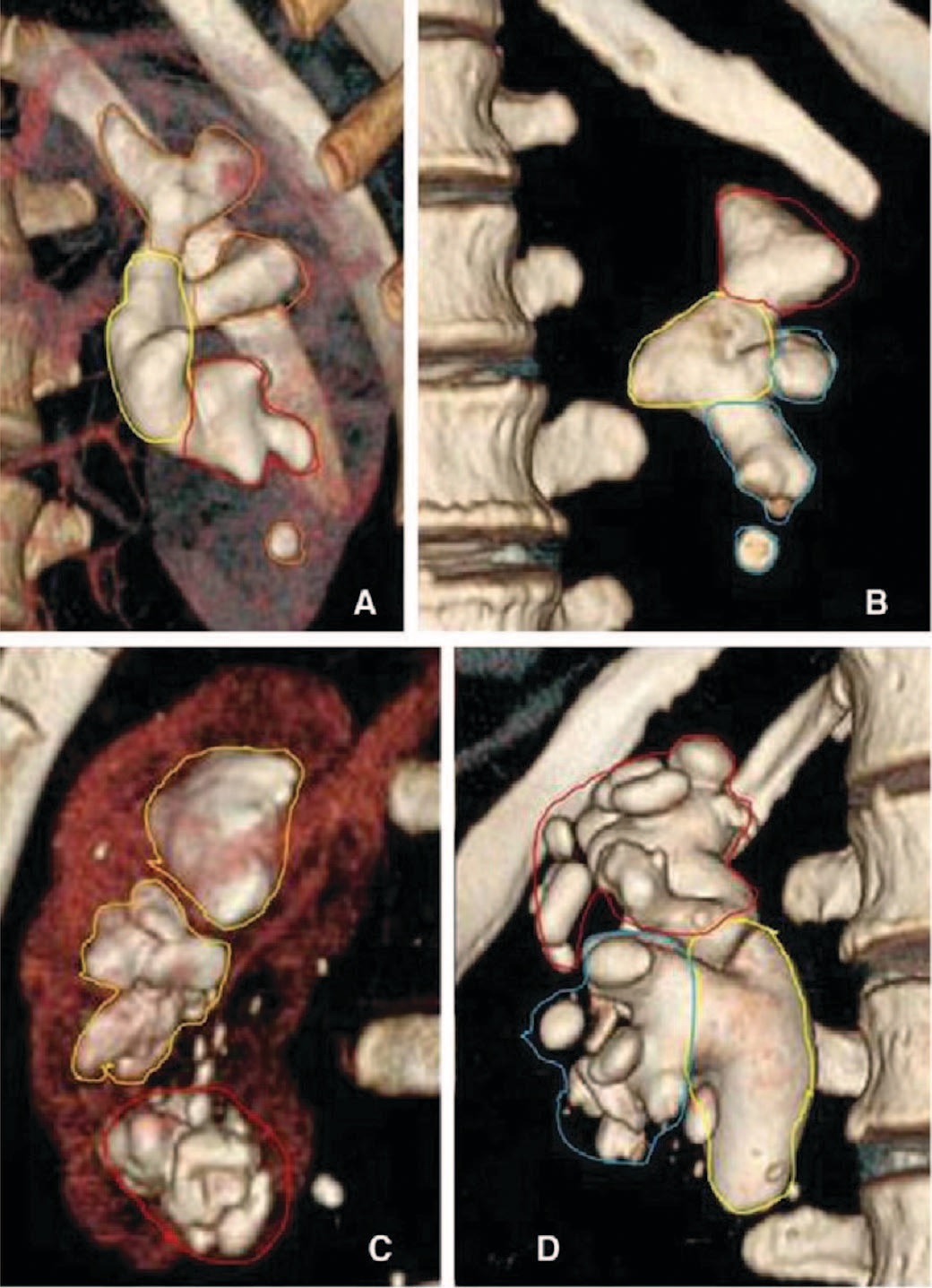
Рис. 1А-D. Построение 3D моделей почки конкрементом и камня с помощью программы 3D-DOCTORTM (Able Software Corp., Lexington, MA)
Fig. 1А-D. 3D models of kidney with stone and stone using 3D-DOCTORTM (Able Software Corp., Lexington, MA)
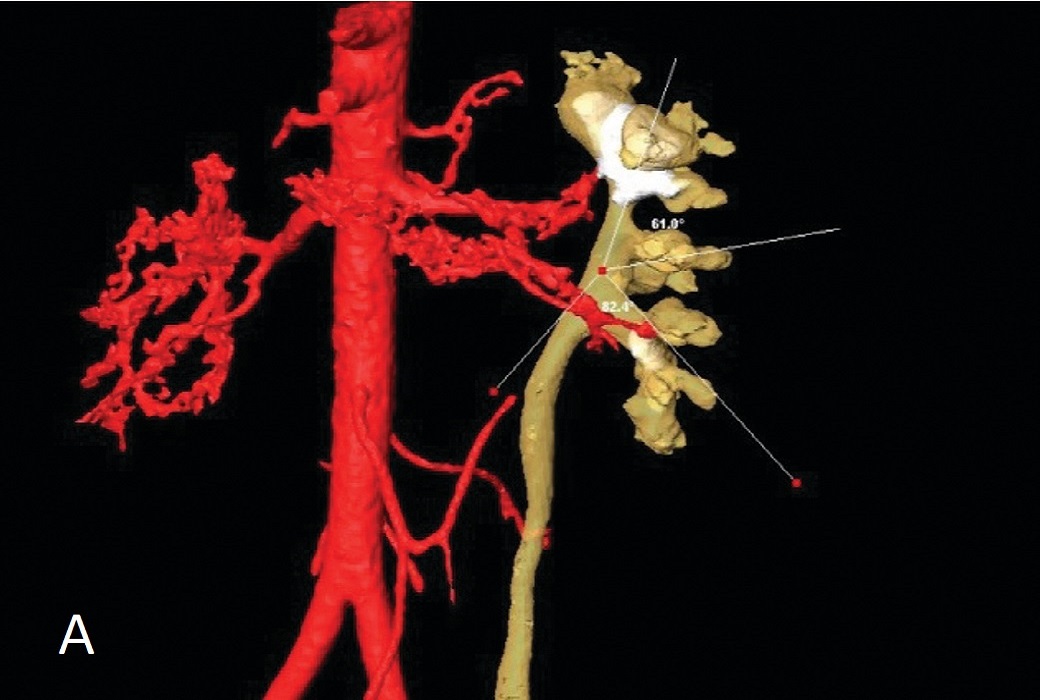
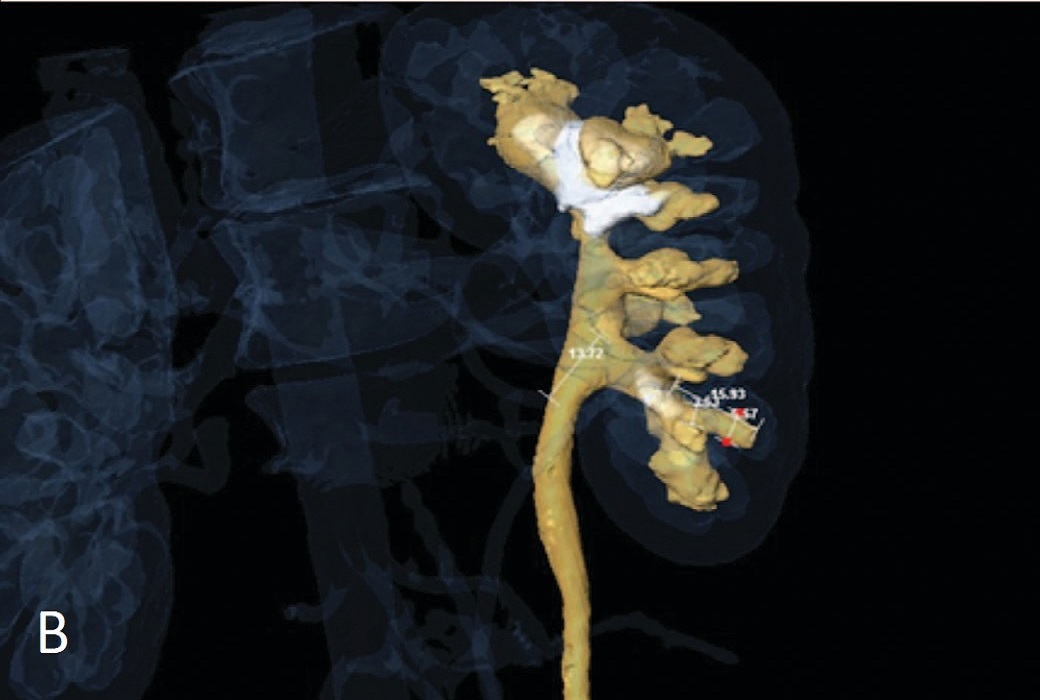
Рис. 2А-В. Изображения 3D модели камней и почки с помощью программ Amira 3D Analysis Software (Konrad-Zuse-Zentrum Berlin) и расчет морфометрических показателей
Fig. 2А-В. Images of 3D models of stones and kidneys using Amira 3D Analysis Software (Konrad-Zuse-Zentrum Berlin) and calculation of morphometric parameters
РЕЗУЛЬТАТЫ
Единичные камни почек был определены у 45 пациентов, несколько камней в полостной системе почек выявлено у 24 пациентов, а коралловидные – у 51 больного. Положительный результат посева мочи был отмечен в 64 случаях. Время рентгенологического скрининга в среднем составило 20,5 мин (7-34 мин). Средняя продолжительность оперативного вмешательства составила 110 мин (65-240 мин).
Осложнения после операции были оценены с учетом классификации Clavien-Dindo. Больше было осложнений легкой 1-2 степени и единичные осложнения 4 степени (табл. 1). Индекс массы тела, а также перенесенные до этого операции не влияли на результативность и продолжительность операции.
Таблица 1. Осложнения после ПНЛ
Table 1. Complications after PNL
| Степень осложнений по классификации Clavien-Dindo Complications grade on the skabe Clavien-Dindo |
n (%) | Осложнения Complications |
|---|---|---|
| Степень I Grade I |
5 (4,2%) | Макрогематурия, временная азотемия, дислокация нефростомической трубки Hematuria, temporary serum creatinine level increasing, nephrostomic tube displacement |
| Степень II Grade 2 |
6 (5%) | Инфекция мочевых путей, снижение гемоглобина Urinary tract infection, anemia |
| Степень IIIa Grade IIIa |
4 (3,3%) | Миграция дренажей, пиелокаликэктазия на фоне камня мочеточника после операции, кровотечение из артериовенозной фистулы Drainages migration, pyelocalicoectasy due to the ureteral stone after the surgery, bleeding from the arteriovenal fistula |
| Степень lllb Grade lllb |
3 (2,5%) | Кровотечение после удаления нефростомы, развитие пиелонефрита на фоне резидуального камня мочеточника Bleeding after the nephrostomic tube removal, pyelonephritis due to the ureter obstruction by stone |
| Степень IVa Grade lVa |
2 (1,7%) | Сепсис, развитие острого почечного повреждения почек Sepsic, acute renal damage |
| Степень lVb Grade lVb |
1 (0,8%) | Сепсис, полиорганная недостаточность Sepsis, multiple organ failure |
| ВСЕГО: | 21 (17,5%) | — |
Эффективность оперативного пособия с полным очищением от камней достигло уровня 78%.
В нашей работе мы использовали методику предоперационного планирования с целью улучшения результатов вмешательства. Благодаря проведенным морфометрическим исследованиям у нас появилась возможность оценить все технические аспекты предстоящей операции, располагая детальными знаниями о строении собирательной системы, фенотипе чашечек, стереометрии, а также возможностями расчета длины пункционного хода, объема калькулезного поражения, углов отхождения чашечек.
Топографо-анатомические исследования определили количественное разнообразие чашечек почек, в среднем 8 (от 5 до 14). При этом, в отличие от других средняя группа характерна тем, что в нее впадают только простые чашечки, чаще расположенные попарно [9].
Расположение, чаще одиночной, верхней чашечки имеет медиальное направление с незначительным отклонением по переднезадней оси. При этом пункционный ход через форникс верхней чашечки равен или превышает 135° относительно оси ее шейки [10]. Однако осуществление доступа к верхнему полюсу почки связано с риском торакальных осложнений. Так при супракостальном доступе выше 11 ребра повреждение легких составляет 29% справа и 14% – слева. А при проведении пункционного тракта выше 10 ребра риск травмы достигает 50% [11]. С целью нивелирования рисков нередко используется принудительная экспирация.
Известно, что чашечки средней и нижней группы располагаются в переднезаднем направлении с углом отклонения в 95 и 100о соответственно. Наиболее часто самая нижняя чашечка направлена кпереди, а следующая за ней – кзади [12].
Особое значение в предоперационном планировании имеет геометрия шейки чашечки, в частности ширина, длина и угловые величины. Определение шеечно-шеечного угла мы производили при компьютерной томографии, соединяя две линии, проходящие через середину доступной и интересующей чашечки. Выяснено, что при величине угла менее 75°, вероятность ригидный визуализации приближается к нулю. В случае превышения 95° появляется возможность достижения нужной чашечки у 95% пациентов. Пограничные угловые величины (75-95°) зачастую требуют гипертракции инструмента, что опасно повреждением паренхимы [13].
До сих пор не опровергнут факт, что ширина шейки чашечки определяет возможность проведения инструмента достаточного диаметра. Оптимальным размером шейки для выполнения стандартной нефролитолапаксии (26-30 Ch) является ее величина более 5- 8 мм. При необходимости преодоления узкой шейки чашечки наиболее безопасным методом принята баллонная дилатация перкутанного канала.
Расщепленная полостная система почки часто сочетается с длинными шейками чашечек и вызывает определенные трудности при инструментальных манипуляциях во второй ее половине. Ожидание симметрии собирательной системы почек реализуется только в 37% случаев. Широкая лоханка дает больше возможностей для использования инструментов, однако, создает необходимость поддержания определенного давления в ней для оптимальной визуализации.
По данным нашего исследования степень калькулезного вовлечения полостной системы почек, зоны инструментального доступа, а также процент успеха представлены в таблице 2 и на рисунке 3.
Таблица 2. Объем и распространенность калькулезного поражения, зоны визуального и инструментального доступа, процент полного удаления камня
Table 2. Volume and prevalence of calculous lesion, visual and instrumental access zones, percentage of complete stone removal
| Калькулезное поражение Calculous lesion |
Одиночные камни Single stones |
Множественные камни Multiple stones |
Коралловидные Staghorn stones |
||||
|---|---|---|---|---|---|---|---|
| n | К1 | К2 | К3 | К4 | |||
| Частота встречаемости, % Frequency of occurrence, % |
37,5 | 20 | 42,5 | 21,6 | 13,1 | 13,7 | 21,6 |
| Зона захвата Capture zone |
А-В | А-С | - | A | A-B | B-C | C |
| Полное удаление камня, % Stone free rate, % |
100 | 58 | - | 94 | 89 | 61 | 36 |
| Оптимальные условия Optimal conditions |
есть | нет | - | есть | есть | нет | нет |
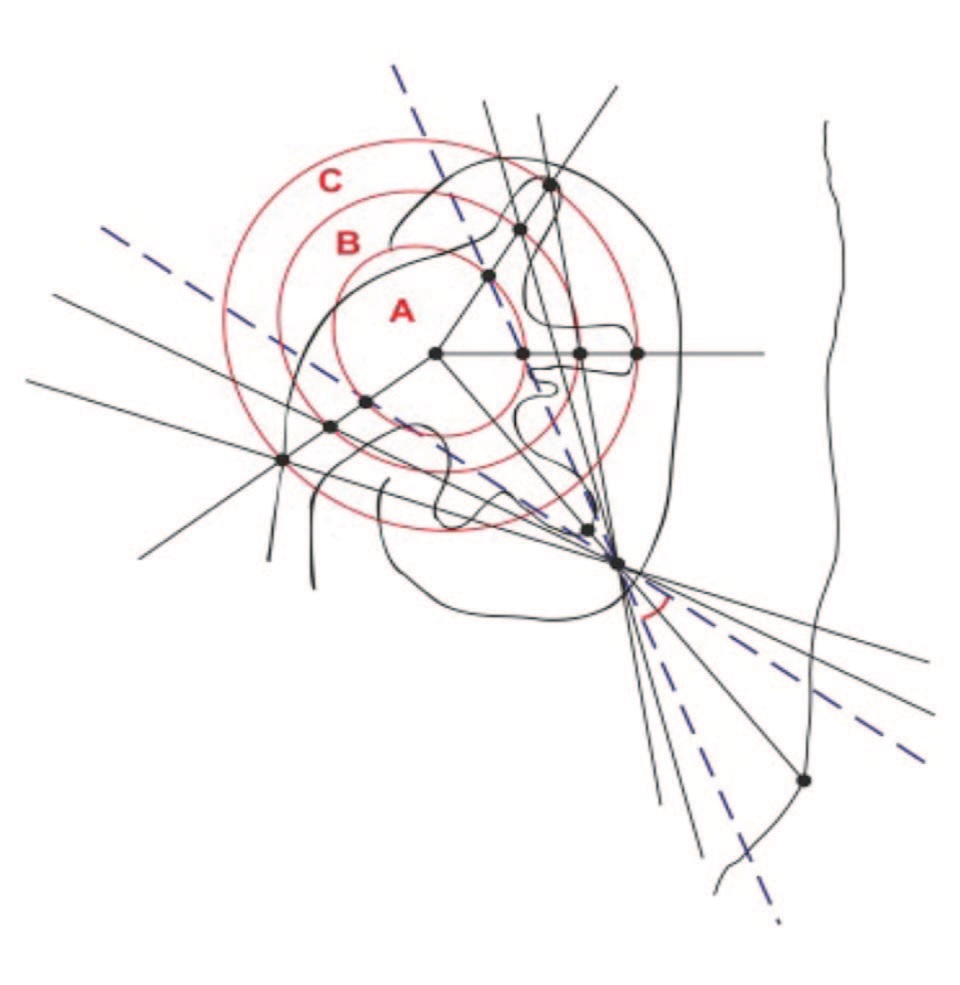
Рис. 3. Зоны визуального и инструментального доступа при нефроскопии [14]
Fig. 3. Areas of visual and instrumental access during nephroscopy [14]
Нами также выяснено, что при калькулезном поражении большого объема полостной системы почки вероятность полного очищения зависит не только от строения коллекторной системы, но также и от степени углового смещения инструмента во время нефроскопии. Так, при распространенности процесса в пределах объема К1 (по классификации коралловидного нефролитиаза по Э.К. Яненко 1990 г.), безопасная тракция нефроскопа не превышает 45°, а при экстракции камней в случае К2-К4 – смещение инструмента в большинстве случаев превышает 90° [14].
Предоперационная виртуальная биометрия, а также сочетание флюроскопии и эндоскопии определяет статические показатели чашечно-лоханочной системы (ЧЛС) почек, а также изменения этих показателей при наполнении полостной системы почки, возможную гиперподвижность почки и инструментов при проведении операции для полного удаления камней (рис. 4).
![Морфометрические данные по результатам МСКТ с 3D реконструкцией [14]](https://ecuro.ru/sites/default/files/issue/2022_4/70.4.jpg)
Рис. 4. Морфометрические данные по результатам МСКТ с 3D реконструкцией [14]:
а, с – ширина шейки нижней чашечки в наиболее узком и широком месте (ШШ), в – длина шейки нижней чашечки (ДШ), d – длина лоханки (ДЛ), е – длина кожно-почечного канала (ДКПК), f – толщина паренхимы в зоне пункции (ТП) – средний шеечно-шеечный угол (СШШУ) – нижний шеечно-лоханочный угол (НШЛУ) – верхний шеечно-шеечный угол (ВШШУ).
Fig. 4. Morphometric data based on the results of MSCT with 3D reconstruction [14]:
a, c – the width of the neck of the lower calyx in the narrowest and widest place, b – the length of the neck of the lower calyx, d – the length of the pelvis, e – the length of the cutaneous-renal canal, f – the thickness of the parenchyma in the puncture area – the average cervicalneck angle – lower neck-pelvis angle – upper neck-neck angle
ОБСУЖДЕНИЕ
В 1901 г. медицинский иллюстратор Max Brodel первым описал бессосудистую зону по заднебоковой поверхности (рис. 5), анатомически-обусловленную особенностями васкуляризации почки передней и задней ветвью основной почечной артерии [15]. Данное открытие навсегда обеспечило безопасный доступ в ЧЛС через заднюю группу чашечек. Дальнейшие анатомические и радиологические исследования доказали вариабельность ширины аваскулярной зоны и локализации максимальной бессосудистой плоскости. Предоперационная идентификация безопасной зоны закономерно уменьшает риски геморрагических осложнений во время чрескожных процедур [16]. Изучение венозных коллекторов вокруг малых чашечек предопределило оптимальный и безопасный вход в чашечку через сосочек [17].
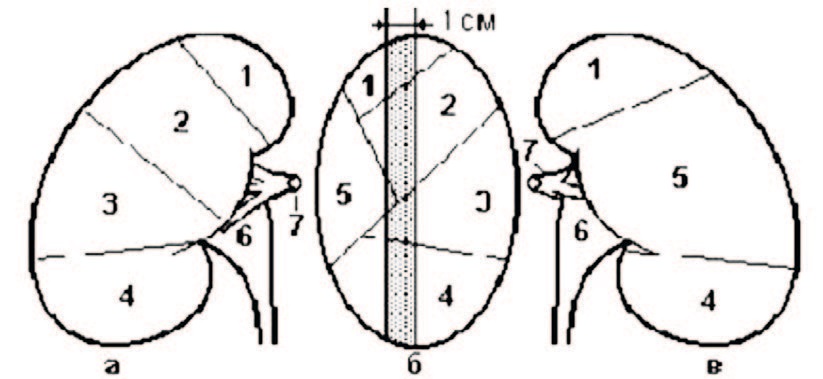
Рис. 5. Схематичное изображение аваскулярной зоны почки [2]
Fig. 5. Schem of the avascular zone of the kidney [2]
В 1988 году F. Sampaio, изучив строение множества почек, с целью оптимизации эндоренальных процедур, предложил анатомическую классификацию вариантов ЧЛС (рис. 6) [18]. При этом обнаружены две закономерности. Первая, однотипность характеристик верхней и нижней группы чашечек. В 98,6% чашечки верхней и в 42,1% чашечки нижней группы сливаются в единую. В 57,9% опорожнение нижнего сегмента осуществляется через переднюю и заднюю группы. Вторая. Разнообразие строения чашечек центрального сегмента. В случае типа А центральный сегмент опорожняется либо в нижнюю или верхнюю чашечку, либо в обе чашечки. Так при подтипе AI (45%) – чашечки центрального сегмента дренируются в чашечки верхнего или нижнего полюса без пересечения, а при подтипе AII (17%) чашечки центрального сегмента имеют пересечение во фронтальной плоскости. При этом имеется закономерность: в 87,5% чашечка, впадающая в нижний полюс, является передней, а впадающая в верхний полис – задней. Отличие подтипа B1 (21%) от B2 (16%), в том, что в первом случае центральный сегмент имеет отдельную среднюю чашечку, а во втором – средние чашечки открываются непосредственно в лоханку.
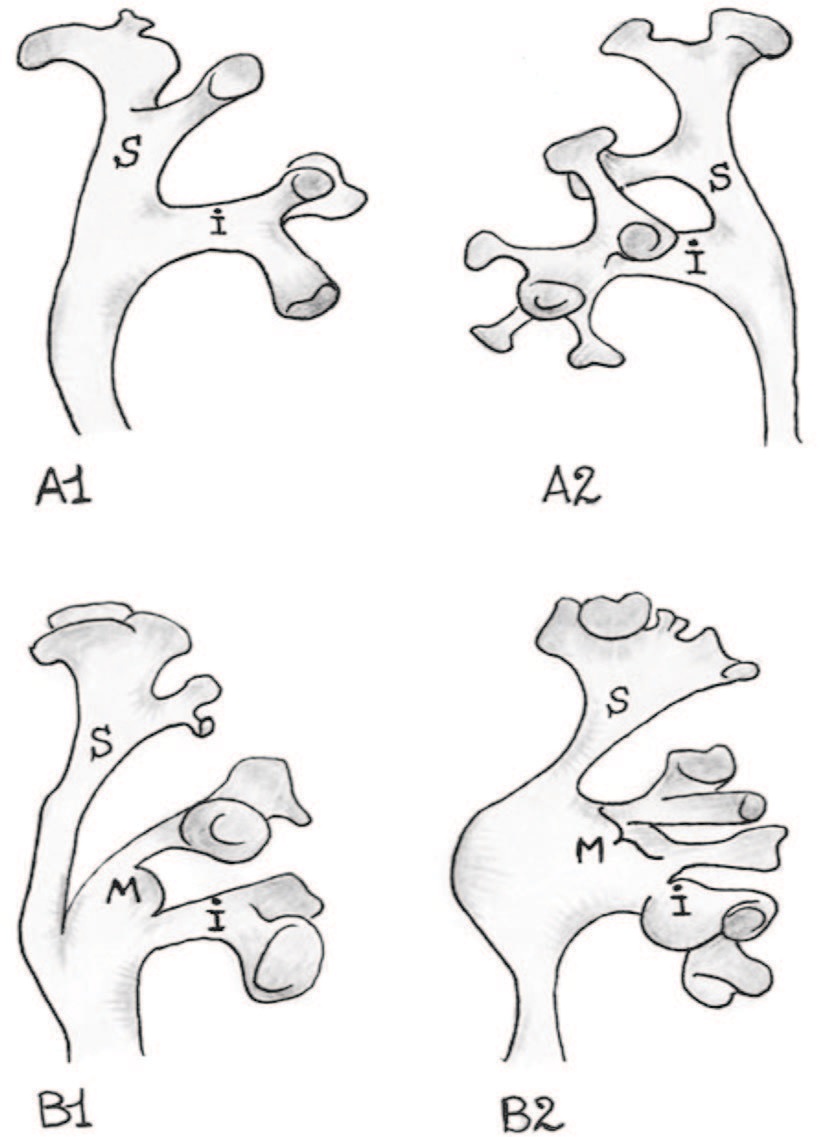
Рис. 6. Фенотипы строения ЧЛС почек по F. Sampaio [18]
Fig. 6. Phenotypes of kindeys’ calical-pelvical system structure according to F. Sampaio
Выявлены отличия в строении передних и задних чашечек нижнего полюса почки. Определены два типа строения нижней группы чашечек: Brodel тип (69% правых почек) и Hodson тип (79% левых почек) (рис. 7). Разница заключается в том, что при Brodel типе чашечки задней группы ротированы по отношению к фронтальной плоскости почки на 20 градусов и имеют заднелатеральное направление. Hodson тип характерен тем, что чашечки задней группы располагаются под углом 70° к фронтальной оси почки и имеют больше заднее направление [12, 19].
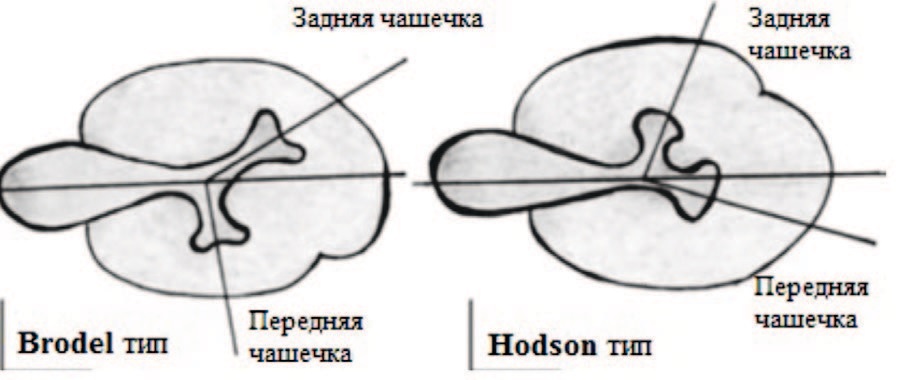
Рис. 7. Brodel тип и Hodson тип строения нижней чашечки [19]
Fig. 7. Brodel type and Hudson type of lower calyx structure [19]
Brodel тип строения является идеальным вариантом для корректного доступа через свод задней нижней чашечки при перкутанном вмешательстве. Hodson тип позволяет пунктировать переднюю чашечку из положения лежа на спине.
В результате нашего исследования определены оптимальные параметры для осуществления перкутанной нефролитотрипсии в режиме монотерапии: нижнеполярная анатомия – длина шейки (ДШ) < 2 см, ширина (ШШ) > 0,5 см, нижний шеечно-лоханочный угол (НШЛУ) > 70°, нижний шеечно-фронтальный угол (НШФУ) >135°; верхнеполярная анатомия – одиночная чашечка, ДШ < 2 см, ШШ >1,0 см, верхний шеечно-шеечный угол (ВШШУ) >135°, верхний шеечно-фронтальный угол (ВШФУ) >135°; анатомия центрального сегмента – А1 [11, 14].
Особенности полостной системы почек пациентов и условия для перкутанного доступа представлены в таблицеах 3-5.
Таблица 3. Строение ЧЛС нижнеполярной области почки и условия для чрескожных методов
Table 3. The structure of the pyelocaliceal system of the lower polar region of the kidney and the conditions for percutaneous methods
| Параметры / Parameters | Brodel тип | Hodson тип | ШШ > 5 мм | ШШ < 5 мм | ДШ > 20 мм | ДШ < 20 мм |
|---|---|---|---|---|---|---|
| Частота встречаемости, % Frequency of occurrence, % |
52,5 | 47,5 | 57,5 | 42,5 | 17,5 | 82,5 |
| Оптимальные условия Optimal conditions |
есть | нет | есть | нет | нет | есть |
ШШ – ширина шейки нижней чашечки в наиболее узком и широком месте
The width of the neck of the lower calyx in the narrowest and widest place
ДШ – длина шейки нижней чашечки
The length of the neck of the lower calyx
Таблица 4. Строение ЧЛС центрального сегмента почки и условия для чрескожных методов
Table 4. The structure of the pyelocaliceal system of the central segment of the kidney and the conditions for percutaneous methods
| Параметры / Parameters | А1 | А2 | В1 | В2 |
|---|---|---|---|---|
| Частота встречаемости, % Frequency of occurrence, % |
5 | 12,5 | 37,5 | 45 |
| Оптимальные условия Optimal conditions |
есть | нет | есть | нет |
Примечание: А1, А2, В1, В2 – Фенотипы строения ЧЛС почек по F. Sampaio
Note: А1, А2, В1, В2 – Phenotypes of kindeys’ calical-pelvical system structure according to F. Sampaio
Таблица 5. Строение ЧЛС верхнеполярной области почки и условия для чрескожных методов
Table 5. The structure of the pyelocaliceal system of the upper polar region of the kidney and the conditions for percutaneous methods
| Параметры / Parameters | Простая / simple | Сложная / complex | ШФУ> 135 град | ШФУ<135 град |
|---|---|---|---|---|
| Частота встречаемости, % Frequency of occurrence, % |
72,5 | 27,5 | 62,5 | 37,5 |
| Оптимальные условия Optimal conditions |
есть | нет | есть | нет |
Примечание: ВШФУ – верхний шеечно-фронтальный угол
Note: Upper neck-frontal angle
При большом объеме калькулезного поражения, сложных вариантах строения собирательной системы, а также при отсутствии условий безопасного многопортового варианта перкутанного вмешательства методом выбора является эндоскопическая комбинированная интраренальная хирургия (ECIRS). В этом случае, помимо планирования чрескожных манипуляций необходима предоперационная оценка полостной системы почки для оптимального использования фиброволоконного инструментария.
Виртуальная компьютерная реконструкция и биометрический анализ параметров позволяют разработать оптимальный план операции, определить задачи антеградного и ретроградного доступов, распределить зоны хирургического интереса, оценить оптимальные методы дезинтеграции.
Биометрическое планирование ECIRS в большинстве случаев позволяет добиться полного калькулезного очищения за одно вмешательство. Как выяснилось, наибольшие сложности при использовании гибкого инструмента имеются у хирурга при манипуляциях в нижней группе чашечек, поэтому, в ряде случаев, успешность интраренальной хирургии зависит от анатомических характеристик нижней половины почки.
Технический прогресс обеспечил преодоление трудностей интралюминального доступа. Так появление гибкого эндоскопа с возможностью двойного отклонения уменьшило ограничения в доступности сложных нижнеполярных зон. А использование лазерного волокна и нитилоновых корзин малого диаметра (1,9 Сh и 200 мкм) обеспечило при этом меньшие потери скорости тока ирригационной жидкости и угла отклонения эндоскопа. Однако даже при использовании сверхтонкого волокна, наличие нижнего шеечно-лоханочного угла <30° сопряжено с высокой вероятностью неполного калькулезного освобождения.
Также неблагоприятным фактором при использовании фибротехнологий является наличие узкой шейки чашечки, что предполагает контактную кровоточивость и потерю прозрачности среды при продвижении инструмента, высокие риски повреждения стенки чашечки и низкую эффективность процедуры. Длина шейки чашечки более 3 см затрудняет продвижение до камня даже если используется двойной изгиб фибронефроскопа, особенно при расположении конкремента в передней нижней чашечке.
Предоперационное изучение статической анатомии в сочетании с биометрией почки, полученной с помощью компьютерной реконструкции необходима, но не всегда достаточна, для выбора стратегии оперативного вмешательства. При интраоперационном контрастировании и инструментальной дилатации, в ряде случаев, мы видим, что полостная система динамична. Изменения анатомических характеристик связаны с эластичностью и податливостью собирательной системы после введения ирригационной жидкости. При этом изменяются не только линейные параметры, но и угловые характеристики, что требует дополнительных исследований.
ВЫВОДЫ
На основе проведенных исследований и полученного опыта был внедрен в практику алгоритм обследования и дооперационного планирования, что привело к снижению времени операции при высокой эффективности при низком уровне послеоперационных осложнений.
Создание морфометрической модели позволяет определить этапность оперативных мероприятий, снизить риски осложнений, повысить эффективность и безопасность процедуры. Использование биометрических параметров перед выполнением перкутанных и эндоскопических интраренальных вмешательств на сегодняшний момент является наиболее эффективным методом виртуального планирования, позволяющим освободить мочевые пути от максимального объема камня и в кратчайшие сроки вернуть пациента к полноценной жизни.
ЛИТЕРАТУРА
1. Yasui T, Ando R, Okada A, Tozawa K, Iguchi M, Kohri K. Epidemiology of urolithiasis for improving clinical practic. Hinyokika Kiyo 2012;58(12):697-701.
2. Рогачиков В.В., Нестеров С.Н., Ильченко Д.Н., Тевлин К.П., Кудряшов А.В. Перкутанная нефролитолапаксия: прошлое, настоящее, будущее. Экспериментальная и клиническая урология 2016;(2):58-66. [Rogachikov V.V., Nesterov S.N., Ilchenko D.N., Tevlin K.P., Kudryashov A.V. Percutaneous nephrolitholapaxy: past, present, future... Eksperimentalnaia i klinicheskaia urologiia = Experimental and Clinical Urology 2016;(2):58-66. (In Russian)].
3. Серняк П.С., Сафронов В.Я., Фролов С.Г., Черников А.В., Сагалевич А.И., Деркач И.А., Фролов А.С. Эволюция лечения мочекаменной болезни при единственной почке. Вестник неотложной и восстановительной медицины 2012;13(3):396-398. [Sernyak P.S., Safronov V.Ya., Frolov S.G., Chernikov A.V., Sagalevich A.I., Derkach I.A., Frolov A.S. Evolution of treatment of urolithiasis with a single kidney. Vestnik neotlozhnoi i vosstanovitelnoi meditsiny = Bulletin of Emergency and Restorative Medicine 2012;13(3):396-398. (In Russian)].
4. Ganpule AP, Desai MR. What's new in percutaneous nephrolithotomy. Arab J Urol 2012;10(3):317-323. https://doi.org/10.1016/j.aju.2012.07.005.
5. Bandi G, Meiners RJ, Pickhardt PJ, Nakada SY. Stone measurement by volumetric three-dimensional computed tomography for predicting the outcome after extracorporeal shock wave lithotripsy. BJU Int 2009;103(4):524-8. https://doi.org/10.1111/j.1464-410X.2008.08069.x.
6. Demehri S, Kalra MK, RybickiFJ Steigner ML, Lang MJ, Houseman EA, et al. Quantification of urinary stone volume: attenuation threshold-based CT method a technical note. Radiology 2011;258(3):915-22. https://doi.org/10.1148/radiol.10100333.
7. Sfoungaristos S, Gofrit ON, Pode D, Landau EH, Duvdevani M. Percutaneous nephrolithotomy for staghorn stones: which nomogram can better predict postoperative outcomes? World J Urol 2016;34(8):1163-8. https://doi.org/10.1007/s00345-015-1743-9.
8. Simpatico FJB, Mandarim-de-Lacerda CA. 3-Dimensional and radiological pelviocaliceal anatomy for endourology. J Urol 1988;140(6):1352-5. https://doi.org/10.1016/ s0022-5347(17)42042-8.
9. Sampaio FJB., Mandarim-de-Lacerda C. 3-dimensional and radiological pelvicaliceal anatomy for endourology. J Urol 1988;140(6):1352–5. https://doi.org/10.1016/s0022-5347(17)42042-8.
10. Miller J, Durack JC, Sorensen MD, Wang JH, Stoller ML. Renal calyceal anatomy characterization with 3-dimensional in vivo computerized tomography imaging. J Urol 2013;189(2):562-7. https://doi.org/10.1016/j.juro.2012.09.040.
11. Lang E, Thomas R, Davis R, Colon I, Allaf M, Hanano A, et al. Risks, advantages, and complications of intercostal versus subcostal approach for percutaneous nephrolithotripsy. Urology 2009;74(4):751-5. https://doi.org/10.1016/j.urology.2009.04.087.
12. Kaye KW, Reinke DB. Detailed caliceal anatomy for endourology. J Urol 1984;132(6):1085-7. https://doi.org/10.1016/s0022-5347(17)50042-7.
13. Guglielmetti GB, Danilovic A, Torricelli FC, Coelho RF, Mazzucchi E, Srougi M. Predicting calyceal access for percutaneous nephrolithotomy with computed tomography multiplanar reconstruction. Clinics (Sao Paulo) 2013;68(6):892-5. https://doi.org/10.6061/clinics/2013(06)27.
14. Нестеров С.Н., Рогачиков В.В., Тевлин К.П., Ильченко Д.Н., Ханалиев Б.В., Бронов О.Ю. Морфометрическое моделирование как фактор, улучшающий результаты перкутанной нефролитолапаксии. Вопросы урологии и андрологии 2016;(1):33-39. [Nesterov S.N., Rogachikov V.V., Tevlin K.P., Ilchenko D.N., Khanaliev B.V., Baranov O.Yu. Morphometric modeling as a factor improving the results of percutaneous nephrolitholapaxy. Voprosy urologii i andrologii = Questions of urology and andrology 2016;(1):33-39. (In Russian)].
15. Brödel M. The intrinsic blood-vessels of the kidney and their significance in nephrotomy. Johns Hopkins Hospital Bulletin 1901;118:10-3.
16. Macchi V, Picardi E, Inferrera A, Porzionato A, Crestani A, Novara G, et al. Anatomic and radiologic study of renal avascular plane (Brödel's Line) and its potential relevance on percutaneous and surgical approaches to the kidney. J Endourol 2018,32(2):154-9. https://doi.org/10.1089/end.2017.0689.
17. Sampaio FJB. Surgical anatomy of the kidney. In Smith’s textbook of endourology. eds. Smith AD, Badlani GH, Bagley DH, Preminger GM, Kavoussi LR, Rastinehad AR, et al. Part II: percutaneous surgery, chapter 6. Quality Medical Publishing, St. Louis. 1996.
18. Sampaio F, Mandarim-de-Lacerda C. Anatomic Classification of the kidney collecting system for endourologic procedures. J Endourol 1988;(2):247-51.
19. Filho DB, Favorito LA, Costa WS, Sampaio FJB. Kidney lower pole pelvicaliceal anatomy: comparative analysis between intravenous urogram and three-dimensional helical computed tomography. J Endourol 2009;23(12):2035–40. https://doi.org/10.1089/end.2009.0262.







