По данным официальной статистики количество больных мочекаменной болезнью (МКБ) в Российской Федерации неуклонно растет - с 2002 по 2014 гг. их прирост составил 34,5% [1]. По-прежнему актуальной остается проблема разработки новых методов профилактики МКБ и повышения эффективности ее лечения [2,3]. Сложность решения поставленных задач определяется полиэтиологичностью уролитиаза и особенностями мультифакторного патогенеза заболевания [4,5]. Особое внимание уделяется вопросам профилактики и метафилактики у пациентов с рецидивным нефролитиазом, частота которого составляет 40-70% [4]. В настоящее время основной причиной рецидивирования мочевых камней считается нарушение метаболизма кальция и мочевой кислоты. Пациенты с высокой литогенной активностью достоверно отличаются повышенным содержанием кальция и мочевой кислоты в моче и увеличенным значением отношения кальция к креатинину мочи по сравнению с группой больных, у которых активность образования мочевых камней низка [6]. При этом, нарушения гомеостаза кальция, фосфора и пуринового обмена тесно связаны с нарушением экскреторной функции почек, с тубулопатиями различного генеза и могут быть обусловлены как генетическими факторами, так и различными патологическими процессами, приводящими к оксидант-ному стрессу, развитию системного воспалительного ответа, мембранной патологии [7,8]. Системные процессы сопровождаются реакциями гиперкатаболизма, гормональными дисфункциями, гиперферментурией,водно-электролитными нарушениями, которые повышают риск развития нефролитиаза.
В ранее проведенных исследованиях было показано, что гипохлорит натрия (ГН) помимо прямого детоксикационного эффекта обладает системным адаптогенным действием на организм человека и способен оказывать гомеостатический эффект при различных патологических процессах [9]. Изменение баланса антиоксидантной системы с помощью парентерального введения 0,06% раствора ГН - вещества с прооксидантной активностью, в сторону активации процессов пере-кисного окисления липидов приводит к ответной реакции в виде увеличения мощности функциональной системы антиоксидантной защиты, усилению репаративно-анаболических процессов, снижению в крови уровня гормонов катаболической направленности, глюкокортикоидов и адренокортикотропного гормона, изменению функции почек с усиленной очистительной и реабсорбционной способностью [10-14]. Такой многогранный эффект ГН позволяет предполагать, что посредством системного воздействия этого препарата имеется возможность коррекции метаболических нарушений, эндокринных дисфункций, воспалительных процессов и функциональных расстройств, в частности тубулопатий, имеющих важное значение в патогенезе мочекаменной болезни [15-17].
В связи с этим, в данной работе было проведено экспериментальное изучение влияния ГН на ряд электролитов и метаболитов крови и мочи, являющихся общепризнанными факторами риска уролитиаза.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальное исследование выполнено на 35 белых беспородных крысах массой 249-450 грамм. Группу интактных животных составили 5 крыс, их не подвергали никаким воздействиям и их показатели считали нормой. Контрольную группу (группа 1) составили 15 крыс, им внутрибрюшинно в течение 4 дней вводили 1,5 мл 0,9% раствора хлорида натрия 1 раз в сутки. Экспериментальную группу (группа 2) составили 15 крыс которым в аналогичном режиме вводили по 1,5 мл 0,06% (2,2-2,5 мг/кг/сутки) раствора ГН.
Животных контрольной и экспериментальной групп обследовали на 5-е, 8-е и 11-е сутки наблюдения. Определяли суточный диурез, помещая животных в обменные клетки на 24 часа, массу животного, брали кровь пункционно из нижней полой вены. Биохимические исследования крови и мочи проводили на аппарате «ФП-901М». Изучали динамику следующих показателей: креатинин, мочевина, калий, натрий, хлор, кальций, магний, фосфор, мочевая кислота. С целью получения более объективной оценки изменения концентрации изучаемых параметров в моче вычисляли их отношение к концентрации креатинина мочи (нормирование на 1 ммоль креатинина) с целью исключить влияние различий в диурезе и степени концентрирования мочи.
Раствор ГН готовили с помощью аппарата «ДЭО-01-Медек» на основе стерильного физиологического раствора в электрохимической камере согласно методическим рекомендациям по применению ГН и положениям технической документации [18,19].
Статистическую обработку данных производили на персональном компьютере, используя программу «Статистика 6», с расчетом достоверности по непараметрическому U-критерию Манна-Уитни.
Эксперимент проводился в соответствии с «Международными рекомендациями по проведению биомедицинских исследований с использованием животных», принятыми Международным Советом Научных Обществ (CIOMS) в 1985 году, со статьей XI Хельсинской декларации Всемирной медицинской ассоциации (1964 год) и правилами лабораторной практики в Российской Федерации (приказ Минздрава России от 19.06.2003 № 267). Крысы содержались в условиях вивария, имели свободный доступ к пище и воде за исключением времени эксперимента.
РЕЗУЛЬТАТЫ
Результаты эксперимента оценивали на 5-е, 8-е и 11-е сутки исследования. Средние величины данных биохимического исследования крови и мочи представлены в таблицах 1 и 2.
Таблица 1. Данные биохимических исследований крови (M±σ)
| 5-е сутки | 8-е сутки | 11-е сутки | |||||
|---|---|---|---|---|---|---|---|
| Показатель | Интактные крысы | Контрольная группа | Экспериментальная группа | Контрольная группа | Экспериментальная группа | Контрольная группа | Экспериментальная группа |
| Креатинин крови, ммоль/л | 0,052±0,003 | 0,049±0,005 | 0,049±0,005 | 0,041 ±0,001* | 0,047±0,004** | 0,044±0,004* | 0,049±0,009 |
| Мочевина крови, ммоль/л | 6,8±0,8 | 4,8±1,0*4 | 4,8±1,0*4 | 5,1 ±0,3*4 | 6,2±1,04 | 5,3±1,44 | 6,7 ±1,6 |
| Калий плазмы, ммоль/л | 4,8±1, 1 | 4,2±0,6 | 4,2±0,6 | 3,8±0,6 | 4,5±0,3 | 4,2±0,5 | 3,8±0,8 |
| Натрий плазмы, ммоль/л | 148±4 | 148±2 | 148±2 | 147 ± 1 | 148±3 | 145±2 | 146±5 |
| Хлор плазмы, ммоль/л | 93±4 | 95±1 | 95±1 | 95±2 | 96±1 | 96±1 | 94±4 |
| Кальций плазмы, ммоль/л | 2,29±0,14 | 2,14±0,12 | 2,14±0,12 | 2,16±0,02 | 2,12±0,1 | 2,12±0,2 | 2,17 ±0,12 |
| Мочевая кислота плазмы, ммоль/л | 0,137 ±0,036 | 0,110±0,011 | 0,110±0,011 | 0,080±0,031 | 0,154±0,036** | 0,113±0,033 | 0,095±0,070 |
| Фосфор плазмы, ммоль/л | 2,69±0,41 | 2,09±0,10* | 2,09±0,10* | 1,84±0,20* | 2,33±0,09 | 2,18±0,19 | 2,05±0,39 |
| Магний плазмы, ммоль/л | 0,72±0,03 | 0,61±0,03* | 0,61±0,03* | 0,94±0,20* | 0,81 ±0,10 | 0,94±0,40 | 0,68±0,14 |
*различие достоверно по сравнению с группой интактных крыс (p<0,05)
**различие достоверно по сравнению с контрольной группой (p<0,05)
В ответ на нагрузку физиологическим раствором и 0,06% раствором гипохлорита натрия на основе физиологического раствора концентрация креатинина и мочевины крови снижалась как в контрольной, так и в экспериментальной группе крыс. Снижение мочевины крови было достоверным по сравнению с группой интактных животных в контрольной группе на 5-е и 8-е сутки, а в экспериментальной группе - на 5-е сутки наблюдения. Снижение уровня креатинина крови было больше выражено в контрольной группе и, наиболее вероятно, было обусловлено задержкой воды на фоне нагрузки натрием и хлором, поскольку суточная экскреция креатинина в обеих группах снижалась, причем в большей степени в контрольной группе (рис. 1).
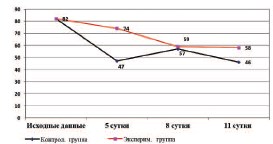
Рис. 1. Изменение средней величины суточной экскреции креатинина в группах контроля и эксперимента (мкмоль/сутки)
Достоверных изменений в крови со стороны показателей калия, натрия, кальция и хлора выявлено не было. Уровень мочевой кислоты в контрольной и экспериментальной группах достоверно не отличался от нормы, но в группе с ГН ее концентрация в крови на 8-е сутки наблюдения оказалась достоверно выше, чем в этот же срок в группе контроля. При этом к 11-м суткам различия между группами исчезали.
В контрольной группе на 5-е и 8-е сутки исследования отмечено снижение концентрация фосфора и увеличение концентрации магния в крови, тогда как в опытной группе эти показатели достоверно не менялись.Наиболее интересные результаты были получены при оценке динамики электролитного состава мочи (табл. 2).
Таблица 2. Данные биохимических исследований мочи (M±σ)
| 5-е сутки | 8-е сутки | 11-е сутки | |||||
|---|---|---|---|---|---|---|---|
| Показатель | Интактные крысы | Контрольная группа | Экспериментальная группа | Контрольная группа | Экспериментальная группа | Контрольная группа | Экспериментальная группа |
| Диурез в сутки, мл | 8±3 | 10±5 | 7±1 | 5±1* | 5±1* | 4±1* | 5±2 |
| Креатинин мочи, ммоль/л | 10,45±1,53 | 5,84±3,65 | 10,57 ±3,09 | 11,19±1,22 | 12,97 ±3,59 | 11,43±1,75 | 12,26±3,89 |
| Экскреция креатинина, мкмоль/сутки | 82±19 | 47±3* | 74±13** | 57±2* | 59±2* | 46±11* | 58±18 |
| Мочевина мочи, ммоль/л | 1144±166 | 949±422 | 1224±234 | 1724±153* | 1713±457 | 1380±547 | 1322±708 |
| Мочевина мочи/креатинин мочи | 109,6±6,5 | 174,5±28,4* | 118,4±14,2** | 154,3±3,2* | 133,0± 19,3* | 121,7 ±47,8 | 103,2±25,5 |
| Калий мочи, ммоль/л | 257,0±45,6 | 207,1±126,7 | 225,9±55,0 | 340,3±14,4* | 385,0±100,0* | 273,7 ± 113,5 | 272,0±200,2 |
| Калий мочи/креатинин мочи | 24,5±0,8 | 36,2±5,6* | 21,6±1,44* | 30,6±2,1 * | 29,8± 1,8* | 24,0±9,8 | 20,4±9,6 |
| Натрий мочи, ммоль/л | 72±14 | 87±47 | 168±131 | 98±22 | 245±79*,** | 58±37,2 | 91±120 |
| Натрий мочи/креатинин мочи | 6,9±0,7 | 15,8±3,5 | 15,0±7,9 | 9,0±2,9 | 18,9±4,2*,** | 5,1 ±3,2 | 6,3±7,1 |
| Хлор мочи, ммоль/л | 53±13 | 128±50* | 170±121* | 118±26* | 246±71 *,** | 51 ±24 | 125±117 |
| Хлор мочи/креатинин мочи | 5,1±1,1 | 25,0±11,2* | 15,1 ±6,6* | 10,8±3,4* | 19,1 ±4,4*,** | 4,5±2,1 | 9,7±6,6 |
| Кальций мочи, ммоль/л | 4,63±2,1 | 2,78±1,9 | 3,36±2,97 | 5,33±2,25 | 3,68±3,78 | 4,41 ±5,64 | 1,58±0,50* |
| Кальций мочи/креатинин мочи | 0,44±0,17 | 0,47±0,07 | 0,32±0,28 | 0,47 ±0,15 | 0,32±0,38 | 0,38±0,49 | 0,17 ±0,10* |
| Мочевая кислота мочи, ммоль/л | 1,83±0,36 | 0,45±0,22* | 1,12±0,97 | 2,44±0,37 | 1,01 ±0,77** | 1,30±1,04 | 0,38±0,01*,** |
| Мочевая кислота мочи/креатинин мочи | 0,17 ±0,02 | 0,08±0,02* | 0,11 ±0,09 | 0,22±0,02* | 0,07±0,04*,** | 0,12±0,09 | 0,03±0,01*,** |
| Фосфор мочи, ммоль/л | 35,4±12,8 | 5,1 ±3,2* | 22,5±20,7 | 60,4±12,1* | 38,6±43,0 | 68,4±23,2* | 36,2±35,1 |
| Фосфор мочи/креатинин мочи | 3,47 ±1,40 | 1,37 ± 1,36 | 2,37±2,03 | 5,47±1,46 | 2,61 ±2,49 | 5,30±2,17 | 2,16±1,55** |
| Магний мочи, ммоль/л | 10,26±2,03 | 0,14±0,08* | 3,54±5,95 | 9,70±5,55 | 1,05±1,21 *,** | 5,34±8,84 | 0,28±0,07* |
| Магний мочи/креатинин мочи | 0,99±0,17 | 0,03±0,03* | 0,01 ±0,001* | 0,84±0,42 | 0,09±0,12*,** | 0,47±0,77 | 0,02±0,006* |
Концентрация мочевины в моче на 5-е и 8-е сутки достоверно возрастала, как в абсолютных значениях, так и при расчете на 1 ммоль креатинина, тогда как ее концентрация в крови в эти сроки была снижена. При этом в группе с ГН экскреция мочевины на всех сроках наблюдения была ближе к норме, чем в контрольной группе. По-видимому, реабсорбция мочевины в почечных канальцах снижалась из-за избытка в организме натрия и хлора, так как эти электролиты обладают высокой осмотической активностью, но в большей степени снижение реабсорбции мочевины отмечено в опытах с парентеральным введением физиологического раствора.
Выведение калия из организма животных в контрольной группе достоверно увеличивалось на 5-е и 8-е сутки эксперимента, в экспериментальной группе - на 5-е сутки достоверно снижалось с последующим повторным увеличением на 8-е сутки. Выведение натрия с мочой как в контрольной, так и в экспериментальной группах было повышенным, причем его концентрация в моче увеличивалась в большей степени в опытной группе с ГН. В связи со значительным разбросом данных достоверные изменения были получены только на 8-е сутки. К 11-м сутки экскреция натрия нормализовалась в обеих группах.
Динамика концентрации хлора в моче соответствовала динамике натрия. Его концентрация (как абсолютная, так и в пересчете на 1 ммоль креатинина) повышалась в обеих группах на 5-е и 8-е сутки наблюдения, причем в большей степени в опытах с ГН. К 11-м суткам концентрация хлора в моче недостоверно отличалась от нормы.
Выведение кальция с мочой в контрольной группе крыс практически не менялось и было таким же, как и в группе интактных крыс. При этом концентрация и экскреция кальция с мочой в группе с ГН снижалась и на 11-е сутки была достоверно ниже по сравнению с группой интактных крыс.
Концентрация мочевой кислоты в моче крыс контрольной группы на 8-е сутки наблюдения достоверно повышалась, а в экспериментальной группе достоверно снижалась на 8-е и 11-е сутки по сравнению с нормой и с контрольной группой в те-же сроки наблюдения.
Абсолютная концентрация фосфора в моче в контрольной группе на 8-е и 11-е сутки повышалась, тогда как в опытной группе этого не происходило. Более того, в пересчете на 1 ммоль креатинина концентрация фосфора достоверно снижалась на 11-е сутки.
Концентрация магния в контрольной группе временно снижалась на 5-е сутки наблюдения, а в дальнейшем нормализовалась, тогда как в группе с ГН происходило ее достоверное снижение на всех сроках наблюдения.
ОБСУЖДЕНИЕ
Сравнивая динамику концентрации в моче изученных электролитов и метаболитов, можно отметить, что в опытах с 4-дневным введением физиологического раствора, при котором происходит значительная нагрузка организма натрием, отмечены изменения электролитного гомеостаза, которые в целом можно охарактеризовать, как увеличение литогенного потенциала мочи. На фоне снижения диуреза происходило увеличение концентрации в моче уровня мочевины, мочевой кислоты и фосфора, при этом показатели других исследуемых электролитов и метаболитов оставались стабильными. В то же время, в опытах с введением ГН, несмотря на такое же уменьшение диуреза, избыток введенного натрия и хлора выводился с мочой более активно, а концентрация кальция, магния, фосфора и мочевой кислоты к концу срока наблюдения достоверно снижалась, как в абсолютных значениях, так и в пересчете на 1 ммоль креатинина, что свидетельствовало об уменьшении литогенного потенциала мочи.
Снижение диуреза может быть вызвано введением избыточного количества натрия и хлора, ведущего к задержке осмотически свободной воды, увеличению объема циркулирующей крови и ее разведению. Это сопровождается компенсаторноприспособительным усилением выведения натрия с сопутствующим увеличением концентрации хлоридов, мочевины и калия в моче.
Гипернатриурия в нормальных условиях всегда сопровождается потерей катионов и анионов мочи [20]. Однако при изучении динамики концентраций кальция, фосфора и мочевой кислоты мы наблюдали парадоксальную картину: в контрольной группе животных потеря этих веществ с мочой возрастала, а в экспериментальной группе - снижалась, особенно выражено к концу периода наблюдения (11-е сутки). В контрольной группе животных натрийурез не сопровождался потерей магния. В экспериментальной группе животных обнаружили достоверное снижение концентрации магния в моче на 8-е и 11-е сутки.
90-95% кальция и магния реаб-сорбируется в почечных канальцах пассивно по градиенту концентрации, которая создается активной реабсорбцией натрия. Против градиента концентрации при натрий-урезе кальций и магний могут реабсорбироваться только активно за счет энергии Са2+-АТФазы и Mg2+-АТФазы. Активная реабсорбция кальция регулируется паратиреоидным гормоном и витамином D. Активная реабсорбция магния не зависит от эндокринной системы. Избыточная продукция паратиреоидного гормона характеризуется гипер-кальциемией [20,21], которую мы не обнаружили у крыс экспериментальной группы. Наиболее вероятно, что активная реабсорбция катионов мочи (кальция и магния) у крыс под действием ГН при натрий-урезе была обусловлена усилением активности трансмембранных энергозависимых процессов негормональной природы.
Анионы мочи, (фосфор и мочевая кислота) не подвергаются активной реабсорбции. Причины достоверного снижения концентрации мочевой кислоты на 8-е и 11-е сутки наблюдения и снижения концентрации фосфора мочи на 11-е сутки в группе крыс, леченых ГН, на фоне нагрузки натрием и натрийурезе, по нашему мнению, носят внепочечный характер. Этот эффект представляет собой результат специфического системного действия ГН, стимуляции пластических репаративно-анаболических процессов и конформационной перестройки клеточных мембран [9,22]. Подобный эффект может быть результатом сдвига пуринового обмена в сторону ресинтеза пуринов и потребления фосфатов для рефосфо-рилирования макроэргических соединений.
Парентеральное введение крысам физиологического раствора сопровождается натрийурезом и увеличением концентрации кальция, магния, фосфора и мочевой кислоты в моче, то есть усилением литогенных свойств мочи. Парентеральное введение крысам 0,06% раствора ГН в течение 4-х дней в дозе 2,2-2,5 мг/кг/сутки сопровождается натрийурезом и достоверным снижением концентрации кальция, магния, фосфора и мочевой кислоты в моче крыс на 8-е и 11-е сутки наблюдения, то есть снижением концентрации веществ, повышающих риск нефролитиаза.
Таким образом, 0,06% раствор ГН в дозе 2,2-2,5 мг/кг/сутки достоверно снижает концентрацию основных факторов риска камнеобразования в мочевой системе крыс и может быть предложен для клинического испытания у человека в качестве средства профилактики и метафилактики мочекаменной болезни.
ВЫВОДЫ
Метаболические нарушения, являющиеся следствием системной патологии и нарушением механизмов саморегуляции и защиты, могут корригироваться системными воздействиями на организм с помощью методов трансфузиологического пособия, а именно методики непрямого электрохимического окисления крови 0,06% раствором ГН. Механизм адаптогенного действия ГН может быть использован для снижения литогенной активности мочи у пациентов с высоким риском рецидивирования мочевых камней.
ЛИТЕРАТУРА
1. Каприн А.Д., Аполихин О.И., Сивков А.В., Солнцева Т.В., Комарова В.А. Анализ уронефрологической заболеваемости и смертности в Российской Федерации за период 2002-2014 гг. по данным официальной статистики. Экспериментальная и клиническая урология 2016;(3):4-13.
2. Константинова О.В., Яненко Э.К., Шадеркина В.А. Метафилактика мочекислых камней почек. Экспериментальная и клиническая урология 2016;(3):116-118.
3. Menard O, Murez T, Bertrand J, Daille AM, Cabaniols L, Robert M, Thuret R. Epidemiology of urolithiasis in south of France: A retrospective monocentric study. Prog Urol 2016;26(6):339-345. doi: 10.1016/
j.purol.2016.04.005.
4. Аполихин О.И., Сивков А.В., Константинова О.В., Сломинский П.А., Тупицына Т.В., Калиниченко Д.Н. Генетические факторы риска рецидивного уролитиаза. Экспериментальная и клиническая урология 2016;(3):127-130.
5. Tasic V, Gusev Z. Nephrolithiasis and nephrocalcinosis in children - metabolic and genetic factors. Pediatr Endocrinol Rev 2015;13(1): 468-476.
6. Arrabal-Polo MA, Cano-Garcia MC Arrabal-Martin M. Lithogenic ac-tivityas a factor to consider in the metabolic evaluation of patients with calcium lithiasis. Iran J Kidney Dis 2015; 9(6): 469-471.
7. Калабеков А.А., Казаченко А.В., Иващенко В.В. Факторы риска
кальциевого и уратного нефролитиаза. Роль канальцевых дисфункций в камнеобразовании. Экспериментальная и клиническая урология 2016;(1 ):8-14.
8. Sharma M, Kaur T, Singla SK. Role of mitochondria and NADPH oxidase derived reactive oxygen species in hyperoxaluria induced nephrolithiasis: therapeutic intervention with combinatorial therapy of N-acetyl cysteine and Apocynin. Mitochondrion. 2016; 27:15-24. doi: 10.1016/j.mito.2016.01.002
9. Иващенко В.В. Механизм адаптогенного действия гипохлорита натрия при непрямом электрохимическом окислении крови и его применение в урологии (экспериментально-клиническое исследование). Дис. ... д-ра мед. наук. М., 2016. 361 с.
10. Кашафеева А.А., Гаймоленко С.Г., Хышиктуев Б.С. Воздействие различных концентраций гипохлорита натрия на динамику параметров системы «ПОЛ-антиоксиданты» брюшины при перитоните в эксперименте. Сибирский медицинский журнал 2010;(5): 82-85.
11. Меерсон Ф.З. Антиоксидантные факторы организма как система естественной профилактики стрессорных и гипоксических повреждений. В кн.: Адаптация, стресс, профилактика. М.: «Наука», 1981. С. 226-257.
12. Кирпатовский В.И., Данилков А.П., Иващенко В.В., Салманов С.А., Кудрявцев Ю.В., Голованов С.А., Дрожжева В.В., Михеева Л.А., Бойко Т.А., Сыромятникова Е.В. Изменение показателей метаболизма и функции почек у интактных крыс после парентерального введения гипохлорита натрия. Урология 2003;(2): 28-32.
13. Иващенко В.В, Кирпатовский В.И., Чернышев И.В., Кудрявцев Ю.В., Перепанова Т.С., Никонова Л.М., Пеньков П.Л. Гипохлорит натрия и общий адаптационный синдром Селье. Экспериментальная и клиническая урология 2012;(3): 15-18.
14. Иващенко В.В., Данилков А.П., Голованов С.А., Кирпатовский В.И., Кудрявцев Ю.В, Дрожжева В.В. Гипохлорит натрия в регуляции концентрирующей функции канальцев. Экспериментальная и клиническая урология 2010;(2):18-23.
15. Miyamoto Y, Tiruppathi C, Ganapathy V, Leibach FH. Multiple transport systems for organic cations in renal brush-border membrane vesicles. Am J Physiol 1989.;256( 4. Pt. 2):540-548.
16. Ott RJ, Hui AC, Yuan G, Giacomini KM. Organic cation transport in human renal brush-border membrane vesicles. Am J Physiol 1991 ;261 (3. Pt. 2): 443-451.
17. Tiselius HG. Metabolic risk-evaluation and prevention of recurrence in stone disease: does it make sense? Urolithiasis 2016;44(1):91-100. doi: 10.1007/s00240-015-0840-y
18. Сергиенко В.И. Детоксикация организма с использованием натрия гипохлорита, полученного электрохимически. Эфферентная терапия 1996;2(4):25-32.
19. Федоровский Н.М. Непрямая электрохимическая детоксикация: Пособие для последипломной подготовки врачей. М.: «Медицина», 2004. 144 с.
20. О’Каллахан К.А. Наглядная нефрология: учебное пособие для вузов. [пер. с англ. под ред. Е.М. Шилова]. М.:ГЭОТАР-Медиа, 2009. 128 с.
21. Ketha H, Singh RJ, Grebe SK, Bergstralh EJ, Rule AD, Lieske JC, Kumar R. Altered calcium and vitamin D homeostasis in first-time calcium kidney stone-formers. J Urol 2016;195(3): 658-659. doi: 10.1371/ journal.pone.0137350
22. Кирпатовский В.И., Онищенко Н.А., Петросова В.Н., Козырева Т.А. Фармакологическая защита почек от ишемического повреждения. О механизме реализации противоишемической защиты донорских почек препаратами различных фармакологических групп. Вестник Академии медицинских наук СССР 1982;(1): 73-78.







