ВВЕДЕНИЕ
Занимая одно из первых мест по распространенности среди урологических заболеваний, мочекаменная болезнь (МКБ), является серьезной медицинской, социальной и экономической проблемой. За последние десятилетия зарегистрирован прогрессивный рост ее заболеваемости. Ежегодно диагноз МКБ устанавливается более 115 миллионам человек, при этом в зависимости от региона, в среднем распространенность варьирует от 1,7 до 14,8%, а в некоторых странах превышает 20% [1, 2].
Доля мочекаменной болезни в урологических стационарах составляет более 50%, а финансовые затраты на ее диагностику и лечение значительны. К примеру, в США на оказание медицинской помощи пациентам с уролитиазом ежегодно тратится более 4 млрд. долларов. При этом, более 90% данных средств направлены на оказание помощи уже состоявшегося заболевания (40% – плановая стационарная, 23 % – экстренная стационарная, 30% – амбулаторная помощь), и лишь порядка 3% идет на профилактику рецидива камнеобразования [3, 4].
МКБ имеет высокую частоту рецидивирования, вследствие чего недостаточное внимание метафилактическим мероприятиям способствует рецидиву заболевания: в течение 2-х лет – у 30%, а через 5 лет – у 50% больных [5]. В свою очередь эффективность правильно подобранной противорецидивной терапии доказана множеством исследований и составляет около 50-80% [6, 7], а ее реализация в рамках стандартизованных программ по оказанию медицинской помощи пациентам представляется наиболее предпочтительной [8–10].
Разработка средств для рациональной метафилактики представляет потенциальную «зону роста» повышения эффективности лечения пациентов с МКБ. Одним из перспективных направлений является коррекция уровня pH мочи, поскольку его нарушения встречаются наиболее часто и вносят значительный вклад в процесс литогенеза [7, 11]. В зависимости от различных условий (потребляемая пища, принимаемые препараты и др.) уровень pH мочи в течение суток может варьировать от 4,5 до 8,0.
При этом, препараты, используемые для коррекции уровня рН, имеют ряд ограничений. К примеру, при длительном превышении уровня pH мочи 7,0-7,2 возможно формирование кальций-фосфатных камней [12]. Монотерапия препаратами для ацидификации мочи, требуемая для предотвращения рецидива инфекционных камней, ограничена, поскольку они с такими свойствами (L-метионин, аскорбиновая кислота, аммония хлорид и др.) либо обладают выраженными побочными явлениями, либо имеют недостаточную эффективность [13]. Возможным решением может явиться создание комбинированных препаратов, способных комплексно воздействовать на факторы, провоцирующие рецидив камнеобразования.
Реализацию обозначенного выше подхода представляет из себя разработанная компанией Devicare (Испания) линия средств Лит-Контроль®: Литура® Up, Литура® Balance, Литура® Down (табл. 1). Они применяются для метафилактики мочекаменной болезни в более чем 50 странах, включая Евросоюз, США и страны Азии. В настоящей статье будет рассмотрена доказательная база средств Литура® Up и Литура® Down, действие компонентов которых направлено на коррекцию уровня pH мочи и ингибирование кристаллизации солей в мочевых путях.
МАТЕРИАЛЫ И МЕТОДЫ
Проведен литературный поиск и анализ зарубежной и отечественной литературы с 1990 по 2024 год с отбором релевантных публикаций в базах eLibrary, PubMed и Google по ключевым словам – активным компонентам средств Lit-Control® pH Up (в России зарегистрирован как Литура® Up) – калий-магний цитрат, теобромин, цинк, витамин А, и Lit-Control® pH Down (в России зарегистрирован как Литура® Down) – фитаты, L-метионин, цинк, витамин А. Было найдено 189 источников, исходя из актуальности которых отобраны 60 статей. Для выявления дополнительных потенциально релевантных исследований проведен анализ ссылок во включенных источниках.
РЕЗУЛЬТАТЫ
Средство для повышения рН мочи
Комплексное средство для метафилактики МКБ Литура® Up содержит в 1 капсуле: цитрат калия – 200 мг, цитрат магния – 200 мг, теобромин – 60 мг, цинк – 1,3 мг и витамин А – 0,15 мг. Действие компонентов направлено на повышение уровня рН мочи с ингибированием нуклеации и роста камней, состоящих из мочевой кислоты, а также замедление образования соединений со свободным кальцием и обеспечение конкурентного связывания оксалатов. Дополнительно благодаря наличию в продукте витамина А обеспечивается улучшение функционального состояния мочевых путей. Данное средство разработано и запатентовано (международный патент WO/2015/150609) для метафилактики МКБ [14]. Регламентированная российской инструкцией схема приема – 1 капсула в сутки, продолжительность приема – не менее 1 месяца.
Цитратные смеси. Преимущества применения калий-магний цитрата. Их медицинское применение известно давно. Еще в 1800 году T. Trotter представил возможности применения цитратов в предотвращении развития цинги, а их использование при лечении МКБ в качестве литолитического средства, предложил в 1951 W. Staehler [15, 16]. Начиная с 1980-х годов, появились публикации, раскрывающие влияние цитратной терапии на метаболизм литогенных веществ. В 1983 году K. Sakhaee и соавт. показали, что на фоне приема калий-цитратных смесей отмечается значительное снижение уровня экскреции с мочой кальция, приводящее к снижению насыщенности кальция-оксалата в моче [17]. Чуть позднее C.Y. Pak и соавт. представили преимущество применения калий-магний цитрата над калий цитратом у пациентов с МКБ [18], а B. Ettinger и соавт. в рандомизированном плацебоконтролируемом клиническом исследовании показали, что ежедневный прием калий-магний цитрата в течение трех лет снижал риск камнеобразования на 85% [19].
В проведенной нами работе по изучению влияния цитратной терапии на содержание литогенных веществ в крови и суточной моче было показано, что на фоне двухнедельного приема калий-натрий цитратных смесей, с поддержанием уровня pH 6,2-6,8, значительно снижался уровень экскреции кальция с мочой [20].
Цитратные смеси используются не только в урологической практике. Известно, что препараты, состоящие из калия-магния цитрата, успешно применяют для предотвращения гипергликемии, вызванной тиазидными диуретиками, при этом они значительно превосходят по эффективности раствор калия-хлорида [21]. Двенадцатинедельный прием цитрата магния пациентами с гипомагниемией значительно улучшает параметры метаболического синдрома за счет нормализации систолического и диастолического артериального давления, а также снижения уровня гликозилированного гемоглобина [22].
Таблица 1. Состав линии средств Литура® для метафилактики МКБ
Table 1. Composition of the Lit-Control® Litura® line for the metaphylaxis of urolithiasis
| Действие Action |
Литура® Up Lit-Control® pH Up |
Литура® Balance Lit-Control® pH Balance |
Литура® Down Lit-Control® pH Down |
|---|---|---|---|
| Коррекция уровня рН мочи Correction of urine pH level |
Калий-магний цитрат Potassium Magnesium Citrate |
L-метионин L-Methionine |
|
| Ингибирование кристаллизации Inhibition of crystallization |
Теобромин Theobromine |
Магний, фитаты Magnesium, phytates |
Фитаты Phytates |
| Антиоксидантная защита уротелия Улучшение функционального состояния мочевых путей Antioxidant protection of the urothelium Improving the functional state of the urinary tract |
Витамин А, цинк Vitamin A, zinc |
Полифенолы Витамин А, цинк Polyphenols Vitamin A, zinc |
Витамин А, цинк Vitamin A, zinc |
В экспериментальных работах на животных (самцах крыс с хронической почечной недостаточностью) Z.Yao и соавт. показали, что прием магния-цитрата оказывает защитную роль в кальцификации сосудов.
B. Koc и соавт. отметили, что однократный прием цитрата магния в дозировке 66 мг/кг веса тела повышает болевой порог за счет снижения концентрации tollподобного рецептора (TLR4) в мозге [23, 24].
Несмотря на то, что цитратные смеси доказали свою эффективность в лечении МКБ, комбинирование их с другими действующими веществами может повышать эффективность и переносимость, а, следовательно, и приверженность пациентов к длительной противорецидивной терапии.
Теобромин – основной алкалоид какао-бобов и зеленого чая. Данное вещество обнаружено более чем в 60 растениях, в том числе в их листьях, семенах или плодах. Являясь диметилксантином, теобромин имеет схожую химическую структуру с другими природными метилксантинами: кофеин, параксантин, теофеллин и др., но в меньшей степени стимулирует работу центральной нервной системы (рис. 1).
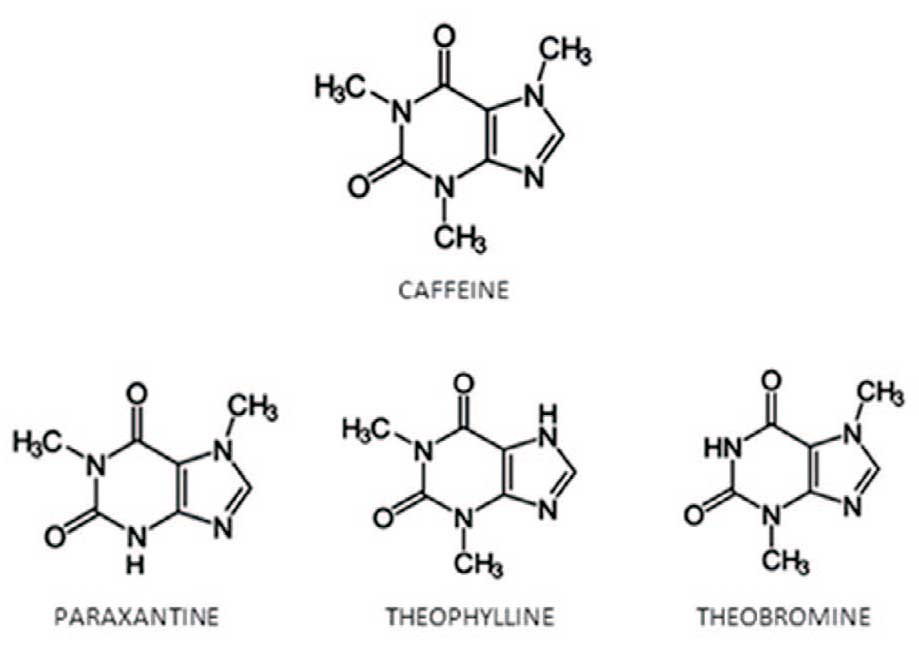
Рис. 1. Химическая структура метилксантинов: кофеин, теобромин, теофиллин и параксантин. Кофеин – это 1, 3, 7триметилксантин. Остальные три соединения представляют собой диметилксантины, которые различаются положением двух метильных групп
Fig. 1. Chemical structure of methylxanthines: caffeine, theobromine, theophylline
and paraxanthine. Caffeine is 1, 3, 7-trimethylxanthine. The remaining three compounds are dimethylxanthines, which differ in the position of the two methyl groups
Прием теобромина имеет ряд положительных эффектов: улучшается поверхность эмали зубов, подавляется кашлевой рефлекс, улучшаются показатели липидного профиля за счет повышения липопротеидов высокой плотности и снижения липопротеидов очень низкой плотности, оказывается диуретический и спазмолитический эффекты, замедляется развитие нейродегенератинвых заболеваний и др. [25–28].
Наряду с этим, для больных уролитиазом теобромин может выступать как ингибитор нуклеации и роста кристаллов мочевой кислоты. В ходе работы F. Grases и соавт. оценивали способность метилксантинов (кофеина, теофиллина, теобромина и параксантина) ингибировать кристаллизацию мочевой кислоты in vitro с помощью турбидиметрического анализа с последующей электронной микроскопией. Авторы показали, что в присутствии теобромина кристаллы мочевой кислоты становятся более мелкими, длинными и тонкими [29]. При этом ингибирующая активность теобромина была напрямую связана с повышением уровня pH мочи, в связи с чем для получения лучшего эффекта авторы рекомендовали использовать теобромин в сочетании с цитратными смесями. В более поздней работе K.G. Chattaraj и S. Paul продемонстрировали, что этот эффект происходит за счет встраивания молекулы теобромина в структуру мочевой кислоты, делая ее более растворимой в водной среде [30].
Способность теобромина повышать растворимость камней мочевой кислоты также была подтверждена in vitro в работе F. Julià и соавт. [31].
Y. Hernandez и соавт. в рандомизированном двойном слепом перекрестном исследовании продемонстрировали, что пациенты, получающие комбинацию калий–магния цитрата и теобромина, в отличии от пациентов, получающих только калий-магний цитрат, имели примерно на 30% меньший риск кристаллизации мочевой кислоты: 1,7% против 33,3% соответственно [32].
Немаловажным вопросом метафилактики МКБ является купирование воспаления, часто сочетающегося с мочекаменной болезнью. Учитывая известные ограничения длительной антибактериальной терапии (антибиотикорезистентность и др. побочные эффекты), возможно комбинирование антибиотиков с витамином А, выступающим в роли антагониста свободных радикалов кислорода.
Витамин А представляет собой группу ненасыщенных пищевых органических соединений, в которую входит ретинол, ретиналь, ретиноевая кислота и несколько каротиноидов провитамина А (особенно бета-каротин) [33]. Витамин А обладает противовоспалительным эффектом, а бета-каротин эффективен в инактивации свободных радикалов кислорода [34, 35]. В проведенном метаанализе G.Q. Zhang и соавт. продемонстрировано, что благодаря роли ретинола, как гормоноподобного фактора роста эпителиальных клеток, витамин А у детей участвует в реэпителизации поврежденной поверхности слизистой оболочки [36].
Исследования на животных также показали, что введение добавок витамина А крысам (модель с инфекцией мочевыделительных путей) позволяет снижать частоту склероза почек, при этом тяжелая форма нефросклероза в большей степени отмечалась только в случаях, когда уровень витамина А в сыворотке был ниже нормы [37].
Цинк, также входящий в состав препарата, играет ключевую роль в регенерации и поддержании состояния тканей, являясь центральным кофактором во множестве ферментативных реакций.
Умеренное потребление цинка благотворно влияет на почечную функцию. В работе A. Tokuyama и соавт. показано, что у пациентов с дефицитом цинка риск развития и прогрессирования хронической болезни почек (ХБП) выше. Назначение же препаратов, содержащих цинк, позволяет значительно снизить этот риск [38]. В тоже время чрезмерное потребление данного микроэлемента может вызывать формирование кальциевых камней [39]. Однако при суточной норме потребления цинка – 12 мг, рекомендованный режим приема средства Литура® Up (1 капсула содержит 1,3 мг цинка) полностью исключает вышеописанные риски.
Средство для снижения рН мочи
Комплексное средство для метафилактики МКБ Литура® Down содержит в 1 капсуле: 500 мг L – метионина, 144,5 г фитатов (производных фитиновой кислоты), 0,15 мг витамина А и 1,3 мг цинка. Механизм действия компонентов заключается в ингибировании роста инфекционных камней посредством подкисления мочи и ингибированию нуклеации кальцийсодержащих соединений. Благодаря наличию в продукте витамина А обеспечивается улучшение функционального состояния мочевых путей. Данное средство разработано и запатентовано (международные патенты WO/2015/150609 и WO/2015/181412) [40] для метафилактики инфекционного нефролитиаза. Рекомендуемая схема приема – 2 капсулы в сутки (утро-вечер), продолжительность приема – не менее 1 месяца.
L-метионин. В качестве основного действующего вещества выступает L-метионин (рис. 2), рекомендованный Российским и Европейским обществом урологов.
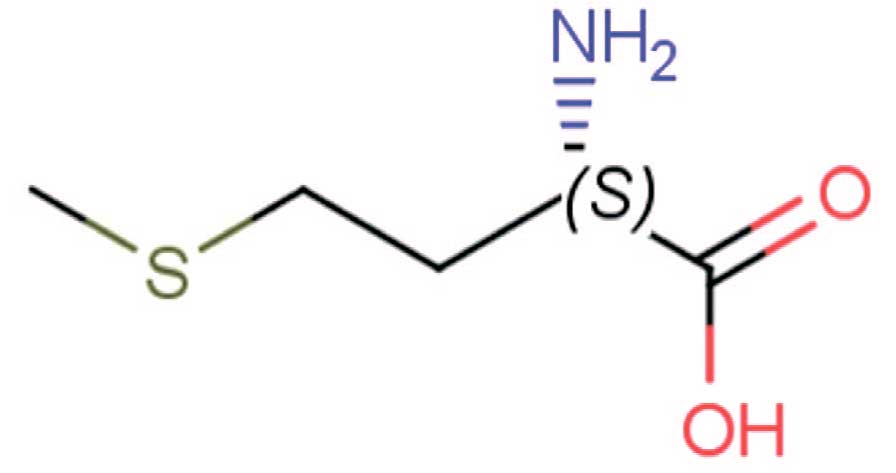
Рис. 2. Химическая формула L-Метионина
Fig. 2. Chemical formula of L-Methionine
Являясь незаменимой аминокислотой, содержащей в своем составе атом серы, L-метионин участвует в синтезе цистеина и таурина, является основой для белков и гормонов, вследствие чего влияет на многие жизненно важные процессы в организме. Подкисление мочи на фоне применения L–метионина у пациентов с инфекционными камнями приводит к формированию оксида азота, токсичного для бактерий, тем самым предотвращая их рост, а также повышает активность антибактериальных препаратов для лечения инфекции мочевыделительной системы (тетрациклины, нитрофурантоин, бета лактамы) и снижает агрегацию кристаллов кальция фосфата [41–44]. Прием суточной дозировки L-метионина 1500 мг здоровыми добровольцами привело не только к снижению уровня pH мочи, но и к увеличению экскреции сульфата с мочой (примерно на 10 ммоль/сут). Известно, что сульфат мочи представляет собой двухвалентный анион, который потенциально может связываться с ионизированным кальцием в моче, тем самым снижать его доступность для образования комплекса со свободным оксалатом и фосфатом [45].
Фитат или фитиновая кислота – (мио-инозитолгексафосфат, InsP6) (рис. 3) являющийся важным компонентом семян, бобовых, орехов и цельзерновых культурах.
Хотя эта молекула была открыта в 1855 году, ее биологические эффекты впервые были описаны только в 1940 году.
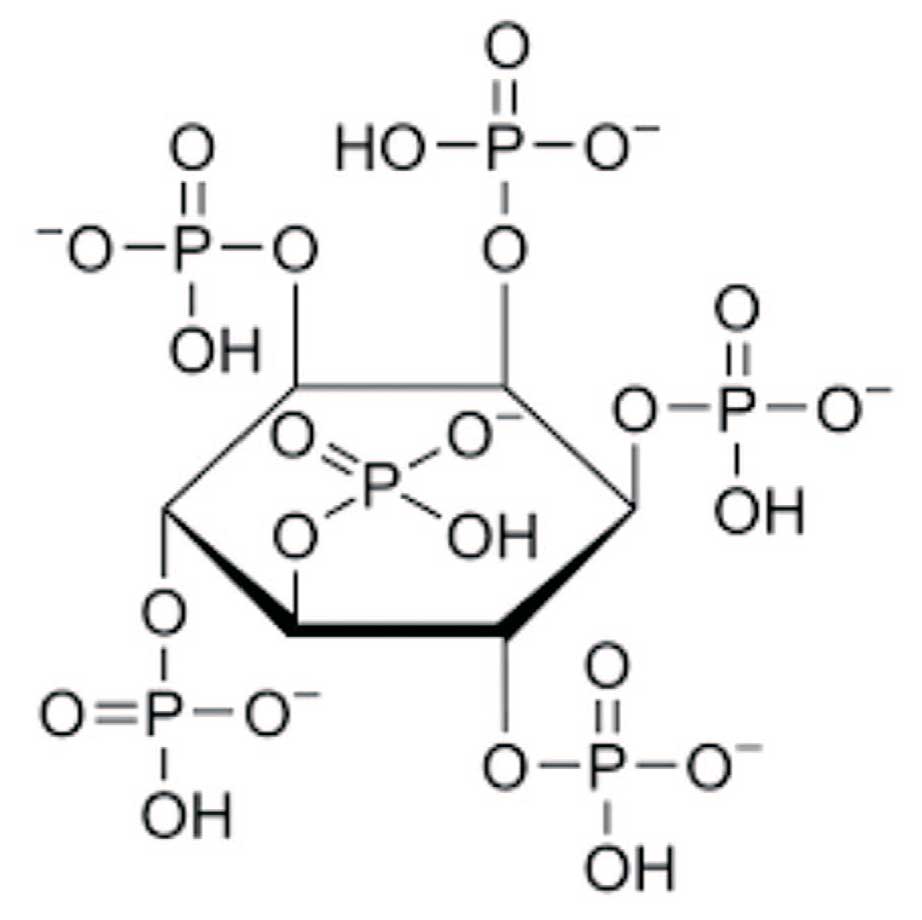
Рис. 3. Химическая формула фитиновой кислоты или фитата
Fig. 3. Chemical formula of phytic acid or phytate
За последние 30 лет представлено множество лабораторных и клинических исследований, результаты которых характеризуют фитат, как вещество, благоприятно влияющее на здоровье человека: может действовать как антиоксидант, обладает противораковой активностью посредством ингибирования роста и индукции дифференцировки опухолевых клеток, снижает риск развития уролитиаза и патологической кальцификации сосудов, снижает гликемический индекс и нормализует уровни глюкозы и холестерина [46–50].
В работе F. Grases и A. Costa-Bauza показано, что фитат можно рассматривать как «антикальцифицирующий витамин», поскольку его применение in vivo значительно снижает развитие кальцификации сосудов и мягких тканей, образования мочевых камней и развития остеопороза [51–54]. Y-C. Hsu и соавт. в исследовании in vitro показали, что фитат в отношении ингибирования нуклеации оксалата-кальция активнее гидроксицитрата, цитратов и магния [55]. В клиническом исследовании A. Conte и соавт. было продемонстрировано, что монотерапия фитатом сопровождается сопоставимой эффективностью в сравнении с цитратом калия по снижению литогенного риска у больных уролитиазом. При этом у пациентов, принимающих фитат, в сравнении с цитратом калия, не было зафиксировано изменений уровня pH мочи, что исключает риски антагонистического взаимодействия с метионином, а также риска стойкого смещения в щелочную сторону с образованием кальций-фосфатных камней [56]. В одном из последних исследований in vitro P. Calvó и соавт. было показано, что использование фитата актуально не только при кальций-оксалатных, но и при кальций-фосфатных камнях, главным образом, по типу брушита и в меньшей степени гидроксиапатита [57].
Интересные данные были получены той же группой авторов в 2022 г. в попытке оценить влияние фитатов на прикрепление бактерий к поверхности катетера в условиях, способствующих кристаллизации. Срезы катетера инкубировали в среде синтетической мочи (рН 6,5) в присутствии или в отсутствии Pseudomonas aeruginosa и фитата, а затем измеряли количество отложений кальция и бактерий, прикрепленных к стенту. В результате фитат успешно уменьшал бактериальную адгезию, ингибируя образование кристаллических отложений фосфата кальция (брушита и гидроксиапатита) и кристаллов оксалата в сравнении с контрольными образцами [58].
ОБСУЖДЕНИЕ
Проведенный литературный анализ показал, что состав Литура® Up и Литура® Down имеет научное обоснование, а входящие вещества и их комбинация могут приводить к потенцированию клинического эффекта при метафилактике МКБ.
Компоненты средства Литура® Up воздействуют на процессы кристаллизации мочевой кислоты не только посредством повышения рН мочи с помощью калий-магний цитрата, но и благодаря использованию в препарате теобромина, который, встраиваясь в кристаллическую решетку мочевой кислоты, вызывает ингибирование нуклеации и роста ее кристаллов. Кроме того, при повышении рН мочи теобромин многократно замедляет скорость формирования кристаллов мочевой кислоты [30]. Это явилось обоснованием для его добавления к калий-магний цитрату в составе Литура® Up с целью получения синергетического эффекта, повышающего его эффективность в сравнении с монотерапией цитратом примерно на 30% [33]. Использование витамина А в средстве Литура® Up обеспечивает противовоспалительный и антиоксидативный эффекты, что профилактирует нефросклероз, тем самым предотвращая развитие и прогрессирование почечной недостаточности. Опубликованные данные о применении комплексного средства Литура® Up в течение трех месяцев при метафилактике мочекислого нефролитаза в рамках интервенционного проспективного исследования 65 пациентов подтвердили отличную переносимость приема в 97,5% случаев [59].
Крайне важным представляется разработка средств для профилактики рецидива инфекционных камней. Компоненты Литура® Down способствуют подкислению мочи с ингибированием роста инфекционных камней и процесса образования нерастворимого фосфата кальция. В двойном слепом рандомизированном плацебо-контролируемом клиническом исследовании C. Torrecilla и соавт. была продемонстрирована эффективность применения Литура® Down у пациентов с установленными во время эндоурологических вмешательств по поводу МКБ мочеточниковыми J-J стентами [60]. На фоне применения Литура® Down в течение 8 недель было отмечено 8-кратное снижение риска инкрустрации концов стентов, а также достоверное снижение уровня pH мочи в сравнении с плацебо. Безопасность приема определялась на уровне группы плацебо. По данным другого проспективного интервенционного исследования коллектива J.A. GalanLlopis и соавт. в 2019 г. также была показана хорошая переносимость в 98,3% случаев приема Литура® Down в течение трех месяцев наблюдения [59].
Безусловно, необходимо дальнейшее проведение контролируемых клинических исследований для оценки перспектив применения данных комплексных средств.
ЗАКЛЮЧЕНИЕ
На основании зарубежных данных экспериментальных и клинических исследований, можно сделать вывод, что линия средств Литура®, используемых для коррекции уровня рН мочи и ингибирования кристаллизации при различных типах камнеобразования, может рассматриваться как новый перспективный подход к метафилактике МКБ.
ЛИТЕРАТУРА
- Zhang L, Zhang X, Pu Y, Zhang Y, Fan J. Global, regional, and national burden of urolithiasis from 1990 to 2019: a systematic analysis for the global burden of disease study 2019. Clinical Epidemiology 2022;14:971–983; https://doi.org/10.2147/CLEP.S370591.
- Scales CD, Jr, Smith AC, Hanley JM, Saigal CS. Urologic diseases in America project. Prevalence of kidney stones in the United States. Eur Urol 2012;62:160–165; https://doi.org/10.1016/j.eururo.
- Малхасян В.А., Семенякин И.В., Колонтарев К.Б. Метафилактика мочекаменной болезни: Учебно-методическое пособие. М.: ГБУЗ «ГКБ им. С.И. Спасокукоцкого ДЗМ», 2021. 76 с. [Malkhasyan V.A., Semenyakin I.V., Kolontarev K.B. Metaphylaxis of urolithiasis: Educational and methodological manual. M.: GBUZ «GKB im. S.I. Spasokukotsky DZM», 2021. 76 p. (In Russian)].
- Просянников М.Ю., Константинова О.В., Войтко Д.А., Анохин Н.В., Кураева В.М., Аполихин О.И., Сивков А.В. «Медицина 4п» на примере ведения пациентов с мочекаменной болезнью. Экспериментальная и клиническая урология 2019;4: 19-2 [Prosyannikov M.Yu., Konstantinova O.V., Voitko D.A., Anokhin N.V., Kuraeva V.M., Apolikhin O.I., Sivkov A.V. «Medicine 4p» using the example of managing patients with urolithiasis. Eksperimental'naya i klinicheskaya urologiya = Experimental and Clinical Urology 2019;4:19-2 (In Russian)].
- Rule AD, Lieske JC, Li X, Melton LJ 3rd, Krambeck AE, Bergstralh EJ. The ROKS nomogram for predicting a second symptomatic stone episode. J Am Soc Nephrol 2014;25(12):2878-86; https://doi.org/10.1681/ASN.2013091011.
- Ferraro PM, Curhan GC, D’Addessi A, Gambaro G. Risk of recurrence of idiopathic calcium kidney stones: analysis of data from the literature. J Nephrol 2017;30(2):227-33; https://doi.org/10.1007/s40620-016-0283-8.
- Fink HA, Wilt TJ, Eidman KE, Garimella PS, MacDonald R, et al. Medical management to prevent recurrent nephrolithiasis in adults: a systematic review for an American College of Physicians Clinical Guideline. Ann Intern Med 2013;158(7):535-43. https://doi.org/10.7326/0003-4819-158-7-201304020-00005.
- Аполихин О.И., Сивков А.В., Катибов М.И., Золотухин О.В., Шадеркин И.А., Просянников М.Ю., и др. Предварительные результаты комплексной этапной стандартизированной программы диагностики и лечения ДГПЖ. Экспериментальная и клиническая урология 2014;(1):4-8 [Apolikhin O.I., Sivkov A.V., Katibov M.I., Zolotukhin O.V., Shaderkin I.A., Prosyannikov M.Yu., et al. Preliminary results of a comprehensive staged standardized program for the diagnosis and treatment of BPH. Eksperimentalnaya i Klinicheskaya urologiya = Experimental and Clinical Urology 2014;1: 4–8 (In Russian)].
- Аполихин О.И., Сивков А.В., Чернышев И.В., Золотухин О.И., Щукин А.В., Кузьменко В.В., и др. Программа «урология» модернизация здравоохранения на примере урологической службы Воронежской области Экспериментальная и клиническая урология 2012;(3):4-8. [Apolikhin O.I., Sivkov A.V., Chernyshev I.V., Zolotukhin O.I., Shchukin A.V., Kuzmenko V.V., et al. Program «urology» modernization of healthcare using the example of the urological service of the Voronezh region. Eksperimentalnaya i Klinicheskaya urologiya=Experimental and Clinical Urology= Experimental and Clinical Urology 2012;(3):4-8 (In Russian)].
- Шишкин С.В., Аполихин О.И., Сажина С.В., Шадеркин И.А., Золотухин О.В., Просянников М.Ю. Повышение эффективности специализированной медицинской помощи: опыт структурных преобразований. Вопросы государственного и муниципального управления 2015;(2):79-99 [Shishkin S.V., Apolikhin O.I., Sazhina S.V., Shaderkin I.A., Zolotukhin O.V., Prosyannikov M.Yu. Increasing the efficiency of specialized medical care: experience of structural transformations. Voprosy gosudarstvennogo i municipal'nogo upravleniya = Issues of state and municipal management 2015;(2):79–99 (In Russian)].
- Голованов С.А., Сивков А.В., Поликарпова А.М., Дрожжева В.В., Андрюхин М.И., Просянников М.Ю. Метаболические факторы риска и формирование мочевых камней. исследование III: влияние pH мочи Экспериментальная и клиническая урология 2018;(1):84-91 [Golovanov S.A., Sivkov A.V., Polikarpova A.M., Drozhzheva V.V., Andryukhin M.I., Prosyannikov M.Yu. Metabolic risk factors and urinary stone formation. study III: influence of urine pH. Eksperimentalnaya i Klinicheskaya urologiya= Experimental and Clinical Urology 2018;(1):84-91 (In Russian)].
- Gao J, Xue JF, Xu M, Gui BS, Wang FX, Ouyang JM. Nanouric acid or nanocalcium phosphate as central nidus to induce calcium oxalate stone formation: a high-resolution transmission electron microscopy study on urinary nanocrystallites. Int J Nanomedicine 2014;9:4399–409; https://doi.org/10.2147/IJN.S66000.
- Гаджиев Н.К., Гелиг В.А., Кутина А.В. Кислотно-основное состояние (pH) мочи: механизм регуляции и его роль в метафилактике мочекаменной болезни. Вестник урологии 2022;(4):120-40 [Gadzhiev N.K., Gelig V.A., Kutina A.V. Acid-base state (pH) of urine: regulation mechanism and its role in the metaphylaxis of urolithiasis. Vestnik urologii = Urology Herald 2022;(4):120-40 (In Russian)].
- International Patent WO2015150609. International Patent Classification: A61K31/191 Combination of a urinary basifying agent and a uric acid crystallisation inhibitor for the treatment or prevention of renal lithiasis. // Inventors: Grases Freixedas, Costa Bauzá, Prieto Almirall, Rodríguez Rodríguez. URL: https://patentscope.wipo.int/search/en/detail.jsf?docId=WO2015150609.
- Trotter T. Dr. Trotter, on Citric Acid. Med Phys J 1800;4(18):154–6.
- Staehler W. Dissolution of renal calculi by citric acid administration through ureteral catheter; instrumental litholysis. Med Welt 1951;20(37):1129-30.
- Sakhaee K, Nicar M, Hill K, Pak C Y. Contrasting effects of potassium citrate and sodium citrate therapies on urinary chemistries and crystallization of stone-forming salts. Kidney Int 1983;24(3):348-52. https://doi.org/10.1038/ki.1983.165.
- Pak CY, Koenig K, Khan R, Haynes S, Padalino P. Physicochemical action of potassium-magnesium citrate in nephrolithiasis. J Bone Miner Res 1992;7(3):281-5; https://doi.org/10.1002/jbmr.5650070306.
- Ettinger B, Pak CY, Citron JT, Thomas C, Adams-Huet B, Vangessel A. Potassium-magnesium citrate is an effective prophylaxis against recurrent calcium oxalate nephrolithiasis. J Urol 1997;158(6):2069-73; https://doi.org/10.1016/s0022-5347(01)68155-2.
- Просянников М.Ю., Константинова О.В., Голованов С.А., Анохин Н.В., Войтко Д.А., Сивков А.В., и др. Роль щелочных цитратов в метафилактике мочекаменной болезни. Урология 2022;3:19-25 [Prosyannikov M.Yu., Konstantinova O.V., Golovanov S.A., Anokhin N.V., Voitko D.A., Sivkov A.V., et al. The role of alkaline citrates in the metaphylaxis of urolithiasis. Urologia = Urology 2022;(3):19-25 (In Russian)]
- Vongpatanasin W, Giacona JM, Pittman D, Murillo A, Khan G, Wang J, et al. Johnson T. Potassium magnesium citrate is superior to potassium chloride in reversing metabolic side effects of chlorthalidone. Hypertension 2023;80(12):2611-20. https://doi.org/10.1161/HYPERTENSIONAHA.123.21932.
- Afitska K, Clavel J, Kisters K, Vormann J, Werner T. Magnesium citrate supplementation decreased blood pressure and HbA1c in normomagnesemic subjects with metabolic syndrome: a 12-week, placebo-controlled, doubleblinded pilot trial. Magnes Res 2021;34(3):130-9. https://doi.org/10.1684/mrh.2021.0489.
- Yao Z, Xu Y, Ma W, Sun XY, Jia S, Zheng Y, et al. Magnesium citrate protects against vascular calcification in an adenine-induced chronic renal failure rat model. J Cardiovasc Pharmacol 2018;72(6):270-6. https://doi.org/10.1097/FJC.0000000000000590.
- Koc B, Kizildag S, Hosgorler F, Gumus H, Kandis S, Ates M, et al. Magnesium citrate increases pain threshold and reduces TLR4 concentration in the brain. Biol Trace Elem Res 2021;199(5):1954-66. https://doi.org/10.1007/s12011-020-02384-5.
- Kargul B, Ozcan M, Peker S, Nakamoto T, Simmons WB, Falster AU. Evaluation of human enamel surfaces treated with theobromine: a pilot study. Oral Health Prev Dent 2012;10(3):275–82.
- Halfdanarson TR, Jatoi A. Chocolate as a cough suppressant: rationaleand justification for an upcoming clinical trial. Support Cancer Ther 2007;4(2):119-22. https://doi.org/10.3816/SCT.2007.n.006.
- Khan N, Monagas M, Andres-Lacueva C, Casas R, Urpi-Sarda M, Lamuela-Raventós RM, et al. Regular consumption of cocoa powder with milk increases HDL cholesterol and reduces oxidized LDL levels in subjects at high-risk of cardiovascular disease. Nutr Metab Cardiovasc Dis 2012;22(12):1046-53. https://doi.org/10.1016/j.numecd.2011.02.001.
- Latosińska JN, Latosińska M, Olejniczak GA, Seliger J, Žagar V. Topology of the interactions pattern in pharmaceutically relevant polymorphs of methylxanthines (caffeine, theobromine, and theophiline): combined experimental (1H14N nuclear quadrupole double resonance) and computational (DFT and Hirshfeld-based) study. J Chem Inf Model 2014;54 (9):2570−84; https://doi.org/10.1021/ci5004224.
- Grases F, Rodriguez A, Costa-Bauza A. Theobromine inhibits uric acid crystallization. A potential application in the treatment of uric acid nephrolithiasis. PLOS One 2014;9 (10):e111184; https://doi.org/10.1371/journal.pone.0111184.
- Chattaraj KG, Paul S. Inclusion of theobromine modifies uric acid aggregation with possible changes in melamine−uric acid clusters responsible for kidney stones. J Phys Chem B 2019;123(49):10483-10504; https://doi.org/10.1021/acs.jpcb.9b08487.2019,123,10483−10504.
- Julià F, Costa-Bauza A, Berga F, Grases F. Effect of theobromine on dissolution of uric acid kidney stones. World J Urol 2022;40(8):2105-2111; https://doi.org/10.1007/s00345-022-04059-3.
- Hernandez Y, Costa-Bauza A, Calvó P, Benejam J, Sanchis P, Grases F. Comparison of two dietary supplements for treatment of uric acid renal lithiasis: citrate vs. citrate + theobromine. Nutrients 2020;12(7):2012; https://doi.org/10.3390/nu12072012.
- Reifen R, Levy E, Berkovich Z, Tirosh O. Vitamin A exerts its antiinflammatory activities in colitis through preservation of mitochondrial activity. Nutrition 2015;31(11-12):1402-7; https://doi.org/10.1016/j.nut.2015.05.011
- Reifen R. Vitamin A as an anti-inflammatory agent. Proc Nutr Soc 2002;61(3):397-400; https://doi.org/10.1079/PNS2002172.
- Bates CJ. Vitamin A. Lancet 1995;345(8941):31-35; https://doi.org/10.1016/s0140-6736(95)91157-x.
- Zhang GQ, Chen JL, Zhao Y. The effect of vitamin A on renal damage following acute pyelonephritis in children: a meta-analysis of randomized controlled trials. Pediatr Nephrol 2016;31(3):373-9; https://doi.org/10.1007/s00467-015-3098-2.
- Kahbazi M, Sharafkhah M, Yousefichaijan P, Taherahmadi H, Rafiei M, Kaviani P, et al. Vitamin A supplementation is effective for improving the clinical symptoms of Urinary tract infections and reducing renal scarring in girls with acute pyelonephritis: A randomized, double-blind placebo-controlled, clinical trial study, Complement Ther Med 2019:42:429-37; https://doi.org/10.1016/j.ctim.2018.12.007.
- Tokuyama A, Kanda E, Itano S, Kondo M, Wada Y, Kadoya H, et al. Effect of zinc deficiency on chronic kidney disease progression and effect modification by hypoalbuminemia. PLoS One 2021;16(5):e0251554. https://doi.org/10.1371/journal.pone.0251554.
- Сальникова Е.В. Потребность человека в цинке и его источники (обзор). Микроэлементы в медицине 2016;17(4):11-5 [Salnikova E.V. Human need for zinc and its sources (review). Mikroelementy v medicine = Microelements in medicine 2016;17(4): 11-15 (In Russian)].
- International Patent WO/2015/181412. Theobromine or its derivatives for the treatment or prevention of renal lithiasis. // Inventors: Grases Freixedas, Costa Bauzá, Prieto Almirall, Rodríguez Rodríguez. URL: https://data.epo.org/publication-server/rest/v1.0/publicationdates/20230816/patents/EP3150208NWB1/document.pdf.
- Carlsson S, Wiklund NP, Engstrand L, Weitzberg E, Lundberg JO. Effects of pH, nitrite, and ascorbic acid on nonenzymatic nitric oxide generation and bacterial growth in urine. Nitric Oxide 2001;5(6):580-6; https://doi.org/10.1006/niox.2001.0371.
- Jarrar K, Boedeker RH, Weidner W. Struvite stones: long term follow up under metaphylaxis. Ann Urol (Paris) 1996;30(3):112-7.
- Yang L, Wang K, Li H, Denstedt JD, Cadieux PA. The influence of urinary pH on antibiotic efficacy against bacterial uropathogens. Urology 2014;84(3):731.e1-7; https://doi.org/10.1016/j.urology.2014.04.048.
- Siener R, Struwe F, Hesse A. Effect of L-methionine on the risk of phosphate stone formation. Urology 2016;98:39-43;
- Rodgers A, Gauvin D, Edeh S, Allie-Hamdulay S, Jackson G, Lieske JC. Sulfate but not thiosulfate reduces calculated and measured urinary calcium and supersaturation: implications for the treatment of calcium renal stones. PLoS One 2014;9(7):e103602; https://doi.org/10.1371/journal.pone.0103602.
- Graf E, Empson KL, Eaton JW. Phytic acid. A natural antioxidant. J Biol Chem 1987;262(24):11647–50.
- Vucenik I, Shamsuddin AM. Protection against cancer by dietary IP6 and inositol. Nutr Cancer 2006;55(2):109-25. https://doi.org/10.1207/s15327914nc5502_1.
- Grases F, Costa-Bauza A. Phytate (IP6) is a powerful agent for preventing calcifications in biological fluids: usefulness in renal lithiasis treatment. Anticancer Res 1999;19(5A):3717–22.
- Lee SH, Park HJ, Chun HK, Cho SY, Cho SM, et al. Dietary phytic acid lowers the blood glucose level in diabetic KK mice. Nutr Res 2006;26:474–9. https://doi.org/10.1016/j.nutres.2006.06.017.
- Lee SH, Park HJ, Chun HK, Cho SY, Jung HJ, Cho SM, et al. Dietary phytic acid improves serum and hepatic lipid levels in aged ICR mice fed a high-cholesterol diet. Nutr Res 2007;27:505–10; https://doi.org/10.1016/j.nutres.2007.05.003.
- Grases F, Costa-Bauza A. Key Aspects of myo-inositol hexaphosphate (phytate) and pathological calcifications. Molecules 2019;24(24):4434. https://doi.org/10.3390/molecules24244434.
- Pires SMG, Reis RS, Cardoso SM, Pezzani R, Paredes-Osses E, Seilkhan A, et al. Phytates as a natural source for health promotion: A critical evaluation of clinical trials. Front Chem 2023;11:1174109; https://doi.org/10.3389/fchem.2023.1174109.
- López-González AA, Grases F, Monroy N, Marí B, Vicente-Herrero MT, Tur F, et al. Protective effect of myo-inositol hexaphosphate (phytate) on bone mass loss in postmenopausal women. Eur J Nutr 2013;52(2):717-26; https://doi.org/10.1007/s00394-012-0377-6.
- Guimerà J, Martínez A, Bauza JL, Sanchís P, Pieras E, Grases F. Effect of phytate on hypercalciuria secondary to bone resorption in patients with urinary stones: pilot study. Urolithiasis 2022;50(6):685-90; https://doi.org/10.1007/s00240-022-01357-8.
- Hsu Y-C, Lin Y-H, Shiau L-D. Effects of various inhibitors on the nucleation of calcium oxalate in synthetic urine. Crystals 2020;10(4):333.
- Conte A, Pizá P, García-Raja A. Urinary lithogen risk test: usefulness in the evaluation of renal lithiasis treatment using crystallization inhibitors (citrate and phytate). Arch Esp Urol 1999;52(1):94-9.
- Calvó P, Costa-Bauza A, Grases F. Effect of phytate (InsP6) and Other Inositol-Phosphates (InsP5, InsP4, InsP3, InsP2) on crystallization of calcium oxalate, brushite, and hydroxyapatite. Biomolecules 2023;13(7):1061; https://doi.org/10.3390/biom13071061.
- Calvó P, Mateu-Borras M, Costa-Bauza A, Albertí S, Grases F. Effect of phytate on crystallization on ureteral stents and bacterial attachment: an in vitro study. Urolithiasis 2022;50(6):737-42; https://doi.org/10.1007/s00240-022-01350-1.
- Torrecilla C, Fernández-Concha J, Cansino JR, Mainez JA, Amón JH, Costas S,et al. Reduction of ureteral stent encrustation by modulating the urine pH and inhibiting the crystal film with a new oral composition: a multicenter, placebo controlled, double blind, randomized clinical trial. BMC Urol 2020;20(1):65; https://doi.org/10.1186/s12894-020-00633-2.
- Galan-Llopis JA, Torrecilla-Ortiz C, Luque-Gálvez MP, Group P-L, PerisNieto X, Cuñé-Castellana J. Urinary pH as a target in the management of lithiasic patients in real-world practice: monitoring and nutraceutical intervention for a nonlithogenic pH range. Clinical Medicine Insights: Urology 2019;12:1–8. https://doi.org/10.1177/1179561119853556.







