ВВЕДЕНИЕ
Подходы к диагностике и стадированию локализованного и местно-распространенного рака предстательной железы высокого риска (РПЖ-ВР) продолжают активно исследоваться и совершенствоваться. Стандартное первичное обследование, длительное время включавшее в себя магнитно-резонансную томографию (МРТ) таза, остеоцинтиграфию (ОСГ), компьютерную томографию (КТ) груди и живота, в последнее время заменяется альтернативными вариантами, часто более существенно оказывающими влияние на лечебный процесс.
МАТЕРИАЛЫ И МЕТОДЫ
Для оценки некоторых неоднозначных и спорных вопросов относительно диагностики РПЖ-ВР был проведен опрос, в котором приняло участие 250 специалистов – онкоурологов, урологов, андрологов, специализирующихся на лечении/наблюдении пациентов с раком предстательной железы (РПЖ).
Опрос проводился в рамках урологического информационного портала Uroweb.ru путем заполнения опросника. Информирование специалистов об опросе проводилось через рассылки по электронной почте.
РЕЗУЛЬТАТЫ
ПЭТ/КТ в первичной диагностике локализованного и местно-распространенного РПЖ-ВР
В рекомендациях Европейской Ассоциации Урологов (EAU) и Hациональной комплексной онкологической сети (NCCN) можно наблюдать определенные различия по данному вопросу.
Согласно данным, приведенным ЕАU, чувствительность и специфичность позитронно-эмиссионной и компьютерной томографий (ПЭТ/КТ) при выявлении метастазов в лимфатические узлы, кости при первичном стадировании значительно выше, чем при выполнении остеосцинтиграфии, КТ органов брюшной полости, малого таза. Так, чувствительность КТ в выявлении поражения лимфатических узлов меньше 40%, специфичность может достигать 98%, а чувствительность и специфичность ПЭТ/КТ с простатспецифическим мембран-антигеном (ПСМА) может достигать 75% и 99% соответственно [1].
Чувствительность и специфичность остеосцинтиграфии, рассчитанные по пациенту, достигают 79% и 82% соответственно, тогда как при использовании ПЭТ/КТ с холином данные показатели составляют 91% и 99%. Но в настоящее время отсутствуют крупные исследования, показывающие как выявление метастазов только с помощью ПЭТ/КТ влияет на тактику и онкологические результаты впоследствии и поэтому на сегодняшний день назначение ПЭТ/КТ для стадирования первичного процесса до сих пор не является общепризнанной диагностической процедурой, в том числе при РПЖ-ВР [1].
Согласно рекомендациям NCCN, пациентам неблагоприятного промежуточного, высокого и очень высокого риска или всем симптомным пациентам при получении сомнительных результатов остеосцинтиграфии может быть рассмотрена ПЭТ/КТ [2].
В недавно опубликованном проспективном многоцентровом исследовании M.S. Hofman и соавт. изучалась точность и влияние на лечение ПЭТ/КТ с 68Ga-ПСМА, выполненной до первичного лечения пациентам с локализованным РПЖ-ВР. Пациенты с гистологически верифицированным РПЖ-ВР были распределены в группу традиционной визуализации (КТ, остеосцинтиграфия) и в группу ПЭТ/КТ с ПСМА. В случаях, когда при первичной визуализации не было выявлено три и более отдаленных метастазов, пациентам с ранее выполненными КТ и остеосцинтиграфией выполнялась ПЭТ/КТ с ПСМА, и наоборот, пациентам с ранее выполненной ПЭТ – остеосцинтиграфия. По результатам исследования точность ПЭТ/КТ с ПСМА превысила на 27% (92% против 65%) методы традиционной визуализации. КТ и остеосцинтиграфия продемонстрировали меньшую чувствительность (38% против 85%) и специфичность (91% против 98%) по сравнению с ПЭТ/КТ-ПСМА. Изменения в ведении пациентов на основе полученных результатов методов визуализации чаще наблюдались в группе ПЭТ/КТ с ПСМА, однако авторы не устанавливают (ввиду сложностей, связанных с перекрестным характером исследования), как эти изменения влияют на долгосрочные онкологические результаты [3]. На основании результатов этой работы можно сделать вывод, что ПЭТ/КТ является более информативным методом по сравнению с традиционными, но требуются крупные проспективные исследования, которые бы показали улучшение долгосрочных результатов.
По данному вопросу получены неоднозначные результаты опроса: 40% участников опроса ответили, что рекомендуют пациентам с РПЖ-ВР выполнение ПЭТ/КТ с 68Ga-ПСМА и 54% – не рекомендуют, что в целом отражает общемировые тенденции в диагностике этих больных (рис. 1).
Назначаете ли вы ПЭТ/КТ перед первичным лечением (РПЭ, лучевая терапия) пациентам с подозрением на локализованный или местно-распространенный рак предстательной железы высокого риска?
Do you prescribe PET / CT before primary treatment (RP, radiation therapy) for patients with suspected high-risk localized or locally advanced prostate cancer?

Рис. 1. Результат ответа на вопрос об отношении к ПЭТ/КТ в первичной диагностике РПЖ-ВР
Fig. 1. The result of answering the question about the attitude to PET/CT in the primary diagnosis of high-risk prostate cancer
Генетические исследования в первичной диагностике локализованного и местно-распространенного РПЖ-ВР
Второй вопрос был посвящен проблеме генетических исследований, выполняемых перед первичным лечением пациентам с локализованным и местно-распространенным РПЖ-ВР. Многочисленные рекомендации и консенсусные группы рекомендуют генетическое исследование для пациентов с метастатическим РПЖ в основном из-за убедительных данных об эффективности определенных групп препаратов у пациентов с мутациями BRCA ½ или диагностированным с помощью генетического исследования дефицитом репарации несоответствий ДНК [1, 2, 4, 5].
Согласно рекомендациям NCCN, генетическое исследование может быть предложено всем пациентам с РПЖ высокого и очень высокого риска [2]. Однако с какой целью необходимо выполнять генетическое исследование таким пациентам и какое значение это будет иметь в лечении остается неясным. На сегодняшний момент генетическое исследование при локализованном РПЖ может лишь информировать о наследственном характере заболевания и наследственном риске, а также, возможно, определить лечебные опции в будущем [4]. Вероятно, в дальнейшем по мере накопления данных генетическое исследование будет иметь большое значение при ведении пациентов с локализованным и местно-распространенным РПЖ-ВР, но сегодня подавляющее количество (88,8%) российских урологов не назначают генетические исследования и консультацию генетика при неметастатическом РПЖ (рис. 2).
Назначаете ли вы генетические исследования перед первичным лечением (РПЭ, лучевая терапия) пациентам с подозрением на локализованный или местно-распространенный РПЖ-ВР?
Do you prescribe genetic testing before primary treatment (RP, radiation therapy) in patients with suspected localized or locally advanced VR-PC?
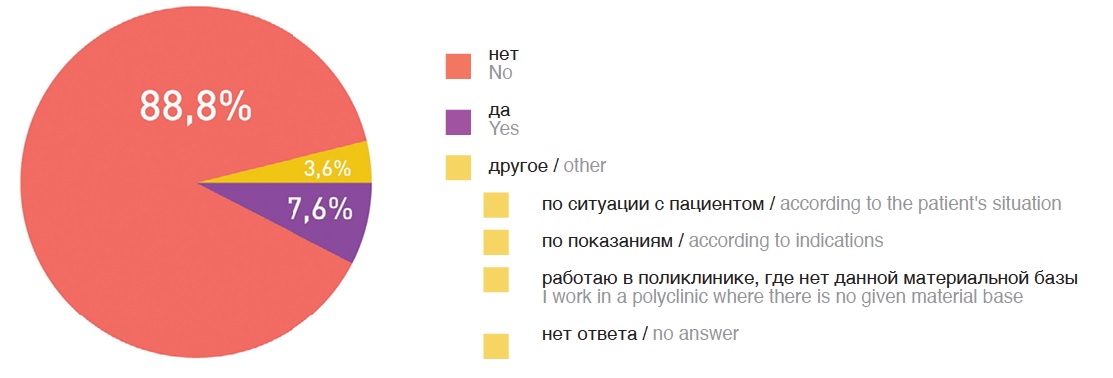
Рис. 2. Ответы на вопрос о назначении генетических исследований в первичной диагностике РПЖ-ВР
Fig. 2. Answers to the question about the purpose of genetic studies in the primary diagnosis of high-risk prostate cancer
Оценка местной распространенности в определении группы риска РПЖ
Третий вопрос был посвящен различию в критериях NCCN и ЕAU по отнесению РПЖ к группе высокого риска. Так, согласно классификации EAU, к группе высокого риска относят пациентов с одним из следующих критериев: уровень ПСА больше 20 нг/мл, сумма баллов по шкале Глисона больше 7, клиническая стадия сТ2с и выше [1]. По рекомендациям NCCN, к группам высокого и очень высокого риска следует относить пациентов с более распространенным РПЖ – с клинической стадией сТ3а и выше [2]. Чтобы ответить на вопрос, критериями каких рекомендаций целесообразнее пользоваться, необходимо исследовать их предиктивную способность. В исследовании R. Zelic и соавт. сравнили предиктивную способность всех распространенных систем стратификации риска РПЖ путем оценки индекса конкордации (C-индекс). В итоге была продемонстрирована практически одинаковая предиктивная способность NCCN и EAU (C-index: 0.73– 0.77), как и в целом всех систем на основе стратификации D`Amico [6]. В то же время, наше недавнее исследование показало, что патоморфологические показатели менее благоприятны при оценке по критериям NCCN. Учитывая полученные нами результаты, для определения прогноза пациентов с РПЖ-ВР перед РПЭ возможно использование любой из предложенных моделей, однако оценка по критериям NCCN позволяет лучше прогнозировать онкологические результаты и на основании них назначить лечение, соответствующее агрессивности заболевания [7]. В целом, большинство (57,4%) коллег ответили, что для стратификации по высокому риску не обязательно иметь местно-распространенный процесс, тогда как 41,8% считают, что распространенность Т3а и выше лучше характеризует РПЖ-ВР (рис. 3).
При прочих равных условиях (ПСА<20 нг/мл, сумма Глисона<8), к РПЖ-ВР вы относите процесс
All other things being equal (PSA <20 ng / ml, Gleason sum <8), you attribute the process to high-risk prostate cancer
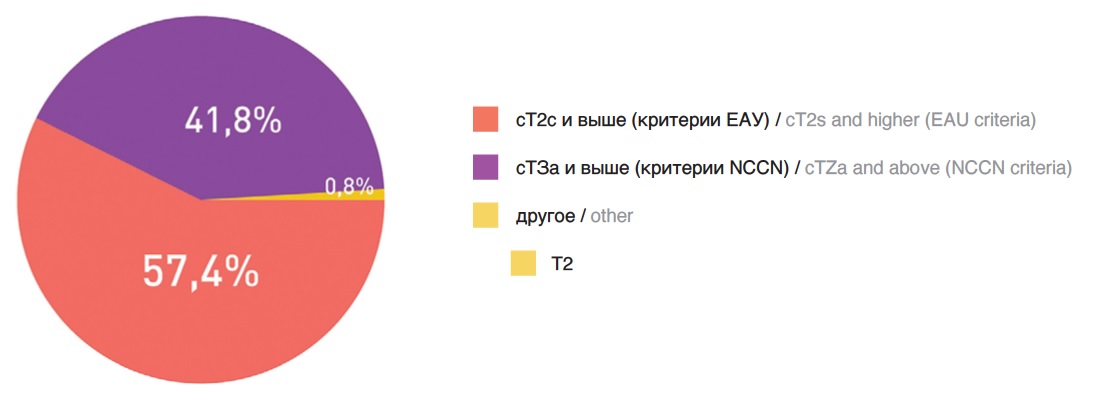
Рис. 3. Ответы на вопрос о роли оценки местной распространённости в стратификации РПЖ по риску прогрессирования
Fig. 3. Answers to the question about the role of local prevalence estimation in stratification of prostate cancer according to the risk of progression
Методы оценки местной распространенности РПЖ.
Какие методы считаются основными для оценки местной распространенности РПЖ? По рекомендациям NCCN, мультипараметрическая МРТ (мп-МРТ) помогает в определении экстракапсулярного распространения опухоли (Т-стадирование). В исследовании D.M. Somford и соавт. изучались положительная и отрицательная прогностические ценности мп-МРТ в определении экстрапростатического распространения опухоли (в качестве ориентира была патологическая стадия после радикальной простатэктомии) [8]. Общая точность в оценке распространенности РПЖ составила 73,8%, чувствительность – 58,2%, специфичность – 89,1%, отрицательная прогностическая ценность – 68,3%, положительная прогностическая ценность – 84,1%. Положительная прогностическая ценность мп-МРТ была наилучшей в когорте РПЖ-ВР – 88,8%. Данные результаты позволили авторам сделать вывод, что мпМРТ является наилучшим методом дооперационной оценки экстрапростатического распространения опухоли [8]. В метаанализе M. Rooij и соавт. на основе 75 исследований (9796 пациентов) определены чувствительность и специфичность мп-МРТ при выявлении экстракапсулярного распространения (соответственно 0,57 и 0,91), инвазии в семенные пузырьки (0,58 и 0,96), общем выявлении стадии T3 (0,61 и 0,88). Таким образом, мп-МРТ обладает высокой специфичностью, но недостаточной чувствительностью в Т-стадировании, в первую очередь, из-за низкой способности выявить микроскопическое прорастание капсулы [9]. В метаанализе А. Eissa и соавт. оценивалась прогностическая точность таблиц Partin в экстрапростатическом распространении опухоли. Объединенная AUC различных версий таблиц Partin показала низкую дискриминативную эффективность (<0,7), что вызывает опасения по поводу надежности этого инструмента при прогнозировании экстрапростатического распространения опухоли [10]. Другими критериями оценки предполагаемой распространенности процесса являются длина столбика опухолевой ткани в биопсийном материале и данные пальцевого ректального исследования. Именно эти параметры распространенности оказались наиболее часто оцениваемыми в опросе (рис. 4).
Какой из методов вы считаете основным для подтверждения или исключения местной распространенности опухоли?
Which of the methods do you consider to be the main one for confirming or excluding the local spread of the tumor?

Рис. 4. Ответы на вопрос о роли оценки местной распространённости в стратификации рака простаты по риску прогрессирования
Fig. 4. Answers to the question about the role of local prevalence estimation in stratification of prostate cancer according to the risk of progression
Критерии при определении прогноза заболевания у пациентов после радикальной простатэктомии (РПЭ)
Прогноз заболевания до радикального лечения и после – не всегда одно и то же. Например, после РПЭ он нередко меняется, тогда как при проведении лучевой терапии остается прежним. В связи с этим, актуален вопрос – какими критериями пользуются клиницисты при определении прогноза заболевания у пациентов после выполнения РПЭ. В исследовании N. Vau и соавт. изучались предикторы биохимического рецидива (БР) у пациентов после лапароскопической простатэктомии, по результатам которого авторами были выбраны следующие независимые предикторы выживаемости без биохимической прогрессии – выполнялась или нет лимфоаденэктомия (выполнение лимфоаденэктомии свидетельствует о более агрессивном характере заболевания, худшем прогнозе, p=0,2), гистологический подтип опухоли (ацинарная аденокарцинома или смешанный подтип характеризуют худший прогноз, р=0,002), лимфоваскулярная инвазия (р=0,023), наличие третичного показателя Глисона 5 (p=0,16), градирующая группа по рекомендации международного общества урологов (ISUP) (р≤0,0001) [11]. В исследовании Т. Negishi и соавт. оценивались такие предикторы (БР), как предоперационный уровень простатспецифического антигена (ПСА) и положительный хирургический край, в разные периоды после РПЭ (группа с рецидивом <5 лет после операции и группа с рецидивом ≥5 лет после операции), по результатам которого было выявлено, что предоперационный ПСА является значимым предиктором БР через <5 лет после операции (отношение рисков: 1,03, p<0,0001) и не является значимым предиктором БР через ≥5 лет после хирургического лечения (отношение рисков: 0,98; p=0,503). В свою очередь положительный хирургический край по результатам авторов является значимым предиктором БР через <5 лет после операции (отношение рисков: 3,20; p<0,0001), а также через ≥5 лет после операции (отношение рисков: 3,03; p=0,0360), на основе чего авторы делают выводы о необходимости длительного наблюдения за пациентами после РПЭ в случае положительного хирургического края [12]. В многоцентровом ретроспективном исследовании А. Yokomizo и соавт. проводилась оценка клинико-патологических данных у пациентов с сТ1-Т2 РПЖ после ПЭ (1192 пациента, медиана наблюдения 45,6 месяца, 302 (25,3%) случая БР). В результате многофакторного анализа было установлено, что процент позитивных столбиков при биопсии простаты, предоперационный уровень ПСА, pT и сумма Глисона в препарате после радикальной простатэктомии являются независимыми значимыми предикторами БР (p<0,001 для всех) [13].
Таким образом, на основании многочисленных исследований, демонстрирующих прогностическую ценность патоморфологического заключения, предоперационного уровня ПСА, можно сделать вывод о необходимости их использования в качестве критерия для прогнозирования рецидива РПЖ после РПЭ, что также отражено в результатах опроса [11-14] (рис. 5).
После выполнении радикальной простатэктомии (РПЭ), какими критериями вы пользуетесь для определения прогноза заболевания у пациента?
After performing radical prostatectomy (RP), what criteria do you use to determine the prognosis of a patient's disease?

Рис. 5. Ответы на вопрос об используемых критериях для определения прогноза заболевания у пациентов после радикальной простатэктомии
Fig. 5. Answers to the question about the criteria used to determine the prognosis of the disease in patients after radical prostatectomy
ОБСУЖДЕНИЕ
Данный анализ показывает насколько отличаются подходы к диагностике, лечению и наблюдению пациентов с РПЖ, в частности высокого риска, в реальной клинической практике.
Полученные результаты свидетельствуют о том, что наиболее значимые различия получены во взглядах на роль ПЭТ/КТ в первичной диагностике неметастатического РПЖ и значение местной распространенности в определении риска прогрессирования, тогда как отношение к генетическому исследованию, первичному локальному стадированию и критериям прогноза после РПЭ у большинства респондентов было схожим.
ВЫВОДЫ
Большинство российских специалистов, занимающиеся лечением РПЖ, не рекомендуют пациентам с РПЖ-ВР выполнение ПЭТ/КТ с 68Ga-ПСМА и не назначают генетические исследования и консультацию генетика при неметастатическом РПЖ. Для оценки местной распространенности процесса при РПЖ основываются на результаты МРТ, пальцевого ректального исследования и процент опухолевой ткани в биопсийном столбике. Большинство специалистов определяют прогноз пациента после РПЭ суммируя патоморфологические (ПСА+лучевая диагностика+результат гистологического исследования) и клинические (ПСА + лучевая диагностика + биопсия) показатели, что вполне коррелирует с общемировыми данными.
ЛИТЕРАТУРА
1. EAU Guidelines: Prostate Cancer. Uroweb. Accessed February 13, 2021. URL: https://uroweb.org/guideline/prostate-cancer.
2. Freedman-Cass D, Shead DA, Schaeffer E. NCCN Guidelines Panel Disclosures NCCN Guidelines Version 1.2021 Prostate Cancer; 2021.
3. Hofman MS, Lawrentschuk N, Francis RJ, Tang C, Vela I, Thomas P. Prostate-specific membrane antigen PET-CT in patients with high-risk prostate cancer before curative-intent surgery or radiotherapy (proPSMA): a prospective, randomised, multicentre study. Lancet 2020;395(10231):1208-1216. https://doi.org/10.1016/S0140-6736(20)30314-7.
4. Genetics of Prostate Cancer (PDQ®)–Health Professional Version – National Cancer Institute. Accessed February 24, 2021. URL: https://www.cancer.gov/types/prostate/hp/prostate-genetics-pdq.
5. Loeb S, Giri VN. Clinical implications of germline testing in newly diagnosed prostate cancer. Eur Urol Oncol 2020;4(1):1-9. https://doi.org/10.1016/j.euo.2020.11.011.
6. Zelic R, Garmo H, Zugna D, Stattin P, Richiardi L, Akre O. Predicting Prostate Cancer Death with Different Pretreatment Risk Stratification Tools: A Head-to-head Comparison in a Nationwide Cohort Study. Eur Urol 2020;77(2):180-188. https://doi.org/10.1016/j.eururo.2019.09.027.
7. Рева С.А., Носов А.К., Король В.Д., Арнаутов А.В., Зятчин И.В., Беркут М.В., Петров C. Б. Результаты лечения больных раком предстательной железы высокого риска: мультицентровой анализ. Экспериментальная и клиническая урология 2020;12(3):36-42. DOI: 10.29188/2222-8543-2020-12-3-36-42. [Reva SA, Nosov AK, Korol VD, Arnautov AV, Zyatchin IV, Berkut MV. Results of treatment of patients with high-risk prostate cancer: multicenter analysis. Eksperimental'naya i klinicheskaya urologiya=Experimental and Сlinical Urology 2020;12(3):36-42. https://doi.org/10.29188/2222-8543-2020-12-3-36-42. (In Russian)].
8. Somford DM, Hamoen EH, Fütterer JJ, Basten JP, Hulsbergen-van de Kaa CA, et al. The predictive value of endorectal 3 tesla multiparametric magnetic resonance imaging for extraprostatic extension in patients with low, intermediate and high risk prostate cancer. J Urol 2013;190(5):1728-1734. https://doi.org/10.1016/j.juro.2013.05.021.
9. de Rooij M, Hamoen EHJ, Witjes JA, Barentsz JO, Rovers MM. Accuracy of Magnetic Resonance Imaging for Local Staging of Prostate Cancer: A Diagnostic Meta-analysis. Eur Urol 2016;70(2):233-245. https://doi.org/10.1016/j.eururo.2015.07.029.
10. Eissa A, Elsherbiny A, Zoeir A, Sandri M, Pirola G, Puliatti S. Reliability of the different versions of Partin tables in predicting extraprostatic extension of prostate cancer: A systematic review and meta-analysis. Minerva Urol Nefrol 2019;71(5):457-478. https://doi.org/10.23736/S0393-2249.19.03427-1.
11. Vau N, Henriques V, Cheng L, Blanca A, Fonseca J, Montironi R. Predicting biochemical recurrence after radical prostatectomy: the role of prognostic grade group and index tumor nodule. Hum Pathol 2019(93):6-15. https://doi.org/10.1016/j.humpath.2019.08.012.
12. Negishi T, Kuroiwa K, Hori Y, Tomoda T, Uchino H, Tokuda N. Predictive factors of late biochemical recurrence after radical prostatectomy. Japanese J Clin Oncol 2017;47(3):233-238. https://doi.org/10.1093/jjco/hyw181.
13. Yokomizo A, Murai M, Baba S, Ogawa O, Tsukamoto T, Niwakawa M. Percentage of positive biopsy cores, preoperative prostate-specific antigen (PSA) level, pT and Gleason score as predictors of PSA recurrence after radical prostatectomy: A multi-institutional outcome study in Japan. BJU International 2006;98(3):549-553. https://doi.org/10.1111/j.1464-410X.2006.06379.x.
14. Ahove DA, Hoffman KE, Hu JC, Choueiri TK, D’Amico AV, Nguyen PL. Which patients with undetectable PSA levels 5 years after radical prostatectomy are still at risk of recurrence-Implications for a risk-adapted follow-up strategy. Urology 2010;76(5):1201-1205. https://doi.org/10.1016/ j.urology.2010.03.092.







