Функция мочевого пузыря в норме и при различных заболеваниях определяется состоянием его кровообращения и сложной системой нервно-рефлекторной регуляции. В настоящее время диагностика кровоснабжения пузыря производится ультразвуковым допплеровским исследованием [1, 2]. Используются также моРФометрические, гистохимические методы, меченые микросферы [3, 4, 5]. Объективными характеристиками состояния нервной регуляции мочевого пузыря в клинике являются неврологические исследования рефлексов мочеполовой системы, а в эксперименте для этих целей применяют электрофизиологические методы регистрации отдельных нервных волокон [6, 7, 8, 9]. О состоянии вагосимпатического баланса судят по вариабельности сердечного ритма, отражающей модулирующие влияния вегетативной нервной системы на ритм работы сердца [10]. Гистохимические и иммуногистохимические исследования тканей пузыря позволяют судить о состоянии рецепторного аппарата уротелия и детрузора.
Вышеперечисленные диагностические методы требуют разного аппаратурного обеспечения. Они не могут использоваться в комплексе одновременно, причем многие из них являются инвазивными.
Настоящая работа посвящена исследованию нового биоимпедансного метода оценки кровообращения и нейрогенной регуляции органов, основанного на изучении тонкой структуры спектра реограммы мочевого пузыря и его изменений, обусловленных колебаниями кровяного давления и вариациями нейрогенной активности.
Материал и методы
Исследования выполнены на анестезированных крысах (эфирнохлоралозный наркоз) в условиях открытого оперативного дост упа к мочевому пузырю. Детрузорное давление (Pdet) регистрировали электроманометром «ТА-2» («Биола») через цистостомический катетер, установленный в дно пузыря. Для отведения реограммы (импеданса) мочевого пузыря использованы два хлорсеребряных электрода, фиксируемых наружно в области тела пузыря и ближе к его шейке. Одновременная регистрация показателей давления, базового (полного) импеданса и его переменной составляющей осуществлялась оригинальным программноаппаратным комплексом («Биола»), включающим высокочувствительный и малошумящий импедансметр с разрешением 250 микроом, 4-канальный преобразователь «ППШ-04» и ЭВМ. Ритмические вариации импеданса мочевого пузыря автоматически выявляли с помощью Фурье-преобразования и представляли как зависимость амплитуды периодической составляющей биоимпеданса от частоты этой составляющей.
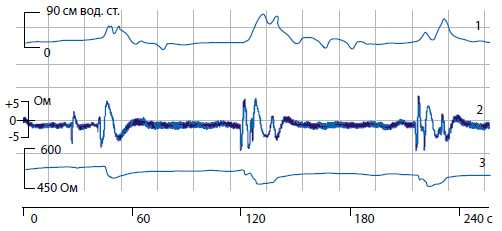
Слева шкала для величины переменной составляющей импеданса (Ом), внизу отмечено время записи в секундах.
Рисунок 1. Синхронная регистрация детрузорного давления (1), переменной составляющей (2) и базового (3) импеданса мочевого пузыря крысы.
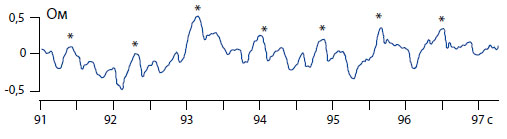
Слева даны шкалы для давления в сантиметрах водного столба, для импеданса (Ом). Внизу отмечено время записи в секундах.
Рисунок 2. Пример короткой (6 сек.) записи переменной составляющей импеданса мочевого пузыря крысы (звездочками отмечены респираторные колебания).
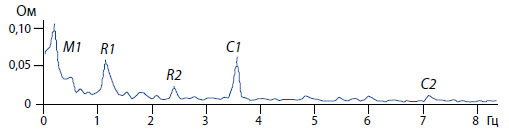
По вертикальной оси (ординат) графика Фурье-преобразования вариаций импеданса мочевого пузыря крысы представлена амплитуда периодической составляющей импеданса (Ом), по горизонтальной оси (абсцисс) дана частота периодической составляющей импеданса (Гц). Пики ритмичной активности на частоте сердечного ритма отмечены С1 и С2; пики активности на частоте дыхания отмечены R1 и R2; ритмичная активность на очень медленной частоте, волна Майера, отмечена М1.
Рисунок 3. Периодические компоненты спектра импеданса мочевого пузыря экспериментальной крысы, выявляемые Фурье анализом.
Измерения производили в разные периоды функциональной активности мочевого пузыря: исходное состояние покоя, во время наполнения (инфузионная цистометрия) физиологическим раствором, и после окончания инфузии. Длительность записей составляла 4 минуты. Исследования выполнены на мочевых пузырях 10 интактных крыс, а также 5 крыс с моделированной частичной инфравезикальной обструкцией (ИВО 1 месяц), вызванной перевязкой уретры на предварительно введенном катетере.
Результаты и их обсуждение
На рисунке 1 представлен пример одновременной записи импеданса мочевого пузыря и детрузорного давления у крысы в состоянии покоя. Сократительная активность в виде фазных сокращений отображается подъемами давления в мочевом пузыре (кривая 1) и периодическими колебаниями на записях переменной составляющей (кривая 2) и базового (кривая 3) импеданса мочевого пузыря.
На канале записи переменной составляющей импеданса видны мелкие осцилляции, лучше различимые на большей развертке при высокоскоростной регистрации (рисунок 2). Импедансметр с высокой разрешающей способностью и низким уровнем шума предоставил возможность изучать тонкую структуру реограммы мочевого пузыря. Фильтрация сигнала реограммы в полосе 0,07-15 Гц позволила различить крупные волны дыхания на частоте около 1 Гц (отмечены звездочками) и меньшие волны сердцебиения (на частоте около 3,5 Гц).
Для анализа вариаций импеданса мочевого пузыря использовали Фурье-преобразование в диапазоне частот от 0,05 Гц до 15,0 Гц. Частота дискретизации составляла 160 Гц. Для анализа выбирали фрагменты длиной 12,8 или 25,6 секунд и соответствующие определенному функциональному состоянию мочевого пузыря, как «покой», накопительная или эвакуаторная фазы. При этом фрагменты не должны были включать артефакты, вызванные непредвиденными движениями. Оригинальная компьютерная программа обработки данных позволила выявить и зарегистрировать спектрограмму мочевого пузыря, которая отображает ритмичные процессы, обусловленные работой сердца, периодическими дыхательными движениями, а также активностью автономной нервной системы. На рисунке 3 представлены три основных пика ритмической активности, которые сопровождаются соответствующими им гармониками.
Пик ритмичной активности, соответствующий частоте сердечного ритма, назван сердечным, ему соответствуют две гармоники пульсовых (сердечных) волн С1 и С2. Пик активности на частоте дыхания (R1) назван респираторным, за ним следует его гармоника R2. Ритмичная активность на очень медленной (0,1 Гц) частоте, которая описана как волна Майера для осцилляций сосудистого тонуса и, как предполагается, отражает нейрогенный симпатический ритм [11], обозначена M1 на рисунке 3 как пик Майера. Природа волны Майера, а также ритмичности на частоте дыхательной активности, не известна, и потребует экспериментального выяснения. Однако, их гемодинамическое происхождение, т.е. их зависимость от кровенаполнения сосудов мочевого пузыря, было продемонстрировано в отдельных экспериментах с пережатием брюшной аорты и нижней полой вены (рисунок 4), обеспечивающих кровью мочевой пузырь.
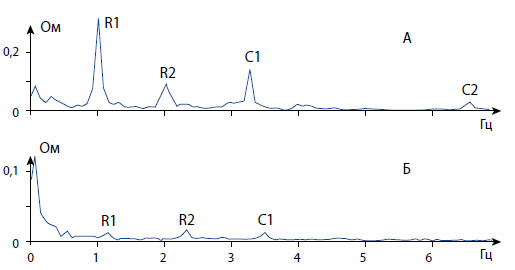
Обозначения как на рисунке 3.
Рисунок 4. Периодические компоненты спектра импеданса мочевого пузыря экспериментальной крысы в нормальных условиях (А) и после нарушения магистрального кровообращения (Б).
После наложения кровеостанавливающих зажимов на эти магистральные сосуды респираторный и сердечный пик были существенно угнетены и были еле различимы на записи в дважды увеличенном масштабе (рисунок 4-б), а вторая гармоника сердечного пика вовсе отсутствовала. Полученные результаты о сильном угнетении сердечного пика после пережатия сосудов, обеспечивающих кровоснабжение, показали, что спектрограмма импеданса мочевого пузыря позволяет судить о состоянии его кровообращения по выраженности сердечного пика и его гармоник.
Изменения показателя мощности сердечного пика в импедансной спектрограмме мочевого пузыря проанализированы в разных группах экспериментальных крыс, а также при разной степени наполнения мочевого пузыря (Таблица 1). Детрузорное давление в состоянии покоя у крыс после моделирования инфравезикальной обструкции было выше на 77% по сравнению с контрольной группой крыс. При этом мощность сердечного пика была у них меньше на 60%. Такие результаты согласуются со сведениями об уменьшении кровотока в обструктивных мочевых пузырях, полученными допплеровскими измерениями [2], и с данными о снижении кровотока в мышечном слое мочевого пузыря через 4 недели после частичной обструкции уретры, полученными с использованием флуоресцирующих микросфер [5].
Важной причиной уменьшения кровотока в мочевом пузыре признано повышение внутрипузырного давления. Так, у пациентов, у которых с помощью лазерной допплеровской флоуметрии регистрировали кровоток в стенке мочевого пузыря при разной степени его наполнения показано, что при максимальном заполнении мочевого пузыря, при котором внутрипузырное давление повышалось с 25,2 до 43,5 см вод. ст., кровоток в стенке мочевого пузыря снижался на 36% [1]. В наших наблюдениях у наркотизированных крыс (Таблица 1) давление во время инфузионной цистометрии возрастало в 6,1-6,5 раз, а угнетение кровообращения по данным импедансной цистометрии происходило на 26% и 57% соответственно в группе крыс с неизмененным и гипертрофированным в результате ИВО мочевым пузырем.
После прекращения наполнения мочевого пузыря детрузорное давление в мочевом пузыре контрольной группы крыс было ниже уровня перед инфузией на 18%, что, вероятно, связано с остаточным
расслаблением стенки пузыря после инфузионной нагрузки. При этом мощность сердечного пика восстанавливалась до 92% от исходного уровня. Напротив, в группе крыс с ИВО детрузорное давление оставалось повышенным после прекращения инфузионной цистометрии на 81% по отношению к исходному уровню. В отличие от контрольных крыс, мощность сердечного пика составляла лишь 69% от исходного уровня, измеренного до начала инфузионной цистометрии.
Таблица 1. Показатели мочевого пузыря, характеризующие функциональное состояние и кровообращение у крыс контрольной группы (1) и крыс с иВо (2), зарегистрированные в разные периоды инфузионной цистометрии.
| Исследуемые показатели и время | Детрузорное давление pdet (см вод. ст.) | Мощность сердечного пика (10-3 ом2) | ||
| Регистрации | 1 | 2 | 1 | 2 |
| Исходное состояние | 4,64 ± 1,40 | 8,23 ± 2,65 | 0,595 ± 0,04 | 0,237 ± 0,06 |
| Стационарная фаза инфузии | 28,40 ± 1,76 | 53,25 ± 2,55 | 0,443 ± 0,04 | 0,177 ± 0,08 |
| После прекращения инфузии | 3,79 ± 0,79 | 14,90 ± 2,13 | 0,546 ± 0,09 | 0,164 ± 0,06 |
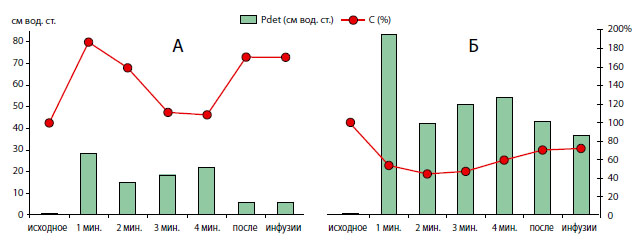
На графике А даны результаты измерений у крыс контрольной группы, на графике Б у крыс с инфравезикальной обструкцией. Столбиками представлены величины детрузорного давления по левой вертикальной шкале в сантиметрах водного столба, линейные диаграммы показывают изменения мощности сердечного пика в спектре импеданса мочевого пузыря, выраженные в % от исходного, до начала инфузионной цистометрии, значения, принятого за 100% (вертикальная шкала справа). По горизонтали внизу обозначены моменты расчета величин.
Рисунок 5. Примеры одновременных изменений давления в мочевом пузыре и мощности сердечного пика в спектре импеданса мочевого пузыря у крысы контрольной группы (А) и после моделирования инфравезикальной обструкции (Б) во время инфузионной цистометрии.
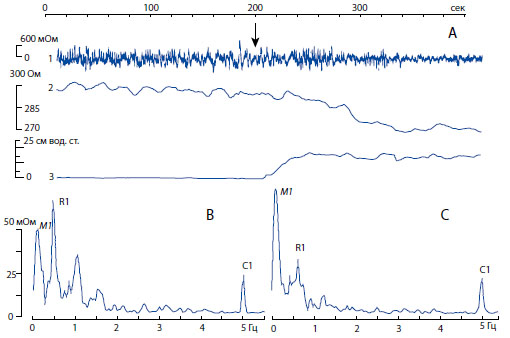
Асинхронная регистрация переменной составляющей (1), базального (2) импеданса мочевого пузыря и детрузорного давления (3); В, С периодические компоненты спектра импеданса мочевого пузыря, выявляемые Фурье анализом в состоянии покоя (В) и в начале инфузии (С). На А верхняя горизонтальная линия представляет время записи в секундах; значения кривых сверху вниз: переменная составляющая импеданса мочевого пузыря крысы, базовый (полный) импеданс, детрузорное давление; слева даны шкалы для переменной составляющей в милиОтах, для базового импеданса в Отах, для давления в сантиметрах водного столба. На В, С обозначения как на рис.3.
Рисунок 6. Пример комплексного обследования мочевого пузыря крысы во время инфузионной цистометрии.
Полученные результаты наглядно продемонстрировали существенное нарушение кровообращения в мочевом пузыре крыс после моделирования ИВО. Кроме того, к преимуществу метода импедансных исследований кровообращения в мочевом пузыре следует отнести возможность наблюдать эти изменения в динамике одновременно с изменениями давления. Так, в некоторых наблюдениях было зарегистрировано увеличение амплитуды сердечного пика во время наполнения мочевого пузыря, а после его прекращения возрастание, что могло указывать на происходящие фазные изменения кровообращения в пузыре и реактивную гиперемию после окончания растяжения пузыря инфузируемым раствором (рисунок 5-А).
Напротив, в некоторых наблюдениях, чаще у крыс с ИВО, отмечали в разной степени выраженное угнетение кардиального пика, как во время, так и в конце инфузионной цистометрии (рисунок 5-Б), что можно объяснить уменьшением кровоснабжения в связи со сдавлением стенки мочевого пузыря и находящихся в ней сосудов в конце цистометрии. Аналогичные данные о более сильном угнетении пеРФузии стенки обструктивного мочевого пузыря, по сравнению с нормальным, получены у собак [12].
Одновременная регистрация давления в мочевом пузыре и его импеданса позволила выявить и проанализировать с помощью Фурье-преобразования взаимосвязь процессов кровообращения и нейрогенной активности в этом органе в разные периоды его функциональной деятельности. К примеру, на рисунке 6 представлены результаты комплексных исследований у крысы во время инфузионной цистометрии. Видно, что мочевой пузырь реагирует на инфузионную нагрузку (момент начала инфузии обозначен стрелкой) повышением детрузорного давления и снижением базального компонента импеданса мочевого пузыря (запись А). Такие наблюдения согласуются с исследованиями у пациентов во время цистометрии, продемонстрировавшими отрицательную корреляцию объема мочевого пузыря и его импеданса [13], на основании которых импедансный метод предложен в качестве альтернативного для косвенного определения объема мочевого пузыря.
Основные пики активности мочевого пузыря в период покоя при низком детрузорном давлении (рисунок 6-В) и в начале инфузионной цистометрии при повышении внутрипузырного давления в результате наполнения теплым физиологическим раствором (С) изменялись следующим образом: амплитуда пика Майера возрастает, а респираторный пик снижается, амплитуда сердечного пика при этом практически не изменялась.
Усиление симпатической активности в фазу накопления мочи является известным фактом, эта система вегетативной регуляции считается ответственной за расслабление стенок пузыря в фазу накопления мочи. При повышении давления в пузыре и особенно при задержке мочеиспускания в связи с инфравезикальной обструкцией отмечали подъемы артериального давления с одновременным усилением активности почечного и селезеночного симпатических нервов [6]. Частота афферентной импульсации по тазовому нерву увеличивалась как функция степени растяжения мышц мочевого пузыря, параллельно усиливались сокращения детрузора, что зарегистрировано прямым отведением с нерва и оптической регистрацией у мышей со спинальным мочевым пузырем [14].
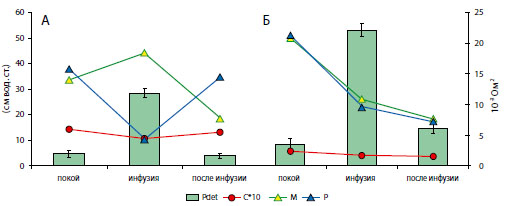
Столбиками представлены величины детрузорного давления по левой вертикальной шкале в сантиметрах водного столба; линейные диаграммы показывают изменения мощности основных пиков (С-сердечного, ММайера, Рреспираторного) в спектре импеданса мочевого пузыря в единицах 10-3 Ом (вертикальная шкала справа); по горизонтали внизу обозначены моменты расчета величин.
Рисунок 7. Динамика внутрипузырного давления и основных периодичностей в спектре импеданса мочевого пузыря при инфузионной цистометрии крыс контрольной группы (А) и крыс с инфравезикальной обструкцией (Б).
Полученные результаты измерений импеданса мочевого пузыря у крыс контрольной группы свидетельствуют о среднем увеличении мощности пика волны Майера в фазу наполнения мочевого пузыря (рисунок 7-А), что может быть связано с активизацией симпатической активности. Однако средняя мощность пика Майера у крыс с гипертрофированным в результате ИВО мочевым пузырем была больше на 50%, чем у контрольных крыс, а во время инфузионной нагрузки зарегистрировано ее уменьшение на 48% в сравнении с исходным значением, до начала цистометрии (рисунок 7-Б). Наблюдаемые изменения мощности пика Майера в спектре импеданса гипертрофированного мочевого пузыря могут указывать на усиление нейрогенных механизмов регуляции его функции в состоянии покоя, что может быть связано с исходно повышенным внутрипузырным давлением, а также на истощение этих регуляторных процессов при инфузионной нагрузке.
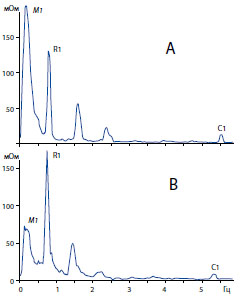
Обозначения как на рисунке 3.
Рисунок 8. Пример изменений амплитуды основных пиков в спектре импеданса мочевого пузыря крысы перед (А) и в конце(В)инфузионной цистометрии.
Природа респираторного пика пока неизвестна и требует выяснения. Изменения мощности респираторного пика обычно носили противоположный характер по отношению к мощности волны Майера. В большинстве наблюдений при наполнении пузыря мощность респираторного пика снижалась, как показали средние изменения этого параметра (рисунок 6). Тем не менее, в конце инфузионной цистометрии при высоком детрузорном давлении можно было наблюдать противоположную картину (рисунок 8) увеличение амплитуды респираторного пика при одновременном уменьшении волны Майера.
Известно, что во время мочеиспускания активность симпатической нервной системы угнетается, а усиливается активность парасимпатического отдела автономной нервной регуляции мочевого пузыря, отвечающей за сокращения детрузора. Можно предположить, что изменения мощностей основных пиков активности в спектре вариаций импеданса свидетельствуют о вкладе разных отделов автономной нервной регуляции в деятельность мочевого пузыря, учитывая реципрокную иннервацию этого органа. Усиление респираторного пика в конце инфузионной цистометрии при мочеиспускании можно объяснить активизацией парасимпатических влияний.
В состоянии покоя мощность респираторного спектрального пика была на 34% большей у крыс с гипертрофированным пузырем, по сравнению с контрольной группой (рисунок 7). При наполненном мочевом пузыре во время инфузионной цистометрии отмечено ее уменьшение, по сравнению с исходным уровнем, на 73% и 55% у крыс контрольной и «ИВО» групп соответственно. После окончания процедуры этот показатель остался сниженным в гипертрофированных пузырях (-76%), но почти полностью восстанавливался у крыс контрольной группы, составляя 92% от уровня, измеренного до начала цистометрии. По аналогии с изменениями мощности пика Майера в спектре импеданса, изменения респираторного пика гипертрофированного мочевого пузыря могут указывать на усиление нейрогенных механизмов регуляции его функции в состоянии покоя, но происходило при дополнительной нагрузке истощения этих регуляторных процессов.
Заключение
Проведенные исследования на экспериментальных крысах продемонстрировали возможности нового метода импедансных исследований функционального состояния мочевого пузыря. Созданный импедансметр высокого разрешения с компьютерной программой автоматической регистрации импеданса и его Фурье-преобразованием позволяет одновременно с регистрацией детрузорного давления комплексно и в динамике оценивать кровообращение мочевого пузыря и его нейрогенную активность. Предварительные исследования показали информативность кардиального пика в спектре импеданса для оценки кровообращения мочевого пузыря. Выяснение природы респираторного и низкочастотного пика Майера как показателей участия разных отделов вегетативной нервной системы в регуляции функции мочевого пузыря будет предметом дальнейших исследований. Полученные результаты продемонстрировали определенные особенности кровообращения и различия нейрогенной активности гипертрофированного мочевого пузыря, в сравнении с неизмененным пузырем, которые проявляются уменьшением кровообращения в нем и недостаточным восстановлением после прекращения инфузионной нагрузки. При этом наблюдались изменения нейрогенной активности, отличные от таковой в контрольной группе крыс, а именно, усиление этой активности в состоянии покоя и ослабление нейрогенных реакций на нагрузку.
Ключевые слова: мочевой пузырь, инфузионная цистометрия, Фурье-анализ, импеданс, функциональная регуляция, инфравезикальная обструкция.
Keywords : urinary bladder, infusion cystometry, Fourier analysis, impedance, functional regulation, infravesical obstruction.
Литература
- Kershen R.T., Azadzoi K.M., Siroky M.B. Blood Flow, Pressure and Compliance in the Male Human Bladder // J. Urol. 2002. Vol. 168. № 1. P. 121- 125.
- Lin W.Y., Mannikarottu A., Li Juan Y.S., Schuler C., Javed Z., Blaivas J., Levin R.M.. Correlation of in vivo bladder blood flow measurements with tissue hypoxia // World J. Urol. 2009. Feb 4.
- Matsumoto S., Chichester P., Kogan B.A., Levin R.M. Structural and vascular response of normal and obstructed rabbit whole bladders to distension // Urol. 2003. Vol. 62. № 6. P. 1129-1133.
- Azadzoi K.M., Radisavljevic Z.M., Golabek T., Yalla S.V., Siroky M.B. Oxidative modification of mitochondrial integrity and nerve fiber density in the ischemic overactive bladder // J. Urol. 2010. Vol.183. № 1. P. 362-369.
- Schroder A., Chichester P., Kogan B.A. Effect of bladder outlet obstruction on blood flow of the rabbit bladder. // J. Urol. 2001. Vol. 165. № 2. P. 640-646.
- Weaver L.C. Organization of sympathetic responses to distension of urinary bladder // Am. J. Physiol. 1985. Vol. 248. P. 236-240.
- Rocha I., Burnstock G., Spyer K.M. Effect on urinary bladder function and arterial blood pressure of the activation of putative purine receptors in brainstem areas // Autonomic Neuroscience. 2001. Vol. 88. Issues 1-2. P. 6-15.
- Habler H.J., McLachlan E.M., Jamieson J., Davies P.J. Synaptic responses evoked by lower urinary tract stimulation in superior cervical ganglion cells in the rat // J. Urol. 1999. Vol. 161. P. 1666-1671.
- Jezernik S., Wen J.G., Rijkhoff N.J.M., Djurhuus J.C. and Sinkj^r T. Analisis of bladder related nerve cuff electrode recordings from preganglionic pelvic nerve and sacral roots in pigs // J. Urol. 2000. Vol.163. P. 1309-1314.
- Mehnert U., Knapp P.A., Mueller N., Reitz A., Schurch B. Heart rate variability: An objective measure of autonomic activity and bladder sensations during urodynamics // Neurourol. Urodynam. 2009. Vol. 28. P. 313-319.
- Julien C. The enigma of Mayer waves: Facts and models // Cardiovasc. Res. 2006. Vol. 70. № 1. P. 12-21.
- Azadzoi K.M., Pontari M., Vlachiotis J., Siroky M B. Canine Bladder Blood Flow and Oxygenation: Changes Induced by Filling, Contraction and Outlet Obstruction. // J. Urol. 1996. Vol. 155. Issue 4., P. 1459-1465
- Kim C.T., Linsenmeyer T.A., Kim H., Yoon H. Bladder volume measurement with electrical impedance analysis in spinal cord-injured patients // Am J Phys Med Rehabil. 1998. Vol. 77. № 6. P. 498-502.
- Carly J. McCarthy C.J., Zabbarova I.V., Brumovsky P.V., Roppolo J.R., Gebhar G.F., Kana A.J. Spontaneous Contractions Evoke Afferent Nerve Firing in Mouse Bladders With Detrusor Overactivity // J. Urology. 2009. Vol. 181. Issue 3. P. 1459-1466.






