ВВЕДЕНИЕ
Под симптомами нарушения функции нижних мочевых путей (СНМП) на сегодняшний день принято понимать расстройства мочеиспускания, включающие учащенное мочеиспускание, ургентность, ноктурию, уменьшение скорости потока мочи, а также постмикционное подтекание мочи. Наиболее часто СНМП встречаются у мужчин пожилого возраста, как следствие развития и прогрессирования доброкачественной гиперплазии предстательной железы (ДГПЖ) [1, 2]. Одним из основных факторов риска развития СНМП является возраст больного [3, 4]. ДГПЖ и развитие СНМП у мужчин пожилого возраста сопровождаются увеличением объема предстательной железы (ПЖ), а также снижением уровня сывороточного тестостерона (Т) у части пациентов. Данные изменения отражают патофизиологические процессы старения мужского организма [5, 6, 7]. Дефицит тестостерона (ДТ) и метаболический синдром (МС) в сочетании с воспалением и повышением активности симпатической нервной системы у мужчин могут способствовать прогрессирующей ишемии тазовых органов [8-10].
Низкий уровень Т вызывает широкий спектр патофизиологических изменений в различных системах организма, которые влияют на структуру стенки мочевого пузыря и паренхимы ПЖ и приводят к нарушениям метаболизма и структурной перестройке тканей.
Снижение уровня T вызывает нарушение высвобождения аденозинтрифосфата и ацетилхолина в ответ на растяжение стенки пузыря, что негативно влияет на его функциональную емкость [11, 12]. Усиление активности симпатической нервной системы при возрастном ДТ ведет к увеличению мышечного тонуса ПЖ, что способствует усугублению тяжести СНМП даже при незначительном увеличении или при нормальных размерах ПЖ [13].
В различных руководствах не рекомендуется использование тестостеронзаместительной терапии (ТЗТ) у пациентов с тяжелыми проявлениями СНМП (сумма баллов по опроснику международной шкалы симптомов ПЖ (IPSS) свыше 19). По результатам нескольких проспективных исследований не продемонстрирована значимая связь ТЗТ с выраженностью СНМП и увеличением объема ПЖ. Необходимы дополнительные исследования для изучения влияния ТЗТ на показатели мочеиспускания у различных категорий пациентов с СНМП/ДГПЖ [14-16].
Цель исследования: изучение влияния заместительной терапии тестостероном на СНМП при андрогендефиците у больных, после проведенного оперативного лечения ДГПЖ.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включены данные обследования 101 пациента с ГПЖ, проходивших лечение на базе урологических отделений ГУЗ ККБ города Чита, ЧУЗ «Клиническая больница «РЖД-Медицина» города Чита».
К критериям включения пациентов в группы исследования отнесены СНМП средней и тяжелой степени тяжести, ассоциированные с ДГПЖ, к критериям исключения – СНМП легкой степени тяжести, отсутствие патоморфологического исследования ткани ПЖ при повышенном уровне ПСА, воспалительные заболеваний мочевых путей в острой фазе, наличие эпицистостомического дренажа, сахарный диабет.
В начале исследования диагностический этап у больных, оперированных по поводу ДГПЖ, включал: опрос, физикальный осмотр, лабораторные исследования (определение уровня половых гормонов, концентрации простатспецифического антигена сыворотки крови (ПСА), биохимических показателей сыворотки крови, проведение общеклинических лабораторных исследований крови и мочи, микроскопии секрета ПЖ определение концентрации С-реактивного белка), выполнение уродинамического исследования качества мочеиспускания, заполнение опросника международной шкалы симптомов ПЖ (IPSS) и дневников мочеиспускания за период не менее трех суток. Помимо первичной диагностики, оценка эффективности лечения с помощью вышеперечисленных методик проводилась в периоды 1, 3, 6, 12 месяцев наблюдения больных.
Все пациенты были распределены в три группы. В группу А включены 48 пациентов (47,5%), средний возраст которых составил 62,0 [61,5; 63,8] года, получавших консервативную терапию по поводу СНМП средней степени тяжести (согласно шкале IPSS, данным КУДИ) – альфа-1-адреноблокаторы и ингибиторы 5-альфаредуктазы. В две основные группы (В, С) включены пациенты с СНМП тяжелой степени после хирургического лечения в объеме трансуретральной резекции ПЖ (ТУР ПЖ) или позадилонной аденомэктомии (с учетом объема гиперплазированной ткани ПЖ). В группу В вошли 38 пациентов (37,6%) в среднем возрасте 65,0 [64,4; 65,7] лет с дефицитом Т, без применения ТЗТ; ТУР ПЖ выполнена в 62% (20/32), аденомэктомия – в 37,5% (12/32) случаев. В группу С включен 21 пациент (20,8%) в среднем возрасте 64,0 [63,5; 64,8] года, также со снижением уровня Т; ТУР ПЖ – в 67,7% (14/21), аденомэктомия – в 33,3% (7/21) случаев. В послеоперационном периоде и в течение последующего наблюдения, пациентам проводилась коррекция трансдермальными препаратами Т.
Статистическая обработка результатов исследования осуществлялась с применением пакета программ «IBM SPSS Statistics Version 25.0» (International Business Machines Corporation, license No Z125-3301-14, США). При проведении статистического анализа авторы руководствовались принципами Международного комитета редакторов медицинских журналов (ICMJE) и рекомендациями «Статистический анализ и методы и методы в публикуемой литературе» (SAMPL). Номинальные данные описывались с указанием абсолютных значений, количественные данные – с указанием медианы первого и третьего квартилей. Анализ статистической значимости различий количественных признаков для трех независимых групп определяли с помощью критерия Краскела-Уолеса, для двух независимых групп – МаннаУитни, качественные признаки оценивали с помощью критерия Хи-квадрат Пирсона. Во всех случаях p<0,05 считали статистически значимым [17].
РЕЗУЛЬТАТЫ
Одним из методов оценки качества мочеиспускания служил опросник IPSS-QoL. Полученные результаты представлены в таблице 1.
При анализе полученных результатов установлены статистически значимые различия во всех группах наблюдения. В группе А суммарный балл до начала терапии составлял 14,0 [13,1; 15,0], в промежуточный период контроля (6 месяцев) и в конце периода наблюдения отмечено его снижение до 6,5 [6,8; 8,2] и 8,0 [6,8; 8,3] баллов соответственно (табл. 1). К окончанию периода наблюдения у пациентов в группе В отмечено уменьшение суммарно полученных баллов с 28,0 [27,5; 29,0] до 9,0 [9,0; 9,8], у пациентов группы С данный показатель сократился с 28,0 [27,5; 29,3] до 4,5 [4,4; 4,8] (p<0,005). У пациентов во всех группах наблюдения снизился индекс QoL: в группе А данный показатель сократился с 4,5 [4,0; 4,6] до 2,5 [2,4; 2,7] баллов, в группе В – с 6,0 [5,5; 5,8] до 3,0 [2,6; 3,0] баллов, в группе С – с 6,0 [5,5; 6,0] до 1,0 [0,9; 1,4] балла (p<0,005).
В ходе исследования проведена дифференцированная оценка симптомов накопления и опорожнения мочевого пузыря во всех группах наблюдения. У пациентов всех групп наблюдения отмечено снижение суммарного балла симптомов опорожнения (IPSSопорож.): в группе А – с 7,0 [6,9; 7,9] до 3,0 [3,0; 4,2] баллов, в группе В – с 17,0 [16,2; 17,2] до 1,0 [1,0; 1,4] баллов, в группе С – с 17,0 [16,7; 18,0] до 2,0 [1,4; 2,0] баллов (p<0,005). Снижение ирритативной симптоматики (IPSSнакоп.) также зарегистрировано во всех группах наблюдения: в группе А – с 7,0 [6,2; 7,1] до 4,0 [3,4; 4,1] баллов, в группе В – с 11,0 [11,0; 11,9] до 8,0 [7,8; 8,4] баллов, в группе С – с 11,0 [9,9; 11,4] до 3,0 [2,8; 3,2] баллов (p<0,005), (табл. 1).
Таблица 1. Изменения показателей по шкале IPSS у пациентов с СНМП
Table 1. Changes in IPSS scores in patients with LUTS
|
Показатели |
Группа А, (n=48) |
Группа В, (n=32) |
Группа С, (n=21) |
|
IPSS исходная / IPSS initial |
14,0 [13,1; 15,0] |
28,0 [27,5; 29,0] |
28,0 [27,5; 29,3] |
|
через 1 месяц / after 1 month |
9,5 [8,0; 9,8] |
13,0 [12,2; 13,4] |
9,5 [8,4; 9,5] |
|
через 3 месяца / after 3 month |
6,5 [6,8; 8,2] |
10,0 [9,6; 10,4] |
5,0 [4,9; 5,5] |
|
через 6 месяцев / after 6 month |
7,5 [6,7; 8,1] |
9,0 [8,9; 9,6] |
4,5 [4,3; 4,9] |
|
через 12 месяцев / after 12 month |
8,0 [6,8; 8,3] |
9,0 [9,0; 9,8] |
4,5 [4,4; 4,8] |
|
Динамика dF= 4 / Dynamics dF= 4 |
χ2=130,5; р<0,001 |
χ2=107,74; p<0,001 |
χ2=73,83; p<0,001 |
|
QoL исходная / QoL initial |
4,5 [4,0; 4,6] |
6,0 [5,5; 5,8] |
6,0 [5,5; 6,0] |
|
через 12 месяцев / after 12 month |
2,5 [2,4; 2,7] |
3,0 [2,6; 3,0] |
1,0 [0,9; 1,4] |
|
Динамика dF= 4 / Dynamics dF= 4 |
χ2=117,54; р<0,001 |
χ2=82,78; p<0,001 |
χ2=71,2; p<0,001 |
|
IPSS опорожнения исходная / IPSS emptying initial |
7,0 [6,9; 7,9] |
17,0 [16,2; 17,2] |
17,0 [16,7; 18,0] |
|
через 1 месяц / after 1 month |
5,0 [4,0; 5,2] |
3,0 [2,9; 3,4] |
3,0 [2,8; 3,5] |
|
через 3 месяца / after 3 month |
3,5 [3,5; 4,3] |
1,0 [1,0; 1,6] |
1,0 [1,0; 1,4] |
|
через 6 месяцев / after 6 month |
4,0 [3,5; 4,4] |
1,0 [1,0; 1,5] |
1,0 [1,0; 1,3] |
|
через 12 месяцев / after 12 month |
3,0 [3,0; 4,2] |
1,0 [1,0; 1,4] |
2,0 [1,4; 2,0] |
|
Динамика dF= 4 / Dynamics dF= 4 |
χ2=113,75; р<0,001 |
χ2=109,91; p<0,001 |
χ2=70,17; p<0,001 |
|
IPSS накопления исходная / IPSS accumulation initial |
7,0 [6,2; 7,1] |
11,0 [11,0; 11,9] |
11,0 [9,9; 11,4] |
|
через 1 месяц / after 1 month |
4,0 [3,8; 4,6] |
10,0 [9,1; 10,1] |
6,0 [5,5; 6,2] |
|
через 3 месяца / after 3 month |
3,5 [3,3; 3,9] |
9,0 [8,4; 9,0] |
4,0 [3,6; 4,6] |
|
через 6 месяцев / after 6 month |
3,0 [3,0; 3,7] |
8,0 [7,7; 8,3] |
3,0 [3,0; 3,9] |
|
через 12 месяцев / after 12 month |
4,0 [3,4; 4,1] |
8,0 [7,8; 8,4] |
3,0 [2,8; 3,2] |
|
Динамика dF= 4 / Dynamics dF= 4 |
χ2=115,82; р<0,001 |
χ2=64,81; p<0,001 |
χ2=68,41; p<0,001 |
В соответствии с представленными данными (рис. 1), наибольший уровень общего тестостерона (ОТ) отмечался у пациентов группы А: за период наблюдения не зарегистрировано значительных колебаний уровня данного гормона. В начале периода наблюдения уровень ОТ составлял 17,2 [16,7; 17,2] нмоль/л, к 12 месяцам – 17,5 [17,2; 17,7] нмоль/л. У больных группы В за период исследования регистрировался сниженный уровень ОТ: исходно данный показатель составлял 10,4 [9,9; 10,4] нмоль/л, к концу 1 месяца наблюдения отмечалось снижение среднего значения до 8,8 [8,4; 8,9] нмоль/л, к 3 месяцам – повышение до 9,5 [9,2; 9,7] нмоль/л. В контрольный период (6 месяцев) наблюдалось восстановление уровня показателя практически до исходных значений 10,2 [10,0; 10,5] нмоль/л. Тенденция сохранялась до окончания периода наблюдения, когда уровень ОТ составлял 10,4 [10,3; 10,8] нмоль/л (p<0,001). У больных группы С исходный уровень ОТ составил 9,0 [8,4; 9,1] нмоль/л. В качестве ТЗТ применялись трансдермальные препараты тестостерона. Через 1 месяц после оперативного лечения и начала применения ТЗТ, наблюдалось повышение уровня ОТ до 14,1 [14,1; 14,7] нмоль/л, к 3 месяцам наблюдения значения ОТ достигли 17,0 [16,7; 17,5] нмоль/л, в 6 месячный период данный показатель составил 17,5 [17,4; 17,9] нмоль/л. Аналогичные значения регистрировались к окончанию периода наблюдения – 17,5 [17,3; 17,8] нмоль/л (p<0,001).
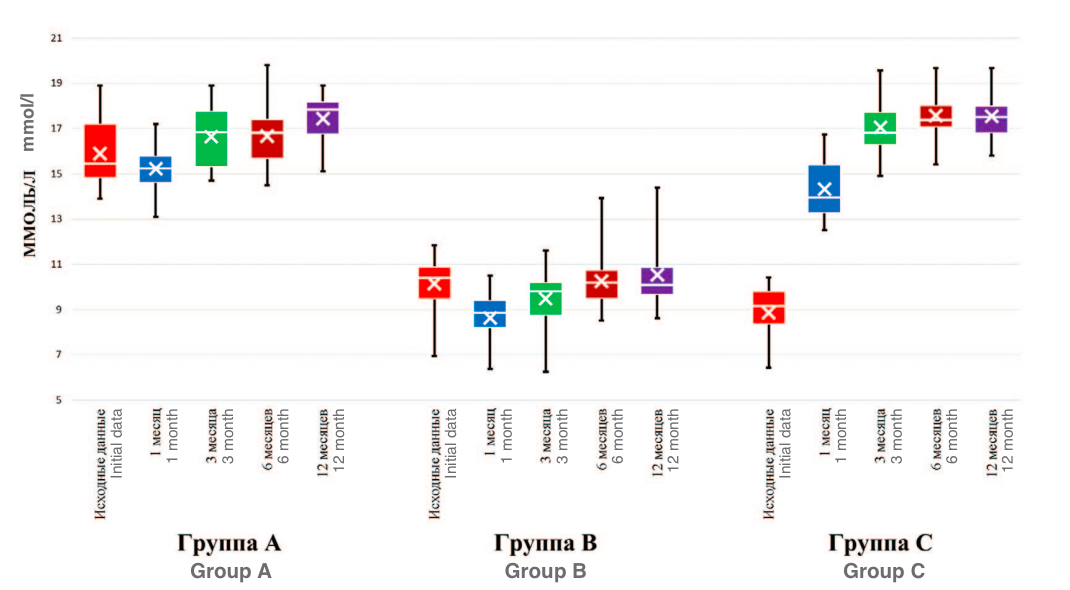
Рис. 1. Динамика изменения уровня общего тестостерона в сыворотке крови
Fig. 1. Dynamics of changes in the level of total testosterone in blood serum
В ходе исследования всем больным выполнялось трансректальное ультрасонографическое исследование с оценкой размеров, объема ПЖ и длины простатического отдела уретры. Динамика изменения объема предстательной железы (Vпр) представлена в таблице 2.
Vпр у пациентов в группе А исходно составлял 60,5 [55,3; 76,4] см3. В промежуточные периоды контроля отмечено снижение данного показателя: 1 месяц – 55,5 [55,2; 73,2] см3, 3 месяца – 51,1 [48,4; 62,5] см3, 6 месяцев – 51,5 [46,9; 59,4] см3. В конце периода наблюдения Vпр увеличился до 61,8 [55,0; 65,6] см3 (р=0,001), что вероятно обусловлено окончанием приема ингибиторов 5-альфаредктазы в 6 месячный период. В группе В вначале исследования Vпр составил 76,0 [71,5; 85,9] см3, через 1 месяц после операции объем уменьшился до 24,0 [23,6; 26,4] см3 (p<0,001). В промежуточные периоды контроля значение существенно не изменялось, и к истечению 12 месяцев наблюдения показатель составил 25,5 [24,8; 27,5] см3. У пациентов группы С исходное значение Vпр составило 70,5 [70,1; 87,3] см3, через 1 месяц после операции – 25,0 [23,6; 25,0] см3 (p<0,001). В оставшийся период наблюдения рассматриваемый показатель значимо не изменялся, и к окончанию исследования составил 26,5 [25,1;26,7] см3 (табл. 2).
Таблица 2. Динамика изменения объема предстательной железы (см3)
Table 2. Dynamics of changes in the prostate volume (cm3)
|
Показатели |
Группа А, (n=48) |
Группа В, (n=32) |
Группа С, (n=21) |
|
Исходные данные / IPSS initial |
60,5 [55,3; 76,4] |
76,0 [71,5; 85,9] |
70,5 [70,1; 87,3] |
|
через 1 месяц / after 1 month |
55,5 [55,2; 73,2] |
24,0 [23,6; 26,4] |
25,0 [23,6; 25,0] |
|
через 3 месяца / after 3 month |
51,1 [48,4; 62,5] |
23,5 [23,2; 25,6] |
25,0 [23,7; 25,3] |
|
через 6 месяцев / after 6 month |
51,5 [46,9; 59,4] |
24,0 [23,8; 26,3] |
25,0 [24,2; 25,9] |
|
через 12 месяцев / after 12 month |
61,8 [55,0; 65,6] |
25,5 [24,8; 27,5] |
26,5 [25,1;26,7] |
|
Динамика dF= 4 / Dynamics dF= 4 |
χ2=19,92; р=0,001 |
χ2=81,34; p<0,001 |
χ2=57,88; p<0,001 |
Оценка толщины стенки мочевого пузыря (ТСМП) проводилась во время наполнения мочевого пузыря, в момент возникновения позыва к мочеиспусканию. Как следует из полученных данных, у пациентов в группе А исходно ТСМП равнялась 3,5 [3,4; 3,5] мм, к 6 месяцам наблюдения – 3,7 [3,5; 3,7] мм, к периоду 12 месяцев – 3,3 [3,3; 3,6] мм (р<0,001). В группе В показатель составил 3,1 [3,0; 3,3] мм, к 12 месяцам – 3,1 [3,0; 3,2] мм (p=0,044). В группе С исходно ТСМП отмечалась на уровне 3,3 [3,2; 3,4] мм, к окончанию наблюдения – 2,7 [2,6; 2,7] мм (p<0,001) (табл. 3).
Толщина мышечного слоя стенки мочевого пузыря (ТММП) у больных из групп наблюдения также имела изменения (рис. 2). У пациентов группы А не отмечено статистически значимых изменений ТММП (р=0,33): вначале исследования среднее значение составляло 1,4 [1,4; 1,5] мм, к окончанию наблюдения – 1,9 [1,8; 2,1] мм. В группе В исходно ТММП составляла 1,9 [1,7; 1,9] мм, к 12 месяцам –1,5 [1,5; 1,6] мм (p=0,035). У пациентов группы С выявлены более выраженные изменения данного показателя: исходно – 1,9 [1,8; 1,9] мм, к окончанию 12 месяцев наблюдения – 1,3 [1,2; 1,3] мм (p<0,001).
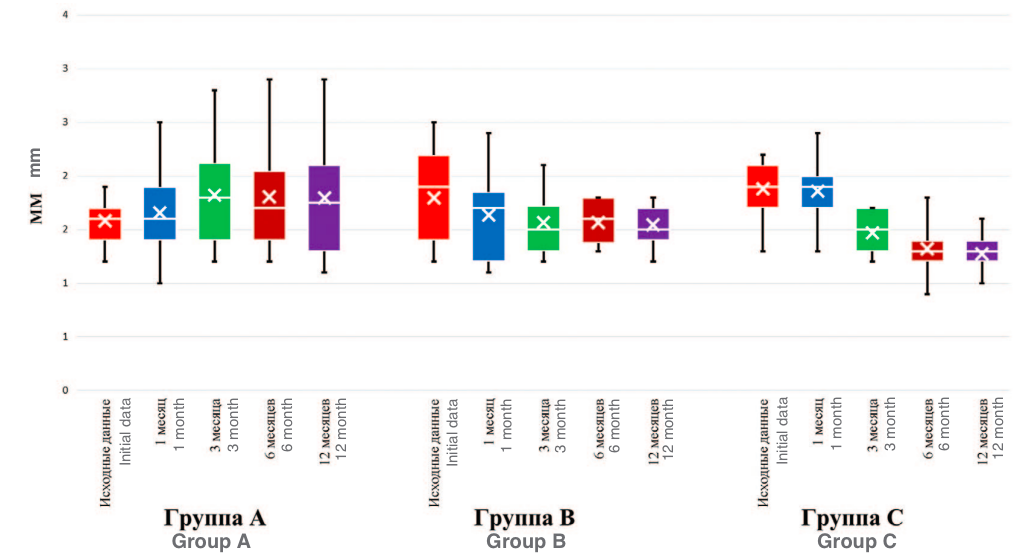
Рис. 2. Динамика изменения толщины мышечного слоя мочевого пузыря
Fig. 2. Dynamics of changes in the thickness of the bladder muscular layer
Для оценки СНМП все пациенты непрерывно заполняли дневники мочеиспускания (ДМ) (в течение 3- 5 суток подряд), по результатам ведения которых проведена оценка количества микций (с разделением на дневной и ночной периоды), объема мочеиспускания, времени наполнения мочевого пузыря, наличия эпизодов ургентности, питьевого режима, режима сна и бодрствования. Количество микций (КМ) у пациентов в течение суток в различные временные периоды исследования представлено в таблице 4.
У пациентов группы А при исходном КМ равном 9,5 [9,3; 9,9] к окончанию периода наблюдения показатель уменьшился до 8,0 [7,8; 8,1] (р<0,001). В группе В при исходном значении 12,5 [12,2; 13,2] отмечено его сокращение через 1 месяц до 11,5 [11,2; 12,1], а к 12 месяцам – до 9,5 [9,3; 9,7] (p<0,001). У пациентов группы С исходный показатель равнялся 13,0 [12,7; 13,8], к окончанию 1 месяца – 9,5 [9,3; 10,0], через 12 месяцев – 8,0 [8,0; 8,4] (p<0,001) (табл. 4, рис. 3).
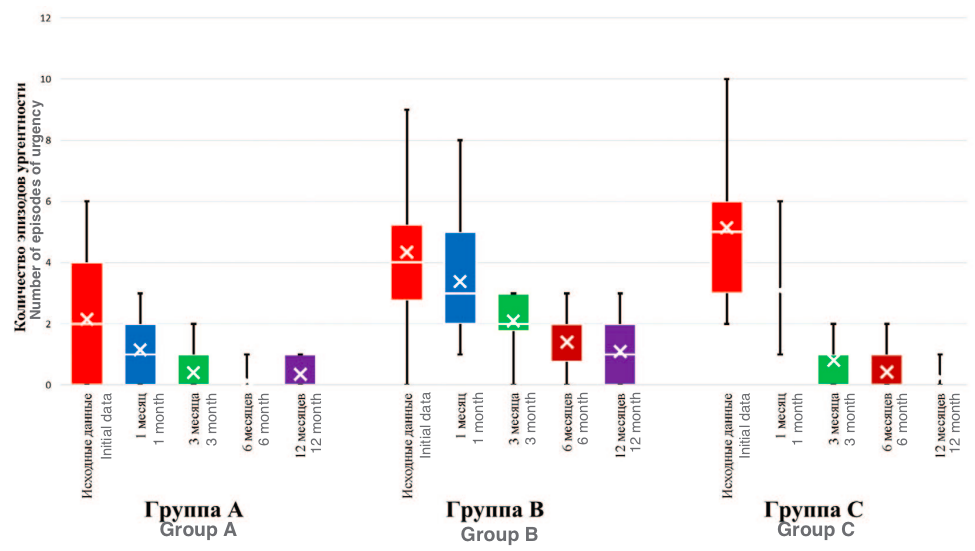
Рис. 3. Количество эпизодов ургентности за сутки
Fig. 3. Number of episodes of urgency per day
Количество эпизодов ургентности у пациентов группы А соответствовало 1,0 [1,0; 2,1], к завершению наблюдения отмечено снижение до 0,4 [0,0; 0,4] (р<0,001). В группе В исходное значение составило 4,0 [3,8; 4,8], через 1 месяц – 3,0 [2,9; 3,8], через 12 месяцев – 1,0 [0,9; 1,3] (p<0,001). У пациентов в группе С ургентность регистрировалась на уровне 5,0 [4,6; 5,8], через 1 месяц – 3,0 [2,7; 3,4], к 12 месяцам – 0,4 [0,0; 0,4] (p<0,001).
Индекс ноктурии (ИН) является одним из показателей, характеризующих функциональное состояние мочевого пузыря в ночной период, а также степень ночной полиурии. Расчет ИН проводился при помощи значений, полученных при анализе ДМ по формуле:
ИН = НД/Vmax, где НД – объем мочи, образовавшейся за ночь; Vmax – максимальный объем мочеиспускания.
Наименьшие значения ИН регистрировались у пациентов в группе А (табл. 5). В начале исследования показатель составил 1,8 [1,8; 2,1], к 12 месяцам – 1,1 [1,1; 1,2] (р<0,001). У пациентов группы В при исходном значении равном 2,4 [2,4; 2,9], ИН к 12 месяцам составил 1,3 [1,3; 1,5] (p<0,001). В группе С в начале исследования ИН имел наибольшее значение – 3,4 [3,0; 3,5], через 1 месяц снизился до – 1,4 [1,4; 1,6], и к 12 месяцам равнялся – 1,1 [1,1; 1,3] (p<0,001) (табл. 5).
Для дифференциальной оценки накопительной способности мочевого пузыря проанализированы временные промежутки между мочеиспусканиями в различное время суток: достоверные различия отмечены по показателям максимального (tmaxН) и минимального (tminН) времени наполнения мочевого пузыря в ночной период времени. В группе А tmaxН составляло 220,0 [200,8; 244,5] мин, к 12 месяцам – отмечается увеличение времени до 305,0 [274,4; 311,8] мин (р<0,001). В группе В исходные значения tmaxН регистрировались на уровне 170,0 [151,1; 181,6] мин, к 6 месяцам – 290,0 [290,0; 322,8] мин, к 12 месяцам – 312,5 [304,5; 333,8] мин (p<0,001). В группе С отмечено увеличение tmaxН с 110,0 [110,0; 140,9] мин вначале периода наблюдения до 370,0 [341,7; 374,4] мин – к 6 месячному периоду. Аналогичные значения получены в 12 месяцев – 372,5 [352,7; 381,7] мин (p<0,001) (рис. 4).
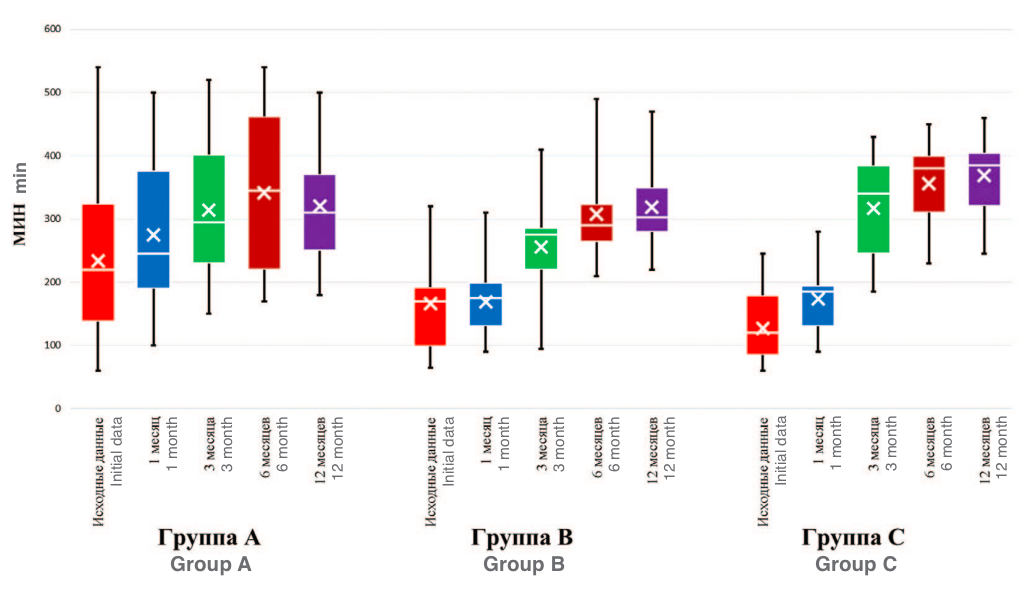
Рис. 4. Максимальное время наполнения мочевого пузыря в ночной период
Fig. 4. Maximum bladder filling time at night
Исходно tminН у пациентов группы А составило 157,5 [136,0; 175,6] мин., к 6 месяцам – 237,5 [237,5; 291,2] мин (р<0,001), к 12 месяцам – 210,0 [184,7; 213,6] мин. В группе В до оперативного лечения tminН составляло 72,5 [70,7; 89,6] мин., к концу исследования – 210,0 [206,7; 254,2] мин. (p<0,001). В группе С значения соответствовали 70,0 [63,4; 83,1] мин. до оперативного лечения, и 332,5 [308,9; 356,1] мин. в конце периода наблюдения (p<0,001) (рис. 5).
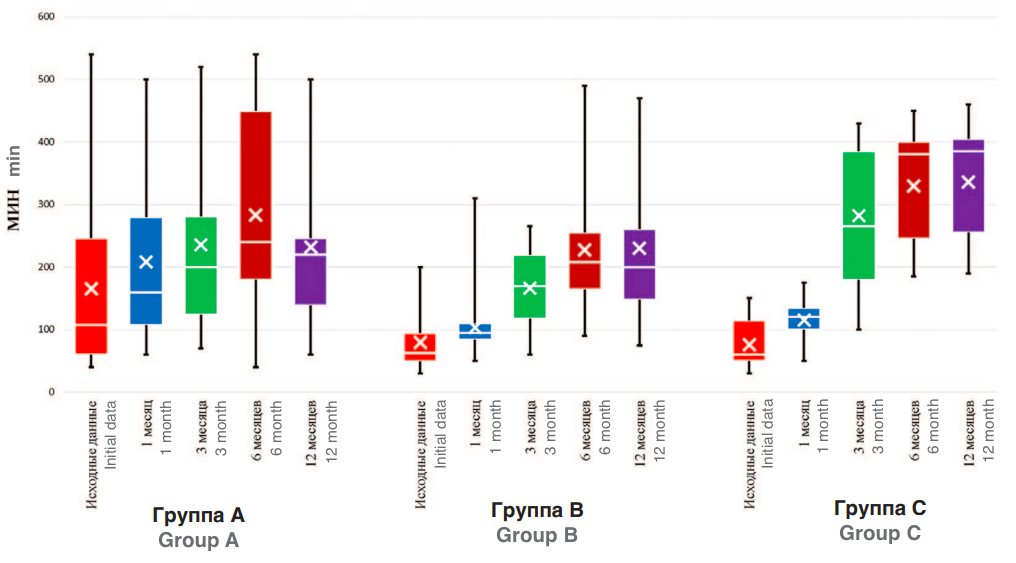
Рис. 5. Минимальное время наполнения мочевого пузыря в ночной период
Fig. 5. Minimum bladder filling time at night
На рисунке 6 представлена динамика изменения максимальной скорости мочеиспускания (Qmax). У пациентов группы А исходно Qmax составила 13,4 [13,2; 14,0] мл/сек, к 12 месяцам – 19,0 [18,1; 19,0] мл/сек (р<0,001). В группе В Qmax исходно равнялось 6,9 [6,9; 7,7] мл/сек, к 12 месяцам показатель увеличился до 21,8 [21,4; 22,7] мл/сек (p<0,001). В группе С при значении Qmax равном 7,5 [7,2; 8,2] мл/сек в начале исследования, наблюдается его увеличение до 24,1 [23,7; 24,7] мл/сек к окончанию периода исследования (p<0,001).
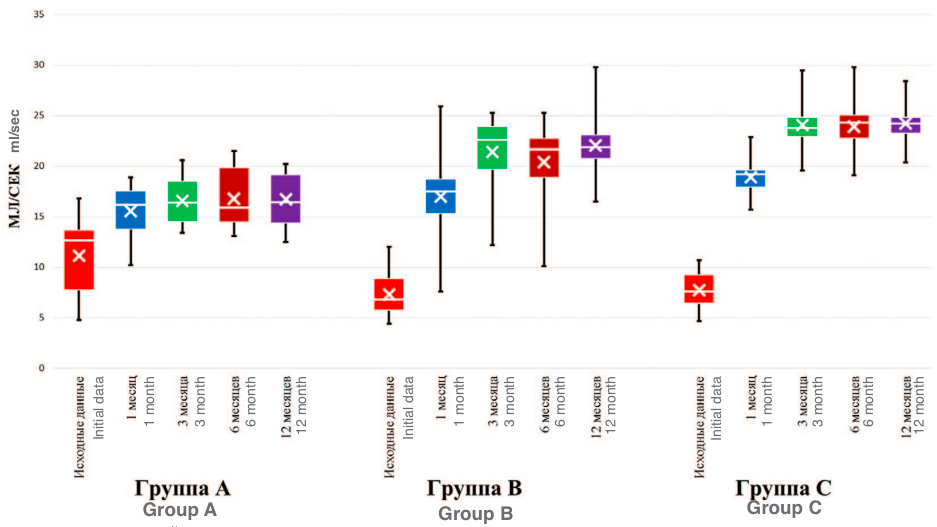
Рис. 6. Динамика изменения максимальной скорости мочеиспускания
Fig. 6. Dynamics of changes in the maximum rate of urination
ОБСУЖДЕНИЕ
В течение периода исследования пациентов с СНМП после хирургического лечения ДГПЖ снижение выраженности нарушений мочеиспускания, по данным опросника IPSS, происходило во всех группах наблюдения. Обращает внимание тот факт, что по достижению завершения наблюдения (12 месяцев) у пациентов группы В отмечались более выраженные проявления симптомов нижних мочевых путей, относительно пациентов групп А и С. При дифференцированной оценке суммарных баллов, минимальные различия в группах наблюдались относительно симптомов опорожнения. Напротив, симптомы накопления имели различия по степени выраженности. Так, в группах пациентов А и С отмечались заметные улучшения СНМП; пациенты группы В имели менее выраженное снижение уровня проявлений симптомов по количеству суммарных баллов, относительно исходных показателей (с 11,0 [11,0; 11,9] до 8,0 [7,8; 8,4]).
Применение трансдермальных препаратов тестостерона позволило повысить уровень ОТ у больных группы С до нормальных значений, соответствующих уровню ОТ пациентов группы А. У гипогонадных больных группы В наблюдалось сохранение низкого уровня ОТ.
При оценке размеров ПЖ, у пациентов в группах В и С, наблюдалось статистически значимое изменение железы после оперативного лечения (р<0,001). Далее в течение периода наблюдения не отмечено значимых различий в размерах ПЖ в указанных группах, что говорит об отсутствии влияния заместительной терапии тестостероном на размеры ПЖ Также в ходе исследования у пациентов в группе А зарегистрировано значимое снижение объема ПЖ в течении 6 месяцев, что соответствовало периоду применения ингибиторов-5- альфаредуктазы (33,2% (16/48)).
В ходе исследования, у пациентов по данным УЗИ наибольшее количество постмикционной мочи прогнозируемо регистрировалось в группах В и С, и в большинстве случаев сочеталось с более выраженной протрузией ПЖ в мочевой пузырь. При оценке изменений в стенки мочевого пузыря обращает внимание, что большие размеры ТСМП регистрировались у пациентов в группе А в начальный период исследования, относительно пациентов групп В и С. Однако, при этом значение ТММП в группе А, несколько меньше, чем в других группах больных (p<0,001). ТСМП у пациентов в группе В значимо не изменялась в течение всего периода исследования, в то время как у пациентов в группе С происходило уменьшение данного показателя. Снижение ТММП более выражено регистрировалось в группе С (p<0,001) по сравнению с больными группы В (p=0,035). Таким образом, у пациентов, получавших андрогензаместительную терапию (группа С), наблюдались более значимые изменения, характеризующиеся уменьшением толщины, как всей стенки мочевого пузыря, так и мышечных волокон детрузора.
По результатам анализа данных ДМ установлено, что у пациентов в исследуемых группах наблюдения, после проведенного лечения, достоверно уменьшилось количество мочеиспусканий за сутки (p<0,001) при увеличении функциональной емкости мочевого пузыря, что наиболее выражено проявилось у больных из групп В и С. Наибольшие значения максимального объема микции, по окончании периода наблюдения, регистрировались у пациентов в группе А, минимального объема микции – в группе С. Во всех группах при сравнении в аналогичные периоды наблюдения количество мочи выделенной в ночной период статистически не отличалось. При этом, наиболее выраженное уменьшение эпизодов ноктурии отмечено у пациентов в группе С. Согласно представленным данным, наибольшее значение ИН, характеризующего функциональное состояние наполнения мочевого пузыря в ночной период, а также степень ночной полиурии, вначале исследования отмечалось у пациентов в группе С, и в этой же группе наблюдались минимальные значения данного показателя в конце исследования. Результаты, полученные при оценке tmaxН и tminН, свидетельствуют о более выраженных «положительных» изменениях в функции нижних мочевых путей у пациентов группы С, относительно других групп пациентов, что проявляется более длительными периодами времени между мочеиспусканиями в течение суток. Количество эпизодов ургентности достоверно снижается во всех группах больных, при этом минимальные значения показателя в конце исследования регистрировались у пациентов в группах А и С.
ЗАКЛЮЧЕНИЕ
Представленные данные свидетельствуют о том, что применение андрогензаместительной терапии позволяет повысить эффективность оперативного лечения, выполняемого по поводу СНМП ассоциированными с ДГПЖ у больных с андрогендефицитом, и способствует более быстрому избавлению от СНМП.
ЛИТЕРАТУРА
1. Аполихин О.И., Сивков А.В., Комарова В.А., Никушина А.А. Болезни предстательной железы в Российской Федерации: статистические данные 2008-2017 гг. Экспериментальная и клиническая урология 2019;(2):4-13. [Apolikhin O.I., Sivkov A.V., Komarova V.A., Nikushina A.A., Prostate diseases in the Russian Federation: statistical data for 2008-2017. Eksperimentalnaya i Klinicheskaya urologiya = Experimental and Clinical Urology 2019;(2):4-13. (in Russian)]. https://doi.org/10.29188/2222-8543-2019-11-2-4-12.
2. Клинические рекомендации Европейской ассоциации урологов 2020; M.;427 с. URL: https://img-cdn.tinkoffjournal.ru/-/kr-eau_2020_razblokirovan-1.pdf. [Guidelines of European Association of Urology 2020;M.;427 p. (in Russian)].
3. Vignozzi L, Gacci M, Maggi M. Lower urinary tract symptoms, benign prostatic hyperplasia and metabolic syndrome. NatRevUrol 2016;13:108–1193. https://doi.org/10.1038/nrurol.2015.301.
4. Phua TJ. The etiology and pathophysiology genesis of benign prostatic hyperplasia and prostate cancer: a new perspective. Medicines (Basel) 2021;8(6):30. https://doi.org/10.3390/medicines8060030.
5. Lee S, Min HG, Choi SH, Kim YJ, Oh SW, Kim YJ, et al. Central obesity as a risk factor for prostatic hyperplasia. Obesity (Silver Spring) 2006;14:172–179. https://doi.org/10.1038/oby.2006.21.
6. Muller RL, Gerber L, Moreira DM, Andriole GJr, Hamilton RJ, Fleshner N, et al. Obesity is associated with increased prostate growth and attenuated prostate volume reduction by dutasteride. Eur Urol 2013;63:1115–1121. https://doi.org/10.1016/j.eururo.2013.02.038.
7. Rył A, Rotter I, Miazgowski T, Słojewski M, Dołęgowska B, Lubkowska A, et al. Metabolic syndrome and benign prostatic hyperplasia: association or coincidence? Diabetol Metab Syndr 2015;7:94. https://doi.org/10.1186/ s13098-015-0089-1.
8. Gorbachinsky I, Akpinar H, Assimos DG. Metabolic syndrome and urologic diseases. RevUrol 2010;12:e157–e180. https://www.ncbi.nlm.nih.gov/ pmc/articles/PMC3020279/.
9. Keast JR, Saunders RJ. Testosterone has potent, selective effects on the morphology of pelvic autonomic neurons which control the bladder, lower bowel and internal reproductive organs of the male rat. Neuroscience 1998;85:543–556. https://doi.org/10.1016/S0306-4522(97)00631-3.
10. Corona G, Monami M, Rastrelli G, Aversa A, Tishova Y, Saad F, et al. Testosterone and metabolic syndrome: a meta-analysis study. J Sex Med 2011;8:272–283. https://doi.org/10.1111/j.1743-6109.2010.01991.x.
11. Bravo G, Massa H, Rose'Meyer R, Chess-Williams R, McDermott C, Sellers DJ. Effect of short-term androgen deficiency on bladder contractility and urothelial mediator release. NaunynSchmiedebergs Arch Pharmacol 2017;390:547–556. https://doi.org/10.1007/s00210-017-1355-6.
12. Corona G, Goulis DG, Huhtaniemi I, Zitzmann M, Toppari J, Forti G, et al. European Academy of Andrology (EAA) guidelines on investigation, treatment and monitoring of functional hypogonadism in males: Endorsing organization: European Society of Endocrinology. Andrology 2020;8:970-87. https://doi.org/10.1111/andr.12770.
13. Russo GI, Castelli T, Urzì D, Privitera S, Fragalà E, LaVignera S, et al. Connections between lower urinary tract symptoms related to benign prostatic enlargement and metabolic syndrome with its components: a systematic review and meta-analysis. Aging Male 2015;18:207–216. https://doi.org/10.3109/13685538.2015.1062980.
14. Bhasin S, Cunningham GR, Hayes FJ, Matsumoto AM, Snyder PJ, Swerdloff RS, et al. Testosterone therapy in men with androgen deficiency syndromes: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2010;95:2536-59. https://doi.org/10.1210/jc.2009-2354.
15. Kathrins M, Doersch K, Nimeh T, Canto A, Niederberger C, Seftel A. The Relationship Between Testosterone-Replacement Therapy and Lower Urinary Tract Symptoms: A Systematic Review. Urology 2016;88:22-32. https://doi.org/10.1016/j.urology.2015.11.006.
16. Lee MH, Shin YuS, Kam SCh. Correlation between testosterone replacement treatment and lower urinary tract symptoms. Int Neurourol J 2021;25(1):12–22. https://doi.org/10.5213/inj.2040234.117.
17. Мудров В.А. Алгоритмы статистического анализа количественных признаков в биомедицинских исследованиях с помощью пакета программ SPSS. Забайкальский медицинский вестник 2020;(1):140-150. [Mudrov V.A. Statistical analysis algorithms of quantitative features in biomedical researchusing the SPSS software package. Zabaykal'skiy meditsinskiy vestnik = The Transbaikal Medical Bulletin 2020;(1):140-150. (in Russian)]. https://doi.org/10.52485/19986173_2020_1_140.







