ВВЕДЕНИЕ
Всемирная организация здравоохранения определяет «репродуктивное здоровье» как отсутствие патологии и нарушений репродуктивных функций у мужчины и женщины, рассматривая пару как единое целое. Бесплодие – отсутствие беременности в течение одного года при регулярной половой жизни без использования средств контрацепции. Согласно статистике, у 50% бездетных пар, ключевую роль играет мужской фактор. Причинами мужского бесплодия могут быть повреждения органов и систем на разных уровнях организма (повреждения яичек, нарушения семяизвержения, нарушении эндокринной регуляции и генетические дефекты) [1]. К сожалению, многие случаи мужского бесплодия относят к идиопатическому бесплодию, т.е. не имеющему известной выявляемой причины. Центр репродуктивной медицины и андрологии Вестфальского университета имени Вильгельма в Мюнстере проанализировал различные диагнозы у 10 469 пациентов с мужским бесплодием, и выявил, что на долю идиопатического бесплодия приходится 31,1% всех случаев [2]. Согласно другим исследованиям, частота идиопатического бесплодия составляет от 30 до 75% [3, 4].
При идиопатическом бесплодии у пациентов не обнаруживается изменений при физикальном, лабораторном и инструментальном обследованиях. Но в анализе эякулята могут отмечаться различные патологические отклонения [3, 4].
Различные исследователи предлагают множество возможных причинных факторов мужского бесплодия, это и загрязнение окружающей среды, стресс, вредные привычки, повреждения ДНК сперматозоидов и генетические аномалии [1].
Одной из групп препаратов для лечения бесплодия являются гонадотропины, пептидные гормоны, которые регулируют функцию яичек и необходимы для нормальной репродуктивной функции. К гонадотропинам относят два гормона передней доли гипофиза: фолликулостимулирующий гормон (ФСГ) и лютеинизирующий гормон (ЛГ), которые секретируюся под контролем гонадоропин-релизинг гормона (ГнРГ), а также выделяемый плацентой хорионический гонадотропин человека (хГЧ) [5].
При гипогонадотропном гипогонадизме терапия гонадотропинами эффективна в 75% случаев [6]. Даже монотерапия хГЧ является успешной, хотя при совместном введении хГЧ и ФСГ положительный результат достигается быстрее. Вероятность зачатия увеличивается даже при неполном восстановлении параметров эякулята [7, 8, 9].
Однако существующие исследования эффективности применения гонадотропинов при нормогонадотропном гипогонадизме являются противоречивыми. В клинических рекомендациях не описано положительного влияния терапии человеческим менопаузальным гонадотропином (чМГ) при олигоастенотератозооспермии в сочетании с нормогонадотропным гипогонадизмом ни на параметры эякулята, ни на вероятность наступления беременности. Таким образом целесообразность и эффективность применения чМГ при патоспермии и эугонадном состоянии или при нормонадотропном гипогонадизме до сих пор остается неясной [10].
Терапия чМГ при мужском идиопатическом бесплодии в настоящее время обсуждается, но убедительных доказательств ее эффективности нет [2, 11]. Но есть исследования, доказавшие эффективность применения чМГ при варикоцеле [12].
На сегодня в России доступны не только лекарственные формы для однократного применения, но и многодозовые формы (600 МЕ ФСГ/ЛГ и 1200 МЕ ФСГ/ЛГ), позволяющие повысить комплаентность к лечению). В литературе на сегодняшний день недостаточно информации об эффективности многодозовых форм менотропинов в лечении мужского бесплодия. Для устранения этого пробела и было предпринято настоящее исследование.
МАТЕРИАЛЫ И МЕТОДЫ
С целью оценки эффективности и безопасности многодозового менотропина у пациентов с мужским бесплодием в условиях реальной клинической практики, а также установления прогностических клинических критериев ответа на терапию было проведено проспективное многоцентровое наблюдательное исследование. Для этого был проведен анализ результатов применения многодозового менотропина у пациентов, обратившихся в период с января по декабрь 2020 года к врачу-урологу с жалобами на бесплодие в браке. Всего в исследовании принимали участие 19 центров на территории РФ.
Всем пациентам выполнялся сбор анамнеза, осмотр, физикальное исследование, спермограмма в соответствии с 5-м изданием Руководства ВОЗ по исследованию и обработке эякулята человека, анализ крови с определением уровня общего тестостерона, лютеинизироующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), глобулина, связывающего половые гормоны (ГСПГ), ингибина В, для исключения обструктивного характера бесплодия пациентам выполнялось ультразвуковое исследование органов мошонки с допплерографией вен семенного канатика.
Исследуемая популяция
В анализ включались случаи назначения изучаемого препарата пациентам с врожденным/приобретенным гипогонадотропным гипогонадизмом, пациентам со снижением уровня гонадотропинов на фоне приема анаболических стероидов, пациентам с нормогонадотропным гипогонадизмом и пациентам с идиопатической нормогонадотропной олигозооспермией. Из исследования исключались пациенты с гипергонадотропным гипогонадизмом, обструктивным бесплодием, верифицированными генетическими причинами бесплодия, нелеченным варикоцеле.
Исследуемая терапия
В качестве исследуемого, рассматривался препарат чМГ высокой степени очистки. Препарат относится к группе менотропинов, содержит ФСГ и ЛГ в соотношении 1:1. Препарат получают экстрагированием ФСГ и ЛГ из мочи женщин в период постменопаузы. В одной упаковке препарата содержалось либо 600 МЕ ЛГ + 600 МЕ ФСГ, либо 1200 МЕ ЛГ + 1200 МЕ ФСГ. Участникам наблюдательной программы проводили назначение в соответствии с рекомендованными режимами: менотропин 75МЕ, 112,5 МЕ или 150 МЕ и выше через день совместно с человеческим хорионическим гонадотропином (чХГ) от 1000 МЕ 2-3 раза в неделю в течение не менее 3 месяцев или меньше в случае достижения беременности у супруги/партнерши.
Учитывая обсервационный характер исследования, окончательная дозировка и длительность применения препарата определяется лечащим врачом в соответствии с клинической ситуацией и клиническими рекомендациями.
Статистическая обработка
Статистическая обработка данных проводилась с помощью программного пакета PS ClementinePro™1.8 (Predictive Solution) на базе платформы IBM SPSS Modeler™ 18 (IBM Corporation).
Поскольку это открытая нерандомизированная наблюдательная программа, при анализе в первую очередь применялись методы описательной сводной статистики. Для оценки характера распределения нами применялся одновыборочный критерий Колмогорова-Смирнова с поправкой Лильефорса. Количественные переменные представлены в виде количества пациентов (N), среднего значения (Mean), стандартного отклонения (SD), медианы (Median), 1-го квартиля, 3-го квартиля, минимального (Min) и максимального значений (Max). При анализе изменений в каждой группе с течением времени применялся двухфакторный ранговый дисперсионный анализ Фридмана для связанных выборок. Оценку наличия статистически значимых отличий между сравниваемыми группами проводили с использованием однофакторного дисперсионного анализа (ANOVA).
В случае сравнения долевых признаков в двух независимых группах объектов исследования использовали точный критерий Фишера. Для оценки вероятности справедливости нулевой гипотезы использовали порог р<0,05. Для выявления взаимосвязи и взаимовлияния различных факторов был использован метод ранговой корреляции по Спирмену.
С целью определения характера взаимного стохастического влияния изменения двух случайных метрических величин применялся коэффициент корреляции Пирсона. При описании результатов в группах используется среднее с указанием стандартного отклонения. В связи с тем, что группы неравнозначны по числу участников, для описания достоверности использовался непарный t-тест.
РЕЗУЛЬТАТЫ
В итоговый анализ исследование были включены результаты обследования 1120 мужчин. Возраст пациентов колебался от 18 до 65 лет (33,6± 7,0 лет). Более подробная информация о демографических и антропометрических характеристиках исследованной популяции указана в таблице 1.
Таблица 1. Демографические данные пациентов, включенных в финальный анализ.
Table 1. Demographic data of patients included in the final analysis
|
Показатели |
Стандартное отклонение М±о/ |
Медиана |
Минимум |
Максимум |
|---|---|---|---|---|
|
Возраст, лет / Age, years |
33,6±7 |
33 |
18 |
65 |
|
Рост, см / Height, sm |
180±7,1 |
180 |
163 |
205 |
|
Вес, кг / Weight, kg |
88,2±14,2 |
87 |
53 |
184 |
|
ИМТ/ВМ1 |
27,1±3,7 |
26,84 |
17,7 |
56,2 |
|
Окружность живота, см / Waist circumference, sm |
94±16,6 |
90 |
60 |
140 |
Абдоминальное ожирение (окружность живота ≥ 94 см) имели 58,4% мужчин. Нормальную массу тела, определяемую по индексу массы тела (ИМТ) в соответствии с критериями ВОЗ, имели 25,4% пациентов, избыточную массу тела – 58,5%, ожирение I, II степени имели 13,3 и 2,9% соответственно. Абсолютное большинство пациентов были женаты (95,8%), 1,1% – были разведены, 3,1% мужчин никогда не состояли в браке.
В отношении первичного/вторичного характера бесплодия было отмечено, что у 30% мужчин ранее не было детей с предыдущими партнершами, у 73,5% мужчин не было детей с настоящими партнершами. При изучении статуса курения оказалось, что никогда не курили 56,1% мужчин, курили, но бросили – 12,8% пациентов, курили на момент включения в исследование – 31,1%. Регулярность половой жизни может оказывать влияние на успешность зачатия. Распределение данного фактора половой жизни представлено на рисунке 1, при этом показано, что 90% пациентов имели от 1 до 3-4 половых контактов в неделю.
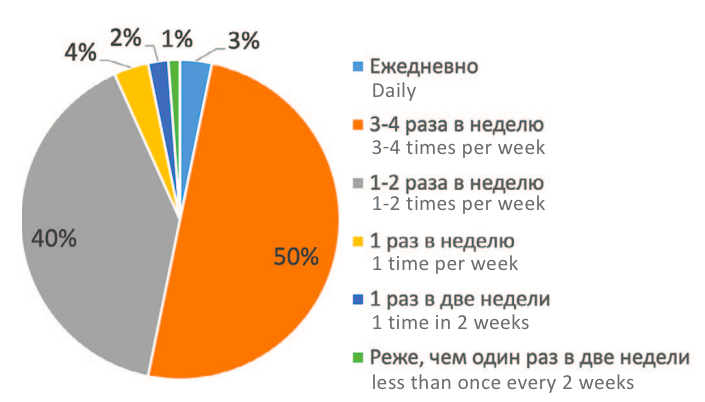
Рис. 1. Распределение регулярности половой жизни
Fig. 1. Distribution of the regularity of sexual activity
Ни у одного их включенных пациентов не было обнаружено инфекций, передаваемых половым путем. Семейный анамнез бесплодия был у 0,3% мужчин.
Только 6,6% мужчин до включения в исследование получали какое-либо лечение по поводу мужского бесплодия. Получаемая предшествующая терапия указана на рисунке 2. Наибольшее число пациентов (60%) лечились препаратами гонадотропинов, 37% принимали витамины, БАДы, растительные комплексы.
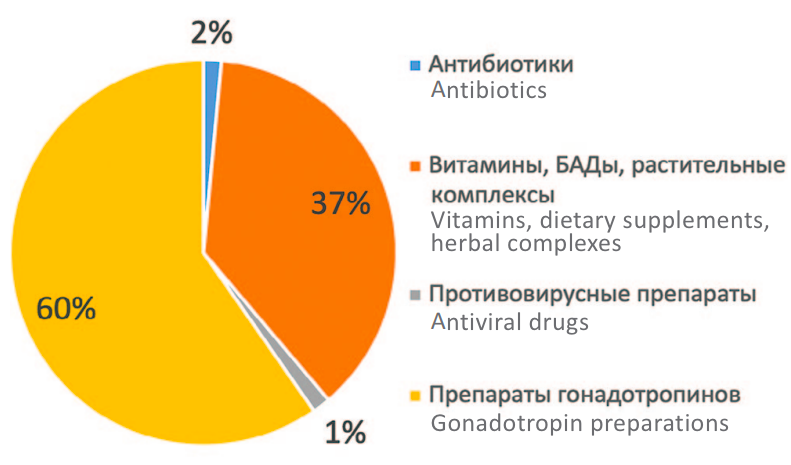
Рис. 2. Препараты предшествующей медикаментозной терапии
Fig. 2. Previously used medical therapy
Средняя длительность бесплодия на момент включения в исследование составила 20,6±30,4 мес. (медиана 12 мес., 0-300 мес.).
Почти четверть (24,4%) мужчин вышли из исследования ввиду наступления беременности во время лечения.
Для удобства клинической интерпретации данных динамика параметров эякулята и гормонального анализ крови представлена отдельно для пациентов, находившихся на лечении в течение 3 месяцев, и, отдельно, в течение 12 месяцев, поскольку число пациентов, в каждой из этих групп отличается. Первую контрольную точку, 3 месяца, прошли 1102 мужчин, а последнюю, 12 месяцев – 137 пациентов.
При сравнении параметров спермограммы было отмечено, что без дифференцировки по назначенной дозе через 3 месяца приема концентрация сперматозоидов увеличилась на 32,6%, общее количество сперматозоидов в эякуляте увеличилось на 32,3%, прогрессивная подвижность выросла на 20,7%, доля морфологически нормальных форм выросла морфология по Крюгеру выросла на 34,8%. Подробная динамика параметров эякулята у пациентов через 3 месяца приема менопаузальных гонадотропинов указана в таблице 2.
Таблица 2. Динамика параметров эякулята у пациентов через 3 месяца приема менопаузальных гонадотропинов
Table 2. Dynamics of semen parameters in patients after 3 months of taking menopausal gonadotropins
|
Показатели |
Концентрация сперматозоидов, млн/мл |
Общее количество сперматозоидов, млн |
Прогрессивная подвижность сперматозоидов, % |
Нормальная морфология по Крюгеру, % |
||||
|---|---|---|---|---|---|---|---|---|
|
0 мес |
3 мес |
0 мес |
3 мес |
0 мес |
3 мес |
0 мес |
3 мес |
|
|
Среднее значение/Mean |
17,5 |
23,2 |
39,6 |
52,4 |
26,6 |
32,1 |
2,3 |
3,1 |
|
Стандартное отклонение Standard deviation |
17,4 |
19,4 |
39,9 |
44,7 |
16,1 |
16,3 |
2,4 |
2,7 |
|
Медиана / median |
12 |
18 |
26,3 |
42 |
31 |
38 |
2 |
3 |
|
Минимум / min |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Максимум / max |
187 |
204 |
311,75 |
421,2 |
77 |
74 |
19 |
17 |
|
P (Wilcoxon test) |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
||||
При применении многодозового менотропина в течение 12 месяцев концентрация сперматозоидов увеличилась на 88,5%, общее количество сперматозоидов в эякуляте увеличилось на 55,3%, прогрессивная подвижность выросла на 42%, доля морфологически нормальных форм выросла морфология по Крюгеру выросла на 64,3% (табл. 3).
Таблица 3. Динамика параметров эякулята у пациентов через 12 месяцев приема менопаузальных гонадотропинов
Table 3. Dynamics of ejaculate parameters in patients after 12 months of taking menopausal gonadotropins
|
Показатели |
Концентрация сперматозоидов, млн/мл |
Общее количество сперматозоидов, млн |
Прогрессивная подвижность сперматозоидов, % |
Нормальная морфология по Крюгеру, % |
||||
|---|---|---|---|---|---|---|---|---|
|
0 мес |
12 мес |
0 мес |
12 мес |
0 мес |
12 мес |
0 мес |
12 мес |
|
|
Среднее значение/Mean |
13,0 |
24,5 |
38,9 |
60,4 |
18,8 |
26,7 |
1,4 |
2,3 |
|
Стандартное отклонение Standard deviation |
15,5 |
25,3 |
51,8 |
65,5 |
16,0 |
18,5 |
2,0 |
2,2 |
|
Медиана / median |
9 |
16 |
26,3 |
46 |
17 |
24 |
1 |
2 |
|
Минимум / min |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Максимум / max |
95 |
154 |
307 |
418,2 |
77 |
80 |
19 |
12 |
|
Р (Wilcoxon test) |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
||||
Примечание: достоверность различий между опытной и sham группами: *р<0,05, **р<0,01
Note: significance of differences between the experimental and sham groups: *p<0.05, **p<0.01
При изучении гормонального профиля выявлено, что уровень общего тестостерона после 3 месяцев применения многодозового гонадотропина вырос на 33,6%. Уровни ингибина В и эстрадиола достоверно не изменились (табл. 4).
Таблица 4. Динамика гормонального профиля у пациентов через 3 месяца приема менопаузальных гонадотропинов
Table 4. Dynamics of the hormonal profile in patients after 3 months of taking menopausal gonadotropins
|
Показатели |
Общий тестостерон, нмоль |
Ингибин В |
Эстрадиол пг/мл |
|||
|---|---|---|---|---|---|---|
|
0 мес |
3 мес |
0 мес |
3 мес |
0 мес |
3 мес |
|
|
Среднее значение/Mean |
11,0 |
14,7 |
126,1 |
117,7 |
35,8 |
43,2 |
|
Стандартное отклонение Standard deviation |
4,4 |
5,9 |
72,3 |
66,0 |
30,6 |
48,2 |
|
Медиана / median |
10,9 |
14,1 |
125 |
107,5 |
25,1 |
29,35 |
|
Минимум / min |
0 |
0,69 |
8,2 |
12,1 |
5 |
9,81 |
|
Максимум / max |
42 |
52 |
400 |
312 |
173 |
362 |
|
Р (Wilcoxon test) |
<0,001 |
не значимо |
не значимо |
|||
В ходе наблюдательной программы исследователями применялись различные дозировки чМГ в зависимости от клинической ситуации. В связи в этим представляет особый интерес оценка эффективности различных дозировок препарата (75 МЕ, 112,5 МЕ, 150 МЕ, 225 МЕ) в отношении параметров эякулята и уровня тестостерона через 4 недели после начала лечения во всех группах.
При оценке влияния дозировки на концентрацию оказалось, что эффективность достоверно отличается, причем данные отличия носят нелинейный характер. Самой эффективной оказалась дозировка 112,5 МЕ 3 раза в неделю. При этом концентрация сперматозоидов в эякуляте увеличилась на 85,6% (табл. 5).
Таблица 5. Динамика параметров спермограммы в зависимости от дозировки исследуемого препарата
Table 5. Dependence of the dynamics of sperm concentration on the dosage of the study drug
|
Концентрация сперматозоидов, млн/мл /Sperm concentration, mln/ml |
|||
|---|---|---|---|
|
|
До лечения / Before treatment |
4 недели / 4 weeks |
Динамика / Dynamics |
|
75 ME / IU |
11,7 |
15,4 |
32,1%* |
|
112,5 ME/ IU |
15,7 |
29,2 |
85,6%* |
|
150 ME / IU |
22,5 |
29,4 |
30,6%* |
|
225 ME / IU |
8,2 |
13,4 |
64,1% |
|
Общее количество сперматозоидов, млн / Total sperm count, mln |
|||
|
75 ME / IU |
25,2 |
35,0 |
38,8%* |
|
112,5 ME/ IU |
45,2 |
66,2 |
46,4%* |
|
150 ME / IU |
51,3 |
66,5 |
29,7%* |
|
225 ME / IU |
19,5 |
28,9 |
48,4% |
|
Прогрессивная подвижность сперматозоидов, % / Sperm progressive motility, % |
|||
|
75 ME / IU |
25,8 |
29,5 |
14,3%* |
|
112,5 ME/ IU |
13,1 |
33,0 |
152,5%* |
|
150 ME / IU |
27,9 |
34,2 |
22,6%* |
|
225 ME / IU |
27,0 |
33,0 |
22,2% |
|
Нормальная морфология сперматозоидов, % / Normal sperm morphology, % |
|||
|
75 ME / IU |
2,8 |
3,4 |
20,1%* |
|
112,5 ME/ IU |
2,0 |
2,8 |
41,1%* |
|
150 ME / IU |
1,9 |
2,8 |
44,7%* |
|
225 ME / IU |
1,8 |
2,7 |
45,5% |
* Различие статистически значимо (p<0,001)
* The difference is statistically significant (p<0.001)
В отношении общего числа сперматозоидов отмечалась схожая схема зависимости эффекта от дозировки. Схожими по эффективности также оказались дозировки 112,5 МЕ и 225 МЕ 3 раза в неделю (увеличение концентрации на 46,4% и 48,4%, соответственно).
Прогрессивная подвижность сперматозоидов показала самую высокую динамику при использовании дозировки 112,5 МЕ. Данный показатель увеличился на 152,5% через 4 недели.
Влияние дозировки «Менопура мультидозы» на морфологию сперматозоидов показало меньшую вариабельность. Все дозировки, превышающие 75 МЕ, показали схожую эффективность: 41,1-45,5% (табл. 5).
Нежелательных явлений в ходе исследования зафиксировано не было. О серьезных нежелательных явлениях в процессе исследования также сообщений не поступало.
ОБСУЖДЕНИЕ
Менопаузальные гонадотропины рекомендованы Европейской ассоциацией урологов и Российским обществом урологов к применению у пациентов с гипогонадотропным гипогонадизмом в качестве средства для индукции сперматогенеза. Вместе с этим клинические рекомедации РОУ упоминают гонадоропины в качестве возможного варианта эмпирической терапии также и идиопатического мужского бесплодия, в том числе для повышения вероятности спонтанного наступления беременности [3, 13]. В ходе проведенного исследования были получены уникальные данные достаточно длительного наблюдения за эффективностью применения многодозового менотропина у бесплодных мужчин с различной степенью нарушений параметров эякулята и гормонального профиля. Оказалось, что уже четырехнедельный курс лечения позволяет добиться эффекта и достоверно улучшить характеристики (концентрацию, общее количество, прогрессивную подвижность, морфологию). Вероятно, это связано с влиянием на поздние стадии созревания сперматозоидов и улучшения их функциональных характеристик.
Это частично согласуется с данными U.A. Knuth и соавт., которые в рандомизированном плацебо-контролируемом клиническом исследовании с участием 39 мужчин с идиопатическим мужским бесплодием, (150 МЕ менотропинов 3 р/нед. + 2500 МЕ ХГЧ 2 р/нед. в течение 4-12 недель) показали, что уже через четыре недели процент подвижных сперматозоидов достоверно превышал группу плацебо. Однако, в отличие от упомянутого исследования, наши данные говорят о нарастании эффекта в отношении подвижности сперматозоидов с течение времени. Поэтому на наш взгляд целесообразно при недостаточной эффективности короткого курса (1 месяцев) целесообразно, продолжить лечение в течение, как минимум 3 месяцев, и далее вплоть до 12 месяцев подряд [14].
Кроме того, менотропины показали свое влияние на результаты применения вспомогательных репродуктивных технологий. Так, G. Beretta и соавт. показали, что применение 75 МЕ менотропина при идиопатической олигоастенотератозооспермии (ОАТ-синдром) приводит к статистически значимому улучшению концентрации сперматозоидов (р=0,016) и снижению атипичных форм (р=0,040). Более того, лечение менотропином улучшило качество эмбрионов при проведении ИКСИ [15].
Также до сих пор открытым оставался вопрос о влиянии индивидуального подбора дозы менотропина при мужском бесплодии. Не существует четких рекомендаций по выбору режима лечения, причем как длительности лечения, так и выбора конкретной дозировки.
Существуют различные мнения относительно старта терапии гонадотропинами. В то время как одни авторы рассматривают монотерапию чМГ или ФСГ, другие предлагают одновременное назначение ХГЧ и чМГ, так же есть отдельные работы, показавшие эффективность последовательного назначения данных препаратов (3-6 месяцев ХГЧ, затем добавляется ФСГ общей длительностью 16 месяцев) [5, 16-18].
В инструкции по применению менотропинов разрешается использование дозировок 75–150 МЕ менотропина 2-3 раза в неделю в сочетании с 1000-2000 МЕ ХГЧ 2 раза в неделю, врач в своей реальной клинической практике выбирает дозировку и кратность применения исходя из тяжести состояния и результатов обследования. Также врач в зависимости от наблюдаемого эффекта может изменить применяемую схему лечения. В приведенных выше исследованиях используются различные фиксированные дозировки, что затрудняет их сравнение.
Пациенты с идиопатическим бесплодием имеют множество клинических особенностей, отличающих их друг от друга. Поэтому терапия должна быть индивидуальной для каждого пациента. Кроме того, научные исследования должны исследовать патофизиологические механизмы, лежащие в основе бесплодия; только таким образом могут быть разработаны новые таргетные методы лечения [19].
ВЫВОДЫ
Применение многодозового менотропина как в коротких (1 месяц), так и в стандартных курсах (3-4 месяца) позволяет добиться улучшения репродуктивных исходов, а в ряде случаев и избежать хирургической экстракции сперматозоидов.
ЛИТЕРАТУРА
1. Agarwal A, Baskaran S, Parekh N, Cho CL, Henkel R, Vij S, Arafa M, Panner Selvam MK, Shah R. Male infertility. Lancet 2021;397(10271):319-333. https://doi.org/10.1016/S0140-6736(20)32667-2.
2. Andrology. Male Reproductive Health and Disfunction, Ed. Nieschlag E, Behre HM. 3-rd edition. Spinger 2010;455 p.
3. Minhas S, Bettocchi C, Boeri L, Capogrosso P, Carvalho J, Cilesiz NC, et al. European association of urology guidelines on male sexual and reproductive health: 2021 update on male infertility. Eur Urol 2021;80(5):603-620. https://doi.org/10.1016/ j.eururo.2021.08.014.
4. WHO Manual for the standardized investigation and diagnosis of the infertile couple (Cambridge, 2000). Ed. Rowe PJ, Comhaire FH, Hargreave TB, Mahmoud AMA. URL: https://www.who.int/publications/i/item/9780521774741.
5. Cocci A, Cito G, Russo GI, Falcone M, Capece M, Timpano M, et al. Effectiveness of highly purified urofollitropin treatment in patients with idiopathic azoospermia before testicular sperm extraction. Urologia 2018;85(1):19-21. https://doi.org/10.5301/ uj.5000253.
6. Hao M, Nie M, Yu BQ, Gao YJ, Wang X, Ma WL, et al. Gonadotropin treatment for male partial congenital hypogonadotropic hypogonadism in Chinese patients. Asian J Androl 2020;22(4):390-395. https://doi.org/10.4103/aja.aja_88_19.
7. Matsumoto AM, Snyder PJ, Bhasin S, Martin K, Weber T, Winters S. Stimulation of spermatogenesis with recombinant human follicle-stimulating hormone (follitropin alfa; GONAL-f): long-term treatment in azoospermic men with hypogonadotropic hypogonadism. Fertil Steril 2009;92(3):979-990.
8. Stamatiades GA, Kaiser UB. Gonadotropin regulation by pulsatile GnRH: Signaling and gene expression. Mol Cell Endocrinol 2018;463:131-141. https://doi.org/10.1016/ j.mce.2017.10.015.
9. La Vignera S, Condorelli RA, Duca Y, Cannarella R, Giacone F, Calogero AE. FSH treatment for normogonadotropic male infertility: a synergistic role for metformin? Eur Rev Med Pharmacol Sci 2019;23(13):5994-5998. https://doi.org/10.26355/eurrev_201907_18346.
10. Schill WB, Jüngst D, Unterburger P, Braun S. Combined hMG/hCG treatment in subfertile men with idiopathic normogonadotrophic oligozoospermia. Int J Androl 1982;5(5):467-77. https://doi.org/10.1111/j.1365-2605.1982.tb00278.x.
11. Bertrand-Delepine J, Leroy C, Rigot JM, Catteau-Jonard S, Dewailly D, Robin G. Stimulation of spermatogenesis: For whom? Why? How? Gynecol Obstet Fertil 2016;44(9):505-516.
12. De Rose AF, Gallo F, Giglio M, Parisini B, Carmignani G. Early use of menotropin in the treatment of varicocele. Arch Ital Urol Androl 2003;75(1):53-7.
13. Ахвледиани Н.Д., Аполихин О.И., Бабенко А.Ю., Боголюбов С.В., Божедомов В.А., Виноградов И.В. Клинические рекомендации. Мужское бесплодие. Одобрено Научно-практическим Советом Минздрава РФ; М., 2021;41 с. [Akhvlediani N.D., Apolikhin O.I., Babenko A.Yu., Bogolyubov S.V., Bozhedomov V.A., Vinogradov I.V. Clinical guidelines. Male infertility. Approved by the Scientific and Practical Council of the Ministry of Health of the Russian Federation; M., 2021;41 p. (in Russian)].
14. Knuth UA, Hönigl W, Bals-Pratsch M, Schleicher G, Nieschlag E. Treatment of severe oligospermia with human chorionic gonadotropin/human menopausal gonadotropin: a placebo-controlled, double blind trial. J Clin Endocrinol Metab 1987;65(6):1081-7. https://doi.org/10.1210/jcem-65-6-1081.
15. Beretta G, Fino E, Sibilio L, Dilena M. Menotropin (hMG) and idiopathic oligoastenoteratozoospermia (OAT): effects on seminal fluid parameters and on results in ICSI cycles. Arch Ital Urol Androl 2005;77(1):18-21.
16. Casarini L, Crépieux P, Reiter E, Lazzaretti C, Paradiso E, Rochira V, et al. FSH for the treatment of male infertility. Int J Mol Sci 2020;21(7):2270. https://doi.org/10.3390/ijms21072270.
17. Yasukawa A, Nakahara M, Kume T, Muromoto T, Mizutani H. Combined administration of human chorionic gonadotropin and human menopausal gonadotropin in idiopathic male infertility. Hinyokika Kiyo 1984;30(2):279-84.
18. Liu PY, Turner L, Rushford D, McDonald J, Baker HW, Conway AJ, Handelsman DJ. Efficacy and safety of recombinant human follicle stimulating hormone (GonalF) with urinary human chorionic gonadotrophin for induction of spermatogenesis and fertility in gonadotrophin-deficient men. Hum Reprod 1999;14(6):1540-5. https://doi.org/10.1093/humrep/14.6.1540.
19. Duca Y, Calogero AE, Cannarella R, Condorelli RA, La Vignera S. Current and emerging medical therapeutic agents for idiopathic male infertility. Expert Opin Pharmacother 2019;20(1):55-67. https://doi.org/10.1080/14656566.2018.1543405.







