ВВЕДЕНИЕ
Нефрэктомия – это хирургическая операция удаления почки, которая выполняется при определенных патологических состояниях и злокачественных опухолях. Основной целью является избавление человека от болезни, либо потенциальной угрозы жизни и здоровью. Применяется при запущенных гнойно-воспалительных и специфических заболеваниях, распространенном злокачественном новообразовании (при невозможности выполнения резекции почки), тяжелой травме, сморщивании или терминальном гидронефрозе (то есть при стойкой и необратимой утрате почечной функции), диспластических, рефлюксирующих и вазоренальных заболеваниях. Также донорская нефрэктомия может быть выполнена как этап трансплантации [1].
Традиционные открытые доступы все больше уступают эндовидеохирургическим операциям, в том числе робот-ассистированным. При выполнении эндовидеоскопической нефрэктомии применяется два доступа: лапароскопический и ретроперитонеоскопический [2]. Методика выполняется как мультидоступом, так и через единственный порт (Laparoendoscopic Single-Site Surgery, LESS). Диаметр рабочих портов также может различаться, от стандартных 5–12 Fr, до минилапароскопии (2-5Fr). Допускается hand-assisted способ (эндовидеохирургическая операция с ассистированием рукой хирурга) при любом варианте эндовидеоскопии [3].
Простая нефрэктомия предполагает удаление только непосредственно почки, в отличие от расширенной операции [2]. Простая нефрэктомия применяется при неонкологических заболеваниях, когда сохранение почки нецелесообразно или опасно. Классически эта операция применяется при сморщивании почки (нефросклерозе любого генеза), терминальном гидронефрозе, поликистозе, туберкулезе, пост-трансплантационной гипертонии, ксантагранулематозном пиелонефрите и ряде других заболеваний. Технически простая нефрэктомия не является по своей сути легкой операцией, и зачастую представляет собой серьезный вызов даже опытным хирургам [4].
Так как простая нефрэктомия является по сутки типичной органоуносящей операцией, существует возможность оптимизации периоперационного периода для сокращения сроков госпитализации и нетрудоспособности. При аналогичных операциях холецистэктомии или гистерэктомии протоколы ускоренного выздоровления (ПУВ, ERP) применяются успешно и уже стали одним из стандартов оказания помощи [5, 6].
Протоколы ускоренного выздоровления успешно применяются при резекции почки. В независимости от объема резекции, большинство пациентов могут быть выписаны через сутки после хирургического лечения [7]. Особенно следует отметить, что по данным исследования продленная госпитализация не влияет на частоту осложнений и риск реадмиссии [8]. Применение ПУВ при выполнении резекции почки сопровождается лучшим послеоперационным статусом пациентов, менее выраженной болью, меньшим сроком госпитализации, риском развития осложнений со стороны желудочно-кишечного тракта [9, 10].
Цель исследования – сравнительный анализ исходов простой лапароскопической нефрэктомии по протоколу ускоренного выздоровления и при стандартном подходе.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования
Проведение клинического исследования было одобрено локальным этическим комитетом Федерального государственного бюджетного образовательного учреждения высшего образования «Иркутский государственный медицинский университет» Министерства здравоохранения Российской Федерации. Характер исследования: рандомизированное проспективное слепое. Все операции выполнены одним специалистом.
Исследование включает анализ периоперационного статуса и исходов лечения у пациентов, которым была выполнена простая лапароскопическая нефрэктомия по поводу нефункционирующей почки в период с 2018 г. по 2021 г.
Критерии включения:
- планирование простой лапароскопической нефрэктомии по поводу нефункционирующей почки;
- соответствие операции критериям утвержденного протокола;
- показатель дифференциальной функции почек (DRF) менее 10%;
- периоперационное ведение пациента планируется по одному из утвержденных протоколов;
- возраст старше 18 лет;
- подписанное согласие на участие в исследовании.
Критерии невключения:
- отсутствие конкретизированных показаний;
- онкологическое заболевания почки;
- сомнительные данные DRF по результатам динамической нефросцинтиграфии;
- отсутствие пробного дренирования почки на срок не менее 2-3-х месяцев при терминальном гидронефрозе;
- отказ от участия в исследовании;
- исходно сниженный соматический статус (декомпенсированные сахарный диабет, сердечная недостаточность c фракцией выброса менее 50%, грубые неврологические дефициты, злокачественные заболевания в зоне интереса и прочее);
- невозможность соблюдения ПУВ.
Критерии исключения:
- отказ от участия до достижения контрольных точек;
- изменение состава хирургической бригады;
- отклонение от протокола исследования.
Выполнен предварительный расчет минимального размера выборки: 10 (Хи-квадрат) и 12 (t-критерий) случаев в группе достаточно для получения статистических значимых различий по длительности послеоперационного пребывания, рискам развития тошноты и рвоты, послеоперационной боли. Минимальный размер выборки увеличен на 10%. Таким образом, общий размер выборки должен быть ≥ 26 случаев. Для представления достоверного мультифакторного прогностического анализа риска реадмиссии, реоперации (по осложнениям по классификации Clavien-Dindo >3a класса) и другим редким осложнениям размер групп должен большим. В рамках представленного проспективного исследования на момент публикации искомый объем не достигнут.
Набор пациентов осуществлялся сплошным способом до достижения размера выборки. В 2018–2021 годах показания для простой нефрэктомии согласно критериям включения выявлены у 45 пациентов.
Отклонения от протокола
Из первично включенных 35 пациентов, 8 – были исключены из исследования (2 – отклонение от протокола, 6 – отказались в процессе). В окончательный анализ включены 27 случаев (per-protocol): первая группы (n=14, I группа, ST group), стандартное лечение; вторая группа (n=13, II группа, ER group), по протоколу enchanted recovery.
Конечные точки
«Жесткие» конечные точки: свобода от реоперации и реадмиссии не ранее, чем через месяц; выявленные осложнения по классификации Clavien-Dindo ≥3a класса на любом этапе послеоперационного наблюдения.
«Мягкие» конечные точки: послеоперационный локальный статус, послеоперационные осложнения по Clavien-Dindo 1–2 класса.
Сопоставимость группы сравнения
Исходные параметры пациентов представлены в таблице 1.
На основании сравнительного анализа установлена однородность групп (p>0,05) по большинству исходных параметров.
Таблица 1. Предоперационный статус пациентов
Table 1. Preoperative status of patients
| Показатель Indicator |
Группа I, (n = 14) Group I, (n = 14) |
Группа II, (n = 13) Group II, (n = 13) |
Р |
|---|---|---|---|
| Общие показатели/ General indicators: Возраст, лет / Age, years Рост, см / Height, cm Вес, кг / Weight, kg Женский пол / Female, n (%) |
63,5 (52;68) 170,8 (±8,6) 81,2 (±12,5) 5 (35,7%) |
40 (34;67) 173,1 (±6,6) 71,8 (±18,0) 6 (46,1%) |
0,132 0,447 0,128 0,720 |
| Вероятная причина заболевания/ Etiology factor: Гидронефроз / Hydronephrosis, n (%) Васкулярная патология / Vascular pathology, n (%) Другие причины / Other, n (%) |
10 (71,4%) 1 (7,1%) 3 (21,4%) |
10 (76,9%) 2 (15,3%) 1 (7,6%) |
0,900 0,542 0,385 |
| Сопутствующие заболевания / Accompanying illnesses: Ишемическая болезнь сердца / Coronary artery disease, n (%) Гипертоническая болезнь / Hypertonic disease, n (%) Сахарный диабет / Diabetes mellitus, n (%) Хроническая мочевая инфекция / Chronic urinary infection, n (%) |
2 (14,2%) 1 (7,1%) 0 (0%) 4 (28,5%) |
4 (30,7%) 6 (46,1%) 1 (7,6%) 10 (76,9%) |
0,411 0,074 0,308 0,154 |
| DRF удаляемой почки/ DRF of the removed kidney, n (%) | 2,2 (±2,3) | 2,1 (±2,3) | 0,882 |
DRF – Differential Renal Function
Методы диагностики
При обследовании применяли анамнестические (с целью установления давности заболевания, сопутствующих болезней и прочее), клинические, биохимические, ультразвуковые, томографические, рентгенологические, эндоскопические методы исследования. Патологические изменения в почках и мочеточниках оценивали по мультиспиральной компьютерной томографии (МСКТ) с ангиографией и урографией. Для оценки почечной функции выполняли динамическую нефросцинтиграфию (в исследование представлен параметр DRF). Послеоперационный статус, наличие урогематом и прочее также оценивались по данным МСКТ. Выраженность послеоперационной боли оценивали повизуальной аналоговой шкале (ВАШ; VAS).
По достижении месячного периода все пациенты не реже чем один раз в год проходили стандартное обследование: консультация уролога, анализы крови и мочи, ультразвуковое исследования почек или МСКТ почек, динамическая нефросцинтиграфия. Успешными считали клинические случаи, свободные от реадмиссии и реоперации не ранее, чем через месяц.
Статистический анализ
Анализ исходных данных и результатов хирургического лечения осуществляли с помощью программ «STATISTICA для Windows версия 10.0» (Statsoft, Inc, США), «SPSS Statistics версия 23.0» (IBM, США) и «Stata версия 16.0» (StataCorp, США). Уровень значимости для всех использующихся методов установлен как p≤0,05 (исключение – множественная логистическая регрессия).
Протокол лечения
При выполнении исследования применены два протокола лечения: стандартный (группа I) и протокола ускоренного выздоровления (группа II; ER) (табл. 2).
Окончательный выбор протокола лечения принимался заранее в момент первичного обращения. Пациенты соответствовали протоколу ER при выполнении не менее 90% условий из таблицы 2.
Таблица 2. Схема ПУВ периоперационного ведения пациентов при лапароскопической нефрэктомии
Table 2. ER protocol for patients with laparoscopic nephrectomy
| Пооперационный период Preoperative |
Интраоперационный период Intraoperative |
Послеоперационный период Postoperative |
|---|---|---|
| Углубленное информирование пациента patient education |
Мультимодальное обезболивание Multimodal pain relief |
Раннее употребление жидкости (через 2-3 часа после операции) и пищи (через 6 часов после операции) Early fluid intake (2-3 hours after surgery) and food (6 hours after surgery) |
| Концепция одного дня - пациент проходит большую часть предоперационных обследований в один день One-day-diagnostic conception |
||
| Мультидисциплинарный осмотр пациентов Multidisciplinary examination of patients |
Контроль нормотермии, эуволемии Control of normothermia, euvolemia |
Подробное обсуждение поведения пациента и плана реабилитации перед выпиской Detailed discussion about rehabilitation plan before discharge |
| Бритье операционного поля с последующей обработкой растворами кожных антисептиков накануне Shaving of the surgical field with skin antiseptic solutions |
Миниинвазивность (в том числе минилапароскопия, оптические троакары/порты, применение шейвера, endobag, одноразовый инструмент) Minimally invasive (including minilaparoscopy, optical trocars/ports, shaver, endobag, disposable instrument) |
Мультимодальная профилактика тошноты и рвоты Multimodal prevention of nausea and vomiting |
| Однократная антибиотикопрофилактика за 60 минут до операции Single antibiotic prophylaxis 60 minutes before surgery |
Отказ от монополярной энергии Refusal of monopolar energy |
Контрольное УЗИ, анализы в первые сутки после операции Control ultrasound, tests on the first postoperative day |
| Выполнение CT/MRI с 3D-моделированием CT/MRI with 3D modeling |
Дополнительная герметизация культи клеем Additional sealing of the stump with glue |
Послеоперационный контроль боли Postoperative pain control |
| Преабилитация Prehabilitation |
Отказ от использования дренажей Refusal to use drains |
Использование жевательной резинки в первые и вторые сутки после операции Use of chewing gum on the first and second days after surgery |
| Отказ от очищения кишечника и голодания, перевод пациента на бесшлаковую диету за 1-3 дня до операции Refusal to cleanse the intestines and fasting, transfer the patient to a slag-free diet 1-3 days before the operation |
Отказ от орошения в процессе операции Refusal to irrigate during the operation |
Выписка из стационара через один день после операции с переводом пациента на амбулаторное наблюдение Discharge from the hospital at the first postoperative day |
| Рабочее давление в полости почки в пределах 5-10 mmHg Working pressure within 5-10 mmHg |
Строгий контроль гликемии у пациентов с нарушением толерантности к углеводам и сахарным диабетом Strict glycemic control |
|
| Герметичный косметический шов кожи без свободных концов и узлов на коже, клеевая повязка на кожу Sealed cosmetic suture of the skin with glue bandage |
Строгий план контрольных осмотров в послеоперационном периоде Strict plan of follow-up examinations in the postoperative period |
Ограничения исследования
Ограничения исследования: малый размер выборки, средний период послеоперационного наблюдения менее двух лет.
Преимущества исследования: один оперирующий хирург, проспективный рандомизированный слепой набор пациентов, строгий учет критериев включения, невключения и исключения, строгий послеоперационный контроль, однородность групп, углубленный анализ исходных и послеоперационных данных.
РЕЗУЛЬТАТЫ
Объективные и функциональные результаты
В интра- и послеоперационном периоде случаев летальности, осложнений анестезиологического пособия, критического ухудшения состояния здоровья по сопутствующим заболеваниям в обеих группах не зафиксировано. В раннем и позднем послеоперационном периоде не зафиксировано осложнений анестезиологического пособия, либо ухудшения состояния по общесоматическому статусу.
Анализ размеров хирургических доступов (в суммарном выражении): средние линейные размеры у пациентов I группы составили 50,3 ±6,0 мм, что больше, чем у пациентов II группы (35,3±5,9 мм, p<0,001). Продолжительность операции в группах I и II в среднем составила 115 (90;120) и 80 (80;90) минут, соответственно (р=0,001).
В таблице 3 представлен послеоперационный статус пациентов.
Таблица 3. Послеоперационный статус пациентов
Table 3. Postoperative status of patients
| Показатель Indicator |
Группа I, (n = 14) Group I, (n = 14) |
Группа II, (n = 13) Group II, (n = 13) |
Р |
|---|---|---|---|
| Осложнения по Clavien-Dindo/ Complications by Clavien-Dindo: I класс/ class, n (%) II класс/class, n (%) Illa класс/class, n (%) |
10 (71,4%) 8 (57,1%) 1 (7,1%) |
8 (61,5%) 1 (7,6%) 0 (0%) |
0,807 0,048 0,343 |
| Фебрилитет в 1-й послеоперационный день / Febrile 1POD, n (%) | 6 (42,8%) | 0 (0%) | 0,029 |
| Тошнота/дискинезия кишечника в 1-й послеоперационный день Nausea/intestinal dyskinesia 1POD, n (%) |
6 (42,8%) | 1 (7,6%) | 0,104 |
| Рвота/диарея/парез кишечника в 1-й послеоперационный день Vomiting / diarrhea / intestinal paresis 1POD, n (%) |
2 (14,2%) | 0 (6,6%) | 0,186 |
| Гематома в ложе удаленной почки Hematoma in the area of the removed kidney, n (%) |
1 (7,1%) | 0 (0%) | 0,343 |
| ВАШ >5 / VAS > 5, n (%) Послеоперационная боль, баллы / Postoperative pain, points Наркотическое обезболивание / Narcotic pain relief, n (%) |
14 (100%) 8 (7;8) 8 (57,1%) |
3 (23,0%) 5 (5;5) 0 (0%) |
0,040 <0,001 0,013 |
| Продолжительность послеоперационного пребывания, дни post-operative hospitalization, days |
9,5±2,2 | 1,0±0,0 | <0,001 |
| Удовлетворенность проведенным лечением Satisfaction with the treatment, n (%) |
8 (57,1%) | 13 (100%) | 0,342 |
VAS – visual analog scale; 1POD – first postoperative-day
Послеоперационные осложнения III классов ClavienDindo развивались крайне редко, их уровень оказался сопоставим в обеих группах (p>0,05). Единственное зарегистрированное осложнение IIIa класса связано с выявленной в послеоперационном периоде гематомой в зоне удаленное почки. Выполнено чрескожное дренирование под ультразвуковым наведением с последующим выздоровлением (гематома частично дренировалась, частично лизировалась без отдаленных последствий). Осложнения II класса преобладали в группе I и были связаны с дисфункцией желудочно-кишечного тракта и гипертермией более 38оС (p<0,05).
При сравнении продолжительности госпитализации отмечается достоверно (p<0,001) более длительное пребывание пациентов I группы (9,5±2,2 дней) в сравнении с II группой (1,0±0,0 день). Субъективная удовлетворенность проведенным лечением (при просьбе критического анализа по всем возможным жалобам) оказалась сопоставима, и составила 57,1% для I группы и 100% для II группы (p=0,342).
Среднее значение показателя послеоперационной боли в I группе было равно 8 (7;8) баллов, во II группе – 5 (5;5) баллов (р<0,001). Обезболивание наркотическими анальгетиками в первые сутки после операции потребовалось только 8 (57,1%) пациентам I группы (р=0,013). Таким образом, выраженность послеоперационного болевого синдрома у пациентов I группы оказалась достоверно выше, чем во II группе.
При проведении логистического регрессионного анализа для послеоперационного болевого синдрома >5 баллов VAS установлена высокая прогностическая значимость ряда факторов, отраженная в таблице 3. На основании полученных результатов выполнен многофакторный регрессионный анализ (выбор из предикторных факторов с уровнем значимости p<0,05, статистическая значимость результата p<0,1).
Значимым предиктором возникновения болевого синдрома по ВАШ>5 баллов стало увеличение размеров хирургического доступа на каждый 1 мм (ОШ 0,14; 95% ДИ -0,01;0,307; р=0,077). Получена модель с очень хорошей прогностической ценностью (AUC = 0,89), представленная в виде ROC-кривой на рисунке 1.
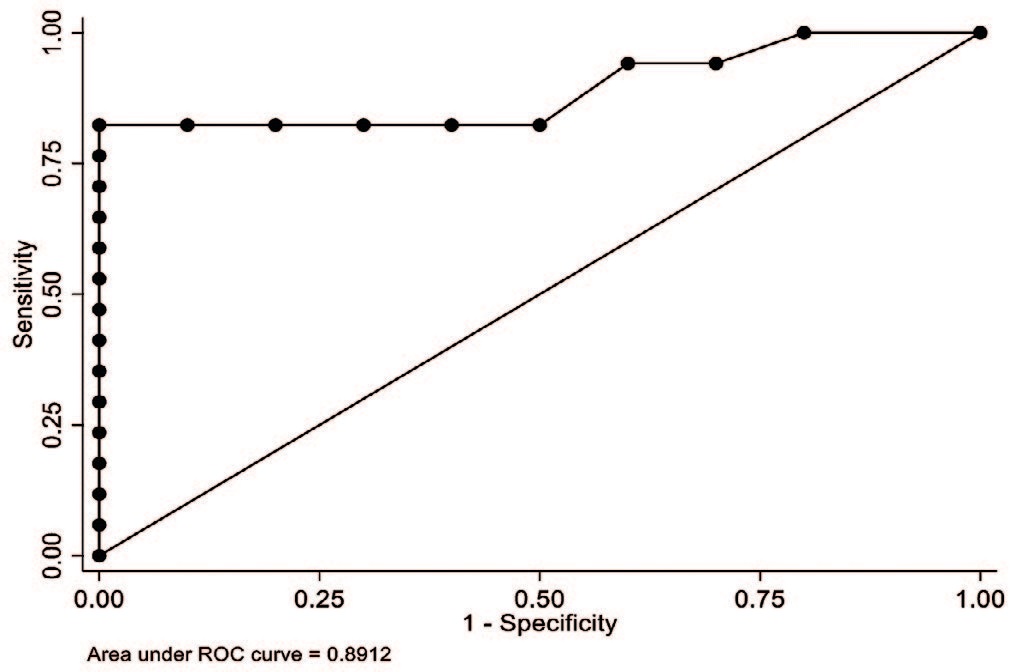
Рис. 1. ROC-кривая для многофакторной логит-регрессии предикторов послеоперационной боли >5 баллов по VAS
Fig. 1. ROC curve for multivariate logit regression of predictors of postoperative pain >5 VAS scores
Для определения предикторов развития послеоперационных осложнений и состояний проведен логистический регрессионный анализ, результаты которого частично представлены в таблице 4. Достоверных предикторов развития требующих коррекции осложнений со стороны желудочно-кишечного тракта не установлено.
Таблица 4. Предикторы осложнений и удовлетворенности лечением
Table 4. Predictors of complications and satisfaction with treatment
| Фактор Sign |
Предиктор Predictor |
Однофакторный анализ Univariate analysis |
Многофакторный анализ Multivariate analysis |
|||
|---|---|---|---|---|---|---|
| X2 | ОШ/OR (95% ДИ/CI) | X2 | ОШ/OR (95% ДИ/CI) | X2 | ||
| ВАШ/VAS >5 Многофакторная логит-регрессия Multivariate analysis X2 =17,60; p=0,0005 |
Гиперволемия / Hypervolemia Размер доступа, мм Access size Время операции, мин / Operation time, min |
6,96 12,58 8,45 |
2,55 (0,27;4,83) 0,206 (0,05;0,35) 0,07(0,006;0,15) |
0,028 0,008 0,033 |
2,36 (-0,75;5,47) 0,14 (-0,01;0,307) 0,06 (-0,02;0,15) |
0,138 0,077 0,176 |
| Послеоперационная гипертермия >38°C / Febrile Многофакторная логит-регрессия Multivariate analysis χ2 = 16,94; р=0,0002 |
Объем инфузии, мл / Volume of infusion, ml Размер доступа, мм / Access size |
13,72 8,98 |
0,003 (0,0007;0,005) 0,19 (0,027;0,367) |
0,011 0,023 |
0,003 (0,0001;0,005) 0,18 (-0,05;0,426) |
0,042 0,127 |
| Субъективная удовлетворенность / Subjective satisfaction Многофакторная логит-регрессия / Multivariate analysis χ2=12,19; р=0,0023 |
Каждый 1 день госпитализации Every 1 day of hospitalization Каждый POD Each POD |
6,55 10,29 |
-0,15(-0,29;-0,012) 0,464(-0,90;-0,024) |
0,033 0,038 |
0,28(-0,15;0,72) -1,08(-2,32;0,15) | 0,207 0,086 |
VAS/ВАШ - visual analog scale/визуально-аналоговая шкала боли;
POD – postoperative day/послеоперационный день
При проведении логистического регрессионного анализа для послеоперационной гипертермии >38оC по данным многофакторной регрессии значимым предиктором установлен объем интраоперационной инфузии (за каждый +1 мл; ОШ 0,003; 95% CI 0,0001;0,005; р=0,042). Получена модель с отличной прогностической ценностью (AUC = 0,96), представленная в виде ROC-кривой на рисунке 2.
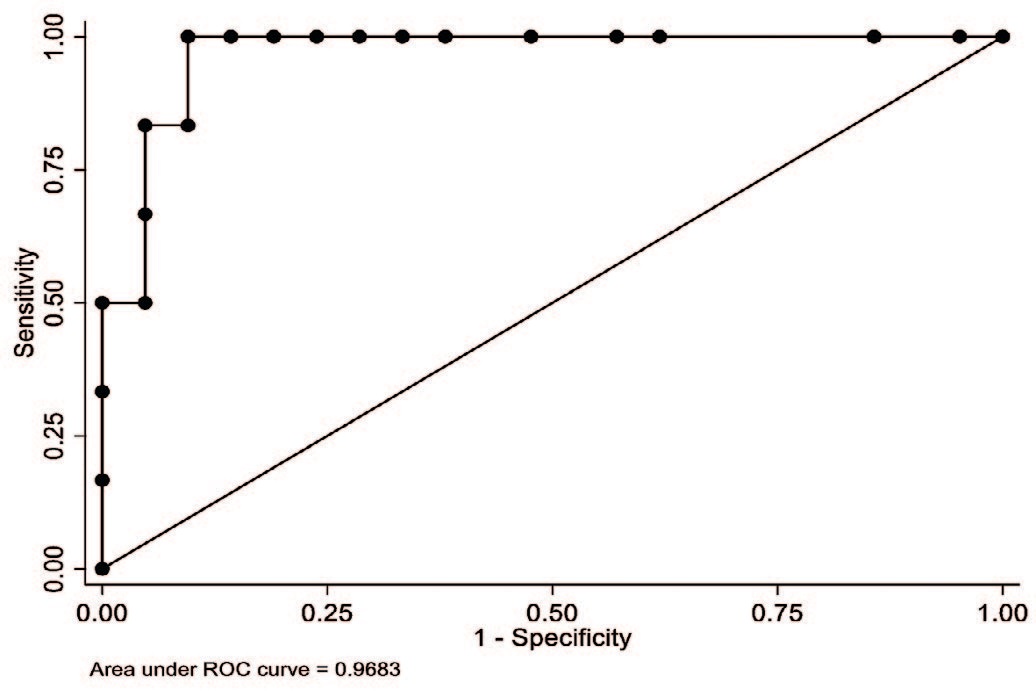
Рис. 2. ROC-кривая для многофакторной логит-регрессии предикторов послеоперационной гипертермии >38оC
Fig. 2. ROC curve for multivariate logit regression of febrile predictors
При проведении логистического регрессионного анализа для удовлетворенности проведенным лечением по данным многофакторной регрессии значимым предиктором установлена длительность послеоперационного пребывания (за каждый +1 день; ОШ -1,08; 95% CI -2,32;0,15; р=0,086). Получена модель с очень хорошей прогностической ценностью (AUC = 0,87), представленная в виде ROC-кривой на рисунке 3.
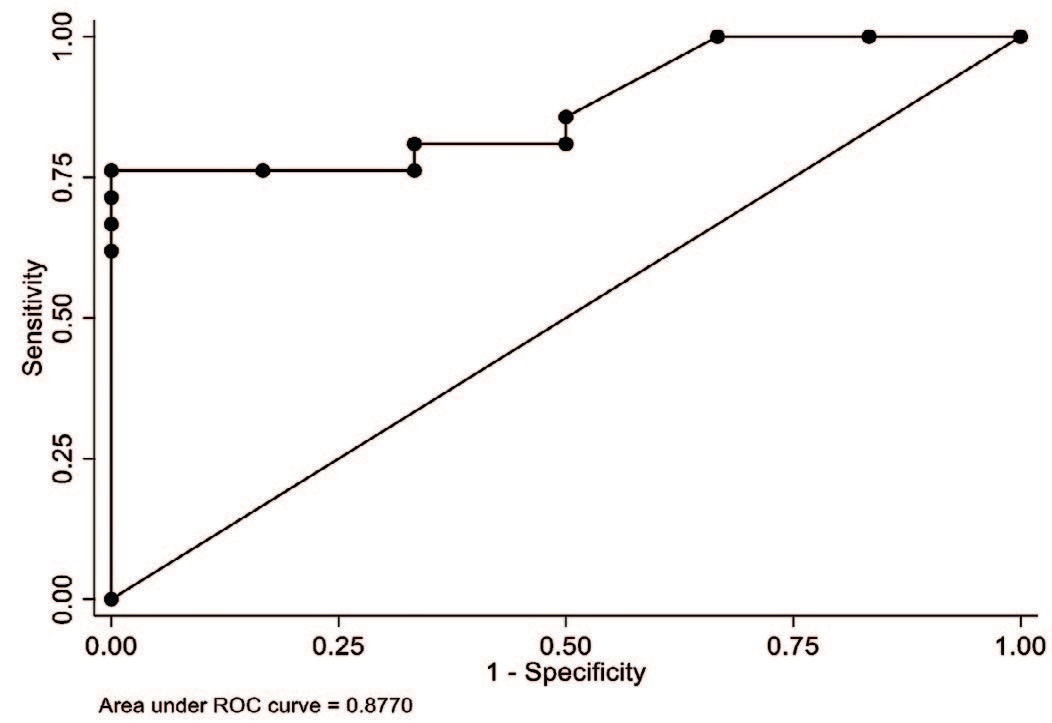
Рис. 3. ROC-кривая для многофакторной логит-регрессии предикторов удовлетворенности проведенным лечением
Fig. 3. ROC-curve for multivariate logit-regression of predictors of satisfaction with the performed treatment
Общие результаты
Средний срок клинических наблюдений составил 401 (388;429) дней, максимальный срок – 452 дней. I группа – 400 (388;427) дней (max 452 дней), II группа – 419 (392;447) дней (max 918 дней). Период наблюдения оказался сопоставим для обеих групп (p=0,344).
В послеоперационном периоде случаев летальности, осложнений Clavien-Dindo >3a не зафиксировано. Соответственно статистический анализ выживаемости не выполнялся.
В I группе из 14 операций показатель успешности составил 92,8% (n=13), а во II группе – 100% (n=13). Первичная эффективность оказалась сопоставима (p=0,892). Единственный случай потенциальной реадмиссии зарегистрирован в I группе через 7 дней. Для логистической оценки реадмиссии принята гипотеза, что все пациенты были выписаны на первый послеоперационный день (потенциальная реадмиссия).
Значения оценок Каплана-Мейера свободы от потенциальной реадмиссии в I группе оказались равными 92,8 ±6,8% (95% CI 59,08–98,96%) в течение всего периода наблюдения, а пациентов II группы – 100±0%.
Лог-ранговый критерий не выявил статистически значимых различий (р=0,335; χ2=0,93) по частоте рецидива за весь период наблюдения, что графически выражено по методу Каплана-Мейера на рисунке 4.
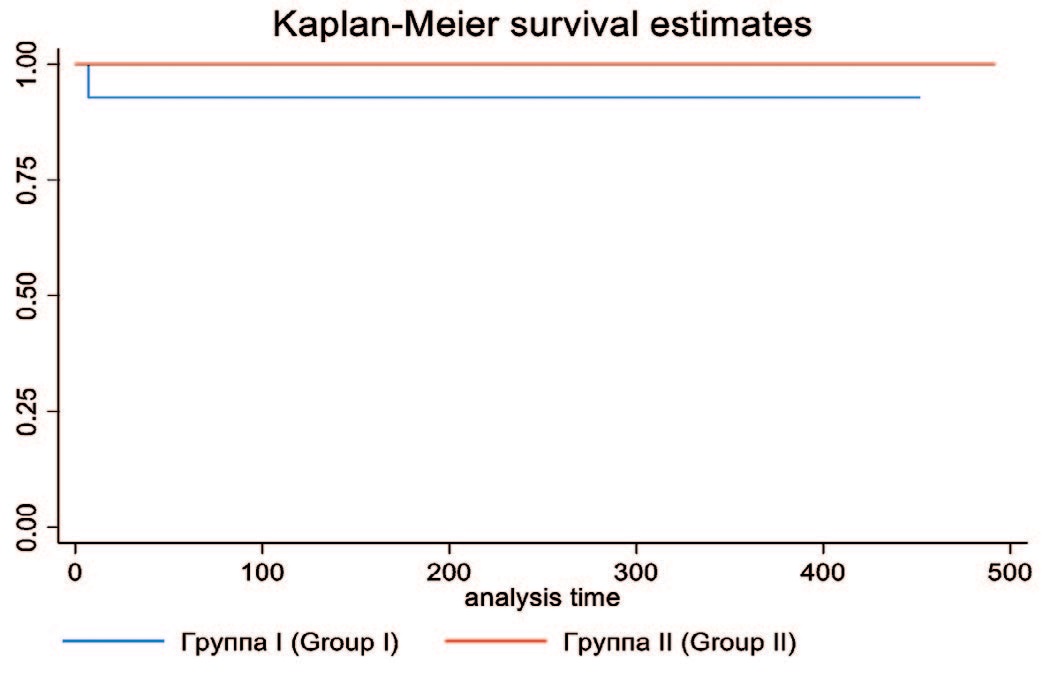
Рис. 4. Свобода от потенциальной реадмиссии в группах исследования по методу Каплан-Мейера.
Fig. 4. Freedom from potential readmission by Kaplan-Meier method
Регрессионная модель пропорциональных рисков Кокса не продемонстрировала достоверных предикторов в связи единственным случаем реадмиссии.
ОБСУЖДЕНИЕ
Выполнено сравнение полученных результатов с данными работ других авторов. При литературном поиске за последние 10 лет в базах данных Scopus, WoS, PubMed выявлено менее пятидесяти работ, посвященных ускоренному выздоровлению при выполнении нефрэктомии или резекции почки, из которых представлено всего несколько рандомизированных исследований и мета-анализов данных.
Следует отметить, что в настоящее время не существует четко определенных показаний к удалению почки только лишь на основании оценки дифференцированной почечной функции (по данным динамической нефросцинтиграфии). Ряд авторов считает нецелесообразным сохранение почки при DRF менее 10% [11]. При этом представлены исследования, опровергающие данный вывод [12]. Поэтому в рамках работы при терминальных гидронефрозах выполнялось предварительное дренирование почки с повторной оценкой почечной функции через несколько месяцев. Только в случае отсутствия позитивных изменений принималось решение об удалении почки.
В целом отмечается позитивная мировая тенденция все более широкого распространения и разработок протоколов ускоренного выздоровления в самых разных хирургических сферах, в том числе и в урологии. Внедрение подобного подхода позволяет добиться существенной экономии средств как системы здравоохранения, так и частных учреждений здравоохранения [13]. Помимо высокой финансовой эффективности, протоколы ускоренного выздоровления позволяют добиться лучшего качества жизни пациентов в сравнении с традиционными подходами периоперационной курации [14, 15].
При литературном поиске не выявлено ни одной работы, посвященной рандомизированному сравнению результатов простой лапароскопической нефрэктомии при неонкологических заболеваниях по протоколу ускоренного выздоровления. Имеется ряд исследований, демонстрирующих лучший послеоперационный объективный и психологический статус при выполнении донорской нефрэктомии по протоколу ускоренного выздоровления. Исследование продемонстрировало возможность и безопасность ранней выписки пациентов из стационара, что подтверждено полученными в представленной работе результатами [16].
По данным проведенного исследования установлено, что применение протокола ускоренного выздоровления позволяет добиться сопоставимых результатов лечения при более коротком периоде госпитализации и лучшем общем функциональном статусе. Отмечен достоверно менее выраженный послеоперационный болевой синдром и риски развития послеоперационной тошноты и рвоты без увеличения риска реадмисии. Аналогичные выводы получены в исследованиях, посвященных сравнению стандартного лечебного подхода и протокола ускоренного выздоровления при резекции почки [9] и при донорской нефрэктомии [17]. При этом размер удаляемого органа не коррелирует напрямую с общим суммарным размером доступа и объемом операционной травмы при применении современного инструментария, шейвера или фрагментации удаляемой почки [18].
Примененный в исследовании протокол мультимодального и интра- и послеоперационного обезболивания, отказ от опиатов в послеоперационном периоде является обоснованным и эффективным с точки зрения качественного контроля боли и риска развития осложнений [10, 19].
Применение мультимодальной профилактики тошноты, рвоты, в том числе использование жевательной резинки достоверно снижает вероятность развития осложнений со стороны желудочно-кишечного тракта [20]. Крупный мета-анализ данных продемонстрировал эффективность локального применения клея с целью гемостаза и профилактики вторичных кровотечений на примере резекции печени. Однако ранее не было представлено работ, демонстрирующих результаты применения клея для обработки культи сосудов и почечного ложа [21].
Применение клеев для закрытия раневых дефектов в настоящее время не рекомендуется, так как их применение увеличивает вероятность расхождения краев раны [22]. Однако вязкие клеи в качестве раневой повязки позволяют уменьшить вероятность развития раневой инфекции [23]. Применение клеевой повязки позволяет необходимости избежать туалета раны, ежедневных или периодичных перевязок, позволяет осуществлять гигиенические водные процедуры уже в первый день после операции. Соответственно, улучшается послеоперационный статус и общая удовлетворенность лечением.
ВЫВОДЫ
Простая лапароскопическая нефрэктомия по протоколу ускоренного выздоровления позволяет добиться лучших результатов лечения в сравнении с традиционным подходом. Ускоренное выздоровление достигается без увеличения риска повторной операции или госпитализации, и с лучшими показателями послеоперационного статуса пациента.
Целесообразно дальнейшее изучение и оптимизация разработанного протокола в рамках мультицентрового исследования с последующим внедрением в повсеместную клиническую практику.
ЛИТЕРАТУРА
1. Lecoanet P, Chammas MF, Sime WN, Guillemin F, Karam G, Ladrière M, et al. Minimally Invasive and Open Donor Nephrectomy: Lessons Learned From a French Multicenter Experience. Transplant Proc 2022:S0041-1345(22)00131-2. https://doi.org/10.1016/j.transproceed.2022.02.005.
2. Ali AI, Abdel-Karim AM, Abdelghani MM, Eldakhakhny A, Fawzy AM, Hassan A, et al. Transperitoneal laparoscopic simple nephrectomy for giant hydronephrosis: Tips and tricks to make it easier. Urologia 2022:3915603211048147. https://doi.org/10.1177/03915603211048147.
3. Shah PC, de Groot A, Cerfolio R, Huang WC, Huang K, Song C, et al. Impact of type of minimally invasive approach on open conversions across ten common procedures in different specialties. Surg Endosc 2022. https://doi.org/10.1007/s00464-022-09073-5.
4. Atik YT, Cimen HI, Gul D, Uysal B, Köse O, Halis F. The simple nephrectomy is not always simple: predictors of surgical difficulties. Urol Int 2022:1–7. https://doi.org/10.1159/000521394.
5. Lambat Emery S, Brossard P, Petignat P, Boulvain M, Pluchino N, Dällenbach P, et al. Fast-Track in minimally invasive gynecology: a randomized trial comparing costs and clinical outcomes. Front Surg 2021(8):773653. https://doi.org/10.3389/fsurg.2021.773653.
6. Beloborodov V, Vorobev V, Sherbatykh A, Luchkevich V, Kelchevskaya E, Kozhevnikov M, et al. Effectiveness of the Fast Track Surgery Program for Patients with Planned Cholecystectomy. Surg Technol Int 2022(40):sti40/1534. https://doi.org/10.52198/22.STI.40.GS1534.
7. Sentell KT, Badani KK, Paulucci DJ, Hemal AK, Porter J, Eun DD, et al. A Single Overnight Stay After Robotic Partial Nephrectomy Does Not Increase Complications. J Endourol 2019(33):1003–8. https://doi.org/10.1089/end.2019.0218.
8. Abaza R, Shah K. A single overnight stay is possible for most patients undergoing robotic partial nephrectomy. Urology 2013(81):301–6. https://doi.org/10.1016/j.urology.2012.08.067.
9. Xue X, Wang D, Ji Z, Xie Y. Enhanced recovery after surgery in patients undergoing laparoscopic partial nephrectomy. Results from a real-world randomized controlled trial. Wideochir Inne Tech Maloinwazyjne 2022(17):116–26. https://doi.org/10.5114/wiitm.2021.108216.
10. Dong X, Burton BN, Little C, Woodhouse L, Grogan T, Blumberg JM, et al. Intraoperative opioid and analgesic adjuvant administration practice patterns following implementation of an enhanced recovery after surgery protocol for laparoscopic donor nephrectomy. J Clin Anesth 2022(79):110751. https://doi.org/10.1016/j.jclinane.2022.110751.
11. Ransley PG, Dhillon HK, Gordon I, Duffy PG, Dillon MJ, Barratt TM. The postnatal management of hydronephrosis diagnosed by prenatal ultrasound. J Urol 1990(144):584-7.; discussion 593-594. https://doi.org/10.1016/s0022-5347(17)39528-9.
12. Bowen DK, Mittal S, Aghababian A, Eftekharzadeh S, Dinardo L, Weaver J, et al. Pyeloplasty is a safe and effective surgical approach for low functioning kidneys with ureteropelvic junction obstruction. J Pediatr Urol 2021;17:233.e1-233.e7. https://doi.org/10.1016/j.jpurol.2020.12.018.
13. Heathcote S, Duggan K, Rosbrugh J, Hill B, Shaker R, Hope WW, et al. Enhanced Recovery after Surgery (ERAS) Protocols Expanded over Multiple Service Lines Improves Patient Care and Hospital Cost. Am Surg 2019(85):1044–50.
14. Brooks NA, Kokorovic A, McGrath JS, Kassouf W, Collins JW, Black PC, et al. Critical analysis of quality of life and cost-effectiveness of enhanced recovery after surgery (ERAS) for patient’s undergoing urologic oncology surgery: a systematic review. World J Urol 2020. https://doi.org/10.1007/s00345-020-03341-6.
15. Miao C, Yu A, Yuan H, Gu M, Wang Z. Effect of Enhanced Recovery After Surgery on Postoperative Recovery and Quality of Life in Patients Undergoing Laparoscopic Partial Nephrectomy. Front Oncol 2020(10):513874. https://doi.org/10.3389/fonc.2020.513874.
16. Prionas A, Craddock C, Papalois V. Feasibility, Safety and Efficacy of Enhanced Recovery After Living Donor Nephrectomy: Systematic Review and Meta-Analysis of Randomized Controlled Trials. J Clin Med 2020(10):E21. https://doi.org/10.3390/jcm10010021.
17. Byrne MHV, Mehmood A, Summers DM, Hosgood SA, Nicholson ML. A systematic review of living kidney donor enhanced recovery after surgery. Clin Transplant 2021(35):e14384. https://doi.org/10.1111/ctr.14384.
18. Gobishangar S, Shelton J. Minimally invasive management of massive giant hydronephrosis in tertiary care centre Northern Sri Lanka: A case report. Int J Surg Case Rep 2021(88):106514. https://doi.org/10.1016/j.ijscr.2021.106514.
19. Yip W, Chen AB, Malekyan C, Widjaja W, Yan K, Stankey M, et al. An Enhanced Recovery After Surgery protocol for robotic-assisted laparoscopic nephrectomies utilizing a quadratus lumborum block. J Robot Surg 2022. https://doi.org/10.1007/s11701-022-01379-9.
20. Short V, Herbert G, Perry R, Atkinson C, Ness AR, Penfold C, et al. Chewing gum for postoperative recovery of gastrointestinal function. Cochrane Database Syst Rev 2015:CD006506. https://doi.org/10.1002/14651858.CD006506.pub3.
21 Wells CI, Ratnayake CBB, Mentor K, Sen G, Hammond JS, French JJ, et al. Haemostatic Efficacy of Topical Agents During Liver Resection: A Network Meta-Analysis of Randomised Trials. World J Surg 2020(44):3461–9. https://doi.org/10.1007/s00268-020-05621-z.
22. Dumville JC, Coulthard P, Worthington HV, Riley P, Patel N, Darcey J, et al. Tissue adhesives for closure of surgical incisions. Cochrane Database Syst Rev 2014:CD004287. https://doi.org/10.1002/14651858.CD004287.pub4.
23. Wood C, Phillips C. Cyanoacrylate microbial sealants for skin preparation prior to surgery. Cochrane Database Syst Rev 2016:CD008062. https://doi.org/10.1002/14651858.CD008062.pub4.







