В настоящее время радикальная простатэктомия и радикальная цистэктомия являются наиболее оптимальными методами лечения локализованных форм рака предстательной железы (РПЖ) и инвазивных форм рака мочевого пузыря. По данным литературы эректильная дисфункция после радикальной простатэктомии развивается в 25-75 % случаев [1], а частота развития недержания мочи колеблется от 2 до 49 % [2, 3]. Недержание мочи различной тяжести после радикальной цистэктомии может достигать 53% [4], а частота эректильной дисфункции – 81% независимо от метода формирования мочевого резервуара [5]. Выполнение нервосберегающих модиэтих операций позволяет уменьшить частоту развития осложнений в послеоперационном периоде.
Строение сосудисто-нервных пучков (СНП) весьма вариабельно. Часто нервные волокна, составляющие СНП, имеют рассыпной тип строения и микроскопический размер, и не могут быть адекватно визуализированы во время операции [6]. В зависимости от распространенности опухолевого процесса, которая окончательно оценивается только во время операции, возможно выполнение интрафасциальной, интерфасциальной и экстрафасциальной диссекции предстательной железы (ПЖ) [6, 7]. Интрафасциальная техника мобилизации ПЖ гарантирует сохранение элементов СНП и восстановление потенции с большей вероятностью, чем интерфасциальная (90,9% и 66,7% соответственно через 9 месяцев после операции). В то же время при применении этого вида диссекции возрастает риск получения положительного края, достигая по данным литературы 7,55% при стадии заболевания Т2 [8].
Хорошая визуализация тканей, составляющих СНП, необходима и при выполнении реконструктивных меторазрабатываемых время в случае необходимости полного иссечения СНП. Авторами реконструктивных методик с использованием генитофеморального нерва показаны хорошие предварительные результаты [9-11]. Однако при использовании техники трансплантации нервных стволов также необходима хорошая визуализация последнего, что может затруднительным [12]. Учитывая эти данные, представляется актуальным разработка новых методик, направленных на повышение степени прецизионности выполнения нервосберегающих операций.
Для решения этой клинической задачи предложены различные методы интраоперационной идентификации СНП предстательной железы. Из внедренных в клиническую практику методик можно отметить интраоперационную стимуляцию кавернозного нерва с последующим мониторингом тумесценции. Методика предполагает использование оборудования CaverMap. Производится электрическая (ток 8-20 mA, длительность до 80 с) стимуляция тканей предположительно содержащих нервные волокна, затем измеряется степень изменения тумесценции [13-15].
Cуществуют методики интраоперационной лазерной стимуляции СНП с одномоментной оценкой степени тумесценции путем динамического измерения интракавернозного давления [16, 17].
При выполнении электрической и лазерной стимуляции СНП в массиве тканей без непосредственной визуализации кавернозных нервов необходимо одномоментное выполнение и оценка изменения внутрикавернозного давления. Недостатком электрической стимуляции является электрода с нервной тканью и возможность ее повреждения. Кроме того, исследование может быть лимитировано размером электрода и артефактами, возникающими при электрической стимуляции [18, 19].
Также используется ственная интраоперационная визуализация нервно-сосудистых применением увеличительной оптики, допплеровского УЗИ-наведения, окрашивания флюоресцентными маркерами, оптической когерентной томографии (ОКТ).
Также используется ственная интраоперационная визуализация нервно-сосудистых применением увеличительной оптики, допплеровского УЗИ-наведения, окрашивания флюоресцентными маркерами, оптической когерентной томографии (ОКТ).
Методики с использованием флюоресцентных маркеров применяются пока только в экспериментах на животных. В частности используются интракавернозные инъекции различных маркеров, после чего изучается отсроченное (в среднем от 9 до 14 дней после введения) накопление флюоресцентного маркера в аксонах кавернозных нервов [21].
К визуализирующим технологиям также относится способ визуализации элементов нервно-сосудистого пучка с помощью традиционной ОКТ [17, 22]. Работ по изучению свойств нервной ткани и практическому применению кросс-поляризационной ОКТ (КП ОКТ) для визуализации нервной ткани нет.
Целью нашего исследования явилась интраоперационная визуализация и дифференцировка элементов СНП предстательной железы методом КП ОКТ.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Нами был использован оптоволоконный оптический когерентный томограф «ОКТ1300-У», разработанный в ИПФ РАН (г. Нижний Новгород) и оснащенный торцевым эндоскопическим зоннаружный диаметр которого составляет 2,7 мм [23]. В «ОКТ1300-У» используется зондирующее излучение с длиной волны 1300 нм и мощностью 3 мВт. Каждое ОКТ изображение имеет следующие характеристики: 200x200 пикселей, размер 2x2 мм, разрешение по глубине 15 мкм в свободном пространстве, продольное разрешение 25 мкм. Изображение регистрируется в течение 2 секунд. Прибор имеет два канала и одновременно демонстрирует два сопряженных изображения: в прямой поляризации (нижнее из двух изображений) и в ортогональной поляризации (верхнее изображение) со строгим взаимным соответствием пространственного расположения элементов изображений. ОКТ-устройство оснащено торцевым многофункциональным эндоскопическим зондом диаметром 2,7 мм [24, 25].
Проведены предварительные исследования для определения возможности визуализации нервных структур с помощью КП ОКТ. С целью подтверждения существования поляризующих свойств у нервного волокна было выполнено нирование соматических нервных стволов.
Основное КП ОКТ-исследование нервно-сосудистых элементов пучка выполнено у 30 пациентов: 6 пациентам была выполнена радикальная цистэктомия и 24 пациентам – радикальная простатэктомия. Целью КП ОКТ-исследования явилась визуализация и дифференцировка элементов СНП с определением нервных стволов.
Интраоперационно всем пациентам выполнялось КП ОКТ-исследование тканей в проекции СНП до и после удаления комплекса ПЖ+семенные пузырьки. После операции во всех случаях выполнялось гистологическое исследование препаратов, полученных тем вырезки материала из комплекса ПЖ+семенные пузырьки из точек сканирования еx vivo и окраски их гематоксилин-эозином.
Техника радикальных простатэктомии и цистэктомии была классической. После рассечения латеральной фасции таза, выполнялось КП ОКТ-сканирование тканей в проекции СНП до получения четкого поперечного изображения кавернозных нервов. Далее производилось КП ОКТ–сканирование нескольких точек вдоль нерва. В зависимости от стадии процесса (клиническая патологическая стадия T, начальный уровень ПСА, степень дифференцировки биопсийного материала, количество «положительных» биопсийных столбиков у больных РПЖ) и интраоперационного состояния перипростатических тканей (наличия или отсутствия инфильтрации), нервные пучки сохраняли или удаляли.
С целью верификации интраоперационных данных во всех случаях выполнялось КП ОКТ-сканирование на препарате предстательной железы в проекции прохождения СНП (по задне-боковой поверхности ПЖ). Из точек сканирования выполнялся забор материала для гистологического исследования. Гистологичеконтролировалось отсутствие нервного волокна в точке сканирования. Далее выполнялось сравнение гистологических данных и данных, полученных при КП ОКТ–сканировании in vivo и ex vivo.
Чувствительность, специфичность, диагностическая ценность метода, прогностическая ценность положительного и отрицательного результата были рассчитаны стандартными статистическими методами с определением 95% доверительного интервала (ДИ) для доли по методу Вильсона. Материал обработан в программе Excel.
РЕЗУЛЬТАТЫ
При выполнении исследования было получено 582 ОКТ-изображения, в том числе интраоперационно – 225 изображений, на препаратах ex vivo – 357. У ряда пациентов СНП, с учетом полученных при сканировании данных, сохранялся, для чего выполнялось смещение тканей, содержащих кавернозный нерв латерально и кзади. При интраоперационном фильтративного процесса с одной или обеих сторон, главной задачей оставалась радикальность проведения операизмененные иссекались с СНП.
При выполнении сканирования соматического нерва (бедренно-генитальный нерв) были получены КП-ОКТ изображения округлых однородных гиперинтенсивных структур, расположенных в верхних слоях тканей и дающих сильный сигнал как в прямой, так и ортогональной поляризациях, что подтвердило наличие у нервного волокна поляризующих свойств (рис. 1, 2).
Было произведено КП ОКТ-сканирование различных типов тканей, составляющих СНП: нервной, жировой, сосудов артериального и венозного типов. Структурные элементы сосудисто-нервного пучка обладали различКП ОКТ-характеристиками. Сосудам (артерии и вене) на ОКТ изображениях соответствовали крупные округлые включения, видимые в обеих поляризациях с четкими стенками с гиперинтенсивным сигналом и гипоинтенсивной зоной в центре (просвет), интима и адвентиция сосудов давали сильный сигнал в прямой и ортогональной проекциях (рис 3, 4). У сосудов артериального типа в обеих поляризациях определялась толстая мышечная стенка (слой с гипоинтенсивным сигналом).Венозный сосуд выраженной мышечной стенки не имел. Было отмечено, что сосуды артериального типа подвергались компрессии датчиком в значительно меньшей степени, чем сосуды венозного типа.
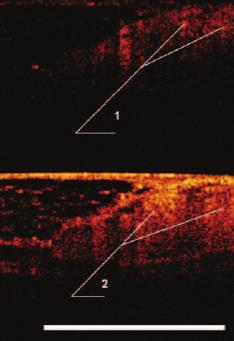
Рис. 1. КП ОКТ-изображение соматического нервного ствола в кроссполяризации (1) и при стандартной ОКТ (2). Бар 1 мм
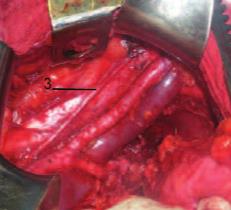
Рис. 2. Интраоперационная область КП ОКТ-сканирования: соматический (бедренно-генитальный) нерв (3).
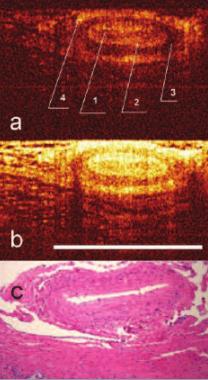
Рис. 3. Изображение сосуда артериального типа. КП ОКТ в кроссполяризации (а) и при стандартной ОКТ (b): 1) просвет сосуда 2) интима, 3) мышечный слой, 4) адвентиция. c) гистологический препарат х100 (кадр 1,25*0,94 мм) Окраска гематоксилин-эозин. Бары 1 мм
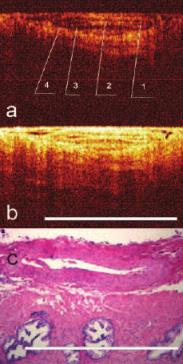
Рис. 4. Изображение сосуда венозного типа. а) КП ОКТ в кроссполяризации (a) и при стандартной ОКТ (b). 1) просвет сосуда 2) интима, 3) мышечный слой, 4) адвентиция. c) гистологический препарат х100 (кадр 1,25*0,94 мм) Окраска гематоксилин-эозин. Бары 1 мм.
Нервное волокно. При проведении КП ОКТ-сканирования нервное волокно могло располагаться относительно хода сканирующего луча либо вдоль, либо поперек. Поперечным срезам нервного ствола на КП ОКТ – изображениях соответствовали однородные гиперинтенсивные включения округлой формы, расположенные в верхних слоях изображений. Основными признаками нервного ствола считали расположение образования в верхних слоях сканируемых тканей, однородное гиперинтенсивное включение на изображении в стандартной поляризации, наличие сильного сигнала в ортогональной поляризации за счет деполяризующих свойств нервного волокна. Причем, при повороте датчика на 900 и, соответственно, изменении угла сканирования, нервные стволы визуализировались, как однородные гиперинтенсивные, продольно расположенные волокна (рис 5, 6).
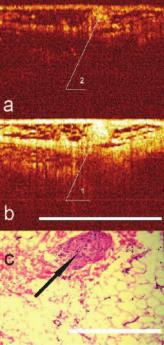
Рис. 5. Изображение кавернозного нерва (1,2) в поперечном сечении при КП ОКТ в кроссполяризации (a) и при стандартной ОКТ (b). Бар 1 мм
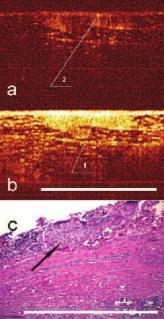
Рис. 6. Изображение кавернозного нерва (1,2) в косопоперечном сечении при КП ОКТ в кроссполяризации (a) и при стандартной ОКТ (b). Бар 1 мм. c) гистологический препарат (нерв указан стрелкой) х100 (кадр 1,25*0,94 мм) Окраска гематоксилин-эозин. Бар 1 мм
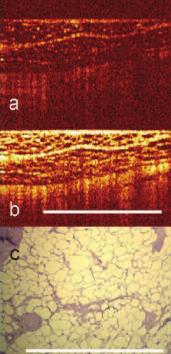
Рис. 7. Изображение жировой ткани при КП ОКТ в кроссполяризации (a) и при стандартной ОКТ (b). Бар 1 мм. c) гистологический препарат х100 (кадр 1,25* 0,94 мм) Окраска гематоксилин-эозин. Бар 1 мм.
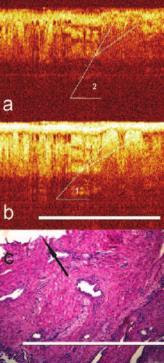
Рис. 8. Пример дифференциальной диагностики при КП ОКТ в кроссполяризации (a) и при стандартной ОКТ (b). 1) гиперэхогенное образование в ОКТ, напоминающее нервный стол, 2) отсутствие свечения в кроссполяризации. Бар 1 мм. c) гистологический препарат х100. Капсула предстательной железы (стрелка) с тканью ПЖ, отсутствие нервных волокон в точке сканирования (кадр 1,25*0,94 мм) Окраска гематоксилинэозин. Бар 1 мм
Жировая ткань в обеих поляризациях на КП ОКТ-изображениях была представлена характерной ячеистой структурой (рис. 7).
В наших исследованиях мы неоднократно получали КП ОКТ-изображения гиперинтенсивных, в том числе и округлых структур. Однако при отсутствии интенсивного сигнала в ортогональной поляризации округлое включение или продольное волокно, видимое на стандартном ОКТ – изображении, нервным стволом не являлось, что впоследствии подтверждалось данными гистологического исследования биоптата, взятого из места сканирования (рис. 8).
Таким образом, КП ОКТ позволяет проводить дифференциальную диагностику элементов СНП с другими соединительно-тканными структурами.
Нами были изучены чувствительность и специфичность ОКТ-визуализанервных стволов на основе сравнения данных, полученных при ОКТ-сканировании тканей, содержащих СНП, с данными гистологического исследования препаратов, полученных из аналогичных точек. При расчете этих показателей за истинно-положительный результат мы принимали наличие нервного ствола как на КП ОКТ скане ex vivo, так и в гистологическом препарате, за истинно-отрицательный результат – отсутствие нервного ствола как на КП ОКТ-скане ex vivo, так и в гистологическом препарате. Ложно-отрицательрезультатом мы считали отсутствие нервного ствола на КП ОКТ скане ex vivo при наличии нервного ствола в гистологическом препарате, ложно-положительным результатом – наличие нервного ствола на КП ОКТ скане ex vivo, отсутствие нервного ствола в гистологическом препарате. Полученные результаты представлены в табл. 1.
Таблица 1. Расчетные статистические показатели возможностей кросс-поляризационной оптической когерентной томографии
| Статистические параметры | КП ОКТ ex vivo | 95% ДИ |
|---|---|---|
| Чувствительность | 0,941 | 0.8090.984 |
| Специфичность | 0,885 | 0.7500.977 |
| Диагностическая ценность | 0,917 | 0.8190.964 |
| Прогностическая ценность положительного результата |
0,914 | 0.7760.970 |
| Прогностическая ценность отрицательного результата |
0,92 | 0.7500.978 |
Таким образом по результатам наисследования диагностическая ценность КП ОКТ составила 91,7%. Метод обладает высокой чувствительностью (94,1%) и специфичностью (88,5%), что позволяет использовать его в клинической практике.
ОБСУЖДЕНИЕ
Впервые метод стандартной ОКТвизуализации апробирован в эксперименте на крысах группой Fried MN. et al. [17] и во время лапароскопической простатэктомии Aron M. et al. [22]. Во время оперативных вмешательств выполнялось ОКТ–сканирование тканей на оптическом когерентном томографе – «Niris» (производства кампании «Imalux») в проекции нервно-сосудистого пучка с получением ОКТ-изображений в одной (прямой) поляризации. Однако отсутствие четких ОКТ критериев элементов, составляющих нервнососудистый пучок, затрудняло их визуализацию и дифференцировку. Недостатком стандартной ОКТ – визуализации, выполненной как моноисследование, является ее относительно низкая чувствительность для тканей, не имеющих послойного строения. Стандартные ОКТ-изображения могут выявлять структуры, которые лишь напоминают нервный ствол и не имеют при этом гиперинтенсивного сигнала в кросс-поляризации. При могут выглядеть также как соединительно-тканная капсула, элементы фасции и жировая ткань [26].
КП ОКТ является одним из вариантов развития ОКТ, однако дополнительно использует поляризационные характеристики рассеянного света. КП ОКТ помимо информации об обратном рассеянии тканью зондирующего излучения (изображение в основной поляризации) также демонстрирует его деполяризацию при рассеянии на локальных анизотропных микронеоднородностях в целом изотропной среды (которой является нервно-сосудистый пучок). Такое рассеяние приводит к появлению изображений в ортогональной поляризации. Получение и сравнение изображений рассеяния в исходной и ортогональной поляризациях являются основой КП ОКТ, которая позволяет получать детальную информацию о микроструктурных и биохимических изменениях деполяризующих компонентов ткани. Ранее применение КП ОКТ было описано для коллагена [27-29]. КП ОКТ является высокочувствительным (чувствительность 93,7%, специфичность 84%) методом ранней диагностики опухолевых и неспецифических воспалительных изменений уротелия при заболеваниях мочевого пузыря [30]. Одним из возможных применений кросс-поляризационной ОКТ является обнаружение и дифференциация продольно-организованных анатомических структур в массиве тканей, что не всегда возможно выполнить визуально, в частности, не инвазивное обнаружение нервных стволов в массиве соединительной и жировой ткани и дифференциация их от сосудов, фасций и других структур in vivo на основе поляризационных свойств. Кроме того, методика КП ОКТ-сканирования, являясь контактным методом обследования, абсолютно безопасна для интраоперационного применения и исключает ятрогенное повреждение нервной ткани.
Данные об анатомических особенностях строения сосудисто-нервного пучка, полученные современными исследователями [31,32], говорят о большой вариабельности строения нервных сплетений. Многие нервные волокна в силу своих малых размеров не могут быть идентифицированы визуально, в том числе и с применением оптического увеличения. Полученные при КП ОКТ данные позволяют судить об оптических свойствах структур, составляющих СНП. Особые поляризационные свойства нервных волокон, которые являются упорядоченными продольными структурами и дают характерное изображение в ортогональной поляризации, позволяют с высокой долей вероятности дифференцировать их от других структур СНП, визуально схожих с нервными волокнами.
ЗАКЛЮЧЕНИЕ
Согласно результатам проведенного исследования нами были изучены оптические свойства элементов СНП, оценена способность тканей, составляющих СНП, к поляризации светового пучка, что дало возможность визуализировать и дифференцировать их в масперипростатических тканей высокой чувствительностью (94,1%) и специфичностью (88,5%). Преимуществами предложенного способа мы считаем возможность атравматичного получения изображения элементов СНП в реальном времени in vivo, дифференцировка их, возможность применения методики как во время открытых, так и лапароскопических операций, что, возможно, позволит улучшить отдаленные функциональные результаты хирургического лечения больных раком предстательной железы и инвазивными формами рака мочевого пузыря.
ЛИТЕРАТУРА
1. EAU Guidelines 2013 edition. Guidelines on male sexual dysfunction: Erectile Dysfunction and Premature Ejaculation. p.6. 2. Walsh PC, Marschke P, Ricker В, Burnett AL. Patient – reported urinary continence and sexual function aer anatomical radical prostatectomy. // Urology. 2000. Vol.55. Р. 58-61.
3. Lepor H, Kaci L. The impact of open radical postprostatectomy on continence and lower urinary tract symptoms: a prospective assessment using validated self-administered outcome instruments. // J Urol. 2004. Vol.171. Р.1216-1219.
4. Ahmadi H, Skinner EC, Simma-Chiang V, Miranda G, Cai J, Penson DF, Daneshmand S. Urinary functional outcome following radical cystoprostatectomy and ileal neobladder reconstruction in male patients. // J Urol. 2013. Vol.189 №5. Р.1782-1788.
5. Frich PS, Kvestad CA, Angelsen A. Outcome and quality of life in patients operated on with radical cystectomy and three different urinary diversion techniques. // Scand J Urol Nephrol. 2009. Vol.43 № 1. Р. 37-41.
6. Walz J, Burnett AL, Costello AJ, Eastham JA, Graefen M, Guillonneau B, Menon M, Montorsi F, Myers RP, Rocco B, Villers A. A crical Analisis of the current knowledge of surgical anatomy related to optimization of cancer control and preservation of continence and erection in candidates for radical prostatectomy. // EuroUrology 2010. Vol. 57, № 2. Р.179-192.
7. Yossepowitch O, Bjartell A, Eastham JA, Graefen M, Guillonneau BD, Karakiewicz PI, Montironi R, Montorsi F. Positive Surgical Margins in Radical Prostatectomy: Outlining the Problem and Its Long-Term Consequences. //EuroUrology 2009. Vol. 55. Р.87-99.
8. Potdevin L, Ercolani M, Jeong J, Kim IYJ. Functional and oncologic outcomes comparing interfascial and intrafascial nerve sparing in robot-assisted laparoscopic radical prostatectomies. // Endourol. 2009. Vol. 23, №
9. Р.1479-1484. 9. Fujioka M, Tasaki I, Kitamura R, Yakabe A, Hayashi M, Matsuya F, Miyaguchi T, Tsuruta J. Cavernous nerve graft reconstruction using an autologous nerve guide to restore potency// BJU Intern. 2007. Vol.100. Р.1107–1109.
10. Kim ED, Scardino PT, Hampel O, Mills NL, Wheeler TM, Nath RK. Interposition of sural nerve restores function of cavernous nerves resected during radical prostatectomy. // J Urol. 1999. Vol. 161, № 1. Р. 188-192.
11. Sugimoto M, Tsunemori H, Kakehi Y. Health-related Quality of Life Evaluation in Patients Undergoing Cavernous Nerve Reconstruction During Radical Prostatectomy. // J J Clinic Oncol 2009. Vol. 39 № 10. Р. 671-676.
12. Turkof E, Wulkersdorfer B, Bukaty A. Reconstruction of cavernous nerves by nerve grafts to restore potency: contemporary review of technical principles and basic anatomy. // Current Opinion in Urology. 2006. Vol. 16 № 6. Р. 401-406.
13. Klotz L. Intraoperative cavernous nerve stimulation during nerve sparing radical prostatectomy: how and when? // Urology 2000. Vol. 10, № 3. Р. 239-243.
14. Klotz L, Heaton J, Jewett M. A randomized phase 3 study of intraoperative cavernosus nerve stimulation with penile tumescence monitoring to improve nerve sparing during radical prostatectomy. //J Urol. 2000. Vol. 164. № 5. Р. 1573-1578.
15. Gianduzzo TR, Colombo JR, El-Gabry E, Haber GP, Gill IS. Anatomical and electrophysiological assessment of the canine periprostatic neurovascular anatomy: perspectives as a nerve sparing radical prostatectomy model. // J Urol. 2008. Vol. 179 №5. Р.2025-2029.
16. Fried NM, Lagoda GA, Scott NJ, Burnett AL. Laser stimulation of the cavernous nerves in the rat prostate, in vivo: Optimization of wavelength, pulse energy, and pulse repetition rate. // Engineering in Medicine and Biology Society, 2008. EMBS 2008. 30th Annual International Conference of the IEEE Aug. 2008 Р. 2777 – 2780.
17. Fried NM, Rais-Bahrami S, Lagoda GA, Chuang Y, Burnett AL, Su LM. Identification and Imaging of the Nerves Responsible for Erectile Function in Rat Prostate, In Vivo, Using Optical Nerve Stimulation and Optical Coherence Tomography. // Lasers Surg Med. 2007. Vol.39, №1. Р.36-41.
18. Walsh PC, Marschke P, Catalona WJ, Lepor H, Martin S, Myers RP, Steiner MS. Efficacy of first-generation Cavermap to verify location and function of cavernous nerves during radical prostatectomy: a multi-institutional evaluation by experienced surgeons.//Urol. 2001. Vol. 57, № 3. Р. 491-494.
19. Han M. Ultrasound-Guided Navigation in Robot-Assisted Laparoscopic Radical Prostatectomy, Johns Hopkins University. Interventional Study. ClinicalTrials.gov identifier: NCT00956904 http://clinicaltrials.gov/ct2/show/study/NCT00956904.
20. Ukimura O, Gill IS, Desai MM, Steinberg AP, Kilciler M, Ng CS, Abreu SC, Spaliviero M, Ramani AP, Kaouk JH, Kawauchi A, Miki T. Real-time transrectal ultrasonograthy during laparoscopic radical prostatectomy. // JUrol. 2004. Vol. 172, №1. Р. 112-118.
21. Davila HH, Mamcarz M, Nadelhath I, Salup R, Lockhart J, Carrion RE. Visualization of the neurovascular bundles and major pelvic ganglion with fluorescent tracers after penile injection in the rat. // BJU Intern 2007. Vol. 101. № 8. Р. 1048 – 1051.
22. Aron M, Kaouk JH, Hegarty NJ, Colombo JR Jr, Haber GP, Chung BI, Zhou M, Gill IS. Preliminary experience with the Niris™ optical coherence tomography system during laparoscopic and robotic prostatectomy. // J Endourol. 2007. Vol. 21 № 8. Р. 114-118.
23. Gelikonov VM, Gelikonov GV. New approach to cross-polarized optical coherence tomography based on orthogonal arbitrarily polarized modes. // Laser Physics Letters. 2006. Vol.3, №9. Р. 445-451.
24. Гладкова Н.Д., Шахова Н.М., Снопова Л.Б., Геликонов Г.В., Фельдштейн Ф.И. Оптический когерентный томограф. Процедура исследования. Идентификация ОКТизображений. // В кн. Руководство по оптической когерентной томографии. [Под ред. Н.Д.Гладковой, Н.М.Шаховой, А.М.Сергеева]. М.: ФИЗМАТЛИТ, 2007. С.25-58.
25. Гладкова Н.Д. Оптическая когерентная томография в ряду методов медицинской визуализации: Курс лекций. Н.Новгород: ИПФ РАН, 2005. 324 с.
26. Rais-Bahrami S, Levinson AW, Fried NM, Lagoda GA, Hristov A, Chuang Y, Burnett AL, Su LM. Optical coherence tomography of cavernous nerves: a step toward real-time intraoperative imaging during nerve-sparing radical prostatectomy. // Urol. 2008. Vol. 72, №1. Р.198-204.
27. Schmitt JM, Xiang SH. Cross-polarized backscatter in optical coherence tomography of biological tissue. // Optics Letters. 1998. Vol.1, №23. Р.1060-1062.
28. Kuranov RV, Sapozhnikova VV, Shakhova NM, Gelikonov VM, Zagainova EV, Petrova SA. Combined application of optical methods to increase the information content of optical coherent tomography in diagnostics of neoplastic processes. // Quantum Electronics. 2002. Vol.32, №11. Р.993-998.
29. Kuranov R, Sapozhnikova V, Turchin I, Zagainova E, Gelikonov V, Kamensky V, Snopova L, Prodanetz N. Complementary use of cross-polarization and standard OCT for differential diagnosis of pathological tissues. // Optics Express. 2002. Vol.10, №1. Р.707-713.
30. Gladkova N, Streltsova O, Zagaynova E, Kiseleva E, Gelikonov V, Gelikonov G, Karabut M, Yunusova K, Evdokimova O. Cross-polarization optical coherence tomography for early bladder-cancer detection: statistical study. // J Biophotonics. 2011. Vol.4, №7-8. Р.519-32.
31. Walsh PC, Schlegel PN. Radical pelvic surgery with preservation of sexual function. // Annals of Surgery. 1988. Vol.208, № 4. Р. 391–400.
32. Eichelberg C, Erbersdobler A, Michl U, Schlomm T, Salomon G, Graefen M, Huland H. Nerve Distribution along the Prostatic Capsule. // Euro Urol. 2007. Vol. 51, № 1. Р. 105-110.







