Согласно рекомендациям Европейской Ассоциации Урологов α1-адреноблокаторы (α1-АБ) являются препаратами выбора (уровень доказательности – 1а, степень рекомендации – А) для лечения пациентов с симптомами нарушения функции нижних мочевых путей (СНМП), вызванных доброкачественной гиперплазией (ДГПЖ) [1].
Многие непрямые сравнения между плацебо-контролируемыми исследованиями, так же, как и не столь многочисленные прямые сравнительные исследования, продемонстрировали одинаковую селективность α1-АБ при использовании адекватных дозировок [2, 3]. С другой стороны, различные α1-АБ отличаются по переносимости [4, 5]. Селективные α1-АБ (тамсулозин, силодозин, альфузозин) пациенты переносят намного лучше, чем другие α1АБ без выраженной подтиповой селективности, такие как доксазозин и теразозин. Это особенно важно в отношении нежелательных явлений со стороны сердечно-сосудистой системы [4, 6].
Тамсулозин обладает умеренной селективностью (примерно в 10-15 раз выше) в отношении alA по сравнению с αlB адренорецепторами (АР) и промежуточным сродством к αlD-АР [7]. Shibata K. и соавт. (1995 г.), Tatemichi S и соавт. (2006 г.) показали высокую селективность нового α1-АБ силодозина к αlA-АР. Силодозин не только имеет значительно более высокую селективность в отношении αlA-АР по сравнению с αlB-АР (> 100 раз), но обладает селективностью и в отношении αlA по сравнению с αlD-АР (примерно в 50 раз) [8-11]. Селективность силодозина выше селективности тамсулозина примерно в 16 раз [11]. Следует отметить, что α1A-АР располагаются преимущественно в простатической части уретры и играют главную роль в обеспечении сокращения предстательной железы [12, 13], в то время как α1Bи α1D-АР располагаются в кровеносных сосудах и вызывают их дилатацию [14]. Исходя из этих данных, можно предположить, что высокая селективность силодозина в отношении рецепторов подтипа α1A должна приводить к лучшей переносимости со стороны сердечно-сосудистой системы без потери эффективности в отношении симптомов нарушения функции мочевого тракта по сравнению с менее селективными α1-АБ.
Для оценки клинической эффективности и безопасности силодозина у больных с СНМП, обусловленных ДГПЖ, были проведены три больших двойных слепых рандомизированных клинических исследования III фазы с режимом дозирования силодозина 8 мг 1 раз в сутки [15, 16]. Два исследования были проведены в США (рандомизировано 923 пациента), а одно – в Европе (рандомизировано 955 пациентов). В отличие от американских исследований, которое включало группу силодозина и плацебо, дизайн европейского исследования включал три группы пациентов: группу силодозина, группу тамсулозина (тамсулозин 0,4 мг 1 раз в день) и группу плацебо. Пациенты были рандомизированы в группы плацебо и активного 12-недельного лечения после 4-недельного вводного периода приема плацебо (так называемого периода "отмывания"). осуществляли в отношении 1:1 в США и 2:2:1 (1 – в группу плацебо) в европейском исследовании.
Критерии включения во всех этих исследованиях были одинаковыми: IPSS ≥ 13 баллов, максимальная скорость потока мочи (Qmax) 4-15 мл/с при минимальном объеме мочеиспускания ≥ 125 мл. Основным критерием, по которому определяли эффективность силодозина в исследованиях, было изменение общего балла шкалы IPSS на фоне лечения. Также оценивали изменения по отдельным показателям шкалы IPSS и динамике Qmax.
В американских исследованиях в группе силодозина было отмечено достоверное уменьшение общего балла IPSS при сравнении с плацебо – 2,8 (95% ДИ; −3.6, −2.0) (p< 0,0001). Подобные изменения отмечены и в европейском исследовании: силодозин против плацебо -2,2 (95% ДИ; –3.2,-1.3) (p< 0,001), тамсулозин против плацебо -1,9 (95% ДИ; -2.8, -0.9) (p< 0,001).
При анализе динамики симптомов накопления и опорожнения отмечена тенденция большей эффективности в отношении симптомов опорожнения. Улучшение по сравнению с плацебо по подшкале IPSS симптомов опорожнения в американских исследованиях достигло – 1,9 (95% ДИ; −2.4, −1.4) (p< 0,0001), а в европейском исследовании –1,7 баллов (95% ДИ; –2,2; –1,1) (p< 0,001). Улучшение по подшкале IPSS симптомов накопления по сравнению с плацебо в американских исследованиях составило – 1.0 (95% ДИ; −1.3, −0.6) (p < 0,0001), а в европейском исследовании – 0,7 баллов (95% ДИ; –1,1; – 0,2) (p=0,002). В европейском исследовании силодозин оказался несколько эффективнее тамсулозина только в снижении общего значения IPSS (-7,0 против -6,7), но и по подшкалам накопления (–0,7 против –0,6) и опорожнения (–1,7 против –1,4).
Во всех исследованиях было показано, что изменение Qmax наступает в пределах 2–6 часов после приема первой дозы силодозина. При этом, изменение общего показателя IPSS, по сравнению с исходным, отмечено через 3–4 дня после начала лечения. К моменту завершения американских исследований группе пациентов, получавших силодозин, статистически достоверно увеличилась на 2,6 мл/с (p< 0,0007 против плацебо). В отличие от американских исследований, в европейском исследовании во всех группах изменения Qmax были статистически недостоверны: в группе силодозина Qmax увеличилась на 3.77 мл/с (p=0.089 против плацебо), в группе тамсулозина – на 3.53 мл/с (p = 0.221 против плацебо), в группе плацебо – на 2,93 мл/с.
Среди нежелательных явлений на лечения силодозином наиболее часто наблюдали нарушения эякуляции (21,5% против 0,8% в группе плацебо) и головокружение (1,8% против 0,8% в группе плацебо). Другие нежелательные явления, которые отмечали хотя бы у 1% пациентов, включали ортостатическую гипотензию, заложенность носа, головную боль (все по 1,3%) и диарею (1,0%).
На основании полученных результатов этих трех исследований авторы сделали вывод о высокой эффективности и безопасности силодозина (8 мг в 1 раз в день) при лечении СНМП, обусловленных ДГПЖ.
Целью нашего клинического наблюдения была оценка эффективности силодозина у пациентов с выраженными симптомами нарушения функции нижних мочевых путей, обусловленных ДГПЖ.
МАТЕРИАЛЫ И МЕТОДЫ
В клиническое наблюдение было включено 30 больных в возрасте от 47 до 75 лет с СНМП, вызванных ДГПЖ, которые в течение 60 дней принимали силодозин в дозе 8 мг 1 раз в день, одновременно с приемом пищи. В наблюдение включали амбулаторных и стационарных пациентов, давших письменное согласие и соблюдающих указания врача, относительно назначенной терапии. Выраженность СНМП по шкале IPSS должна была быть более 7 баллов, Qmax более 5 и менее 15 мл/с, объем остаточной мочи – не более 200 мл, а объем предстательной железы – более 25 см3, при уровне ПСА не превышающем 4 нг/мл.
Наблюдение включало 3 визита: V0 – скрининг; V1 – через 5 дней после начала лечения и V2 – через 60 дней после начала лечения. На каждом визите пациенты заполняли анкеты IPSS и QоL, им выполняли урофлоуметрию с определением объема остаточной мочи. Эффективность лечения оценивали по изменению баллов шкал IPSS и QоL, динамике Qmax и объема остаточной мочи.
Полученные результаты обрабатывали с помощью статистической программы «STATISTICA for Windows», версии 6,0 (StatSoft Inc., США).
Таблица 1. Количество пациентов с выраженными СНМП и нарушениями мочеиспускания
| Параметр мочеиспускания |
Количество пациентов (%) |
|---|---|
| IPSS > 18 | 60% (n=18) |
| QоL > 4 | 63% (n=19) |
| Qmax < 10 мл/сек | 40% (n=12) |
| Vres > 100 мл | 23% (n=7) |
Таблица 2. Динамика СНМП и основных параметров мочеиспускания на фоне приема силодозина (n=30; M±m)
| V0 | V1 | V2 | |
|---|---|---|---|
| IPSS | 19,7±0,81 | 16,8±1,05 p<0,001 |
15,6±1,50 p1<0,01 p2=0,31 |
| QоL | 4,13±0,24 | 3,90±0,23 p=0,07 |
3,63±0,25 p1<0,001 p2<0,05 |
| Qmax (мл/с) | 10,8±0,52 | 13,7±0,99 p<0,001 |
16,4±1,42 p1<0,001 p2<0,01 |
| Qave (мл/с) | 6,07±0,28 | 8,87±1,68 p=0,12 |
8,50±0,67 p1<0,001 p2=0,84 |
| Vcomp (мл) | 298±11,1 | 297±9,51 p=0,96 |
326±11,8 p1<0,05 p2<0,05 |
| Vres (мл) | 60,9±9,48 | 45,7±7,25 p<0,03 |
32,6±6,90 p1<0,001 p2<0,01 |
p-сравнение V0-V1; p1-сравнение V0-V2; p2-сравнение V1-V2
РЕЗУЛЬТАТЫ
У большинства пациентов, включенных в наблюдение, до начала лечения были зарегистрированы выраженные СНМП и объективные параметры нарушенного мочеиспускания (табл. 1). Средний показатель составил 19,7±0,81 баллов, 4,13±0,24 балла, a Qmax 10,8±0,52 мл/с. То есть, группу пациентов включенных в наблюдение, в целом, можно рассматривать, как группу с выраженными СНМП и нарушениями мочеиспускания.
Известно, что больные с выраженными СНМП хуже поддаются консервативному лечению α1-АБ [1]. Тем не менее, уже через 5 дней после начала терапии силодозином выявлено достоверное (p< 0,001) улучшение симптомов на 2,9 балла, достигшее 4,1 балла к 60 дню и Qmax – на 2,9 мл/с (p< 0,001) и 5,6 мл/с (p< 0,001) соответственно. При этом, показатель качества жизни достоверно (p< 0,01) улучшился к концу исследования. Одновременно зарегистрирован статистически достоверный рост средней скорости мочеиспускания (Qave), объема мочеиспускания (Vcomp) и уменьшение среднего объема остаточной мочи (Vres). Динамика всех указанных параметров наглядно представлена в табл. 2. Характерно, что «клинически значимые» изменения по показателям IPSS (уменьшение СНМП > 30% от исходного уровня) и Qmax (увеличение > 25% от исходного уровня) на этапе завершения исследования были зарегистрированы у 53,3% и 73,3% больных, соответственно. Одновременное «клинически значимое» улучшение по двум этим параметрам наблюдали примерно у половины пациентов (46,6%, n=14).
Дополнительно нами был проведен анализ динамики изменения количества пациентов с выраженными СНМП в ближайший и 2-х месячный сроки от начала лечения силодозином (табл. 3).
Динамика изменений по шкалам IPSS, QоL и основных уродинамических показателей различалась у больных с выраженными и умеренными симптомами (табл. 4). Так, для IPPS и Qmax разница между исходными и итоговыми значениями у пациентов с выраженными и умеренными нарушениями составила -19,5% против -42,9% и +35,9% против +58,6% соответственно (p< 0,05). В меньшей степени наблюдали разницу показателей качества жизни и объема остаточной мочи.
ОБСУЖДЕНИЕ
Полученные в нашей работе результаты согласуются с ранее опубликованными американскими и европейским исследованиями. Интересно отметить, что в упомянутых работах, в отличие от многих других исследований α1-АБ, наблюпациентов с выраженными симптомами и значительно нарушенным мочеиспусканием. Так, среднее исходное значение IPSS в Европейском исследовании составило 19,1±4,2 балла [15], в американских исследованиях (объединенные данные) – 21,3±5,1 балла [16], а в клиническом наблюдении НИИ урологии – 19,7±0,81 балла. При этом исходная величина Qmax была равна 10,7±2,72 мл/с; 8,7±2,6 мл/с и 10,8±0,52 мл/с, соответственно [15, 16].
Достигнутые в ходе лечения изменения по общему баллу IPSS и в американских и в европейском исследованиях были статистически достоверными при сравнении полученных данных с исходными значениями и группой плацебо (p< 0,05). В нашем же наблюдении продемонстрировано наличие достоверной разницы (p< 0,01) между конечным баллом IPSS (через 60 дней) и показателем IPSS на скрининге (рис. 1). Различия уровней IPSS до и после лечения составили: – 7 баллов или 36,6% (p< 0,001) в Европейском исследовании; – 6,4 или 30,1% (p< 0,0001) по данным объединенных американских исследований и – 4,1 балла или 20,8% в работе НИИ урологии.
Таблица 3. Количество пациентов с выраженными СНМП и параметрами нарушенного мочеиспускания на фоне лечения силодозином (%)
| V0 | V1 | V2 | |
|---|---|---|---|
| IPSS 18-35 | 60 | 50 | 33 |
| QоL 4-6 | 63 | 60 | 50 |
| Qmax < 10 мл/с | 40 | 27 | 23 |
| Vres > 100 мл | 23 | 10 | 7 |
Таблица 4. Динамика IPSS, QоL, Qmax и Vres у пациентов с выраженными СНМП и нарушениями мочеиспускания
| n | V0 | V1 | V2 | Динамика V0-V2 (%) |
|
|---|---|---|---|---|---|
| IPSS 18-35 | 18 | 22.6 | 20.3 | 18.2 | 19,5 |
| IPSS <18 | 12 | 15.4 | 11.6 | 8.8 | 42,9 |
| QоL 4-6 | 19 | 5 | 4.6 | 4.4 | 12,0 |
| QоL <4 | 11 | 2.6 | 2.7 | 2.4 | 7,7 |
| Qmax < 10 мл/с | 12 | 7.8 | 9.5 | 10.6 | + 35,9 |
| Qmax >10 мл/с | 18 | 12.8 | 16.4 | 20.3 | + 58,6 |
| Vres ≥ 100 мл | 7 | 135.6 | 87.3 | 73.3 | 45,9 |
| Vres <100 мл | 23 | 38.1 | 33 | 20.3 | 46,7 |
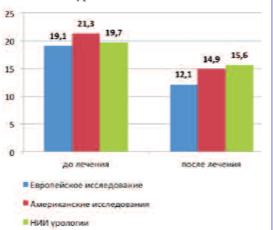
Рис. 1. Сравнительные результаты динамики IPSS в исследованиях силодозина
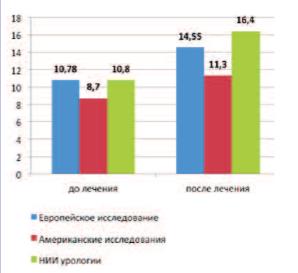
Рис. 2. Сравнительные результаты динамики Qmax в исследованиях силодозина
На фоне терапии силодозином показатель Qmax также показал положительную динамику. Во всех исследованиях отмечена общая тенденция увеличения максимальной скорости потока мочи, однако статистически достоверными являются только изменения Qmax в американских исследованиях при сравнении с плацебо (p< 0,0007). В нашем наблюдении мы показали наличие достоверной разницы (p< 0,01) между конечным показателем Qmax (через 60 дней) и Qmax на скрининге. Различия уровней Qmax до и после лечения составили: +3,77 мл/с или 35,0% (p=0,89 против плацебо) в Европейском исследовании; +2,6 мл/с или 29,9% (p< 0,0007 против плацебо) в американских исследованиях и +5,6 мл/с или 51,8% в работе НИИ урологии (рис. 2). Существенное увеличение Qmax в нашем наблюдении по сравнению с зарубежными исследованиями можно объяснить более высоким исходным значением максимальной скорости потока мочи у наших пациентов и большей однородностью группы по данному показателю.
Следует отметить, что хотя наше наблюдение и не является плацебоконтролируемым, полученные результаты по основным клиническим параметрам статистически достоверны, демонстрируют высокую эффективность изучаемого препарата при лечении пациентов с СНМП, обусловленных ДГПЖ и сопоставимы с данными других широкомасштабных исследований по силодозину.
ВЫВОДЫ
На основании клинического наблюдения пациентов с выраженными СНМП и нарушениями мочеиспускания, нами сделаны следующие выводы:
- силодозин достоверно улучшает основные клинические симптомы и параметры мочеиспускания (IPSS, QoL, Qmax, Qave, Vcomp, Vres);
- силодозин демонстрирует быстрый терапевтический эффект, статистически достоверное улучшение через 5 дней лечения зарегистрировано по параметрам IPSS, Qmax и Vres;
- клинически значимое улучшение к 60 дню отмечено у 53,3% по показателю IPSS и у 73,3% – по Qmax; – у больных в подгруппах с умеренной выраженностью СНМП эффективность применения силодозина выше;
- при IPSS < 18 баллов и Qmax > 10 мл/с можно рассчитывать на более выраженный клинический эффект при лечении силодозином.
ЛИТЕРАТУРА
1. Matthias Oelke, Alexander Bachmann, Aurelien Descazeaud et al. EAU Guidelines on the Treatment and Follow-up of Non-neurogenic Male Lower Urinary Tract Symptoms Including Benign Prostatic Obstruction. EUROPEAN UROLOGY 64 (2013) 118–140.
2. Milani S., Djavan B. Lower urinary tract symptoms suggestive of benign prostatic hyper-plasia: latest updated on a1-adrenoceptor antagonists // BJU Int. 2005. Vol. 95, Suppl 4. P. 29-36.
3. Суриков В.Н. Сравнительная оценка эффективности и безопасности применения α1-адреноблокаторов у больных доброкачественной гиперплазией предстательной же-лезы. Дисс. к.м.н., Москва, 2004, с.1-34.
4. Суриков В.Н., Ивлева А.Я., Максименко О.К., Сивков А.В. Сравнительная оценка безопасности различных α1-адреноблокаторов у больных доброкачественной гиперплазией предстательной железы. Клиническая фармакология и терапия, 2003, том 12, № 4, стр. 32-35.
5. Van Dijk M.M., de la Rosette JJMCH, Michel M.C. Tamsulosin – modifi ed-release and oral-controlled absorption system formulation in the treatment of benign prostatic hyperplasia // Therapy. 2006. Vol. 3. P. 237-246.
6. Nickel J.C., Sander S., Moon T.D. A-meta-analysis of the vascular-related safety profile and efficacy of a-adrenergic blockers for symptoms related to benign prostatic hyperplasia // Int J Clin Pract. 2008. Vol. 62. P. 1547-1559.
7. Michel M.C., Kenny B.A., Schwinn D.A. Classification of a1-adrenoceptor subtypes // Naunyn-Schmiedeberg's Arch Pharmacol. 1995. Vol. 352. P. 1-10.
8. Shibata K., Foglar R., Horie K., Obika K., Sakamoto A., Ogawa S., Tsujimoto G. KMD3213, a novel, potent, a1A-adrenoceptor-selective antagonist: characterization using recombinant human a1-adrenoceptors and native tissues // Mol Pharmacol. 1995. Vol. 48, № 2. P. 250-258.
9. Murata S., Taniguchi T., Muramatsu I. Pharmacological analysis of the novel, selective a1-adrenoceptor antagonist, KMD-3213, and its suitability as a tritiated radioligand // Br J Pharma-col.1999. Vol. 127. P. 19-26.
10. Piao H., Taniguchi T., Nakamura S. et al. Cloning of rabbit a1badrenoceptor and phar-macological comparison of a1A, a1Band a1Dadrenoceptors in the rabbit //Eur J Pharmacol. 2000. Vol. 396. P. 9-17.
11. Tatemichi S., Kobayashi K., Maezawa A., Kobayashi M., Yamazaki Y, Shibata N. a1-Adrenoceptor subtype selectivity and organ specifi city of silodosin (KMD-3213) // Yakugaku Zasshi. 2006. Vol. 126. P. 209-216.
12. Michel MC, Vrydag W. Alpha1, alpha2and beta-adrenoceptors in the urinary bladder, urethra and prostate. Br J Pharmacol 2006; 147: S88–119.
13. Roehrborn CG. Efficacy of a-adrenergic receptor blockers in the treatment of male lower urinary tract symptoms. Rev Urol 2009; 11(Suppl 1): S1–8.
14. Guimaraes S, Moura D. Vascular adrenoceptors: an update. Pharmacol Rev 2001; 53: 319–56.
15. Marks LS, Gittelman MC, Hill LA, Volinn W, Hoel G. Rapid efficacy of the highly selective alpha1A-adrenoceptor antagonist silodosin in men with signs and symp-toms of benign prostatic hyperplasia: pooled results of 2 phase 3 studies. J Urol. 2013 Jan;189(1 Suppl): S122-8
16. Christopher R. Chapple, Francesco Montorsi, Teuvo L.J. Tammela, Manfred Wirth, Evert Koldewijn, Eldiberto Fernaґndez Fernaґndez. Silodosin Therapy for Lower Urinary Tract Symptoms in Men with Suspected Benign Prostatic Hyperplasia: Results of an International, Randomized, Double-Blind, Placeboand Active-Controlled Clinical Trial Performed in Europe. EROPEAN UROLOGY 59 (2011) 342-352.







