Злокачественные новообразования почки (ЗНП) в 2013 году составили 3,9% всех злокачественных новообразований населения РФ, занимая 10 ранговое место в структуре онкологической заболеваемости обоих полов. Абсолютное число больных с впервые в жизни установленным диагнозом ЗНП в РФ в 2013 году составило 11 442 человек. Прирост заболеваемости за 10 лет был равен 41%, стандартизированный показатель заболеваемости – 9,39 на 100 000 человек [1, 2].
Рак врожденной единственной почки встречается крайне редко. Частота аплазии почки по данным аутопсий составляет 1 на 1100. Ультразвуковое скрининговое исследование 280 000 детей школьного возраста выявило подобную частоту встречаемости 1 на 1200 (0,083%) [3, 4].
Стандартом хирургического лечения рака почки долгое время считалась радикальная нефрэктомия (РНЭ). Однако у больных, перенесших РНЭ, в большем проценте случаев, по сравнению с резекцией почки, развивается хроническая почечная недостаточность (ХПН), повышается риск развития сердечнососудистых заболеваний (ССЗ) и смерти [5-7].
Анализируя результаты лечения более 1 миллиона пациентов в США, A.S. Go и соавт. установили, что значительное снижение функции почек ассоциируется с увеличением заболеваемости ССЗ и смертности от них, а также с повышением частоты госпитализаций по разным причинам [8]. Исторически считалось, что, поскольку большинство доноров почки на протяжении длительного времени после удаления органа чувствуют себя хорошо, то нефрэктомия у пациентов опасности также не представляет. Современные взгляды это представление более не разделяют. Данные, полученные P. Koenig, показывают, что у больных почечно-клеточным раком (ПКР) вероятность развития ХПН больше, чем у здоровых доноров [9]. Кроме того, J. McKiernan продемонстрировал развитие ХПН у трети больных ПКР еще до лечения [10]. Несмотря на значительные успехи в заместительной терапии почечной недостаточности (ЗТПН) с использованием таких методов как диализ или трансплантация, ЗТПН остается значимой причиной появления других заболеваний и смертности от них. У пациентов, находящихся на длительном гемодиализе, смертность от ССЗ в 10-30 раз выше, чем в общей популяции [11]. При анализе смертности от инфаркта миокарда R.N. Foley и соавт. отметили, что общая выживаемость пациентов на диализе значительно меньше, чем у пациентов без ХПН или даже при наличии сопутствующих болезней [12]. Согласно базе данных США по заболеваниям почек (USRDS) смертность у больных на диализе составляет 22% в первые два года после начала его применения и 15% во время последующих трех лет. M. Rocco и соавт. показали, что в стационарном лечении нуждаются более 50% больных, находящихся на хроническом диализе. Несмотря на стационарное лечение около 20% больных погибают [13]. При этом необходимо отметить высокую стоимость диализа: только в США выделяется около 70000$ в год на одного пациента [14].
Трансплантация почки является жизненно важной для некоторых пациентов, но и она сопряжена с рисками. Согласно современным рекомендациям трансплантацию почки в случае ПКР можно проводить через 2 года безрецидивного периода [15]. Это вынуждает пациентов ждать, получая диализ не менее двух лет. Кроме того, недостаточное количество аллогенных трансплантантов может привести к увеличению периода ожидания трансплантации и сроков проведения гемодиализа. При этом, несмотря на очевидные достижения в трансплантации, от 20 до 33% трансплантатов функционируют не более 5 лет [11, 16]. Согласно результатам некоторых исследований 5-летняя выживаемость после трансплантации составляет только 75% [13, 16]. Поскольку в этих исследованиях эффективность диализа и трансплантации изучалась в группе пациентов с множеством сопутствующих заболеваний, результаты ЗТПН в группе пациентов с ПКР без серьезной сопутствующей патологии могут отличаться. Тем не менее, осложнения длительной заместительной терапии являются очевидными.
Следует обсудить отдельную, сложную группу больных с опухолями единственной почки больших размеров, являющихся потенциально резектабельными. Для таких пациентов выполнение резекции почки является единственно возможным методом сохранения почечной функции и возможность избежать перевода в ренопривное состояние. Зачастую таким больным отказывают в выполнении оперативных вмешательств. Однако выявление опухоли единственной или единственно функционирующей почки не должно быть причиной отказа от оперативного лечения, так как только активная хирургическая тактика у этой категории больных позволяет добиться продления их жизни, а в ряде случаев – излечения. Выполнение таким пациентам экстракорпоральной резекции почки (ЭКРП) с последующей ее аутотрансплантацией является наиболее перспективным, а порой и единственно возможным методом лечения.
Представляем клиническое наблюдение органосохраняющего оперативного лечения ex vivo почечно-клеточного рака врожденной единственной почки с интралюминальной инвазией (подпеченочная форма).
Больной К., 38 лет, госпитализирован в урологическую клинику Института хирургии им. А.В. Вишневского с жалобами на постоянный вечерний субфебрилитет. Обследовал-ся по месту жительства по поводу лихорадки неясного генеза в течение трех месяцев. При ультразвуковом исследовании (УЗИ) впервые в жизни была выявлена аномалия развития мочевыводящей системы: единственная правая почка. По данным мультиспиральной компьютерной томографии (МСКТ), магнитно-резонансной томографии (МРТ), УЗИ диагностировано объемное образование единственной правой почки, размерами 65х70х68 мм, активно накапливающее контрастный препарат в артериальную фазу до 97 ед. Н. У больного выявлена интралюминальная опухолевая инвазия в нижнюю полую вену (НПВ): в ее просвете, начиная от уровня устья почечной вены, определяются тромботические массы с четкими контурами, протяженностью до 50 мм, распространяющиеся антеградно, занимающие большую часть просвета вены. Окрашиваемый просвет вены определялся диаметром 4,0 – 6,0 мм. Верхушка тромба лоцировалась в 10 мм от устьев печеночных вен. По данным МСКТ грудной клетки выявлены мелкие метастазы в обоих легких, числом 8, размерами от 2 мм (самый крупный 15 мм). Других отдаленных метастазов не выявлено (рис. 1, 2). Установлен диагноз: Аномалия развития мочевыводящей системы (АРМС). Рак единственной правой почки IV ст., сТ3вNхМ1[PUL]. Опухолевый тромб (подпеченочная форма).
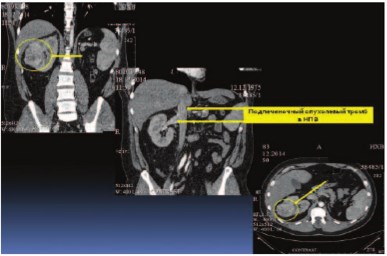
Рис. 1. Мультиспиральная компьютерная томография (МСКТ) почек. Стрелками указана локализация опухоли и опухолевого тромба в нижней полой вене.
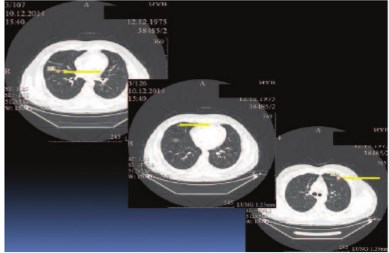
Рис. 2. Мультиспиральная компьютерная томография (МСКТ) органов грудной клетки. Стрелками указаны легочные метастатические очаги.
В случае реализации паллиативного оперативного пособия больной будет отнесен к группе хорошего прогноза по MSKCC (Memorial Sloan Kettering Cancer Center) с последующей таргетной терапией. Учитывая немногочисленность и размер легочных метастазов, удовлетворительное соматическое состояние больного было решено выполнить резекцию единственной правой почки ex vivo с тромбэктомией по разработанной в Институте хирургии собственной методике экстракорпоральной резекции (рис. 3, 4).
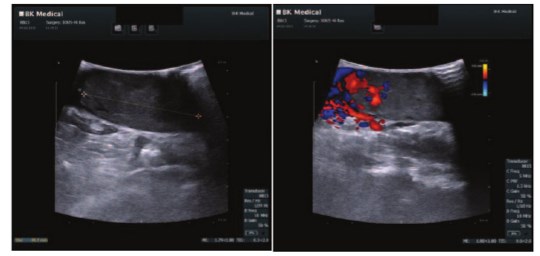
Рис. 3. Интраоперационная допплерография нижней полой вены с опухолевым тромбом
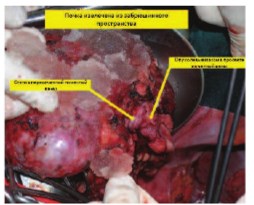
Рис.4. Почка ex vivo. Стрелками изображена почечная вена с опухолевыми тромботическими массами.
04.02.15г. пациенту выполнено оперативное вмешательство: резекция единственной правой почки ex vivo в условиях фармако-холодовой ишемии раствором Кустодиол без пересечения мочеточника с одномоментной тромбэктомией из НПВ, резекцией НПВ с ортотопической реплантацией почечных сосудов, аорто-кавальной лимфаденэктомией и установкой внутреннего стента.
Интраоперационно: имеется одна почечная артерия до 6 мм в диаметре, одна почечная вена диаметром до 25 мм. При интраоперационном допплерографическом исследовании подтверждены данные МСКТ.
Верхушка опухолевого тромба находилась в 10 мм от устьев печеночных вен. Пересечена почечная артерия в области устья. Наложены сосудистые зажимы на стенку НПВ ниже устьев печеночных вен в инфраренальном отделе. Выполнена венотомия НПВ по линии устья с выкройкой «капюшона» из стенки НПВ в дистальном направлении. Опухолевый тромб выведен в рану. На образовавшийся дефект в НПВ наложены сосудистые зажимы. Сняты сосудистые зажимы с сосудистой изоляции НПВ. Почка сразу же извлечена из забрюшинного пространства в лоток с ледяной крошкой для налаживания перфузии охлажденным раствором Кустодиола через почечную артерию. Восстановлена целостность НПВ. Завершена перфузия 700 м раствора Кустодиола. Выполнена резекция опухоли почки в пределах здоровых тканей с отступом 2 мм от края резекции. Со стороны пересеченной почечной вены извлечен опухолевый тромб до уровня сегментарных вен. В дне резекции паренхимы почки визуализируется две пересеченные сегментарные вены до 3х3 мм с опухолевыми массами. Интрапаренхиматозная часть измененных сегментарных вен иссечена остро и отправлена на морфологическое исследование. Зияющие сосуды, дефекты в собирательной системе дна резекции почки ушиты (рис. 5-7). Полость ЧЛС дренирована стентом 7 Ch. Пересеченная нижнесегментарная почечная артерия восстановлена непрерывном микро-сосудистым проленовым швом 8\0. Паренхима почки ушиты узловыми викриловыми швами 1\0. Произведено формирование аорто-артериального (на 2 см дистальнее истинного устья почечной артерии и почечной вены), каваренального сосудистого анастомозов (пролен 5\0). После пуска кровотока перфузия почки по данным допплерографии удовлетворительная (рис. 8, 9). Гемостаз надежный. Время тепловой ишемии составило 4 минуты. Время фармако-холодовой ишемии составило 2 часа 23 минуты. На всем протяжении оперативного пособия проводилась холодовая ишемия органа ледяной крошкой с термометрией (6 литров замороженного физиологического раствора). Продолжительность операции была 8 ч 35 мин. Кровопотеря составила 700 мл (рис. 10).
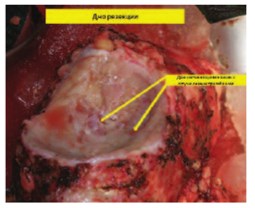
Рис. 5. Почка ex vivo после резекции. Стрелками указаны сегментарные почечные вены с интралюминальными опухолевыми массами
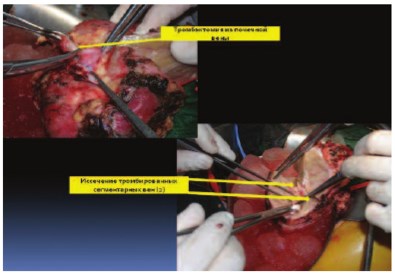
Рис. 6. Почка ex vivo после резекции. Стрелками показана тромбэктомия из почечной вены и резекция сегментарных вен
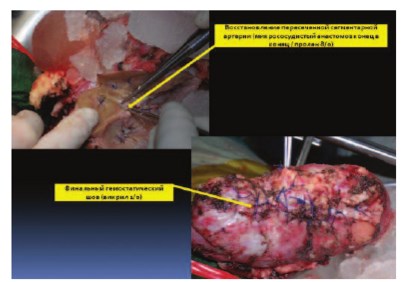
Рис. 7. Почка ex vivo после резекции. Стрелками указан микросоудистый анастомоз пересеченной сегментарной вены и финальный гемостатичекий шов
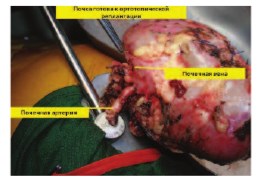
Рис. 8. Почка после восстановительного этапа резекции готова для перемещения в ортотопическую позицию
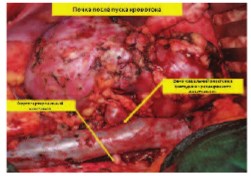
Рис. 9. Почка после пуска кровотока (удовлетворительная перфузия). Стрелками указаны зоны артерио-аортального и вено-венозного анастомозов почечных сосудов
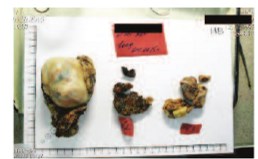
Рис. 10. Макроскопические препараты после резекции почки и регионарной лимфаденэктомии
В первые сутки после операции у больного отмечалось незначительное повышение уровня креатинина крови до 177 ммоль/л и снижение уровня гемоглобина до 93 г/л, незначительный метаболический ацидоз. Наблюдалась транзиторная анурия. В таблице 1 приведена динамика уровня креатинина, мочевины и скорость клубочковой фильтрации (СКФ).
Таблица 1. Динамика уровня сывороточного креатина, мочевины, скорость клубочковой фильтрации (СКФ)
| Дата | 03.02. | 04.02. | 05.02. | 06.02. | 07.02. | 08.02. | 09.02. | 10.02. | 13.02. |
|---|---|---|---|---|---|---|---|---|---|
| Креатинин, мкМоль/л | 112 | 177 | 291 | 386 | |||||
| Мочевина, мМоль/л | 3,54 | 5,9 | 8, 6 | 11,6 | |||||
| СКФ, мл/мин | 71 | 30 | 21 | 15 | 12 | 18 | 20 | 22 | 25 |
На 2-е сутки в отделении ОРИТ у больного сохранялось состояние анурии, которое было расценено как ОПН RIFLE-F. При допплерографии отмечена проходимость сосудистых анастомозов. На 3-и сутки после операции отмечен рост азотистых шлаков, снижение СКФ. Всего проведено 3 сеанса гемодиализа. Фаза восстановления диуреза началась с третьих суток. На 5-е сутки послеоперационного периода пациент переведен в профильное отделение. На 10-е сутки после операции по данным УЗИ почка размерами 157 х 80 мм, отчетливо прослеживается кортико-медуллярная дифференцировка, паренхиматозный слой достаточно выражен – 26,0 мм, ЧЛС не расширена, сохранен внутриорганный кровоток. На 11-е сутки после операции пациент выписан из отделения в удовлетворительном состоянии.
По данным гистологического исследования материала, полученного в ходе оперативного вмешательства, диагностирован низкодифференцированный светлоклеточный ПКР (Grade 4 по Fuhrman) с размерами опухолевого узла 7,5х6х5 см с массивными некрозами (около 25% площади всех срезов) и выраженной воспалительной инфильтрацией, участками веретеноклеточного строения, фокусами сосудистой инвазии в структуре и наличием опухолевого тромба в почечной и НПВ, без метастазов в региональные лимфатические узлы. Статус краев резекции – негативный. Патоморфологический диагноз: рак единственной правой почки pT3в pN0(0/6) cM1; M 8310/3, Grade 4; R0; Pn0; L0, V1. ИП Ki67 – около 55%.
Через 8 недель после операции пациенту была назначена таргетная терапия: бевацизумаб в дозе 10 мг\кг внутривенно 1 раз в 14 дней + интерферон альфа-2а в дозе 3 млн МЕ внутримышечно 3 раза в неделю. Через 6 месяцев после операции при контрольном обследовании у больного не выявлены признаки местного и системного прогрессирования (стабилизация метастатического процесса в легких).
ОБСУЖДЕНИЕ
Сохранение почки при распространении опухолевого процесса в почечную и тем более в нижнюю полую вену – весьма сложная и далеко не всегда выполнимая задача. В мировой литературе описано не более 20 наблюдений использования органосохраняющей техники у этих пациентов. Эти случаи в большей степени являются казуистическими, нежели отражают какую-либо сложившуюся хирургическую стратегию. Основными показаниями для выполнения органосохраняющего лечения у подобных больных является наличие опухоли единственной или единственно функционирующей почки. При этом перед врачом и пациентом стоит непростой выбор: радикальная нефрэктомия с последующим хроническим диализом, либо менее радикальная, но органосохраняющая операция, позволяющая избежать ренопривного состояния.
В мировой литературе мы обнаружили четыре отчета, которые посвящены проблеме лечения этих больных. Первое исследование было проведено в 1990 году группой авторов из Кливленда во главе с K.W. Angermeier и A.C. Novick. Авторами были оценены результаты органосохраняющих операций 10 пациентов с ПКР и сосудистой инвазией. Билатеральное опухолевое поражение имело место у 6 больных, опухоль единственной почки – у 4-х. Все случаи имели локализованный характер и опухоли были удалены в пределах здоровых тканей. Однако нужно учитывать один немаловажный факт – в 4-х наблюдениях отмечалась всего лишь микроскопическая венозная инвазия, в остальных 6 случаях опухоль достигала притоков или основного ствола почечной вены. У трех больных выявлена инвазия опухоли в паранефральную клетчатку. Анализ онкологических результатов показал, что 40% больных погибли от прогрессирования процесса, в среднем, через 35,5 мес. Пять пациентов оставались живыми без очевидной прогрессии заболевания при наблюдении от 5 до 88 мес. (в среднем 28,4 мес.). У 3-х из 4-х умерших имел место локальный рецидив ПКР. Авторы заключают, что органосохраняющая операция является технически возможной у пациентов с венозным распространением опухоли, однако риск рецидива у них высок [17].
В 1999 году R.S. Pruthi и соавт. опубликовали сообщение о больной с раком единственной правой почки, которой была выполнена резекция верхнего полюса почки и удаление опухолевого тромба, распространяющегося в подпеченочный отдел НПВ. За период наблюдения, который составил больше года, у больной не было выявлено признаков рецидива заболевания [18].
M.K. Tollefson и соавт. в 2005 году также продемонстрировали результаты органосохраняющего хирургического лечения пациента с опухолью единственной почки и неопластическим подпеченочным тромбозом. Решение о проведении этой операции было принято на основе данных МСКТ, выявившей добавочную почечную вену [19].
Анализ результатов лечения 13 больных с опухолью единственной почки в стадии рТ3в, находившихся на лечении в клинике Mayo, представлен в 2005 году S. Sengupta и соавт. [20]. Резекции почки успешно выполнены у 7 больных, один больной умер во время операции от тромбоэмболии легочной артерии. Остальным 5 пациентам произведена радикальная нефрэктомия, у двух из них сначала была выполнена резекция почки. Причинами выполнения в дальнейшем нефрэктомии послужили кровотечение, большие размеры внутрипочечного образования, а также малые размеры остающейся части органа и инвазия опухоли венозную стенку. Рассматривая спектр органосохраняющих вмешательств, необходимо отметить, что в 4-х случаях операции проводились in situ, тогда как в трех наблюдениях ex vivo с аутотрансплантацией почки. В 11 случаях опухолевая инвазия ограничивалась почечной веной. В двух случаях опухоль распространялась в подпеченочный отдел НПВ. У трех пациентов отмечались серьезные осложнения после резекции почки: мочевой свищ, эвентерация, гемоперитонеум, необходимость установки кава-фильтра из-за легочной эмболии и интимэктомия артерии аутотрансплантата. В двух случаях возник острый тубулярный некроз, потребовавший несколько сеансов гемодиализа. Четверо больных умерли от прогрессирования заболевания в среднем через 9,5 мес. (всем пациентам были выполнены органосохраняющие операции), еще 4 погибли по причинам не связанным с наличием опухоли почки. Пять больных живы при медиане наблюдения 25 мес. (8-204 мес.). При этом у одного из них имеется прогрессирование заболевания.
До сих пор сложным остается вопрос о приоритете лечебной тактики у подобных больных: органосохраняющая или органоуносящая операция? По данным мировой литературы в большинстве случаев проводится нефрэктомия, которая рассматривается как стандарт лечения. Это обосновывается следующим: во-первых, резекция опухоли с тромбэктомией – более длительная и сложная операция, чем нефрэктомия; во-вторых, она значительно чаще сопровождается осложнениями (15-30%); в-третьих, онкологические результаты нефрэктомии с последующим гемодиализом оказались прогностически лучше [21, 22].
Хотя большая часть локальных рецидивов и смертей, связанных с ПКР наблюдалась в группе органосохраняющих операций, в настоящее время делать выводы еще преждевременно, т.к. количество больных небольшое, а резекция почки зачастую использовалась у больных с регионарными и отдаленными метастазами или стадией Т2-Т3. До сих пор остается открытым вопрос – насколько нефрэктомия продлевает жизнь по сравнению с органосохраняющей операцией. S. Sengupta и соавт. считают оба метода эквивалентными по эффективности [20]. Нельзя забывать и о проблемах, связанных с хроническим гемодиализом, включающих осложнения, низкое качество жизни пациентов и высокую смертность [23, 24]. С уверенностью можно констатировать только одно – органосохраняющая хирургия может успешно использоваться для лечения пациентов с опухолью единственной почки и неопластическим тромбозом. Показания к данному хирургическому пособию еще предстоит разработать.
ЗАКЛЮЧЕНИЕ
В работе описан редкий клинический случай пациента с диагнозом: АРМС. Рак единственной правой почки IV стадии, рТ3вN0М1[PUL], интралюминальная инвазия (подпеченочная форма). Пациенту успешно выполнено органосохраняющее оперативное пособие с морфологически подтвержденным местным радикальным эффектом. Использовался метод резекции почки ex vivo, разработанный в урологической клинике Института хирургии им. А.В. Вишневского. Данный случай демонстрирует широкие возможности сложной техники оперативного пособия: экстракорпоральной резекции почки в условиях фармако-холодовой ишемии без пересечения мочеточника с ортотопической реплантацией почечных сосудов при ПКР, что позволяет избежать ренопривного состояния как в процессе ожидания трансплантации почки, так и в процессе таргетной терапии.
ЛИТЕРАТУРА
1. Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2013 году. М., 2015. С. 9-15.
2. Широкорад В.И., Махсон А.Н., Ядыкова О.А. Состояние онкоурологической помощи в Москве, онкоурология. 2013. №4. С.11.
3. Duroshow LW, Abeshouse BS. Congenital unilateral solitary kidney report of 37 cases and a review of the literature. // Urol Surv. 1961. Vol. 11. P. 219.
4. Sheih C P, Hung C S. Cystic dilatations within the pelvis in patients with ipsilateral renal agenesis or dysplasia. // J Urol. 1990. Vol. 144 (2 Pt 1). P. 324-327.
5. Bratslavsky G, Boris RS. Emerging Strategies of Nephron Sparing Surgery in Patients with Localized and Recurrent Renal Cell Carcinoma. // Malign Tumours 2010. Vol. 1. P. 5-14. 6. Gill I. Laparoscopic radical nephrectomy for cancer. // Urol Clin. 2000. Vol. 27. Р. 707-719.
7. Клиническая онкоурология. [Под редакцией профессора Б.П. Матвеева] 2011. М.: ООО «Издательский дом «АБВ-пресс». С.76-77.
8. Go AS, Chertow GM, Fan D, McCulloch CE, Hsu CY. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. // N Engl J Med. 2004. Vol. 351. P. 1296.
9. Koenig P, Gill IS, Kamoi K, Aron M, Haber G, Singh AB, Weight CJ, Desai MM, Kaouk JH, Goldfarb DA, Poggio ED. Kidney cancer and the risk for chronic kidney disease: matched-paired comparison with living donors. // Jour Urol. 2008. Vol. 179. P. 170.
10. McKiernan J, Simmons R, Katz J, Russo P. Natural history of chronic renal insufficiency after partial and radical nephrectomy. // Urol. 2002. Vol. 59. P. 816.
11. System U. S. R. D.: Annual Data Report. National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK), National Institutes of Health (NIH), and US Department of Health and Human Services (DHHS). // 2007
12. Foley RN, Parfrey PS, Sarnak MJ. Clinical epidemiology of cardiovascular disease in chronic renal disease. // Am J Kidney Dis. 1998. Vol. 32. P. 112.
13. Rocco M, Frankenfield DL, Hopson SK, McClellan WM. Relationship between clinical performance measures and outcomes among patients receiving long-term hemodialysis. // Ann Intern Med. 2006. Vol. 145. P. 512.
14. Neil N, Guest S, Wong L, Inglese G, Bhattacharyya SK, Gehr T. The financial implications for Medicare of greater use of peritoneal dialysis. // Clin fter. 2009. Vol. 31. P. 880.
15. Kasiske BL, Cangro CB, Hariharan S, Hricik DE, Kerman RH, Roth D. The evaluation of renal transplantation candidates: clinical practice guidelines. // 2001. Am J Transplant. 2001. 1 Suppl 2. P. 3. 16. Lin SJ. The association between length of post-kidney transplant hospitalization and long-term graft and recipient survival. // Clin Transplant. 2006. Vol. 20. P. 245.
17. Angermeier KW, Novick AC, Streem SB, Montie JE. Nephron-sparing surgery for renal cell carcinoma with venous involvement. // Journal of Urology. 1990. Vol. 144, N 6. P. 1352-1355. 18. Pruthi RS, Angell SK, Brooks JD, Gill H. Partial nephrectomy and caval thrombectomy for renal cell carcinoma in a solitary kidney with an accessory renal vein. // BJU Int. 1999. Vol. 83. P.142-143.
19. Tollefson MK, Kawashima A, Blute ML. In situ partial nephrectomy and tumor thrombectomy for renal cell carcinoma wiyh level 11 vena cava extension in a solitary kidney. // Urology. 2005. Vol. 66, N 4. P.882.
20. Sengupta Sh, Zinke H, Leibovich BC and Blute ML. Surgical treatment of stage pT3b renal cell carcinova in solitary kidneys: a case sries. // BJU Int. 2005. Vol. 96. P. 54-57.
21. Stephenson AJ, Hakimi AA, Snyder ME and Russo P. Complications of radical and partial nephrectomy in a large contemporary cohort. // J Urol. 2004. Vol. 171. P. 130-134.
22. Campbell SC, Novick AC, Streem SB, Klein E, Licht M. Complications of nephron sparing surgery for renal tumors. // J Urol. 1994. Vol. 151. P. 1177–1180.
23. Thomas N. Measurement of quality of life for elderly people on dialysis. // Br J Nurs. 1992. Vol. 1. P. 284-285.
24. Okechukwu CN, Lopes AA, Stack AG. Impact of years of dialysis therapy on mortality risk and the characteristics of longer term dialysis survivors. // Am J Kidney Dis. 2002. Vol. 39. P. 533-538.







