Рак предстательной железы (РПЖ) имеет лидирующие показатели в структуре мужской онкологической заболеваемости и смертности [1]. В настоящее время основным методом ранней и неинвазивной диагностики РПЖ является оценка уровня простат-специфического антигена (ПСА) – гликопротеина, секретируемого эпителием предстательной железы. Ценность метода определяется его простотой и объективностью, но при этом показатели чувствительности и специфичности (прогностической значимости) не превышают, по разным оценкам, 70% и 50%, соответственно. Клиническая значимость этого маркера несколько возрастает при анализе уровня общего ПСА и соотношения его фракций (свободной, связанной). Тем не менее, повышение ПСА может сопровождать не онкологические патологии предстательной железы, а прогрессирование низкодифференцированного РПЖ может не отражаться на уровне циркулирующего маркера. Трактовка клинического значения повышенного ПСА является не тривиальной проблемой, и это стимулирует поиск новых маркеров и разработку новых диагностических подходов. В настоящее время на стадии испытаний находятся несколько новых методов (PCA3/DD3, 4Kscore, TMPRSS2-ERG), сравнительный анализ которых представлен в ряде обзорных публикаций [2, 3]. Выделение из мочи или плазмы мембранных микровезикул (экзосом) и анализ их биохимического состава обсуждается в этих статьях как один из перспективных методов ранней и специфической диагностики РПЖ.
Экзосомы – это мембранные везикулы размером 100-200 нм, секретируемые практически всеми типами клеток [4]. Экзосомы формируются в клеточной цитоплазме в составе т.н. «мультивезикулярных телец» (MVB, multivesicular bodies) и высвобождаются во внеклеточное пространство после слияния клеточной мембраны и мембраны мультивезикулярного тельца [5]. До недавнего времени считалось, что секреция экзосом является «санитарным» процессом очистки клетки от ненужных веществ. Однако исследования последних лет показали, что экзосомы опосредуют межклеточный обмен веществ и информации [6]. Экзосомы, секретируемые опухолевыми клетками, играют важную роль в различных аспектах прогрессии заболевания: локальной инвазии, подавлении противоопухолевых иммунных реакций, стимуляции неоангиогенеза и формировании отдаленных метастазов [7]. Кроме того, биохимический состав экзосом сохраняет признаки секретирующей их клетки. Этот важный феномен определяет огромный диагностический потенциал экзосом, которые могут быть выделены из большинства биологических жидкостей, включая мочу.
В настоящее время рядом исследований показано, что биохимический состав экзосом, выделенных из плазмы или мочи больных РПЖ, отличается от состава экзосом здоровых доноров. В основном исследования направлены на анализ белкового состава экзосом и «профайлинг» экзосомальных миРНК [8, 9]. С учетом структурных и биологических особенностей молекул миРНК, регулирующих экспрессию генома на пост-транскрипционном уровне, анализ экзосмальной фракции миРНК представляется одним из перспективных направлений развития диагностических технологий [10]. Значимым этапом на пути развития метода явился анонс положительных результатов клинических испытаний нового теста – «Prostate Cancer Liquid Biopsy Test» – основанного на анализе миРНК экзосом, выделенных из мочи, сделанный компанией Exosomes Diagnostics.
Однако внедрение новой методики в клиническую практику задерживается из-за отсутствия стандартного способа выделения экзосом. Эта технологическая проблема активно обсуждается в современной литературе [11]. В основе существующих методов лежат предположения о специфических характеристиках физической плотности, нано-размерности или наличии специфических белковых маркеров на поверхности экзосом. Существование принципиально различных подходов свидетельствует об отсутствии оптимального метода. Так, основной проблемой является гетерогенность популяции экзосом в составе любой биологической жидкости в плане как физических так и биохимических характеристик [12, 13]. Кроме того, любая биологическая жидкость, в том числе и моча, содержит комплексы молекул или субклеточных образований, которые могут иметь физические или биохимические характеристики, аналогичные экзосомальным. Поэтому, ни один из существующих методов выделения экзосом не может гарантировать получения «всех и только» экзосом.
Цель работы – разработка нового метода выделения экзосом из мочи, в основе которого лежит феномен взаимодействия гликосахаридов на поверхности экзосом с лектинами.
МАТЕРИАЛЫ И МЕТОДЫ
Клинический материал. Исследование было одобрено этическим комитетом НИИ Онкологии им. Н.Н. Петрова. Характеристика пациентов (n=25) приведена в таблице 1. Соответствующая по возрасту контрольная группа (n=25) была представлена здоровыми мужчинами, не имеющими клинических проявлений РПЖ с уровнем ПСА менее 4 нг/мл.
Таблица № 1. Клиническая характеристика пациентов
| РПЖ (25 пациентов) | Контроль (25 здоровых волонтеров) | ||
|---|---|---|---|
| Возраст, медиана [IQR], лет | 65 [43-78] | 67 [63-75] | |
| ПСА, нг/мл | < 10 | 9 | – |
| 10 20 | 10 | – | |
| ≥ 20 | 6 | – | |
| Сумма баллов по Глисону |
< 6 | 0 | – |
| 6 7 | 20 | – | |
| ≥ 8 | 5 | – | |
| Стадийность | 11 | 3 | – |
| 12 | 15 | – | |
| 13 | 7 | – | |
Образцы мочи центрифугировали (3000 хg, 15 мин., +4°С), супернатант хранили при температуре минус 80оС.
Выделение экзосом. Для выделения экзосом пробы мочи размораживали до +4°C и центрифугировали (20000 хg, 45 мин) для удаления клеточного детрита, инкубировали с Конканавалином А (2 мг/л) на качалке при +4°C в течение ночи и снова центрифугировали при 20000 хg, 90 мин. Осадок, содержащий экзосомы, растворяли в фосфатно-солевом буфере и хранили при минус 80°C.
Динамическое светорассеяние (ДСР). Измерения производили на Zetasizer Nano ZS (Malvern Instruments, UK). Клетки и клеточные остатки удаляли центрифугированием мочи (20000 хg, 45 мин) перед анализом, который проводили при +23°C в соответствии с инструкциями изготовителя.
Вестерн-блот. Образцы были лизированы (0,05 М Tris-HCl, pH 7,4; 0,15 М NaCl, 1% Triton X-100, 1% SDS) в присутствии смеси ингибиторов протеолиза P8340 (Sigma Aldrich, USA) в течение часа, при +4оC. После центрифугирования (17 000 xG, 20 минут, +4оC), экстракты протеинов были нормализованы с помощью BCA Protein Assay Kit (Thermo Scientific, USA). Электрофорез проводился в 10% SDS-PAAG, для нанесения использовался стандартный нередуцирующий буффер (Laemlli Sample Buffer). Разделенные электрофорезом белки переносили на поливиниловую мембрану, которую блокировали в течение часа в 0,1% растворе казеина в трис-солевом буфере с твином-20 и инкубировали с антителами против TSG101 или CD9 производства компании Santa Cruz, USA. Визуализацию блотов проводили с помощью вторичных антител, меченых люминесцентной меткой, на аппарате Quantitative Western Blot – LI-COR Biosciences (LICOR Biotechnology, USA).
Выделение и анализ РНК. РНК из экзосом выделяли с помощью набора для выделения (BioSilica, Россия). Для анализа РНК использовали приборы: NanoDrop 2000 (ermo Scientific, USA), и Tape Station 2200 (Agilent Technologies Inc., USA).
ОТ-ПЦР. Для количественного определения уровня миРНК синтезировали кДНК с использованием miRCURY LNA Universal RT microRNA Polyadenylation and cDNA synthesis Kit (Exiqon, Denmark). ПЦР в реальном времени (qPCR) проводили с использованием ExiLENT SYBR Green master mix (Exiqon, Denmark) на CFX96 Touch™ Real-Time PCR Detection System (Bio-Rad, USA). Список миРНК, включенных в исследование, и соответствующих праймеров приведены в таблице 2.
Таблица 2. Список исследованных микроРНК
| миРНК | Результаты ОТ-ПЦР | Ссылка | ПЦР праймеры | |
|---|---|---|---|---|
| соотношение Ca/N | P | (Exiqon Cat.N) | ||
| Hsa-miR-21-5p | 4,05 | 0,0128 | [15-17] | 204230 |
| Hsa-miR-107 | 1,1 | 0,9781 | [18] | 204468 |
| Hsa-miR-141-5p | 11,7 | 0,0023 | [15,18, 19] | 206088 |
| Hsa-miR-221-5p | * | [15, 20] | 204032 | |
| Hsa-miR-298 | * | [19] | 204115 | |
| Hsa-miR-326 | 2,21 | 0,9912 | [18, 19] | 204512 |
| Hsa-miR-375 | 1,55 | 0,8315 | [18] | 204362 |
| Hsa-miR-432-5p | * | [18] | 204776 | |
| Hsa-miR-574-3p | 3,90 | 0,0017 | [18] | 206011 |
| Hsa-miR-2110 | 1,25 | 0,1911 | [18] | 204328 |
| Hsa-miR-625-5p | * | [18] | 206999 | |
| Hsa-miR-301a-5p | * | [18] | 206999 | |
| U6 snRNA | Reference | 203907 | ||
| Hsa-miR-191-5p | Reference | 204306 | ||
Все статистические расчеты были выполнены с использованием программного обеспечения MedCalc и GraphPad.
РЕЗУЛЬТАТЫ
Выделение и характеристика экзосом мочи. Для апробации метода и анализа выделяемых микровезикул использовалась моча здоровых доноров (40 мл). После первого центрифугирования (20000 хg, 45 мин) был получен осадок, содержащий, вероятно, клеточный детрит и крупные везикулы. После инкубации супернатанта с лектином в концентрации ≥ 2 мг/л, и последующего центрифугирования (20000 хg, 90 мин) образовывался едва видимый осадок. Процесс агглютинации экзосом был исследован методом ДСР (рис. 1). После удаления клеток (3000 хg, 15 мин., +4°С) в моче детектировались два типа частиц размером около 10 и 100 нм. Инкубация с лектином приводила к образованию больших конгломератов со средним размером около 600 нм. Второй этап центрифугирования приводил к полному удалению больших (600 нм) везикул.
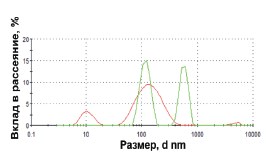
Рис. 1. Анализ содержания наноразмерных везикул в моче до (красная линия) и после (зеленая линия) инкубации с Конканавалином А с помощью метода динамического светорассеяния (аппарат Zetasizer Nano ZS, Malvern, UK)
Наличие белковых маркеров экзосом (TSG101 и CD9) анализировали с помощью Вестерн-блоттинга (рис. 2). Следовые количества CD9 были обнаружены в осадке после центрифугирования (20000 хg, 45 мин). Оба экзосомальных маркера (TSG101 и CD9) присутствовали в большом количестве в осадке, полученном после инкубации с Конканавалином А и последующего центрифугирования (20000 хg, 90 мин), что подтверждало наличие в нем экзосом. Затем был проведен сравнительный качественный анализ РНК в первом и втором осадках (рис. 3). В профиле РНК первого осадка присутствовали пики, соответствующие двум фракциям рибосомальной РНК (28S и 18S), что характерно для клеточной РНК. Наличие фракции молекул РНК длиной 25-40 пар в первом осадке свидетельствовало о существенной деградации, что ожидаемо для РНК в составе клеточного детрита. В профиле РНК второго осадка пики, отражающие рибосомальную РНК, не наблюдались, но осадок был обогащен РНК с размером 2002000 нуклеотидов.
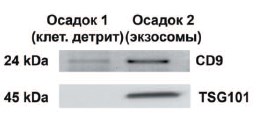
Рис. 2. Вестерн-блот анализ экзосомных маркеров (TSG101, CD9) в осадках, получаемых в процессе последовательного центрифугирования мочи. Первый осадок предположительно содержит клеточный детрит и крупные мембранные везикулы, второй – экзосмы
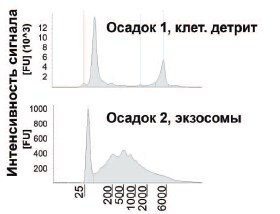
Рис. 3. Анализ РНК, выделенной из осадков в процессе последовательного центрифугирования мочи (Tape Station 2200). Первый осадок предположительно содержит клеточный детрит и крупные мембранные образования, второй получен после инкубации с конканавалином А и содержит экзосомы
Приведенные данные свидетельствуют о том, что в моче присутствуют везикулы размером около 100 нм, которые образуют крупные агглютинаты при взаимодействии с лектинами (Конканавалин А). Эти агглютинаты могут быть выделены путем центрифугирования, их белковый состав обогащен экзосомальными маркерами, и они имеют специфический (отличный от клеточного) состав РНК.
Анализ профиля экспрессии миРНК в экзосомах из мочи пациентов с РПЖ. На следующем этапе работы описанный метод был применен для выделения экзосом из мочи пациентов с РПЖ (25) и здоровых доноров (25). Осадок, полученный после поэтапного центрифугирования и содержащий экзосомы, использовали для выделения РНК и последующих реакций обратной транскрипции и ПЦР. ПЦР делали в трех повторениях и оценивали средние значения Ct. Список миРНК, включенных в анализ был сформирован на основе литературных данных (табл. 2) и включал в себя 12 миРНК для которых показано повышенное содержание в плазме или моче больных РПЖ. Из 12 миРНК, пять были обнаружены менее чем в половине образцов мочи пациентов с РПЖ, они были исключены из дальнейшего анализа (обозначены * в таблице 2). Данные, полученные по остальным миРНК, были нормализованы относительно значений полученных для референсных миРНК (U6 мяРНК и has-miR191-5p) с использованием стандартного подхода (2^ (Ct reference-Ct miR). Согласно полученным результатам, миРНК-574-3p, миРНК-141-5p и миРНК-21-5p представлены в более высокой концентрации в моче мужчин с РПЖ по сравнению с контрольной группой (рис. 4). Однако эта разница была статистически значима только для миРНК -574-3p и миРНК-141-5p (ANOVA р< 0,01).
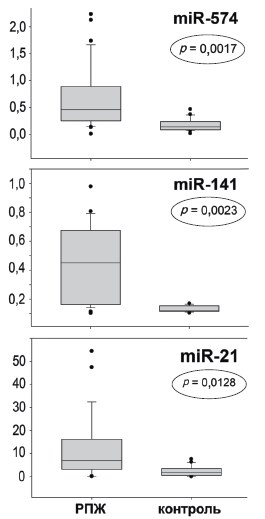
Рис. 4. Сравнительный анализ содержания миРНК в экзосомах, выделенных из мочи пациентов с РПЖ и здоровых доноров, проведенный методом ОТПЦР. Статистический анализ проведен с помощью U-теста Манна и Уитни
В заключении, показатели диагностической значимости для трех «маркерных» миРНК были определены с учетом результатов проведенного анализа 25 пациентов с РПЖ и 25 здоровых доноров (табл. 3), соотношение специфичности и чувствительности теста представлено с помощью ROC (receiver operating characteristic) кривой (рис. 5).
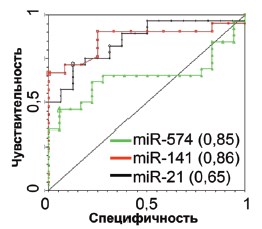
Рис. 5. Оценка диагностической значимости анализа «маркерных» миРНК в экзосомах, выделенных из мочи с помощью построения ROC (receiver operating characteristic) кривой. Были получены следующие статистические показатели: miRNA-574-3p: чувствительность 0,71; AUC ROC 0,85; 95% CI = 0,736-0,964, miR-141-5p: чувствительность 0,66; AUC ROC 0,86; 95% CI = 0,732-0,994 miR-21-5p: чувствительность 0.46; AUC ROC 0,65; 95% CI = 0,477-0,814
ОБСУЖДЕНИЕ
В работе представлен новый метод выделения экзосом из мочи, и доказана его пригодность для последующего анализа экзосомальной миРНК. В результате сравнительного анализа экзосомальной миРНК из мочи пациентов с РПЖ и здоровых доноров показано, что развитие РПЖ сопровождается повышением содержания трех миРНК (miR-574-3p, miR-141-5p и miR-21-5p). Чувствительность диагностического теста на основе анализа miR-574-3p оказалась сопоставима с чувствительностью широко используемого в клинической практике теста ПСА (~70%), чувствительность анализа miR-141-5p и miR-21-5p – ниже, чем ПСА (66% и 41% vs. 70%, PSA). В тоже время диагностическая специфичность всех трех «маркерных» миРНК превосходит аналогичные параметры ПСА (72-80% vs. 50%, PSA) (табл. 3). По данным ряда клинических исследований диагностические показатели новой тест-системы Progensa, на основе сравнительного анализа уровней экспрессии PCA-3 (DD3) и PSA, колеблются в диапазоне 53-69% (чувствительность) и 71-83% (специфичность) [14], что сопоставимо с результатами данного исследования. Анализ экспрессии химерного онкогена TMPRSS2:ERG имеет низкую диагностическую чувствительность (37%), что обусловлено соответствующей частотой встречаемости этой мутации в популяции пациентов с РПЖ. Однако, специфичность позитивного результата этого теста разными авторами оценивается как 93-98% [14]. Так, представленный нами метод является более чувствительным, но менее специфичным по сравнению с анализом экспрессии онкогена TMPRSS2:ERG.
Таблица 3. Показатели диагностической значимости для «маркерных» миРНК
| Показатели | Чувствительность | Специфичность | PPV* | NPV* |
|---|---|---|---|---|
| miR-574-3p | 0,71 | 0,72 | 0,68 | 0,76 |
| miR-21-5p | 0,66 | 0,8 | 0,75 | 0,66 |
| miR-141-5p | 0,47 | 0,77 | 0,66 | 0,63 |
* PPVпрогностическая ценность положительного результата, NPVпрогностическая ценность отрицательного результата
В наше исследование было включено лишь 25 пациентов и 25 здоровых волонтеров, поэтому представленные результаты имеют ориентировочный характер. Для адекватной оценки чувствительности теста необходимо исследование большего числа пациентов с РПЖ. Для определения специфичности анализа миРНК необходимо проведение более широкого исследования с включением пациентов с не онкологическими заболеваниями предстательной железы и онкологическими заболеваниями другой локализации. Тем не менее, представленные результаты показывают перспективность дальнейшей работы по валидации и оптимизации метода диагностики РПЖ на основе анализа экзосомальный миРНК в моче. В частности, планируется работа по оптимизации методики нормализации результатов ПЦР, уточнению диагностически значимого уровня повышения концентрации «маркерных» миРНК и разработка алгоритма анализа профиля экспрессии набора «маркерных» молекул. Решение этих вопросов позволит разработать новый метод скрининга и ранней диагностики РПЖ, способный успешно конкурировать с другими тестами.
ЗАКЛЮЧЕНИЕ
Новый метод выделения экзосом из мочи, с учетом его простоты и низкой стоимости, представляется перспективным как для проведения масштабных клинических исследований, так и для разработки тестов клинической диагностики.
ЛИТЕРАТУРА
1. Чиссов В.И., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2011 году. ФГБУ «МНИОИ им П.А. Герцена» Минздравсоцразвития России 2012.
2. Boxer RJ. Prostate Cancer Biomarkers: Improvement in Predicting Clinically Significant Disease. // ASCO Post. 2014. Vol.5, N 12:on line. URL: http://www.ascopost.com/issues/july-25,-2014/prostatecancerbiomarkers-improvement-in-predicting-clinically-significant-disease.aspx
3. Dijkstra S, Mulders PF, Schalken JA. Clinical use of novel urine and blood based prostate cancer biomarkers: a review. // Clin Biochem. 2014. Vol. 47, N 10-11. P. 889-896.
4. Филатов М.В., Ланда С.Б., Пантина Р.А., Гармай Ю.П. Исследование экзосом, секретируемых различными нормальными и злокачественно трансформированными клетками in vitro и in vivo. // Клиническая Лабораторная диагностика. 2010. N 12. С. 35-42. 5. Colombo M, Raposo G, Thery C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. // Annu Rev Cell Dev Biol. 2014. N 30. P. 255-289.
6. Nazimek K, Bryniarski K, Santocki M, Ptak W. Exosomes as mediators of intercellular communication: clinical implications. // Pol Arch Med Wewn. 2015. Vol.125, N 5. P. 370-380.
7. Малек А.В., Берштейн Л.М., Филатов М.В, Беляев А.М. Система экзосомальных межклеточных коммуникаций и ее роль в процессе метастатической диссеминации. // Вопросы онкологии. 2014. Т. 60, N 4. C. 429-436.
8. Drake RR, Kislinger T. The proteomics of prostate cancer exosomes. // Expert Rev Proteomics. 2014. Vol. 11, N 2. P. 167-177.
9. Hessvik NP, Sandvig K, Llorente A. Exosomal miRNAs as Biomarkers for Prostate Cancer. // Front Genet. 2013. N 4. P. 36.
10. Sato-Kuwabara Y, Melo SA, Soares FA, Calin GA. The fusion of two worlds: non-coding RNAs and extracellular vesicles-diagnostic and therapeutic implications (Review). // Int J Oncol. 2015. Vol. 46, N 1. P. 17-27.
11. Zeringer E, Barta T, Li M, Vlassov AV. Strategies for isolation of exosomes. // Cold Spring Harb Protoc. 2015. Vol. 2015, N 4. P. 319-323.
12. Jeppesen DK, Hvam ML, Primdahl-Bengtson B, Boysen AT, Whitehead B, Dyrskjot L, Orntoft TF, Howard KA, Ostenfeld MS. Comparative analysis of discrete exosome fractions obtained by differential centrifugation. // J Extracell Vesicles. 2014. N 3. P. 25011.
13. Tauro BJ, Greening DW, Mathias RA, Mathivanan S, Ji H, Simpson RJ. Two distinct populations of exosomes are released from LIM1863 colon carcinoma cell-derived organoids. // Mol Cell Proteomics. 2013. Vol. 12, N 3. P. 587-598.
14. Sartori DA, Chan DW. Biomarkers in prostate cancer: what's new? // Current opinion in oncology. 2014. Vol. 26, N 3. P.259-264.
15. Yaman Agaoglu F, Kovancilar M, Dizdar Y, Darendeliler E, Holdenrieder S, Dalay N, Gezer U. Investigation of miR-21, miR-141, and miR-221 in blood circulation of patients with prostate cancer. // Tumour biology. 2011. Vol. 32, N 3. P.583-588.
16. Zhang HL, Yang LF, Zhu Y, Yao XD, Zhang SL, Dai B, Zhu YP, Shen YJ, Shi GH, Ye DW. Serum miRNA-21: elevated levels in patients with metastatic hormone-refractory prostate cancer and potential predictive factor for the efficacy of docetaxel-based chemotherapy. // Prostate. 2011. Vol. 71, N 3. P.326-331.
17. Shen J, Hruby GW, McKiernan JM, Gurvich I, Lipsky MJ, Benson MC, Santella RM. Dysregulation of circulating microRNAs and prediction of aggressive prostate cancer. // Prostate. 2012. Vol. 72, N 13. P.1469-1477.
18. Bryant RJ, Pawlowski T, Catto JW, Marsden G, Vessella RL, Rhees B, Kuslich C, Visakorpi T, Hamdy FC. Changes in circulating microRNA levels associated with prostate cancer. // Br J Cancer. 2012. Vol. 106, N 4. P.768-774.
19. Selth LA, Townley S, Gillis JL, Ochnik AM, Murti K, Macfarlane RJ, Chi KN, Marshall VR, Tilley WD, Butler LM. Discovery of circulating microRNAs associated with human prostate cancer using a mouse model of disease. // Int J Cancer. 2012. Vol. 131, N 3. P.652-661.
20. Larne O, Martens-Uzunova E, Hagman Z, Edsjo A, Lippolis G, den Berg MS, Bjartell A, Jenster G, Ceder Y. miQ-a novel microRNA based diagnostic and prognostic tool for prostate cancer. // Int J Cancer. 2013. Vol. 132, N 12. P.2867-2875.







