Число пациентов со стойкой утратой эрекции после радикальной простатэктомии (РПЭ) может достигать 28%. Патогенез эректильной дисфункции (ЭД) является многокомпонентным и сложным. С морфофункциональной точки зрения ключевой механизм ЭД состоит в интраоперационном повреждении нервных стволов, которое вызывает локальную ишемию, ведущую к апоптозу эндотелия кровеносных сосудов. В результате снижается выработка оксида азота (NO) и ингибируется высвобождение простагландина, который, в свою очередь, ингибирует процессы аккумуляции коллагена I и III типов в гладкой мускулатуре и соответственно, интенсифицируется развитие соединительной ткани, развивается фиброз. Отсутствие спонтанных эрекций в послеоперационном периоде только усугубляет выраженность патологического процесса, усиливая процессы ишемии и апоптоза в кавернозных телах [1]. В целом, патогенез и патоморфология ЭД изучены достаточно тщательно, базовые исследования проведены еще 7-10 лет назад [2,3,4]. Доказано, что, денервация при РПЭ запускает механизм развития стресс-реакции всех клеточных пулов в кавернозной ткани, в результате развивается кавернозный фиброз, эндотелиальная дисфункция и нарушается клеточная пролиферация. Апоптоз и фиброз гладких мышечных волокон, в свою очередь, запускает механизм веноокклюзионной эректильной дисфункции [3]. Можно утверждать, что относительно необходимости комплексной и максимально ранней пенильной реабилитации достигнут консенсус. В многочисленных источниках убедительно показано, что тщательное выполнение программы пенильной реабилитации ускоряет время восстановления эректильной функции и увеличивает количество пациентов, способных к сексуальной активности спустя 12 месяцев после операции РПЭ. Основными задачами пенильной реабилитации в период 1-2 лет после простатэктомии считают обеспечение оксигенации кавернозной ткани и замедление процессов фиброза [1,5,6]. Показано, что восстановление уровня оксида азота в кавернозной ткани сдерживает развитие стресс-реакции клеток и может являться методом профилактики ремоделирования кавернозной ткани и эректильной дисфункции после РПЭ [1]. Также среди подавляющего большинства ученых и врачей сложилось общее восприятие следующей последовательности лечебных мероприятий: медикаментозная терапия, интракавернозные инъекции и аппаратные методы, хирургическое лечение; при этом фаллопротезирование рассматривается как «третья линия обороны», финальный, необратимый метод [7-12].
Однако в настоящее время практически полностью отсутствуют какие-либо обоснованные подходы к определению оптимального временного диапазона и условий для выполнения фаллопротезирования. Так, по данным ряда публикаций интервал между основной операцией и протезированием составляет от 2 месяцев до 10 лет (в среднем -2,5-3 года) [13-15]. При этом исследователи не приводят данные, которые хотя бы субъективно поясняли выбор срока проведения хирургического лечения ЭД.
Сторонники максимально раннего выполнения фаллопротезирования основывают свои подходы на анализе функциональных исходов. В исследование G. Megas и соавт. было включено 153 пациента, перенесших нервосберегающую РПЭ; через 6 месяцев после операции у 69 (45%) зафиксирована ЭД. Из этой группы 44 пациента приняли участие в дальнейшем исследовании. В первой группе (n=25) пациентам было выполнено фаллопротезиро-вание, во второй (n=29) — больным назначен пероральный прием тадалафила. Демографически и медицински группы были стандартизированы. Для оценки функциональных результатов использовалась общепризнанная шкала «International Index of Erectile Function (IIEF)». Анкетирование пациентов проводилось в сроки 6, 12 и 24 месяца после начала лечения ЭД. В итоге, по всем показателям, характеризующим эректильную функцию, в группе фаллопротезирования зафиксированы более высокие статистически достоверные результаты. Эти данные авторы работы использовали для обоснования концепции раннего фаллопротезирования после нервосберегающей РПЭ [16]. Вместе с тем, явных указаний об оптимальных сроках восстановительной хирургии в статье не приводится. Лишь косвенно можно понять, что показанием к операции служил факт диагностики ЭД через 6 месяцев после РПЭ.
Достаточно убедительным контраргументом служат данные, полученные в результаты ряда экспериментов на животных. Согласно исследованиям K. Hatzimouratidis и соавт. ингибиторы фосфодиэсте-разы 5-го типа обладают выраженной способностью к торможению процессов апоптоза и фиброза. Показана нормализация выработки и соотношения I и III типов коллагена под действием тадалафила и силденафила и их антипролиферативный эффект относительно фибробла-стов. Вместе с тем тадалафил не оказывает значимого влияния на уровень трансформирующего фактора роста бета-1, синтазы оксида азота, ксантина оксидоредуктазы. Все приведенные результаты подтверждены иммуногистохимически и гистологически [17-19]. Более современные исследования, базирующиеся на анализе экспрессии генов, факторов роста, металлопротеиназ, в целом подтверждают уже известные данные о влиянии силденафила [20]. Сторонники концепции раннего фаллопротезирования апеллируют к отсутствию сведений об аналогичных эффектах у людей, в основном обусловленных отсутствием единых подходов и протоколов медикаментозной пенильной реабилитации [16]. Однако еще в 2008 г. F. Iacono и соавт. были опубликованы результаты гистопатоло-гического исследования кавернозных тел по результатам биопсии. В группу (n= 21) вошли пациенты, перенесшие РПЭ и регулярно получавшие силденафил в течение двух месяцев после операции. Биопсия кавернозных тел проводилась до и после РПЭ. В результате не было обнаружено достоверных различий в удельном весе соединительной ткани в кавернозных телах до и после радикальной простатэктомии на фоне терапии ингибиторами фосфодиэстеразы 5 типа [21]. Более современные исследования подтверждают приведенные результаты. Инструментально и гистологически показано, что ингибиторы фосфо-диэстеразы 5 типа способны оказывать положительный эффект на клеточном уровне на фоне ЭД после РПЭ [22].
Определенным ограничением данных исследований является длительность наблюдения. Остается неясным наличие динамического изменения «восприимчивости» кавернозной ткани к ингибиторам фос-фодиэстеразы 5 типа в отдаленном периоде после РПЭ. Таким образом, приходится констатировать, что за практически полувековую историю применения фаллопротезирования как метода восстановления эректильной функции после РПЭ так и не сложились обоснованные критерии выбора оптимального срока для его применения [23]. Фаллопротезирование дает хорошие функциональные результаты. Но применение необратимого метода в ситуации, когда возможности для медикаментозной терапии еще полностью не исчерпаны, представляется неправильным. В связи с этим важной научной задачей является обоснование сроков для фал-лопротезирования, точнее — разработка методов объективизации состояния кавернозной ткани, после РПЭ. M.C. Cho и соавт. показано, что иммуногистохимические исследования потенциально могут быть использованы для оценки степени фиброза кавернозной ткани [24]. Следовательно, эти методы могут объективизировать состояние тканей, выявить «необратимый фиброз» как четкое и однозначное показание к фаллопротезированию. Однако значимых научных исследований в этой сфере нет.
Полагаем, что наличие четких критериев планирования сроков фаллопротезирования может положительно сказаться на финансовых аспектах (сокращение расходов на диагностические вмешательства, на уже заведомо неэффективную консервативную терапию), моральнопсихологическом состоянии пациентов (сокращение периода пребывания в состоянии выраженной ЭД), уровне послеоперационных осложнений (проведение протезирования в максимально безопасные периоды с позиций течения основного заболевания, его терапии и т.д.), устойчивости достигнутых функциональных результатов. Необходимо дальнейшее изучение вопроса формирования подходов к выбору оптимальных сроков фалло-протезирования после радикальной простатэктомии. Реализация сказанного может быть достигнута только путем углубленного исследования состояния кавернозной ткани на клеточном и молекулярном уровне с применением арсенала современных гистологических и иммуногистохимических методов.
Целью исследования явилось изучение состояния кавернозной ткани в разные сроки после РПЭ.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на базе ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России и ФГАУ «Лечебно-реабилитационный центр» Минздрава России. В исследование были включены пациенты, перенесшие РПЭ с 2011 по 2016 годы. В течение трех месяцев после операции все пациенты принимали малые дозы ингибиторов фосфодиэстеразы 5 типа. При отсутствии эффекта в течении трех месяцев (стойкая ЭД) пациенты включались в исследование (n=96). Все пациенты были разделены на 2 группы: основная группа (n=53) — пациенты, которым фал-лоэндопротезирование проводилось через 3-4 месяца после РПЭ; контрольная группа (n=43) — пациенты, которым фаллоэндопротезирование проводилось через 12 и более месяцев после РПЭ.
Возраст пациентов колебался от 47 до 70 лет в обеих группах, средний возраст составил 60±6 лет. Критерии включения в исследование:
- наличие эрекции до РПЭ;
- отсутствие заболеваний соединительной ткани;
- желание вести регулярную половую жизнь;
- отсутствие эрекции в течении трех месяцев после РПЭ.
- Критерии исключения из исследования:
- длительная эректильная дисфункция до РПЭ;
- заболевания соединительной ткани;
- наличие эрекции после РПЭ.
Для оценки состояния кавернозной ткани проводилось ее морфологическое исследование на основании материала, полученного при выполнении фаллоэндопротезиро-вания. Материал фиксировали в 10% забуференном растворе формалина, затем заливали в парафин по обычной методике. Серийные парафиновые срезы толщиной 3 мкм де-парафинировали по стандартной схеме, затем окрашивали гематоксилином и эозином по Малори, применяли метод серебрения. В качестве первичных антител для иммуногистохимии использовали актин гладкомышечных клеток, коллагены I, III. Интенсивность реакций оценивали полуколичественным методом: (-/0) — отрицательная, (+/1)-слабая, (++/2)- средняя, (+++/3)-интенсивная. Статистический анализ проводили при помощи программы STATISTICA 6.0 с вычислением среднего отклонения, коэффициента корреляции Пирсона и критерия Стьюдента.
Оценка выраженности степени фиброзных изменений проводилась полуколичественным методом: 1 балл — минимальные фиброзные изменения, 2 балла — умеренные фиброзные изменения, 3 балла -выраженные фиброзные изменения.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате проведенного исследования обнаружено, что на светооптическом уровне во всех наблюдениях фиброзные изменения кавернозной ткани полового члена носили неравномерный характер. Так, в основной группе больных в большинстве случаев (83,0%) фиброзные изменения расценены как минимальные, проявляющиеся в виде небольших прослоек ретикулиновых и тонких коллагеновых волокон с обильным переплетением мышечных волокон (рис. 1, рис. 2). Фиброзные изменения умеренного и выраженного характера обнаружены в 11,3% и 3,7% случаев, соответственно. Напротив, по мере увеличения сроков протезирования после РПЭ отмечалось нарастание фиброзной массы и заметное уменьшение мышечных волокон. При этом была выявлена прямая корреляционная зависимость между выраженностью фиброзных изменений и сроком протезирования после РПЭ (r=0,80 p=0,0001) (рис. 1, рис. 3). Статистически значимой корреляционной зависимости выраженности фиброзных изменений от возраста пациента выявлено не было (р>0,05) (табл. 1).
Таблица 1. Выраженность фиброзных изменений (ФИ) в разных возрастных группах после РПЭ
| Минимальные ФИ | Умеренные ФИ | Выраженные ФИ | |
|---|---|---|---|
| >50 лет | 5 | 100,00% | 2 |
| 51-60 лет | 12 | 9 | 16 |
| 61-70 лет | 30 | 5 | 16 |
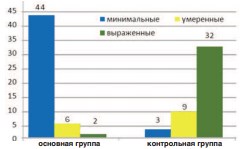
Рис.1. Выраженность фиброзных изменений в основной и контрольной группах
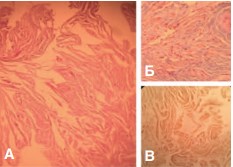
Рис.2. Основная группа, кавернозная ткань. А — коллагеновые и мышечные волокна, Окр.: гематоксилин-эозн, ув. х200; Б — Тонкие прослойки коллагеновых волокон. Окр.: по Малори, ув. х400; В — ИГХ, гладкомышечный актив в мышечных волокнах, ув. х400
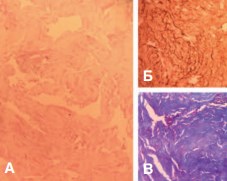
Рис.3. Контрольная группа, кавернозная ткань. А — коллагеновые волокна, Окр.: гематоксилин- эозн, ув. х200; Б — ИГХ, коллаген I типа, ув. х400; В — Коллагеновые волокона. Окр.: по Малори, ув. х400
При иммуногистохимическом изучении фибриллярных коллагенов кавернозной ткани были обнаружены различия, связанные с изменением, как количественного, так и качественного состава коллагенового матрикса в зависимости от степени выраженности фиброзных изменений. Так, при минимальной степени изменений отмечалось усиление экспрессии коллагена III типа (+++), а при выраженной степени — ее снижение. Так же, по мере нарастания склеротических изменений заметно накапливался коллаген I типа, который более характерен для необратимых изменений (рис.4).
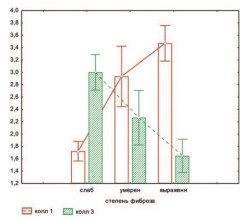
Рис.4. Зависимость количества содержания коллагена I и III типа от степени фиброзных изменений
Очевидно, что в ранние сроки после РПЭ (до 4 мес.) фиброзные изменения кавернозной ткани минимальны и представлены ретикулярными волокнами и коллагеном III типа, в дальнейшем происходит увеличение объема и площади фиброзных изменений и замещение обратимого коллагена III типа на необратимый коллаген I типа, что подтверждается статистически: отмечена обратная зависимость между коллагенами I и III типов (r=-0,49 p=0,0012), ) и коллагеном III типа и степенью фиброзных изменений (r=-0,58 p=0,0001), а также прямая зависимость между коллагеном I типа и степенью фиброзных изменений (r=0,75 p<0,05).
ВЫВОДЫ
Учитывая прогрессивное нарастание фиброзных изменений в кавернозной ткани полового члена после РПЭ и увеличение содержания необратимого коллагена I типа, мы считаем, что при отсутствии эрекции после радикальной простатэктомии протезирование полового члена целесообразно выполнять в срок 3-4 месяца после РПЭ.
ЛИТЕРАТУРА
1. Bratu O, Oprea I, Marcu D. Erectile dysfunction post-radical prostatectomy — a challenge for both patient and physician. JMed Life 2017; 10(1):13-8.
2. Велиев Е.И., Ванин А.Ф., Котов С.В., Шишло В.К. Современные аспекты патофизиологии и профилактики эректильной дисфункции и кавернозного фиброза после радикальной простатэктомии. Урология 2009; (2):46-51.
3. Ciancio SJ, Kim ED. Penile fibrotic changes after radical retropubic prostatectomy. BJUInt 2000.85(1):101-6. DOI: 10.1046/j.1464-410x.2000.00364.x
4. User HM, Hairston JH, Zelner DJ. Penile weight and cell subtype specific changes in a post-radical prostatectomy model of erectile dysfunction. J Urol 2003 Mar. 169(3):Р 1175-79. DOI: 10.1097/01.ju.0000048974.47461.50
5. Пушкарь Д.Ю., Раднаев Л.Г., Прилепская Е.А. Состояние оргазмической функции после радикальной простатэктомии. Онкоурология 2011; (1):45-50.
6. Saleh A, Abboudi H, Ghazal-Aswad MB. Management of erectile dysfunction postradical prostatectomy. Res Rep Urol 2015. 7: 19-33. DOI: 10.2147/RRU.S58974
7. Юдовский С.О., Пушкарь Д.Ю. Коррекция эректильной дисфункции у пациентов, перенесших радикальную простатэктомию. Урология 2014; (2): 66-71.
8. Матвеев В.Б., Гриднева Я.В. Хирургическая реабилитация больных с эректильной дисфункцией после радикальных простатэктомий и цистэктомий. Онкоурология 2010; (4): 65-70.
9. Мягков Ю.А., Мельник К.П. Восстановительное хирургическое лечение эректильной дисфункции у больных после радикальной простатэктомии. Медицинский вестник МВД 2016; 5(84): 52-4.
10. Capogrosso P, Salonia A, Briganti A, Montorsi F. Postprostatectomy Erectile Dysfunction: A Review. World J Mens Health 2016. 34(2):73-88. DOI: 10.5534/wjmh.2016.34.2.73
11. Montague DK. Penile prosthesis implantation for end-stage erectile dysfunction after radical prostatectomy. Rev Urol 2005.7 (2):51-7.
12. Salonia A, Burnett AL, Graefen M, Hatzimouratidis K . Prevention and management of postprostatectomy sexual dysfunctions part 2: recovery and preservation of erectile function, sexual desire, and orgasmic function. Eur Urol 2012.62(2):273-86. DOI: 10.1016/j.eururo.2012.04.047.
13. Menard J, Tremeaux JC, Faix A, Pierrevelcin J, Staerman F. Erectile function and sexual satisfaction before and after penile prosthesis implantation in radical prostatectomy patients: a comparison with patients with vasculogenic erectile dysfunction. J Sex Med 2011; 8(12):3479-86. DOI: 10.1111/j.1743-6109.2011.02466.x.
14. Choi HM, Choi HK, Lee HY. Urinary Incontinence Could Be Controlled by an Inflatable Penile Prosthesis. World J Mens Health 2016;34(1):34-9.
DOI: 10.5534/wjmh.2016.34.1.34
15. Martmez-Salamanca JI, La Fuente JM, Fernandez A . Nitrergic function is lost but endothelial function is preserved in the corpus cavernosum and penile resistance arteries of men after radical prostatectomy. J Sex Med 2015;12(3):590-99. DOI: 10.1111/jsm.12801
16. Megas G, Papadopoulos G, Stathouros G, Moschonas D, Gkialas I, Ntoumas K. Comparison of efficacy and satisfaction profile, between penile prosthesis implantation and oral PDE5 inhibitor tadalafil therapy, in men with nerve-sparing radical prostatectomy erectile dysfunction. BJU Int 2013; 112(2):169-76. DOI: 10.1111/j.1464-410X.2012.11561.x
17. Hatzimouratidis K, Burnett AL, Hatzichristou D, McCullough AR, Montorsi F, Mul-hall JP. Phosphodiesterase type 5 inhibitors in postprostatectomy erectile dysfunction: a critical analysis of the basic science rationale and clinical application. Eur Urol 2009; 55:334-47. DOI: 10.1016/j.eururo.2008.10.028
18. Hu WL, Hu LQ, Song J et al. Fibrosis of corpus cavernosum in animals following cavernous nerve ablation. Asian J Androl 2004; 6(2):111-6.
19. Kovanecz I, Rambhatla A, Ferrini MG . Chronic daily tadalafil prevents the corporal fibrosis and veno-occlusive dysfunction that occurs after cavernosal nerve resection. BJU Int 2008; 101(2):203-10. DOI: 10.1111/j.1464-410X.2007.07223.x
20. Sirad F, Hlaing S, Kovanecz I, Artaza JN . Sildenafil promotes smooth muscle preservation and ameliorates fibrosis through modulation of extracellular matrix and tissue growth factor gene expression after bilateral cavernosal nerve resection in the rat. J Sex Med 2011. Apr.; 8(4):1048-60. DOI: 10.1111/j.1743-6109.2010.02195.x
21. Iacono F, Prezioso D, Somma P . Histopathologically proven prevention of post-prostatectomy cavernosal fibrosis with sildenafil. Urol Int 2008; 80(3): 249-52. DOI: 10.1159/000127335
22. Martinez-Salamanca JI, Espinos EL, Moncada I, Portillo LD, Carballido J. Management of end-stage erectile dysfunction and stress urinary incontinence after radical prostatectomy by simultaneous dual implantation using a single trans-scrotal incision: surgical technique and outcomes. Asian J Androl 2015; 17(5): 792-96. DOI: 10.4103/1008-682X.143757
23. Kim JK, Cho MC, Ku JH, Paick JS. Preperitoneal placement of an inflatable penile prosthesis reservoir for postoperative erectile dysfunction after radical cystoprostatec-tomy with orthotopic neobladder. Investig Clin Urol 2016; 57(5): 364-66. DOI: 10.4111/icu.2016.57.5.364
24. Cho MC, Park K, Chai JS et al. Involvement of sphingosine-1-phosphate/RhoA/ Rho-kinase signaling pathway in corporal fibrosis following cavernous nerve injury in male rats. J Sex Med 2011; 8(3): 712-21. DOI: 10.1016/j.juro.2011.02.709







