Актуальность диагностики и лечения варикозного расширения вен малого таза продолжает оставаться высокой. В последние годы отмечается усиление интереса к феномену расширенных вен мочеполового венозного сплетения как флебологов, так и урологов [1,2]. На основании эпидемиологических исследований доказано, что заболеваемость вен малого таза имеют тенденцию к росту [3]. Частота встречаемости указанной патологии колеблется от 6 до 15%. В развитых странах от 15 до 40% взрослого населения имеют заболевания венозной системы. В России различными формами варикозной болезни (ВБ) страдают более 30 млн человек, при этом у женщин частота ВБ достигает 40%, у мужчин – 20% [3]. К настоящему моменту накоплены знания по анатомическим предпосылкам развития варикозной болезни вен малого таза (ВБМТ)(прямохождение человека, и сложившееся в связи этим строение системы вен таза в виде сплетения), изменения образа жизни, в том числе гиподинамия [4].
Г.З. Инасаридзе выделил 2 типа строения мочеполового венозного сплетения: сетевидный и концентрированный (магистральный) [5]. Н.В. Куренной описывает 3 типа строения мочеполового венозного сплетения: сетевидный, концентрированный (магистральный) и переходный [6]. Рядом автором значительная роль в развитии ВБ отводится комплексу генетически обусловленных факторов, что косвенно подтверждается увеличением частоты варикоза как в целом в стране, так и у больных с дисплазией соединительной ткани [4,7]. Знаменательным является тот факт, что в 2013 году Российская ассоциация флебологов впервые включила в клинические рекомендации раздел о варикозной болезни малого таза (ВБМТ) у женщин в связи с большей ее изученностью [8].
Впервые гипотеза о роли венозного полнокровия в развитии различных заболеваний органов малого таза была высказана еще в 1869 г. E. Posner [9]. Однако данная гипотеза основывалась на знаниях о патофизиологическом значении венозной гиперемии, заключающейся в гипоксии органов малого таза, микротромбообразовании, разрушении эндотелия с последующей миграцией лейкоцитов через венозную стенку, повреждении тканей [9].
Указанная роль ВБМТ в развитии различных патологических процессов основывается либо на общих патофизиологических закономерностях, либо на основе клинических исследований, носящих наблюдательный характер. Таким образом, если с точки зрения констатации факта отрицательного влияния ВБМТ, (в целом, на развитие патологических процессов (таких как воспаление, гипоксия, тромбообразование, дистрофия) существует единое мнение, то в части определения степени этого влияния и оценки эффективности различных методов лечебного воздействия на ВБ представляется необходимым изучение этой проблемы в условиях хронического эксперимента.
В доступной литературе нами найдены единичные публикации, касающиеся моделирования венозного полнокровия в хроническом эксперименте. Так, в базе данных PubMed по запросамpelvic varicose model, varicose model найдены единичные работы, в которых представлены данные о венозном полнокровии малого таза у самок, а упоминаний об использовании мужских особей в качестве лабораторных животных не найдено. Задача осложнялась еще и тем, что млекопитающие не страдают варикозом, как таковым.
Необходимо отметить, что известна роль прогестерона в развитии варикозного расширения вен, включая вены малого таза, у женщин [10-12]. В связи с тем, что биохимическая структура рецепторов у женщин и мужчин в клетках одинакова, чувствительность к прогестерону также одинакова. Поэтому представляется логичным, что воздействие данного гормона на стенку вен в мужском организме фактически останется тем же. С этих позиций для создания стойкого венозного полнокровия у кроликов-самцов нами и был использован именно этот гормон.
Целью работы явилось создание модели стойкого венозного полнокровия малого таза в хроническом эксперименте у животных мужского пола.
МАТЕРИАЛЫ И МЕТОДЫ
Моделирование хронического венозного полнокровия малого таза было осуществлено на 28 половозрелых кроликах самцах породы«Серый великан», с начальной массой от 2,6 до 3,2 кг. Животных содержали в отдельном помещении в клетках с металлической решеткой с основой из дерева в условиях регулируемого искусственного освещения, температура воздуха составляла в среднем 25°С, кролики получали полнорационный брикетированный комбикорм и питьевую фильтрованную воду без ограничений. Условия содержания животных и порядок работы с ними строго соответствовали законодательству Российской Федерации, положениям «Европейской конвенции о защите позвоночных животных, используемых для экспериментальных и других научных целей», требованиям и рекомендациям «Руководства по содержанию и использованию лабораторных животных».
Животные были рандомизированы в три группы. Первая группа (n=4) – группа контроля: животные не являлись объектом воздействия и выполняли функцию предоставления материала с нормальной анатомией. Вторая группа (n=12) – производили моделирование венозного полнокровия в малом тазу по разработанному способу. Третья группа (n=12) – животным производили лишь пересечение срединной крестцовой вены, без введения прогестерона.
Способ моделирования венозного полнокровия в малом тазу заключался в следующем: кроликов фиксировали в положении на спине с разведенными конечностями. После обработки операционного поля первомуром под комбинированным обезболиванием (премедикация – атропин 0,1% подкожно, кетамин 50 мг/кг внутримышечно) выполняли срединную лапаротомию. Мобилизовали сигмовидную и проксимальный отдел прямой кишки до уровня входа в малый таз. Выделяли и пересекали между двумя лигатурами срединную крестцовую вену (v.sacralis mediana)(рис. 1). Рану брюшной стенки ушивали послойно. В послеоперационном периоде внутримышечно вводили 1 мл гентамицина вне зависимости отмассы животного в течение 7 суток, дополнительно парентерально вводили 0,2 мл 1% раствора прогестерона в сутки в течение 30-ти суток, начиная за сутки до пересечения v. sacralis mediana. Все манипуляции проводили с соблюдением правил асептики и антисептики. Описанная методика запатентована авторами в России [13].
Вывод из эксперимента животных группы контроля производили через 30 дней с момента начала эксперимента. Вывод животных второй и третьей групп осуществляли следующим образом. В каждой группе животные были разделенына три подгруппы соответственно срокам вывода (А, B, C) (n=4), которые были выведены из эксперимента через 30, 90 и 180 дней с момента начала эксперимента в соответствии с рекомендациями IACUC посредством введения кетамина по 50 мг/кг внутримышечно с последующим смещением шейных позвонков.
Всем животным до начала эксперимента и при выводе из него были проведены дуплексное сканирование вен малого таза (фиксировали диаметр вен малого таза, регистрировали индуцированный путем мануальной компрессии брюшной полости рефлюкс крови (значимым считали рефлюкс более 1 сек)). После вывода животного из эксперимента проводили полную аутопсию, вводили рентген-контрастное вещество «Урографин» 76% во внутреннюю подвздошную вену с последующим проведением флебографии подвздошных сосудов в прямой проекции.
При обработке цифровых значений использованы непараметрические критерии. Анализ проводили с применением программы Statistica 10.0.
РЕЗУЛЬТАТЫ
В первой группе (контроль) получены следующие результаты: средняя ширина срединной подвздошной вены составила 5,1 мм, левой общей подвздошной и правой общей подвздошной 3,0 мм. Вены парапростатического сплетения – 1,5 мм (рис. 2А). При ультразвуковом исследовании (УЗИ) рефлюкс не регистрировался, вены малого таза не визуализировались.
Во второй группе (основная) подгруппы А через 30 дней после начала эксперимента регистрировали расширенные вены парапростатического сплетения (рис. 2В), расширенные вены малого таза, наличие значимого венозного рефлюкса. Через 90 и 180 дней (подгруппы В и С соответственно) полученный эффект сохранялся (рис. 3А,В). Результаты исследований приведены в таблице 1. Так, с момента формирования стойкого расширения по данным УЗИ диаметр вен не изменился с 30-е по 180-е сутки и составил 3,8-3,93 мм (Χ2 =3,0 р=0,2231), что более, чем в два раза превышает нормальные значения для этого животного.
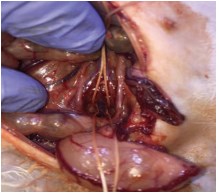
Рис. 1. Этап операции. Срединная крестцовая вена выделена и взята на держалки
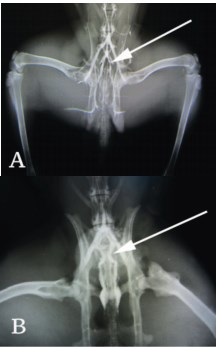
Рис. 2. Флебограмма малого таза, 30 дней после начала эксперимента. А. Группа 1, вены парапростатического сплетения не расширены, визуализируется срединная крестцовая вена. В. Группа 2, парапростатические вены расширены, диаметр сравним с диаметром общих подвздошных вен. Вены указаны стрелками
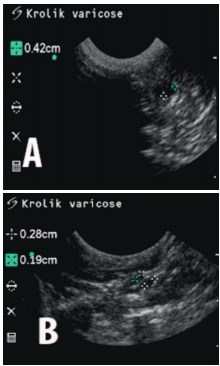
Рис. 3. Ультразвуковые сканограммы вен малого таза, 90 суток после начала эксперимента. А. Группа 2, вены таза расширены до 0,42см; В. Группа 3, расширение вен малого таза до 0,28 см
При флебографии во второй группе отмечено стабильное стойкое увеличение диаметра вен с 1,5 до 4,0- 4,1 мм на протяжении всего эксперимента (Χ2 =13,0 р=0,046). В то время, как в третьей группе (сравнения) при сопоставимом (относительно второй группы) увеличении диаметра парапростатических вен к 30-м суткам (до 3,90 и 3,83 мм соответственно, при р=0,513) к концу эксперимента отмечено значительное уменьшение диаметра вен практически до исходных значений: с 1,5 мм до 3,9 – 2,7 – 1,77 мм (в динамике:Χ2 =7,64 р=0,0542, р=0,0463). Разница в диаметрах парапростатических вен между второй и третьей группами на 90 и 180 сутки была статистически значимой (р=0,0495 и р=0,0463 соответственно). В третьей группе через 30 дней после начала эксперимента при выполнении контрольных исследований регистрировали изменения в целом соответствующие таковым во второй группе, отмеченные в аналогичный период наблюдения. Однако через 90 дней диаметр вен парапростатического сплетения и вен малого таза уменьшился значительно: с 3,70 до 2,73 мм, при Χ2 =6,0 р=0,0143 (рис. 3). Также отсутствовал и венозный рефлюкс. На 180- е сутки от начала эксперимента у животных этой группы полностью компенсировался внутритазовый венозный кровоток, диаметр вен соответствовал норме (табл. 1).
Таблица 1. Сравнительные измерения диаметра парапростатических вен в динамике по группам
| Показатель | Интактные животные | 30 дней | 90 дней | 180 дней | p | ||||
|---|---|---|---|---|---|---|---|---|---|
| 1 группа | 2 группа | 3 группа | 2 группа | 3 группа | 2 группа | 3 группа | 2 группа | 3 группа | |
| Флебография (диаметр парапростатических вен, мм) | 1,53 | 3,83 | 3,90 | 4,17 | 2,70 | 4,10 | 1,77 | Χ2= 13,0 р=0,046 | Χ2= 7,64 р=0,0542 |
| Уровень р при сравнении между группами | – | 0,513 | 0,0495 | 0,0463 | – | – | |||
| УЗ-исследование (рефлюкс, да/нет) | нет | да | да | да | нет | да | нет | – | – |
| Доплерография, (диаметр парапростатических вен, мм) | Не визуалириозованы | 3,80 | 3,70 | 3,93 | 2,73 | 3,93 | Не визуалириозованы | Χ2= 3,0 р=0,2231 | Χ2= 6,0 р=0,0143 |
| Уровень р при сравнении между группами | – | 0,383 | 0,050 | – | – | ||||
ОБСУЖДЕНИЕ
Как было указано ранее, данных о проведении эксперимента, аналогично авторскому, позволившего создать стойкую варикозную болезнь вен малого таза на достаточно большом отрезке времени вообще и у самцов в частности, в доступной литературе найдено не было.Указания на моделирование венозного полнокровия ограничивались острым экспериментом или же сроками сохранения венозного полнокровия до 1 месяца [9].
Созданная модель венозного полнокровия в эксперименте обеспечивает стойкую структурно закрепленную варикозную трансформацию вен малого таза [16]. При этом изолированное создание препятствия кровотоку не приводило к искомому результату. Внутритазовый венозный кровоток компенсировался полностью. Формирование стойкого венозного полнокровия стало возможным благодаря токсическому воздействию прогестерона на венозную стенку в момент перестройки венозной системы малого таза. Важно подчеркнуть, что введение прогестерона осуществляли только в первый месяц после созданной хирургическим путем регионарной флебогипертензии. Такое воздействие лишь в ближайшем послеоперационном периоде оказалось достаточным для формирования и сохранения варикоза малого таза на всем протяжении эксперимента без тенденции к уменьшению последнего.
ЗАКЛЮЧЕНИЕ
Предлагаемая модель может быть использована для изучения в хроническом эксперименте патофизиологических эффектов регионарного венозного полнокровия на возникновение и течение патологических процессов в органах и тканях малого таза, в частности у мужских особей, а так же для изучения эффективности потенциальных лечебных воздействий как на сам варикоз малого таза, так и патологические процессы, протекающие на его фоне.
ЛИТЕРАТУРА
- Капто А.А., Жуков О.Б. Варикозная болезнь малого таза у мужчин (обзор литературы). Андрология и генитальная хирургия 2016;17(2): 10-19.
- Цуканов Ю.Т., Цуканов А.Ю., Левданский Е.Г. Поражение тазовых органов при вторичном варикозном расширении вен малого таза. Ангиология и сосудистая хирургия 2015;21(2): 94-100.
- Хоменко Н.Е., Восканян Ю.Э., Гаспарян С.А. Варикозная болезнь вен малого таза: этиология, патогенез, диагностика, лечение. Акушерство и гинекология 2006;(6):8-10
- Гаврилов, С.Г., Бутенко О.И., Черкашин М.А., Варикозная болезнь вен малого таза: современное состояние проблемы. Анналы хирургии 2003;(1):7–12
- Инасаридзе Г.З. Крайние типы изменчивости мочеполового венозного сплетения и их клиническое значение: дис.… д-ра мед. наук; 1940.
- Куренной Н.В., Особенности строения мочеполового венозного сплетения: автореф. дис. … канд. мед. наук; Киев, 1967. 18 с.
- Цуканов Ю.Т., Цуканов А.Ю. Дисплазия соединительной ткани как морфофункциональная основа формирования флебопатии и варикозной болезни. Регионарное кровообращение и микроциркуляция 2002;1(3 (5)): 44-47.
- Бокерия Л.А., Затевахин И.И., Кириенко А.И., Андрияшкин А.В., Андрияшкин В.В., Арутюнов Г.П. и др. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений. Флебология 2013;(4,выпуск 2):1-52
- Тиктинский О.Л., Михайличенко В.В., Андрология СПб.: Медиа Пресс;1999. 431 с.
- Зароченцева Н.В., Титченко Л.И., Титченко Ю.П., Меньшикова Н.С., Кашина Е.С. Применение Флебодиа 600 у пациенток с варикозным расширением вен малого таза и синдромом тазовых болей. Российский вестник акушера-гинеколога 2011;(3):61-64.
- Цуканов Ю.Т., Цуканов А.Ю., Баженов В.Н., Корниенко И.Ф., Василевич В.В. Медикаментозная коррекция негативных флеботропных эффектов гормонозаместительной терапии у женщин. Ангиология и сосудистая хирургия 2009;15(3):87-91.
- Ramelet AA, Boisseau MR, Allegra C. Veno-active drugs in the management of chronic venous disease. An international consensus statement: current medical position, prospective views and final resolution. ClinHemorheolMicrocirc 2005; 33(4): 309 - 319.
- Цуканов Ю.Т., Цуканов А.Ю., Рудченко Н.В., Ахметов Д.С., Алябушев С.Ф., Васильева А.В. Способ создания стойкого венозного полнокровия в малом тазу у лабораторных животных. Патент РФ № 2612832, 13.03.2017







