ВВЕДЕНИЕ
Рак мочевого пузыря является вторым по частоте онкоурологическим заболеванием в мире, насчитывающим ежегодно более полумиллиона новых случаев [1]. В структуре онкологической заболеваемости населения России рак мочевого пузыря занимает 9-е место среди мужчин и 16-е – среди женщин [2]. Основой лечения мышечно-инвазивного рака мочевого пузыря является радикальная цистэктомия с различными вариантами отведения мочи. Традиционно радикальная цистэктомия рекомендуется пациентам с мышечно-инвазивным раком мочевого пузыря T2-T4a, N0-Nx, M0 [3]. Часто цистэктомия входит в объем комбинированных операций при местно-распространенных опухолях малого таза (рак прямой кишки, злокачественные новообразования яичников, матки и влагалища, рак предстательной железы, неорганные опухоли малого таза) [4]. Цистэктомия также выполняется и пациентам с неопухолевыми заболеваниями органов малого таза. Одной из наиболее сложных категорий составляют пациентки с лучевыми пузырно-влагалищными свищами [4]. По мнению О.Б. Лорана и соавт., не оставляя попыток восстановить произвольное мочеиспускание естественным путем, особенно у молодых, трудоспособного возраста женщин, страдающих лучевыми пузырно-влагалищными свищами, необходимо помнить о том, что возможности современной реконструктивно-пластической хирургии не безграничны [5]. К сожалению, у ряда пациенток этой группы восстановить мочеиспускание естественным путем не представляется возможным [5]. Так Э.Г. Семирджанянц и соавт. из 48 пациенток с лучевыми пузырновлагалищными свищами 11 выполнили цистэктомию, уретероилеокутанеостомию [6].
МАТЕРИАЛЫ И МЕТОДЫ
После удаления мочевого пузыря встает вопрос о способе отведения мочи [4]. Очевидно, что качество жизни таких пациентов напрямую зависит от способов отведения мочи [7, 8]. Ортотопическое замещение мочевого пузыря является на сегодняшний день стандартной операцией как у мужчин, так и у женщин [9]. Улучшение хирургической техники, понимание анатомии малого таза и механизма удержания мочи позволило добиться у женщин превосходных функциональных результатов ортотопической цистопластики, практически сравнимых с результатами у мужчин [10]. Континентные формы гетеротопического отведения мочи также дают возможность пациентам чувствовать себя более уверенно, позволяют сохранять психологический комфорт, и самооценку [10]. Несмотря на то, что методики формирования гетеротопических мочевых резервуаров сложны, сопровождаются большим количеством послеоперационных осложнений и не всегда удовлетворительным функциональным результатом [10, 11], хирурги, на регулярной основе выполняющие данные операции, считают их оптимальной альтернативой ортотопическому замещению мочевого пузыря [12]. Но выбор метода отведения мочи основывается на показаниях и противопоказаниях к конкретной методике, пожеланиях пациента, его соматическом статусе и индивидуальных анатомических особенностях, а также функции почек [10]. Континентные формы деривации мочи имеют абсолютные и относительные противопоказания (табл. 1) [13].
Таблица 1. Абсолютные и относительные противопоказания к континентной гетеротопической и ортотопической деривации мочи [13]
Table 1. Absolute and relative contraindications to continental heterotopic and orthotopic urine diversion [13]
| Абсолютные противопоказания Absolute contraindications |
Относительные противопоказания Relative contraindications |
|---|---|
| Нарушение функции почек Impaired renal function | Сопутствующие коморбидные состояния Associated comorbid conditions |
| Нарушение функции печени Liver dysfunction | Пожилой возраст Elderly age |
| Физические или психические нарушения, препятствующие самокатетеризации Physical or mental disorders that prevent self-catheterization |
Необходимость проведения адъювантной химиотерапии Need for adjuvant chemotherapy |
| Позитивный край резекции уретры (для ортотопической деривации мочи) Positive margin of urethral resection (for orthotopic urine diversion) |
Предшествовавшее облучение органов малого таза Previous irradiation of the pelvic organs |
| Немотивированный пациент Unmotivated patient | Заболевания кишечника Bowel disease |
| Патология уретры Urethral pathology | |
| Обширное местное распространение заболевания и высокий риск местного рецидива Widespread local spread of disease and high risk of local recurrence |
L. Seiffert впервые описал методику уретероилеокутанеостомии в 1935 году [14]. В последующем эта техника широко применялась и была популяризирована E.M. Bricker [15]. Эта процедура привела к более низкой заболеваемости пиелонефритом и гиперхлоремическим ацидозом, чем любой другой метод отведения мочи используемый до 1950 года [16]. Хотя в литературе описано достаточно большое количество вариантов инконтинентного отведения мочи с использованием различных кишечных сегментов (тощая, поперечная ободочная, сигмовидная ободочная кишка, илеоцекальный сегмент), илеумкондуит по Bricker остается наиболее распространенной методикой [10]. Недавно R. Colombo и соавт. подтвердили, что илеумкондуит по Bricker являются подходящим хирургическим решением вопроса деривации мочи для большинства пациентов после радикальной цистэктомии [17]. По мнению J.P. Richie и A.V. D’Amico илеумкондуит по Bricker до сих пор остается наиболее используемой формой инконтинентного отведения мочи в США [10].
Техника формирования илеумкондуита по Bricker основана на использовании короткого изолированного сегмента подвздошной кишки, который анастомозируется с обоими мочеточниками и является «проводником» мочи до инконтинентной уростомы [15]. При этом левый мочеточник проводится под брыжейкой сигмовидной ободочной кишки для анастомозирования с кондуитом [15]. Большой проблемой, с которой сталкиваются урологи при формировании илеумкондуита по Bricker, является левый мочеточниково-подвздошный анастомоз [18]. Хирурги часто заботятся об уровне резекции мочеточников для достижения негативного края резекции при выполнении радикальной цистэктомии, в то время как необходимо иметь левый мочеточник достаточной длины для его проведения под брыжейкой сигмовидной ободочной кишки и анастомозирования с илеумкондуитом на правой стороне [18]. Частота карциномы in situ в дистальном отделе мочеточника во время радикальной цистэктомии по данным срочного гистологического исследования составляет 8,5 – 33% случаев, что требует увеличения объема резекции мочеточников [19–22]. При выполнении цистэктомии у пациенток с осложнениями лучевой терапии мочеточники также необходимо пересекать над входом в полость малого таза, чтобы избежать использования поврежденных мочеточников при формировании анастомозов с кондуитом [23]. Недостаточная длина левого мочеточника может приводить к формированию левого подвздошно-мочеточникового анастомоза с натяжением, что в свою очередь повышает риск несостоятельности анастомоза и формирования стриктуры в отдаленном периоде [17, 18, 24]. По данным Y. Li и соавт. у 10% пациентов после формирования илеумкондуита по Bricker развиваются осложнения со стороны анастомозов, наиболее часто – левого подвздошно-мочеточникового анастомоза [25].
Y. Li и соавт. модифицировали стандартную методику формирования илеумкондуита по Bricker, чтобы свести к минимуму осложнения, связанные с левым подвздошно-мочеточниковым анастомозом. В их модификации проксимальный конец подвздошного кондуита проводили с правой стороны на левую сторону под брыжейкой сигмовидной ободочной кишки в изоперистальтическом направлении. После этого левый мочеточник, оставшийся в естественном экстраперитонеальном положении, анастомозировали с подвздошным кондуитом по типу «конец-в-бок» без необходимости обширной диссекции мочеточника. 42 пациента, оперированные по данной методике, не имели ранних и отдаленных осложнений со стороны обоих подвздошно-мочеточниковых анастомозов. Авторы считают, что их модифицированная методика формирования илеумкондуита по Bricker проста и безопасна для выполнения и может служить альтернативой стандартной методике, особенно когда требуется обширная резекция левого мочеточника в связи с его вовлечением в опухолевый процесс [25]. Чтобы избежать натяжения левого подвздошно-мочеточникового анастомоза в результате перистальтики подвздошной кишки, A.F. Kotb усовершенствовал методику операции, добавив еще два этапа: фиксация пересеченного кондуита к левой поясничной мышце и фиксация мочеточника на 1 см выше анастомоза к стенке подвздошного кондуита [18].
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
В 2019 г. в клинику обратилась пациентка Х., 41 года с диагнозом: «Рак шейки матки IIВ ст. Сочетанная лучевая терапии в 2000 г. Рецидивный пузырно-влагалищный свищ. Микроцистис. Единственная левая почка. хроническая болезнь почек (ХБП) 3а». Учитывая наличие одной почки, ХБП 3а, от выполнения фистулопластики и аугментационной илеоцистопластики решено воздержаться, а для профилактики формирования перегиба левого мочеточника под брыжейкой сигмовидной ободочной кишки и осложнений со стороны подвздошно-мочеточникового анастомоза мы решили выполнить операцию Bricker в модификации Li-Kotb. Пациентке выполнена лапаротомия, передняя тазовая экзентерация, формирование илеумкондуита по Bricker в модификации Li-Kotb, тазовая оментопексия. Послеоперационный период у пациентки протекал без особенностей. Наружный мочеточниковый стент удален на 13 сутки после операции.
ОБСУЖДЕНИЕ
Планируя хирургическое лечение пациентки Х., мы рассматривали несколько вариантов суправезикального отведения мочи: уретерокутанеостома, илеумкондуит по Bricker и илеумкондуита по Bricker в модификации Li-Kotb. Цели хирургического лечения включали избавление пациентки от недержания мочи для улучшения качества жизни, а также сохранение функции почки. Мы отказались от попыток фистулопластики и выполнения аугментационной илеоцистопластики и склонились к суправезикальной инконтинентной деривации мочи, учитывая наличие единственной функционирующей почки, ХБП 3а и риск прогрессирования почечной недостаточности. Уретерокутеностомия как метод деривации мочи используется у пациентов соматическими заболеваниями, не позволяющими использовать кишечный сегмент для деривации мочи [9]. Основным недостатком уретерокутанеостомии является риск развития стеноза стомы (из-за меньшего диаметра мочеточника по сравнению с кишкой), что требует постановки наружных дренажей-интубаторов и ведет к увеличению частоты обострений пиелонефрита [9,10]. Учитывая данные недостатки метода, а также возможные трудности с регулярной заменой наружных дренажей-интубаторов, мы не рассматривали уретерокутанеостомию, как метод деривации мочи у нашей пациентки. Ввиду наличия единственной функционирующей левой почки у пациентки мы стремились обеспечить надежную деривацию мочи. Поэтому мы склонились к модифицированной методике формирования илеумкондуита по Bricker – методике Li – Kotb, а не классической технике.
После выполнения передней тазовой экзентерации по стандартной методике был сформирован илеумкондуит длиной до 30 см, проксимальный конец которого был проведен под брыжейкой сигмовидной ободочной кишки налево. После спатуляции конца мочеточника был выполнен мочеточниково-подвздошный анастомоз «бок-в-конец» аналогично методике Wallace. Согласно методике, описанной Kotb, мы фиксировали проксимальный конец илеумкондуита к поясничной мышце слева. Дополнительную фиксацию мочеточника на 1 см выше анастомоза к стенке подвздошного кондуита мы не выполняли (рис. 1,2). Кондуит был расположен Z-образно согласно методике, описанной Kotb. «Колено» кондуита было дополнительно фиксировано к подвздошной мышце справа.
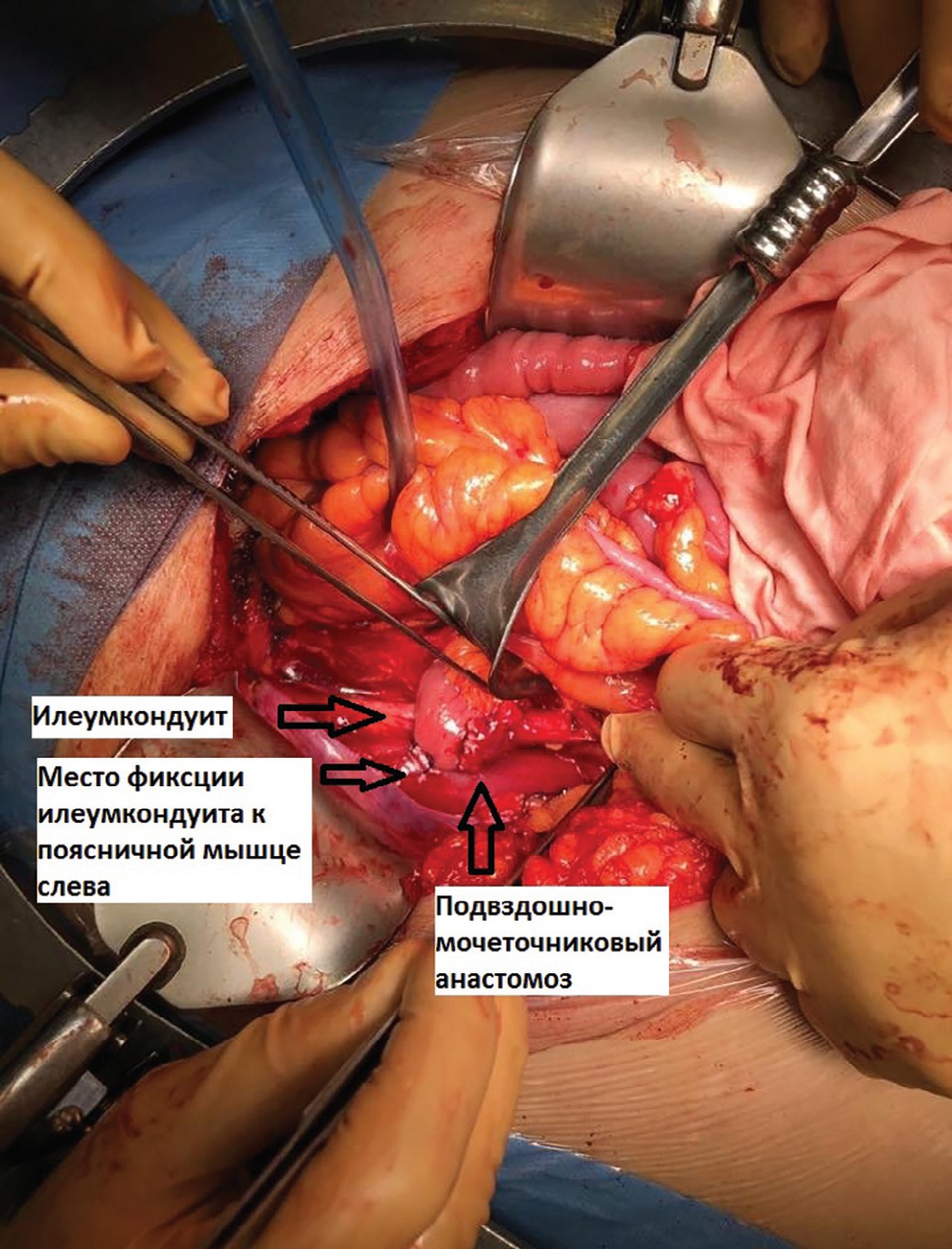
Рис. 1. Проксимальный конец илеумкондуита, проведенный под брыжейкой сигмовидной ободочной кишки и фиксированный отдельными швами к поясничной мышце, сформирован уретероилеоанастомоз
Fig. 1. The proximal end of the ileum conduit, held under the mesentery of the sigmoid colon and fixed with separate sutures to the psoas muscle, formed a ureteroileoanastomosis.
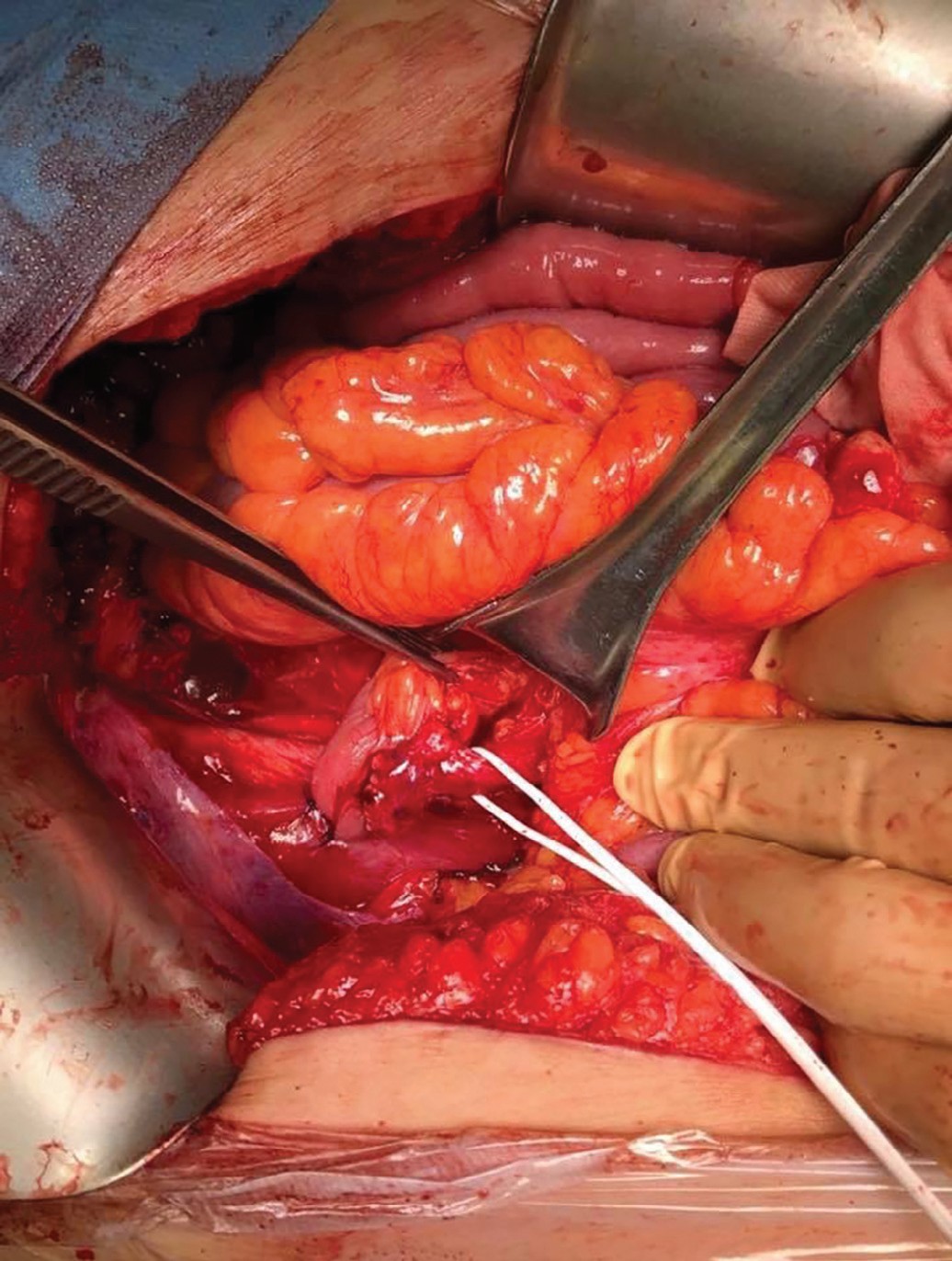
Рис. 2. Сформированный уретероилеоанастомоз. Мочеточник взят на держалку
Fig. 2. Formed ureteroileoanastomosis. The ureter is taken on a holder
Удаление тазовых органов при супралеваторной тазовой экзентерации приводит к образованию лишенного перитонеального покрова «мертвого» пространства [26–31]. Фиксация петель тонкого кишечника к стенкам таза может приводить к формированию спаечной кишечной непроходимости, тонкокишечных свищей, лимфоцеле и абсцессов таза, а также тазовых грыж. Частота таких осложнений повышается у пациенток, которым проводилась лучевая терапия по поводу первичного онкологического процесса или его рецидива до тазовой экзентерации. Ряд авторов данную группу осложнений называет «синдром пустого малого таза» (empty pelvis syndrome) [27–33]. Для профилактики синдрома пустого малого таза мы активно используем тазовую оментопексию. Техника операции состоит в мобилизации большого сальника от поперечной ободочной кишки и большой кривизны желудка, формировании сальникового лоскута на правых или левых желудочно-сальниковых сосудах, низведении и фиксации лоскута большого сальника в полости малого таза [32,34]. Сальниковый лоскут, низведенный в полость малого таза, заполняет «мертвое» пространство, покрывает стенки таза, предотвращает фиксацию петель тонкого кишечника. Кроме того, большой сальник улучшает репаративные процессы в полости малого таза, снижает риск лимфоцеле, гематом и абсцессов в полости малого таза [26, 27,32, 34–36]. У нашей пациентки мы сформировали лоскут большого сальника на основе правых желудочно-сальниковых сосудов и низвели его в полость малого таза вдоль правого латерального канала. При этом сальниковый лоскут был расположен между илеимкондуитом и брюшной стенкой, что является профилактикой попадания петель кишечника в это «окно» между кондуитом и брюшной стенкой.
Также стоит коснуться вопроса выбора кишечного сегмента для деривации мочи. Существует мнение, что отведение мочи в подвздошный кондуит противопоказано больным с облучением органов малого таза в анамнезе [37]. По мнению J.W. Jr. Orr и соавт. наиболее значимым фактором, ассоциированным с тонкокишечной непроходимостью после тазовой экзентерации, является наличие тонко-тонкокишечного анастомоза предварительно облученной кишки, который формируется в процессе создания подвздошного кондуита для отведения мочи. Авторы объясняют этот факт контактом «свежего» межкишечного анастомоза облученной кишки с облученными стенками малого таза и формированием вследствие этого плотных спаечных сращений и считают, что использование изолированного сегмента поперечной ободочной кишки для создания кондуита снижает риск возникновения послеоперационной кишечной непроходимости [38]. В тоже время S.S. Chang и соавт. пришли к выводу, что использование подвздошной кишки для отведения мочи у пациентов с облучением органов таза в анамнезе представляется технически осуществимым вариантом лечения и, что предшествующий анамнез облучения брюшной полости или таза не должен служить единственным определяющим фактором при выборе сегмента кишечника, используемого во время отведения мочи [39].
ВЫВОДЫ
Модифицированная техника формирования илеумкондуита по Bricker безопасна, воспроизводима, а также позволяет снизить риск несостоятельности и стриктуры левого подвздошно-мочеточникового анастомоза. В своей работе мы описали специфическую «нишу» для данной модифицированной методики, но она может быть использована онкоурологами при выполнении радикальной цистэктомии в стандартных ситуациях.
ЛИТЕРАТУРА
- Bray F., Ferlay J., Soerjomataram I. et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018;68(6):394–424. https://doi.org/10.3322/caac.21492.
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2017 году. Заболеваемость и смертность. Москва, 2018. [Kaprin A.D., Starinskiy V.V., Petrova G.V. Zlokachestvennyie novoobrazovaniya v Rossii v 2017 godu. Zabolevaemost i smertnost = Morbidity and mortality 2018. (In Russian)].
- EAU Guidelines Office, Arnhem, The Netherlands. http://uroweb.org/ guidelines/compilations-of-all-guidelines/
- Роман Л.Д., Васильев Л.А., Шестаев А.Ю. Выбор метода формирования уретероилеоанастомоза при деривации мочи по Бриккеру у пациентов пожилого и старческого возраста. Онкоурология. 2011;(4):42-46. [Roman L.D., Vasilev L.A., Shestaev A.Yu. Vyibor metoda formirovaniya ureteroileoanastomoza pri derivatsii mochi po Brikkeru u patsientov pozhilogo i starcheskogo vozrasta. Onkourologiya = Oncourology 2011;(4):42-46. (In Russian)].
- Лоран О.Б., Синякова Л.А., Гуспанов Р.И. Лучевые повреждения органов мочевой системы при онкогинекологических заболеваниях. – М.: Медицинское информационное агентство, 2019. – 120. [Loran O.B., Sinyakova L.A., Guspanov R.I. Luchevyie povrezhdeniya organov mochevoy sistemyi pri onkoginekologicheskih zabolevaniyah. – M.: Meditsinskoe informatsionnoe agentstvo 2019. – 120. (In Russian)].
- Семирджанянц Э.Г., Петровский A.B., Фанштейн И.А., Нечушкин М.И., Геворкян B.C., Автомонов Д.Е. Хирургическая реабилитация больных с постлучевыми везиковагинальными свищами при раке шейки матки. Онкоурология 2013;(4):66-70. [Semirdzhanyants E.G., Petrovskiy A.B., Fanshteyn I.A., Nechushkin M.I., Gevorkyan B.C., Avtomonov D.E. Hirurgicheskaya reabilitatsiya bolnyih s postluchevyimi vezikovaginalnyimi svischami pri rake sheyki matki. Onkourologiya = Oncourology 2013;(4):66-70. (In Russian)].
- Матвеев В.Б., Гриднева Я.В., Паяниди Ю.Г., Кислый Н.Д. Улучшение качества жизни больных после радикальных операций на органах малого таза. Медико-социальная экспертиза и реабилитация. 2011;(4):43-45. [Matveev V.B., Gridneva Ya.V., Payanidi Yu.G., Kislyiy N.D. Uluchshenie kachestva zhizni bolnyih posle radikalnyih operatsiy na organah malogo taza. Mediko-sotsialnaya ekspertiza i reabilitatsiya = Medical and social examination and rehabilitation 2011;(4):43-45. (In Russian)].
- Перепечай В.А. Оптимизация хирургического лечения мышечноинвазивного и местнораспространенного рака мочевого пузыря: Автореферат. дисс. … док. мед. наук. Ростов-на-Дону, 2016. [Perepechay V.A. Optimizatsiya hirurgicheskogo lecheniya myishechnoinvazivnogo i mestnorasprostranennogo raka mochevogo puzyirya: Avtoreferat. diss. … dok. med. nauk. Rostov-na-Donu 2016.(In Russian)].
- Рак мочевого пузыря (классика и новации). Под редакцией М.И. Когана. М., 2019. [Rak mochevogo puzyirya (klassika i novatsii). Pod redaktsiey M.I. Kogana. M., 2019. (In Russian)].
- Рич Д.П., Д’Амико Э.В. Онкоурология. М.: БИНОМ; 2011: 896 с. [Rich D.P., D’Amico E.V. Oncourology. M.:BINOM;2011:896 p. (In Russian)].
- Kalble T. Urinary diversion with continent umbilical stoma: Which techniques are suitable for which patients? Urologe A 2015; 54(9): 1240-1247.
- Al Hussein A. Awamlh B., Wang L.C., Nguyen D.P. et al. Is continent cutaneous urinary diversion a suitable alternative to orthotopic bladder substitute and ileal conduit after cystectomy? BJU Int 2015; 116(5): 805-814.
- Lee RK, Abol-Enein H, Artibani W, Bochner B, Dalbagni G, Daneshmand S, Fradet Y, Hautmann RE, Lee CT, Lerner SP, Pycha A, Sievert KD, Stenzl A, Thalmann G, Shariat SF. Urinary diversion after radical cystectomy for bladder cancer: options, patient selection, and outcomes. BJU Int 2014 Jan;113(1):11-23. https://doi.org/10.1111/bju.12121.
- Seiffert L. Die “Darm-siphonblase.” Arch Klin Chir 1935; 102:569–574
- Bricker EM. Bladder substitution after pelvic evisceration. Surg Clin North Am 1950 Oct;30(5):1511-21. PMID:14782163 https://doi.org/10.1016/ s0039-6109(16)33147-4
- Bricker EM. Current status of urinary diversion. Cancer 1980 Jun 15;45(12):2986- 91. PMID: 7388742 https://doi.org/10.1002/1097-0142(19800615)45:12<2986:: aid-cncr2820451217>3.0.co;2-5
- Colombo R, Naspro R. Ileal conduit as the standard for urinary diversion after radical cystectomy for bladder cancer. Eur Urol Suppl 2010;9(10):736–44.
- Kotb AF. Ileal conduit post radical cystectomy: modifications of the technique. Ecancermedicalscience 2013 Apr 4(7):301. https://doi.org/10.3332/ecancer.2013.301. Print 2013.
- Touma N, Izawa JI, Abdelhady M, Moussa M, Chin JL. Ureteral frozen sections at the time of radical cystectomy: reliability and clinical implications. Can Urol Assoc J 2010 Feb;4(1):28-32.
- Sharma TC, Melamed MR, Whitmore WF. Jr. Carcinoma in-situ of the ureter in patients with bladder carcinoma treated by cystectomy. Cancer 1970;26:583–7. [PubMed] [Google Scholar]
- Cooper PH, Waisman J, Johnston WH et al. Severe atypia of transitional epithelium and carcinoma of the urinary bladder. Cancer 1973;31:1055–60. [PubMed] [Google Scholar]
- Schade RO, Turingen, Serck-Hannson A et al. Morphological changes in the ureter in cases of bladder carcinoma. Cancer 1971;27:1267–72. [PubMed] [Google Scholar]
- Llueca A, Maazouzi Y, Ponce P, Serra A, Garau C, Rodrigo M. Step by step Indiana pouch construction in a previously irradiated patient with a cervical cancer relapse. Int J Surg Case Rep 2020;66:187-191. https://doi.org/10.1016/j.ijscr.2019.11.068. Epub 2019 Dec 9.
- Farnham S.B., Cookson M.S. Surgical complications of urinary diversion. World J Urol 22, 157–167 (2004). https://doi.org/10.1007/s00345-004-0429-5
- Li Y, Zhuang Q, Hu Z, Wang Z, Zhu H, Ye Z. A modified ureteroileal anastomosis technique for Bricker urinary diversion. Urology 2011 Nov;78(5):1191- 5. https://doi.org/10.1016/j.urology.2011.07.001. Epub 2011 Sep 3.
- Ильин К.А., Замятин А.В. Роль тазовой эвисцерации в лечении постлучевых рецидивов рака шейки матки на современном этапе (обзор литературы) Онкогинекология. 2013;(1):43–53. [Ilin K.A., Zamyatin A.V. Rol tazovoy evistseratsii v lechenii postluchevyih retsidivov raka sheyki matki na sovremennom etape (obzor literaturyi). Onkoginekologiya = Oncourology 2013;(1):43–53. (In Russian)].
- Шостка К.Г., Павленко А.Н., Роман Л.Д., Арутюнян К.В., Богородский Д.Ю., Ильин К.С. Технические аспекты и результаты выполнения эвисцераций малого таза при колоректальном рак. Онкология. Журнал им. П.А. Герцена. 2015;(2):41–45 [Shostka K.G., Pavlenko A.N., Roman L.D., Arutyunyan K.V., Bogorodskiy D.Yu., Ilin K.S. Tehnicheskie aspektyi i rezultatyi vyipolneniya evistseratsiy malogo taza pri kolorektalnom rake. Onkologiya. Zhurnal im. P.A. Gertsena = Oncology. Journal them. P.A. Herzen 2015;(2):41–45.(In Russian)].
- Ghosh P.S., Fawzi H. Empty pelvis syndrome. J Obstet Gynaecol 2004, Sep;24(6):714–5.
- Nicolae Bacalbasa, Alexandru Filipescu, Irina Balescu. Total pelvic exenteration as a potentially curative surgical procedure in locally advanced gynecologic malignancy. Gineco.eu J 2014;10(2):78-79. https://doi.org/10.18643/gieu.2014.78
- Nicolae Bacalbasa, Dana Tomescu, Irina Balescu. Use of Infl ated Foley Catheters to Prevent Early Empty Pelvis Complications Following Pelvic Exenteration. ANTICANCER RESEARCH, 2015,35:5543–5546
- Robert J. Schweitzer M.D. Reconstruction of pelvic floor after radical pelvic surgery. Cancer 1964;17(6)785-790; https://doi.org/10.1002/1097-0142(196406)17:6<785:: AID-CNCR2820170615>3.0.CO;2-0
- Laszlo Palfalvi. Reconstruction of the pelvic floor and management of the empty pelvis; correction of pelvic hernias. Nogyogyaszati Onkologia 1998,2:175–176
- Елисеев Д. Э., Алексеев Б. Я., Огай Д. С. Синдром пустого малого таза после тазовой экзентерации (обзор литературы) Онкогинекология 2016;4:64-74. [Eliseev D. E., Alekseev B. Ya., Ogay D. S. Empty pelvis syndrome after pelvic exenteration (overview). Onkoginekologiya 2016;4:64-74].
- Frasson M., Flor-Lorente B., Carreno O. Reconstruction techniques after extralevator abdominoperineal rectal excision or pelvic exenteration: meshes, plasties and fl aps. Cir Esp 2014 Mar;(92 Suppl)1:48–57.
- Косенко И.А., Матылевич О.П. Экзентерация таза у больных раком шейки матки: обзор литературы. Онкологический журнал; 4(8):82–89 [Kosenko I.A., Matyilevich O.P. Ekzenteratsiya taza u bolnyih rakom sheyki matki: obzor literaturyi. Onkologicheskiy zhurnal; 4(8):82–89.(In Russian)].
- Клиническая онкогинекология: в 3 т. / под ред. Ф.Дж. Дисаи, У.Т. Крисмана; пер. с англ. под ред. Е.Г. Новиковой. М.: ООО ≪Рид Элсивер≫, 2011;1:316. [Klinicheskaya onkoginekologiya: v 3 t. / pod red. F.Dzh. Disai, U.T. Krismana; per. s angl. pod red. E.G. Novikovoy. M.: OOO ≪Rid Elsiver≫2011;1:316 с. (In Russian)].
- Pycha A, Trenti E. High urinary diversion after irradiation to the lesser pelvis. Urologe A. 2020 Apr;59(4):416-425. https://doi.org/10.1007/s00120-020-01156-2.
- Orr J.W. Jr., Shingleton H.M., Hatch K.D., Taylor P.T., Partridge E.E., Soong S.J. Gastrointestinal complications associated with pelvic exenteration. Am J Obstet Gynecol 1983;145(3):325–32.
- Chang SS, Alberts GL, Smith JA Jr, Cookson MS. Ileal conduit urinary diversion in patients with previous history of abdominal/pelvic irradiation. World J Urol 2004 Oct;22(4):272-6. Epub 2004 Sep 21.







