ВВЕДЕНИЕ
Острое повреждение почек (ОПП) с развитием острой почечной недостаточности (ОПН) является частым (30- 50%) и жизненно опасным осложнением (летальность 28- 90%) у критически больных пациентов после обширных операций, с тяжелыми воспалительными заболеваниями, в том числе с сепсисом, лекарственными интоксикациями, сердечно-сосудистыми расстройствами [1]. Ранняя диагностика ОПН позволяет раньше начинать лечение, что улучшает прогноз заболевания. Традиционным методом оценки состояния почек у критически больных пациентов является определение уровня креатинина крови с последующим расчетом величины клубочковой фильтрации (КФ). ОПН диагностируется при снижении этого показателя более чем на 50% от нормы. Не менее важным фактором является оценка вероятности перехода ОПП в хроническую форму заболевания – хроническую болезнь почек (ХБП), которая может быть диагностирована при снижении уровня расчетной величины КФ ниже 60 мл/мин/1,73 м2 через 90 дней после развития ОПП [2, 3]. Определение скорости клубочковой фильтрации (СКФ) на основе уровня креатинина крови может давать ошибочные данные в связи с зависимостью уровня креатинина крови от мышечной массы человека и степени нарушения канальцевой реабсорбции, что особенно важно для ОПП токсической этиологии [4]. В связи с этим наряду с СКФ в последние годы изучается диагностическая значимость маркеров ОПП, в частности, цистатина С, липокалина (NGAL), молекулы повреждения почек 1 (KIM-1) и др. Проведенные исследования показывают, что определение маркеров острого повреждения почек позволяет диагностировать ОПН на более ранней стадии, чем при определении расчетной СКФ [5, 6].
Наиболее исследованным маркером в отношении прогнозирования ОПП является цистатин С, который является белком, продуцируемым всеми ядросодержащими клетками человеческого организма. Он относится к семейству ингибиторов цистеиновых протеаз – ферментов, способных расщеплять белковые субстанции, способствуя сохранению внеклеточного белкового матрикса. Скорость синтеза цистатина С в организме постоянна и практически не зависит от антропометрических параметров: пола, возраста, массы тела и мышечной массы. В связи с этим этот маркер можно использовать для определения уровня СКФ у детей и подростков с растущей мышечной массой и при нарушении канальцевой секреции из-за нефротоксического действия ряда фармакологических препаратов, что дает определенные преимущества перед использованием стандартного определения уровня креатинина крови и СКФ по клиренсу эндогенного креатинина [7].
Рядом исследователей выявлены определенные преимущества использования цистатина С в качестве маркера ОПП различной этиологии: более раннее выявление, более точное прогнозирование динамики патологического процесса и эффективности проводимой терапии [6, 8, 9], хотя отдельные авторы не подтвердили значимость его определения для выявления ОПП [10, 11]. При этом выявили одинаковую прогностическую значимость определения этого маркера в крови и моче [12]. Однако вопрос, можно ли с помощью этого маркера прогнозировать вероятность перехода ОПП в ХБП и может ли он служить критерием эффективности проводимой нефропротективной терапии, остается мало изученным [13]. Имеются лишь отдельные публикации по этим вопросам [3, 8, 14].
В связи с вышеизложенным, в данном исследовании мы изучили прогностическую значимость динамического определения цистатина С в модели острого ишемического повреждения почек разной степени выраженности у крыс в отношении направленности развития патологического процесса. Для оценки возможности определения риска развития ХБП вызывали ишемическое повреждение почек разной степени выраженности путем ишемии в течении 60 минут, вызывающей умеренные функциональные расстройства с минимальным риском развития ХБП, или в течение 90 минут, приводящей к значительным функциональным нарушениям, которые потенциально могут сохраниться в хроническом варианте. Для изучения возможности использования определения уровня цистатина С в крови в качестве критерия эффективности нефропротективной терапии, были проведены серии опытов с терапией крыс препаратом Целлекс, представляющим собой хроматографически выделенный белково-пептидный комплекс из головного мозга эмбрионов свиньи (то есть, секретом эмбриональных стволовых клеток), эффективность которого была доказана в предыдущих исследованиях, и без этой терапии [15]. Использование стволовых клеток и продуктов их секреции в настоящее время рассматривается как наиболее перспективный метод терапии ОПН различной этиологии и широко исследуется в эксперименте [16-19].
МАТЕРИАЛЫ И МЕТОДЫ
Опыты были проведены на 40 белых беспородных крысах-самцах массой 290-320 г. Ишемическое ОПП вызывали выполнением правосторонней нефрэктомии и пережатием сосудистой ножки левой почки микрососудистым зажимом на 60 или 90 минут с последующим восстановлением кровоснабжения в органе. Опыты были проведены в 4 сериях (по 10 крыс в каждой серии):
1-я серия – ишемия единственной почки в течение 60 минут;
2-я серия – ишемия единственной почки в течение 60 минут с терапией препаратом Целлекс;
3-я серия – ишемия в течение 90 минут;
4-я серия – ишемия в течение 90 минут с терапией препаратом Целлекс.
Терапию препаратом Целлекс проводили путем ежедневного его подкожного введения в дозе 0,1 мл/кг в течение 10 дней.
Обследование животных проводили через 3, 7 и 14 суток (для определения динамики показателей в острую фазу повреждения), а также через 3 месяца (для оценки отдаленных последствий ОПП). В указанные сроки животных помещали в обменные клетки для сбора суточной мочи и брали пробы крови из хвостовой вены. В пробах крови и мочи определяли концентрацию креатинина с последующим расчетом СКФ. Уровень цистатина С в крови определяли иммуноферментным методом помощью набора реактивов фирмы Rat Cystatin C ELISA фирмы «BioVendor» (Чехия).
Статистическую обработку цифровых данных проводили с помощью программ MS Exсel и Statistica 10.0. Для расчетов использовали среднегрупповые значения показателей и ошибку средней (М±m). Достоверность различий между группами определяли с помощью теста Стьюдента. Наличие корреляционных связей между сравниваемыми показателями выявляли с помощью критерия Пирсона. Достоверными признавались различия и корреляционные связи при p<0,05.
РЕЗУЛЬТАТЫ
Для оценки значимости цистатина С как маркера выраженности ОПП мы сопоставили степень нарушений основных функциональных показателей, вызванных ишемией единственной почки различной длительности с динамикой концентрации цистатина С в крови. Ишемия единственной почки в течение 60 или 90 минут приводила к функциональным нарушениям разной степени выраженности с более тяжелыми расстройствами после 90-минутной ишемии (табл. 1). В течение 14 суток наблюдения в обеих группах сохранялась полиурия и повышенный уровень креатинина крови при снижении СКФ с наибольшей выраженностью в первые 3 суток после ишемического повреждения почки и тенденцией к постепенному улучшению в дальнейшем, не достигая, однако, нормальных значений. Различия между опытами с 60- минутной и 90-минутной ишемией были наибольшими на ранних сроках после ишемического повреждения (табл. 1).
Таблица 1. Изменения функциональных показателей после ишемического повреждения различной длительности единственной почки
Table 1. Changes in functional parameters after kidney ischemic damage of different duration
| Показатель Parameters |
Норма Normal value |
Длительность ишемии Ischemic time (min) |
3 суток 3 days |
7 суток 7 days |
14 суток 14 days |
|---|---|---|---|---|---|
| Диурез (мл/сут.) Diuresis (ml/24 hrs) |
11,3±0,6 | 60 минут | 16,5±1,9* | 13,8±0,4* | 19,9±2,1** |
| 90 минут | 40,0±2,1*** | 23,8±1,9*** | 24,2±0,4*** | ||
| Креатинин крови (мкмоль/л) Blood creatinine (mcmol/l) |
60±2 | 60 минут | 92±1*** | 77±1* | 68±1* |
| 90 минут | 393±4*** | 103±2*** | 77±2** | ||
| Клубочковая фильтрация (мл/мин) Glomerular filtration rate (ml/min) |
1,44±0,07 | 60 минут | 0,71±0,04*** | 0,85±0,05** | 1,26±0,03* |
| 90 минут | 0,23±0,02*** | 0,94±0,04** | 1,22±0,03* |
Примечание: Достоверности различий по сравнению с нормой: * p<0,05, **p<0,01, ***p<0,001
Note: Significance of differences in comparison with the norm: *p <0.05, **p <0.01, ***p <0.001
Определение динамики уровня цистатина С в крови после ишемического повреждения почки показало, что более длительная ишемия почки наряду с более выраженными функциональными расстройствами приводит к более значительному увеличению концентрации этого маркера в крови и более длительному сохранению его повышенных значений (рис. 1).
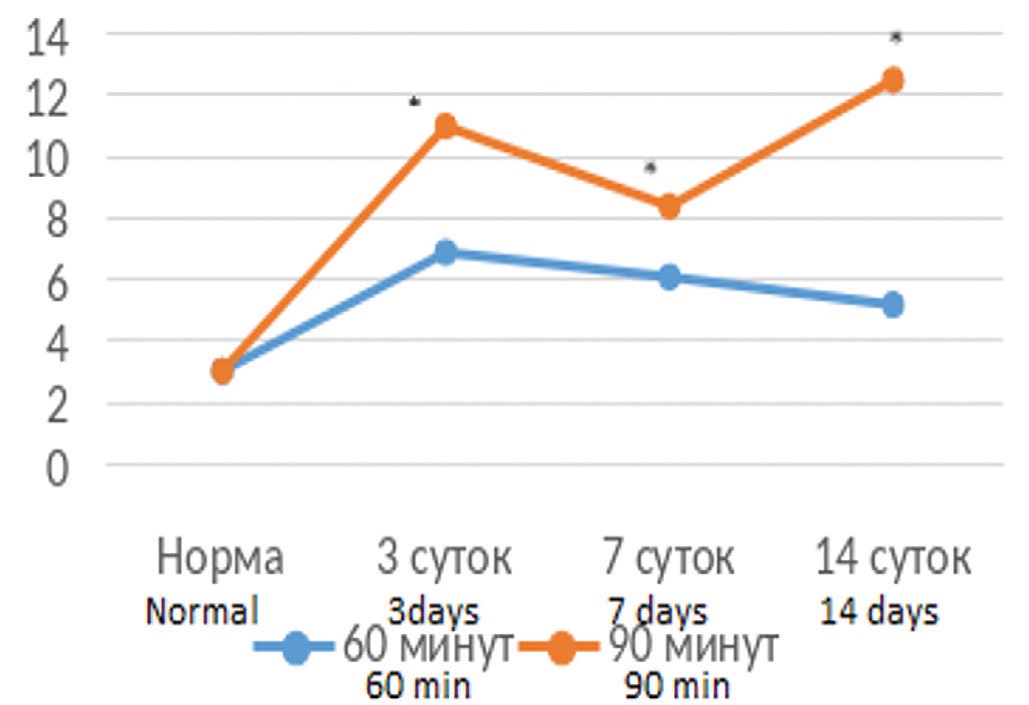
Рис. 1. Динамика концентрации цистатина С в крови (нг/мл) после 60 или 90 минут ишемии единственной почки
Fig. 1. Dynamic of blood Cystatin C concentration (ng/ml) after ischemia of single kidney duration for 60 or 90 minutes
При этом если в опытах с 60-минутной ишемией выявлялась тенденция к нормализации уровня цистатина С, то в опытах с 90-минутной ишемией почки уровень этого маркера стойко сохранялся на повышенных значениях.
Сопоставление динамики концентрации цистатина С в крови с основными функциональными показателями состояния почки при различной длительности ишемического воздействия показало, что в опытах с 60-минутной ишемией имеется четкая корреляция между изучаемыми показателями. Уровень цистатина С возрастал параллельно с ростом концентрации креатинина в крови и снижался при на фоне снижения уровня креатинина (рис. 2 А). В отношении СКФ выявили реципрокные взаимоотношения между этими показателями – на фоне снижения СКФ отмечался рост концентрации цистатина С в крови, а при улучшении фильтрационной функции почки концентрация маркера снижалась (рис. 2Б).
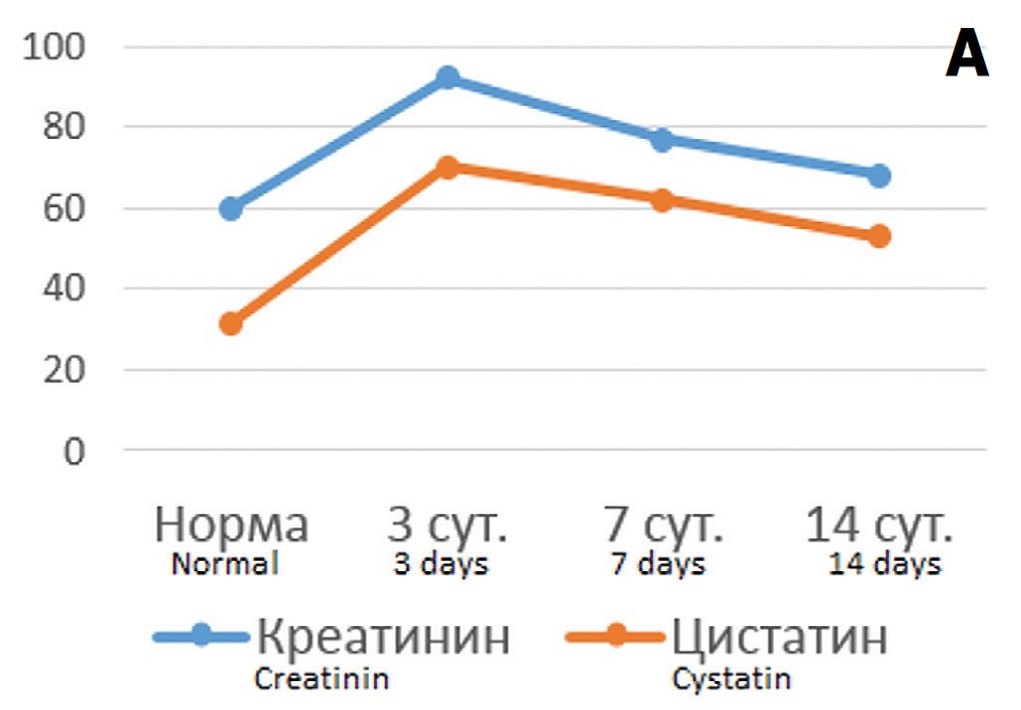
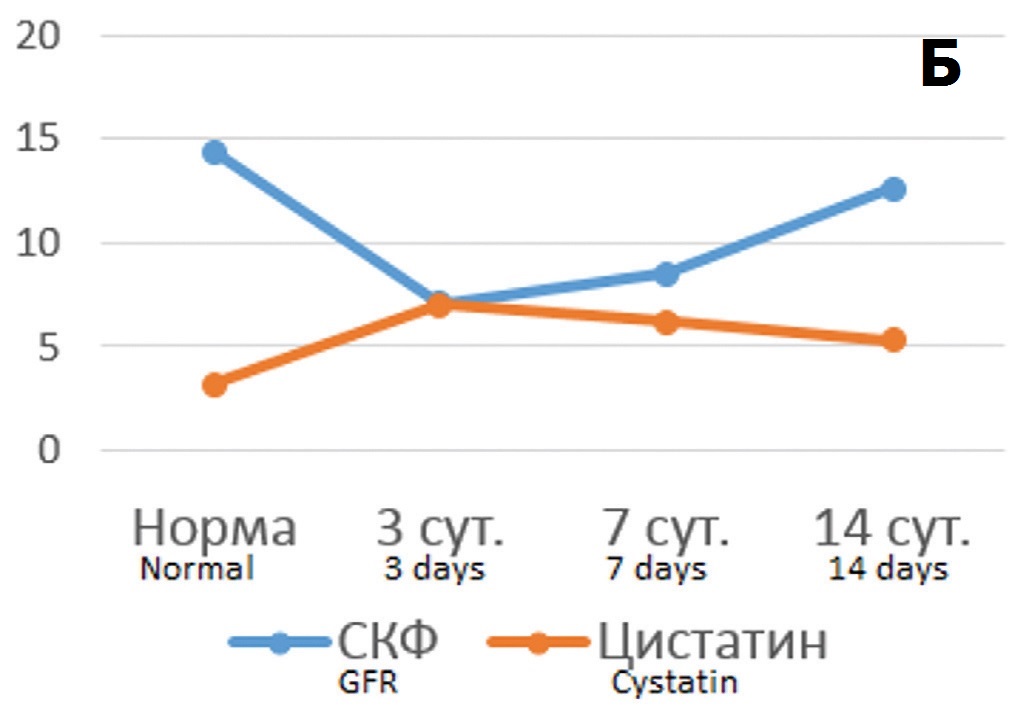
Рис. 2. Соотношение динамики концентрации цистатина С в крови с изменениями функциональных показателей состояния почки в разные сроки после 60-минутной ишемии. А – соотношение уровня цистатина С (для наглядности на графике показаны значения нг/мл умноженные на 10) с концентрацией креатинина крови (мкмоль/л); Б – соотношение уровня цистатина С (нг/мл) с уровнем СКФ (мл/мин умноженные на 10)
Fig. 2. The correlation of the dynamics of the cystatin C blood concentration with changes in the functional parameters of the kidney at different times after 60-minute ischemia. A – the ratio of the level of cystatin C (for clarity, the graph shows the values of ng / ml multiplied by 10) with the concentration of blood creatinine (mmol/l); B – the ratio of the level of cystatin C (ng/ml) with the level of glomerular filtration rate (ml/min multiplied by 10)
Анализ корреляционных связей между этими показателями выявил высоко достоверные зависимости – в отношении креатинина крови коэффициент корреляции Пирсона составил 0,941 (p<0,001), а в отношении СКФ – 0,926 (p<0,001). То есть при умеренной выраженности ишемического повреждения почки динамика цистатина С в крови адекватно отражает течение патологического процесса. В опытах с 90-минутной ишемией через 3 и 7 дней после ишемического воздействия выявлялись принципиально такие же отношения между уровнем цистатина С и функциональными показателями, как и после 60-минутной ишемии. Рост уровня креатинина сопровождался повышением концентрации маркера ОПП, а его снижение – уменьшением уровня маркера. В отношении СКФ наблюдались реципрокные взаимоотношения – при снижении фильтрационной функции на 3 сутки уровень цистатина С возрастал, а на фоне тенденции к ее нормализации на 7 сутки концентрация маркера в крови снижалась (рис. 3 А, Б). Однако на 14 сутки соотношение принципиально менялось: на фоне дальнейшего улучшения функциональных показателей происходил рост концентрации цистатина С. Соответственно, коэффициент корреляции Пирсона между сравниваемыми показателями оказался существенно ниже, чем в опытах с 60-минутной ишемией – для корреляции цистатин С/креатинин – 0,409, а для корреляции цистатин С/клубочковая фильтрация – 0,518, хотя и оставался в пределах статистической значимости (p<0,05). То есть при тяжелой степени повреждения почки цистатин С реально отражает выраженность ОПП только в ранние сроки постишемического периода (до 7 суток), тогда как в более позднем периоде его прогностическое значение меняется.
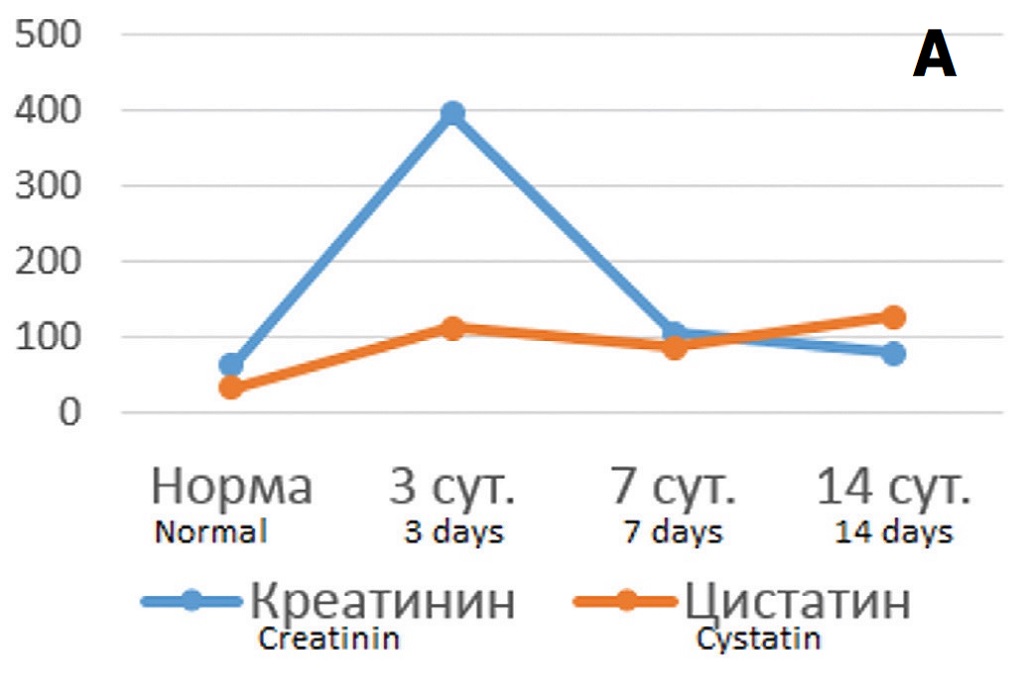
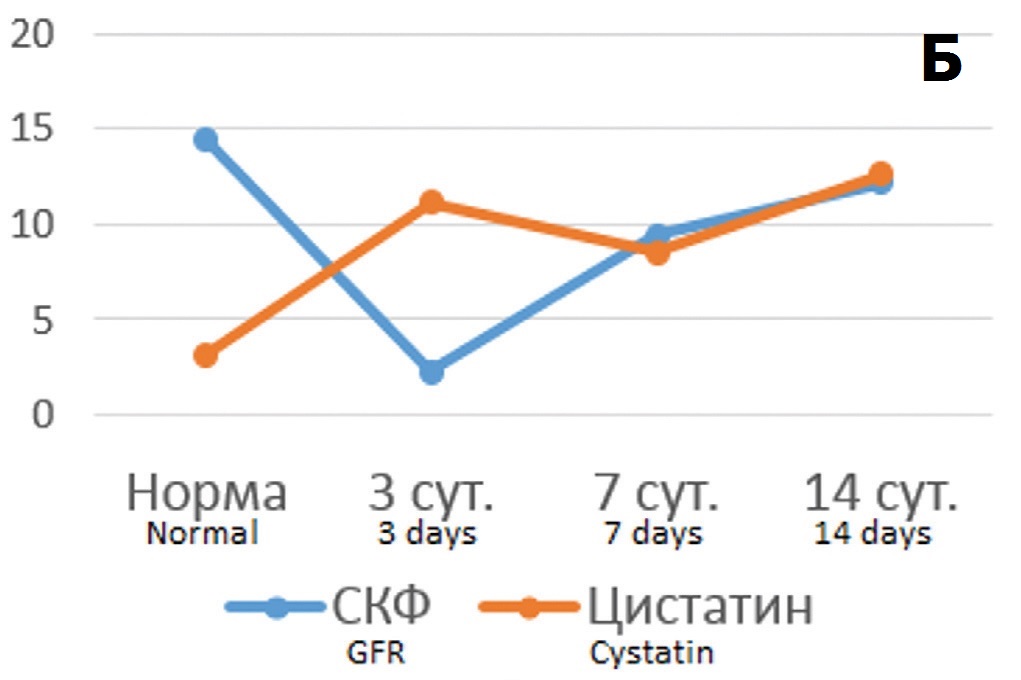
Рис. 3. Соотношение динамики концентрации цистатина С в крови с изменениями функциональных показателей состояния почки в разные сроки после 90-минутной ишемии. А – соотношение уровня цистатина С (для наглядности на графике показаны значения нг/мл умноженные на 10) с концентрацией креатинина крови (мкмоль/л); Б – соотношение уровня цистатина С (нг/мл) с СКФ (мл/мин умноженные на 10)
Fig. 3. The correlation of the dynamics of the cystatin C blood concentration with changes in the functional parameters of the kidney at different times after 90-minute ischemia. A – the ratio of the level of cystatin C (for clarity, the graph shows the values of ng / ml multiplied by 10) with the concentration of blood creatinine (mmol/l); Б – the ratio of the level of cystatin C (ng/ml) with the level of glomerular filtration (ml/min multiplied rate by 10)
Мы предположили, что такие взаимоотношения обусловлены изменением характера течения патологического процесса, а именно, переход ОПП в фазу ХБП. Для проверки этого предположения мы оценили функциональное состояние почек и уровень цистатина С в крови через 3 месяца после ишемического воздействия, то есть, после завершения острой фазы повреждения.
При сопоставлении этих показателей мы установили, что после 60-минутной ишемии все функциональные показатели нормализовались, тогда как после 90-минутной ишемии через 3 месяца средние значения уровня креатинина крови оказались выше нормы, а клубочковой фильтрации – ниже нормальных значений. В соответствии с этим концентрация цистатина С через 3 месяца после ишемического воздействия оставалась незначительно выше нормы, тогда как после 90- минутной ишемии она стойко сохранялась на высоких значениях (табл. 2).
Таблица 2. Показатели функционального состояния почки и уровень цистатина С в крови через 3 месяца после ишемии почки разной длительности
Table 2. Indicators of the functional state of the kidney and the blood level of cystatin C 3 months after kidney ischemia of different duration
| Длительность ишемии Ischemic time (min) |
Диурез (мл) Diuresis (ml) |
Креатинин (мкмоль/л) Creatinine (mcmol/l) |
Клубочковая фильтрация (мл/мин) Glomerular filtration rate (ml/min) |
Цистатин С (нг/мл) Cystatin C (ng/ml) |
|---|---|---|---|---|
| Норма Normal value |
11,5±0,4 | 60±2 | 1,44±0,09 | 3,15±0,24 |
| 60 минут 60 minutes |
12,7±0,5 | 65±2 | 1,42±0,03 | 4,12±0,33 |
| 90 минут 90 minutes |
20,1±1,6* | 70±2* | 1,26±0,03* | 11,54±0,51* |
Примечание: *различия статистически достоверны
Note: *the differences are statistically significant
При дальнейшем анализе мы оценили индивидуальные изменения изученных показателей для каждого животного в серии опытов с 90-минутной ишемией, поскольку только в этой серии отмечено сохранение функциональных расстройств в отдаленном периоде. Оказалось, что у всех 5 подопытных крыс сохранилась почечная дисфункция: полиурия, повышенный уровень креатинина крови и сниженная СКФ, что свидетельствовало о развитии ХБП. Уровень цистатина С в крови также оказался существенно повышенным у всех животных.
Таким образом, сохранение высокого уровня цистатина С в крови в течение 14 суток после действия повреждающего фактора может служить прогностическим признаком высокого риска перехода ОПП в ХБП.
Следующим этапом нашего исследования была оценка прогностической значимости цистатина С в отношении эффективности нефропротективной терапии при разной выраженности повреждения почки. В качестве метода такой терапии использовали лечение животных препаратом Целлекс, содержащим комплекс биологически активных белков и пептидов эмбриональных стволовых клеток (секретом), поскольку использование стволовых клеток или продуктов их секреции рассматривается в настоящее время как наиболее перспективный метод лечения ОПН.
Полученные результаты показали, что терапия подопытных крыс Целлексом способствовала улучшению ряда показателей, причем протективный эффект был более выражен в опытах с 90-минутной ишемией. Хотя динамика уровня креатинина крови в опытах с 60- минутной ишемией на фоне терапии Целлексом достоверно не отличалась от контрольных опытов (без терапии) (рис. 4А), тем не менее СКФ восстанавливалась более быстрым темпом, достигая нормальных значений к 14 суткам наблюдения (рис. 4Б). При этом терапия Целлексом в опытах с 60-минутной ишемией не оказывала существенного влияния на динамику цистатина С (рис. 4В).
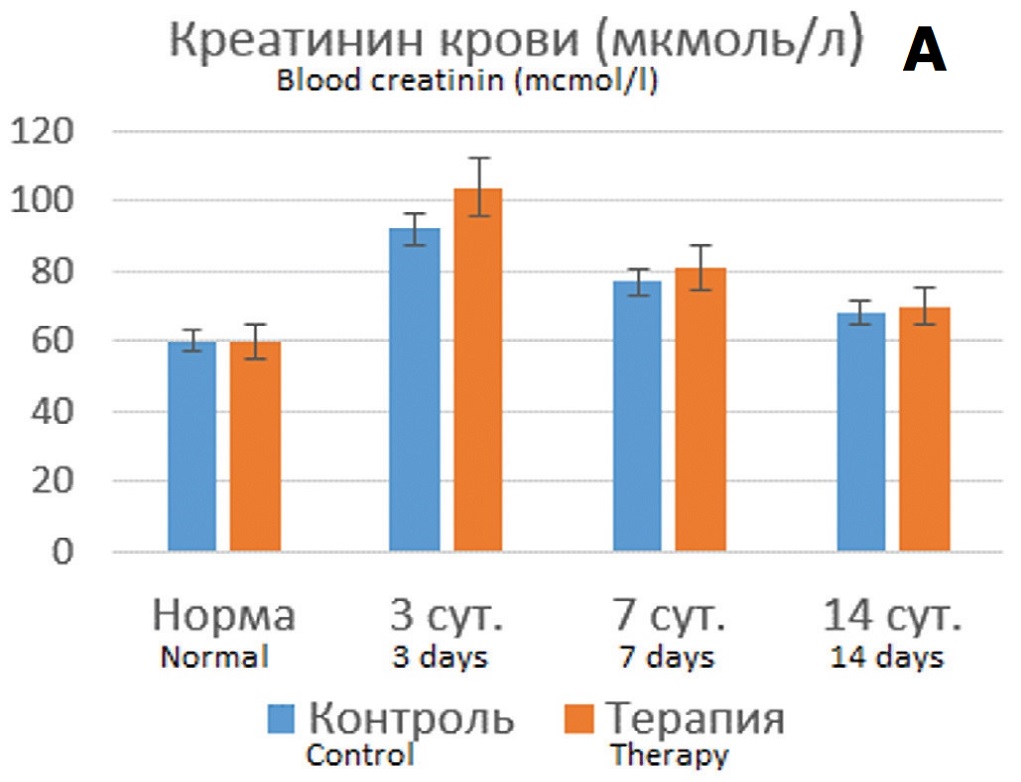
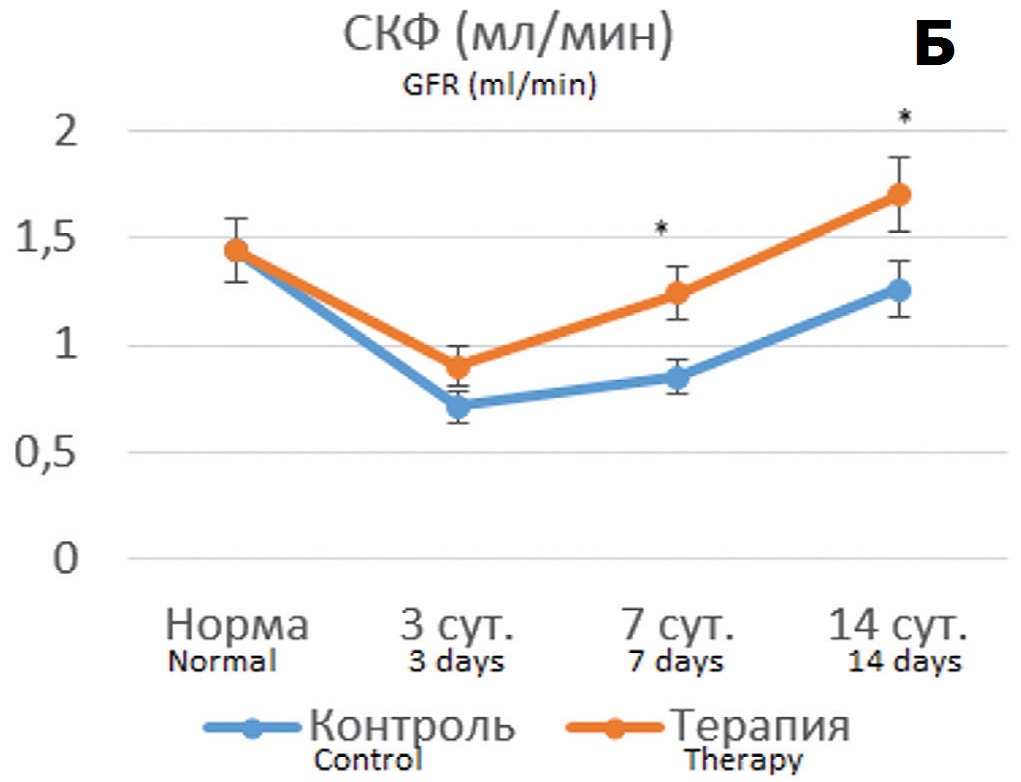
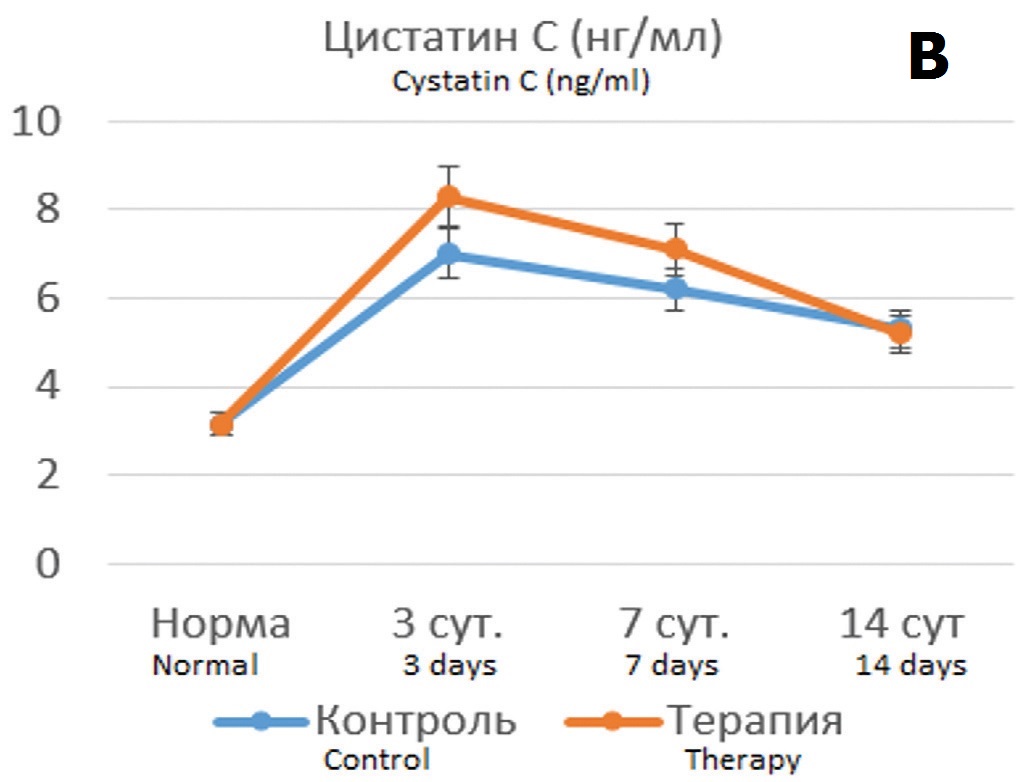
Рис. 4. Динамика показателей функции почки после 60-минутной ишемии без терапии и на фоне терапии Целлексом. А – уровень креатинина крови (мкмоль/л); Б – величина клубочковой фильтрации (мл/мин); В – концентрация цистатина С в крови (нг/мл). * - различия достоверны при p<0,05.
Fig. 4. Dynamics of kidney function indicators after 60-minute ischemia without therapy and during of Cellex therapy. A – the level of blood creatinine (mcmol/l); Б – the value of glomerular filtration rate (ml/min); В – the blood concentration of cystatin C (ng/ml). * - the differences are significant at p<0.05
В опытах с 90 минутной ишемией терапия Целлексом на 3 сутки после ишемического воздействия способствовала сохранению функциональных показателей на уровне субнормальных значений (рис. 5А, Б). При этом наблюдался значительно меньший рост цистатина С с постепенным его снижением, тогда как в контрольных опытах сохранялось 5-6 кратное превышение нормальных значений (рис. 5В).
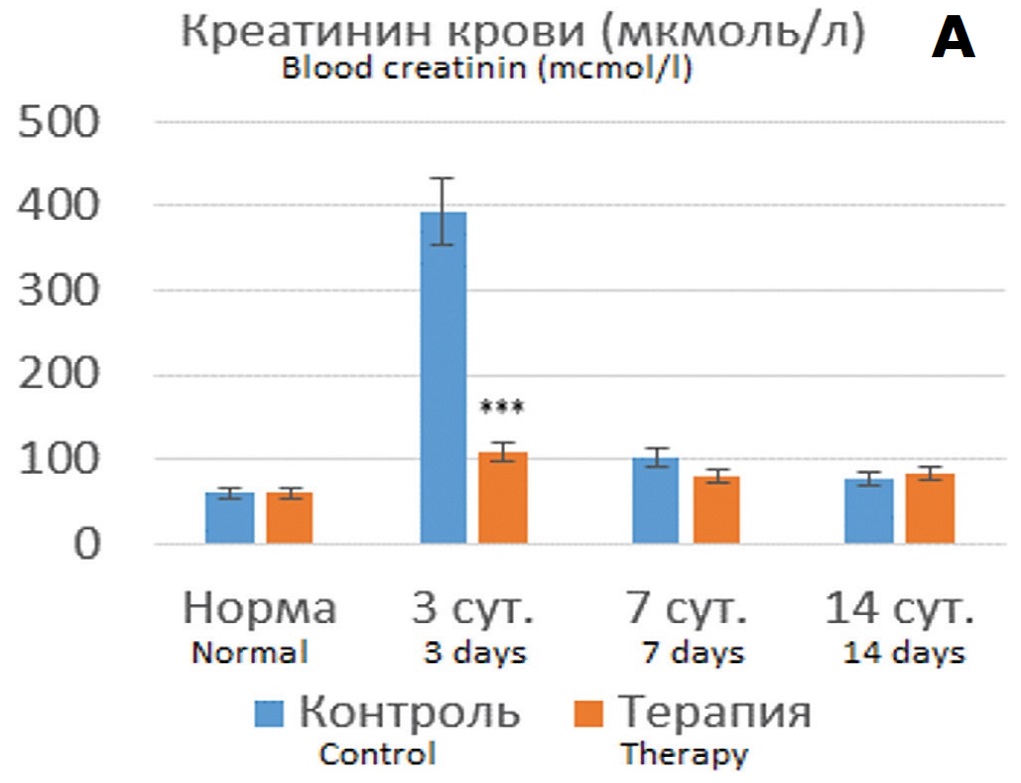
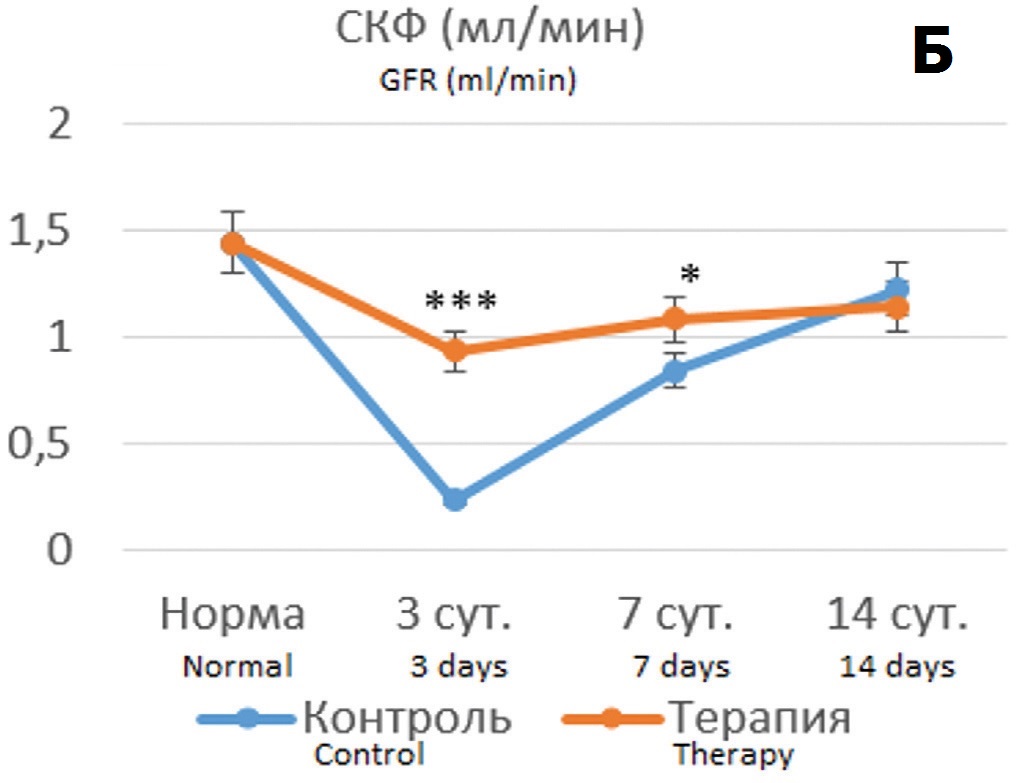
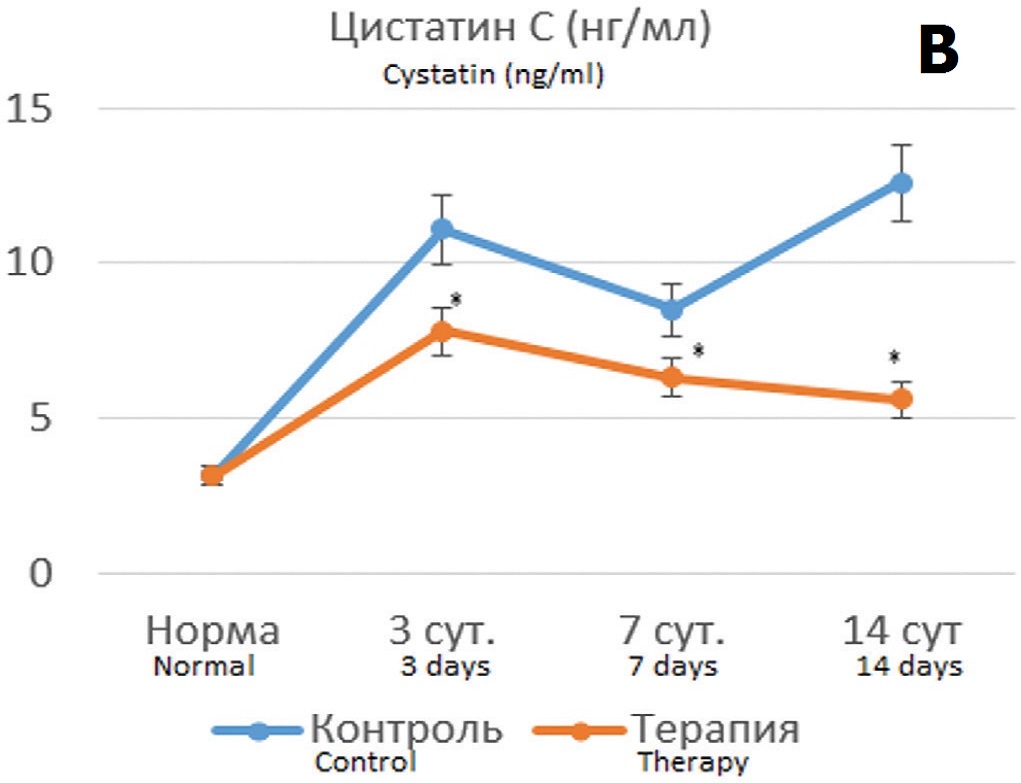
Рис. 5. Динамика показателей функции почки после 90-минутной ишемии без терапии и на фоне терапии Целлексом. А – уровень креатинина крови (мкмоль/л); Б – скорость клубочковой фильтрации (мл/мин); В – концентрация цистатина С в крови (нг/мл). *различия по сравнению с контролем статистически достоверны при p<0,05, ***p<0,001
Fig.5. Dynamics of kidney function indicators after 90-minute ischemia without therapy and during of Cellex therapy. A – the level of blood creatinine (mcmol/l); Б – the value of glomerular filtration rate (ml/min); В – the blood concentration of cystatin C (ng/ml). *the differences are significant at p<0.05, ***p<0,001
Определении корреляционных связей цистатина С с показателями функции почки в условиях терапии Целлексом и без терапии выявило, что в условиях нефропротективной терапии прогностическая значимость динамики цистатина С в отношении направленности патологического процесса при 60-минутной ишемии оказалась такой же, как и без терапии, тогда как в опытах с 90-минутной ишемией она оказалась существенно выше, чем в опытах без терапии. При обоих сроках ишемии на всех этапах наблюдения сохранялись параллельные изменений цистатина С и креатинина и реципрокные взаимоотношения между цистатином С и клубочковой фильтрацией, в том числе и через 14 дней после ишемии, чего не наблюдалось в опытах без терапии Целлексом (рис. 6).
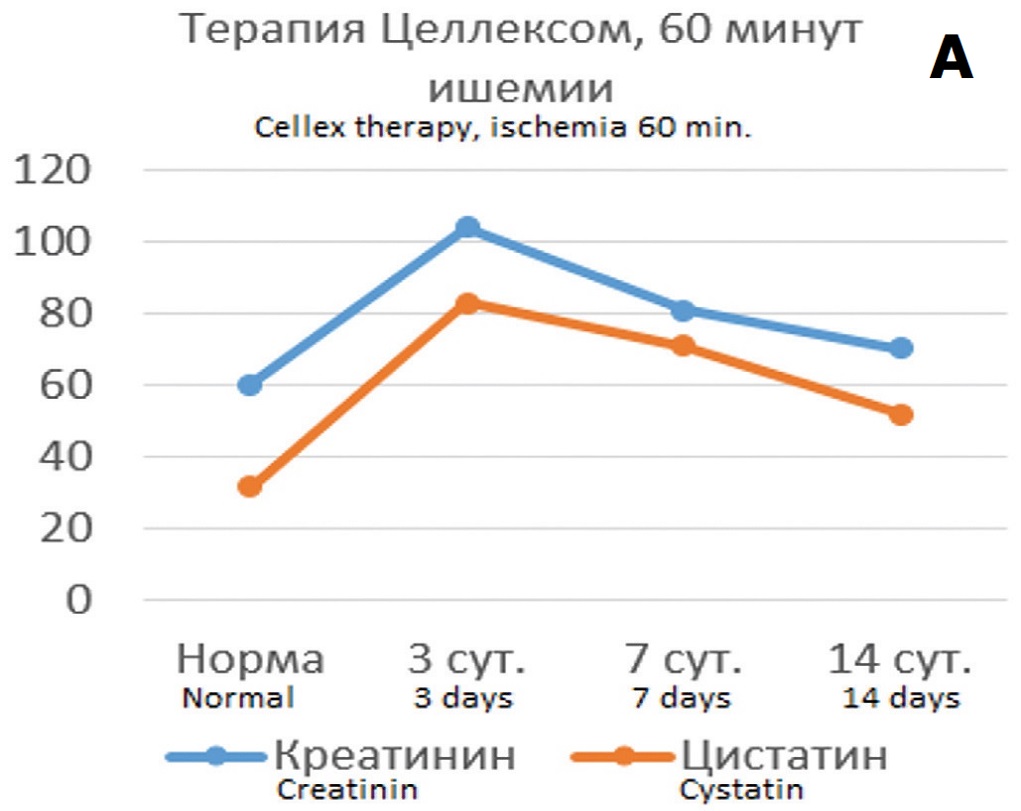
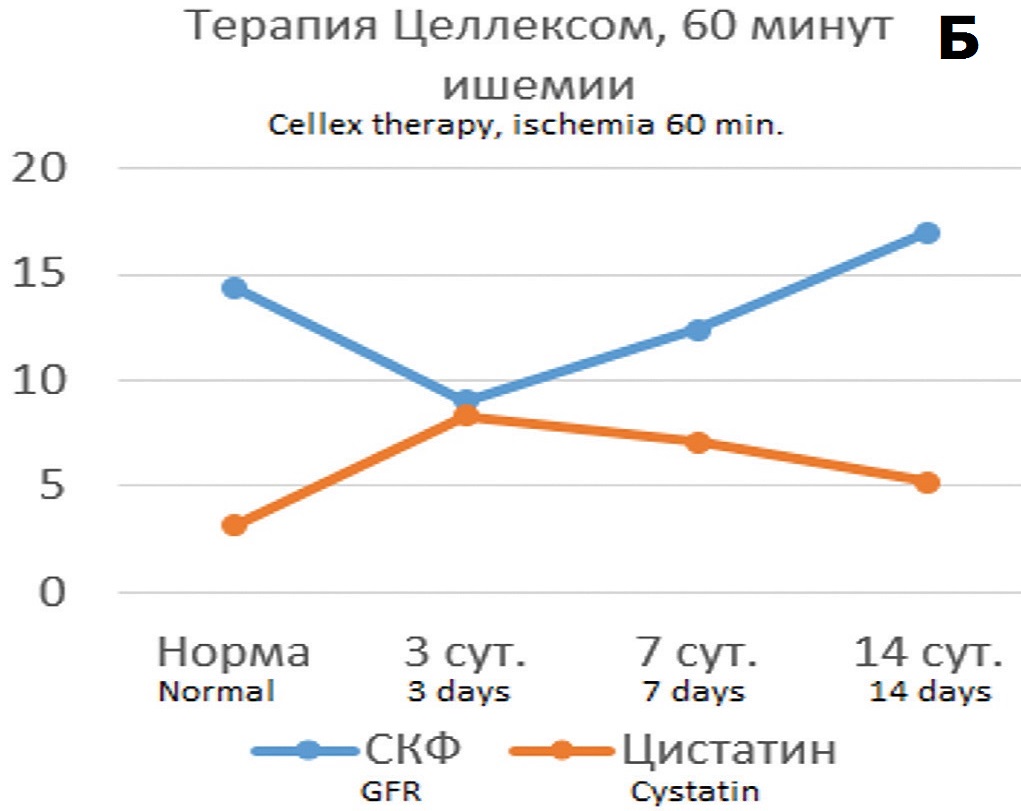
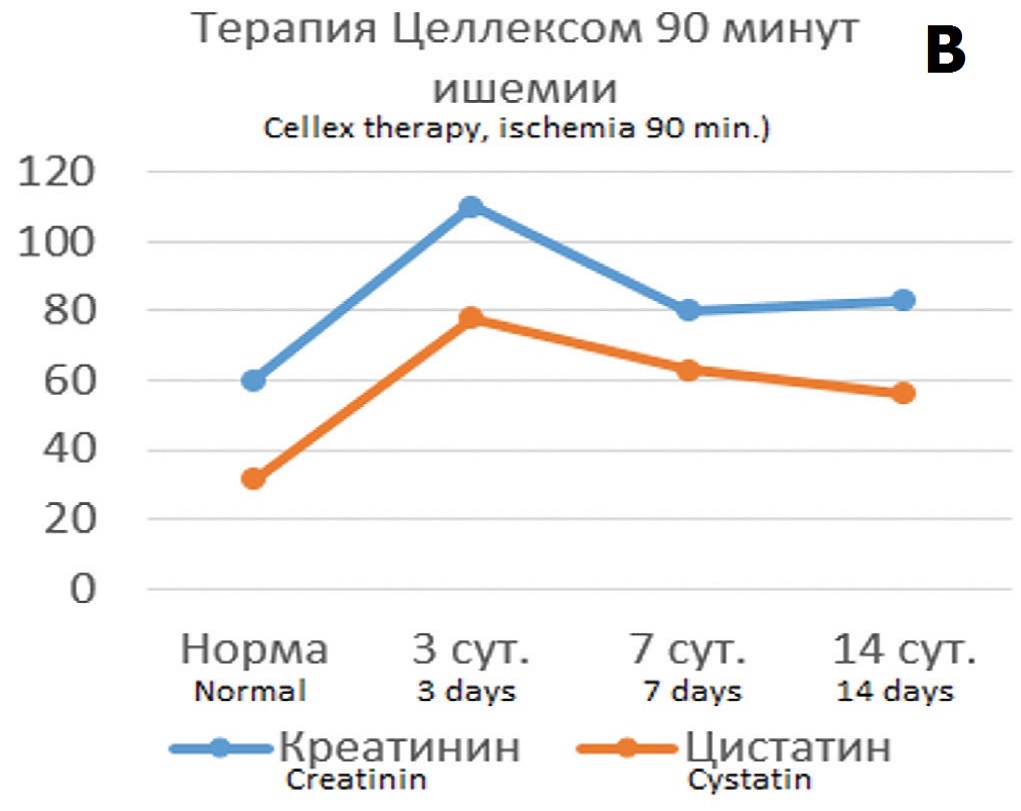
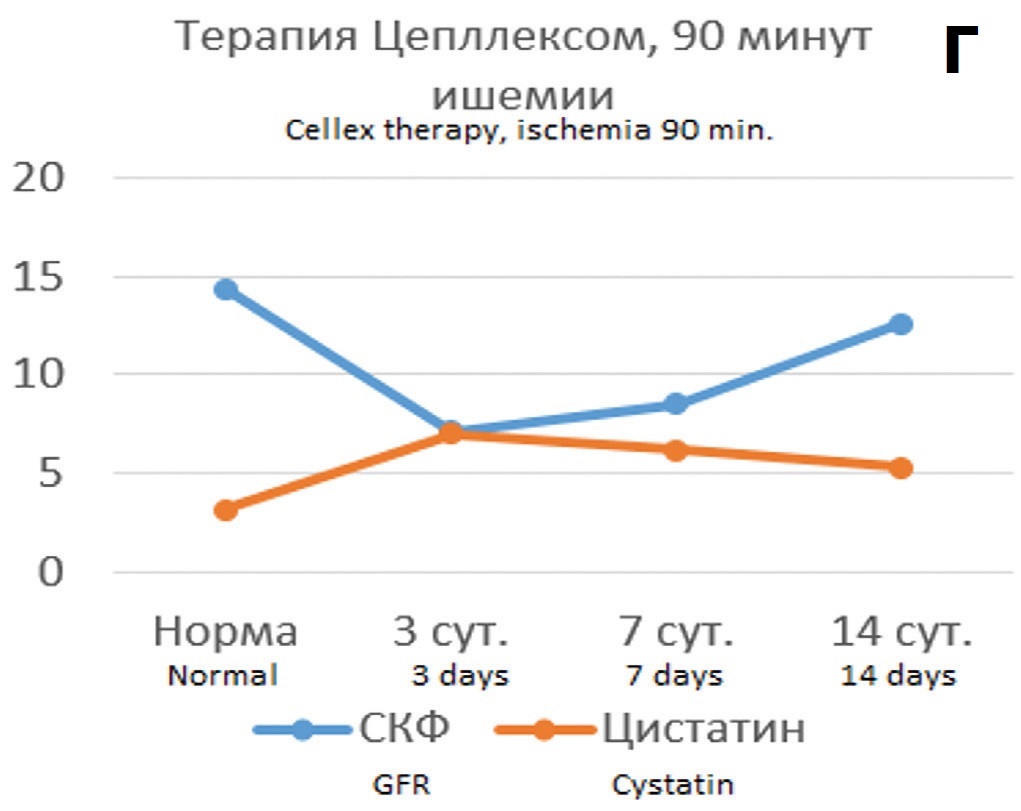
Рис. 6. Корреляция динамики функциональных показателей (уровень креатинина крови (мкмоль/л) и скорость клубочковой фильтрации – CКФ (мл/мин)) и цистатина С (нг/мл) в различные сроки после ишемии единственной почки в течение 60 минут (А,Б) или 90 минут (В,Г)
Fig.6. Correlation of the dynamics of functional indicators (blood creatinine level (mcmol/l) and glomerular filtration rate (ml / min)) and cystatin C (ng / ml) at various times after kidneyischemia for 60 minutes (A,Б) or 90 minutes (В,Г)
Коэффициент корреляции Пирсона между сравниваемыми показателями при терапии Целлексом в опытах с 60-минутной ишемией изменился незначительно, а в опытах с 90-минутной ишемией значительно повысился до значений высокодостоверной корреляции (табл. 3).
Таблица 3. Корреляционные связи (критерий Пирсона) между изменением функциональных показателей почки и концентрации цистатина С в крови крыс в условиях проведения нефрропротективной терапии и без нее при разной степени ишемического повреждения почки
Table 3. The correlations (Pearson's criterion) between changes in the functional parameters of the kidney and the blood concentration of cystatin C in the of rats under the conditions of nephroprotective therapy and without it with different degrees of ischemic kidney damage
| Длительность ишемии Ischemic time (min) |
Креатинин / Цистатин С Creatinine / Cystatin C |
Клубочковая фильтрация / Цистатин С Glomerular filtration rate / Cystatin C |
||
|---|---|---|---|---|
| Без терапии Without therapy |
Целлекс Cellex |
Без терапии Without therapy |
Целлекс Cellex |
|
| 60 минут 60 minutes |
0,941 (p<0,001) | 0,947 (p<0,001) | -0,926 (p<0,001) | -0,750 (p<0,001) |
| 90 минут 90 minutes |
0,409 (p<0,05) | 0,948 (p<0,001) | -0,518 (p<0,05) | -0,941 (p<0,001) |
Эти данные свидетельствуют, что значимость цистатина С в качестве маркера эффективности нефропротективной терапии неоднозначна. При нерезко выраженном повреждении почек на фоне улучшения функционального состояния органа его снижение происходит более медленно и не достигает нормальных цифр при нормализации функции почки. При тяжелом ОПП и проведении нефропротективной терапии динамика цистатина С в большей степени отражает направленность патологического процесса. При этом важно, что в отдаленном периоде (через 3 месяца после тяжелого ишемического повреждения) на фоне терапии Целлексом наряду со снижением концентрации цистатина С в крови у ряда животных происходит полная нормализация функциональных показателей, что свидетельствует об отсутствии у них перехода ОПП в ХБП. Так, если в контроле (без терапии) у всех животных развилась ХБП, то при терапии Целлексом нарушения отдельных функциональных показателей сохранилось лишь в 40-60% (табл. 4).
Таблица 4. Сохранение дисфункции почек через 3 месяца после 90-минутной ишемии без терапии и при терапии Целлексом
Table 4. Preservation of renal dysfunction 3 months after 90-minute ischemia without therapy and with Cellex therapy
| Показатель Parameters |
Без терапии Without therapy |
Терапия Целлексом Cellex therapy |
|---|---|---|
| Полиурия Poliuria |
5 из 5 (100%) | 2 из 5 (40%) |
| Гиперкреатинемия Hypercreatinemia |
5 из 5 (100%) | 3 из 5 (60%) |
| Сниженная скорость клубочковой фильтрации Low glomerular filtration rate |
5 из 5 (100%) | 2 из 5 (40%) |
Эти данные свидетельствуют, что сохранение высоких значений цистатина С через 2 недели и в более отдаленном периоде может служить индикатором высокого риска перехода ОПП в ХБП, а терапия Целлексом снижает риск развития ХБП.
ОБСУЖДЕНИЕ
Проведенное исследование показало, что в целом определение уровня цистатина С в крови коррелирует со степенью нарушения функции почек: при более выраженных функциональных расстройствах степень увеличения уровня этого маркера возрастает и не имеет тенденции к нормализации в отличии от умеренных функциональных расстройств, когда нормализация нарушенных показателей происходит параллельно снижению уровня цистатина С. То есть, динамическое определение уровня цистатина С может служить критерием обратимости развившегося ОПП. При этом стойкое сохранение высоких значений маркера может служить значимым индикатором высокого риска развития ХБП, которая в условиях наших экспериментов развилась у 100% крыс, у которых не отмечена тенденция к снижению уровня цистатина С. При этом динамическое определение уровня цистатина С позволяет оценить эффективность нефропротективной терапии. Мы показали, что терапия животных с ОПП комплексом продуктов секреции эмбриональных стволовых клеток (активный компонент препарата Целлекс) способствует улучшению функциональных показателей как при умеренной, так и при выраженной ОПН, что сопровождается снижением уровня цистатина С в крови. Однако при умеренно выраженной ОПН динамика снижения уровня маркера в опытах с терапией Целлексом и без терапии была одинаковой, тогда как при тяжелой ОПП снижение уровня цистатина С на фоне проводимой терапии соответствовало более выраженному улучшению функции органа. Снижение уровня цистатина С при тяжелой ОПН на фоне нефропротективной терапии свидетельствует об уменьшении риска развития ХБП.
О возможности более широкой значимости динамического определения уровня цистатина С в крови сообщал ряд зарубежных и отечественных авторов [20-24], которые рекомендовали использовать этот маркер для мониторинга больных с ХБП. По данным C. Rimes-Stigare и соавт. развитие ХБП после перенесенного ОПП, определенной на основании расчета СКФ по клиренсу эндогенного креатинина выявлено у 25,8% больных, тогда как при расчете на основании динамики цистатина С – у 51,5% больных, что позволило у этих больных раньше начать нефропротективную терапию [25]. Аналогичные результаты приведены в публикации B. Ravn и соавт., в которой показано, что при выписке критически больных пациентов с тяжелой ОПН из отделения интенсивной терапии развитие ХБП по данным определения уровня цистатина С в крови выявлено у 44% больных, тогда как при расчете по уровню креатинина крови таких больных было 26%. При дальнейшем наблюдении (через 1 год) уровень цистатина С при выписке коррелировал со смертностью пациентов в этот период (17% больных), а в отношении уровня креатинина крови при выписке такой корреляции не выявлено [26]. В публикации M.M. Sinna и соавт. приводятся данные, что на фоне проводимого лечения больных с ОПН уровень цистатина С снижался в соответствии с улучшением функции почек, тогда как у больных с ХБП сохранялись повышенные значения маркера, свидетельствуя о сохраняющимся патологическом процессе [27]. По данным A. Choudhary и соавт. определение уровня цистатина С в крови через 24 часа после урологических операций позволяет с большей вероятностью определить развивающуюся ОПН, при которой уровень этого маркера возрастал на 119%. При этом функция почки через 3 месяца после операции негативно коррелировала с выраженностью подъема уровня цистатина С [14].
Таким образом, хотя цистатин С многие авторы относят к маркерам ОПП, он также может иметь значение в определении риска перехода ОПП в ХБП и прогнозировании последующего течения хронического процесса, а также в определении эффективности проводимой терапии.
ВЫВОДЫ
- Цистатин С является информативным маркером развития ОПП и обратимости развившихся функциональных расстройств.
- Динамическое определение уровня цистатина С позволяет оценить направленность развития патологического процесса и эффективность нефропротективной терапии. При этом прогностическая значимость этого маркера выше при тяжелой степени ОПН.
- Динамическое определение уровня цистатина С в крови позволяет определять риск развития ХБП.
ЛИТЕРАТУРА
1. Uchino S, Kellum JA, Bellono R, Doig GS, Morimatsu H, Morgera S. Acute renal failure in critically ill patients: a multinational, multicenter study. JAMA 2005(294):813-818.
2. Wasung ME, Chawla LS, Madero M. Biomarkers of renal function, which and when? Clin Chim Acta 2015(438):350-7. https://doi.org/10.1016/ j.cca.2014.08.039.
3. Krstic D, Tomic N, Radosavljevic B, Avramovic N, Dragutinovic V, Skodric SR, Colovic M. Biochemical markers of renal function. Curr Med Chem 2016;23(19):2018-40. https://doi.org/10.2174/0929867323666160115130241.
4. Barreto EF, Rule AD, Murad MH, Kashani KB, Lieske JC, Erwin PJ, Steckelberg JM, Gajic O, Reid JM, Kane-Gill SL. Prediction of the renal elimination of drugs with cystatin c vs creatinine: a systematic review. Mayo Clin Proc 2019 Mar;94(3):500-514. https://doi.org/10.1016/j.mayocp.2018.08.002.
5. Teo SH, Endre ZH. Biomarkers in acute kidney injury (AKI). Best Pract Res ClinAnaesthesiol 2017;31(3):331-344. https://doi.org/10.1016/j.bpa.2017.10.003.
6. Beker BM, Corleto MG, Fieiras C, Musso CG. Novel acute kidney injury biomarkers: their characteristics, utility and concerns. Int Urol Nephrol 2018;50(4):705-713. https://doi.org/10.1007/s11255-017-1781-x.
7. Bargnoux AS, Barguil Y, Cavalier E, Cristol JP. Estimation of glomerular filtration rate using cystatin C. Ann Biol Clin (Paris) 2019;77(4):375-380. https://doi.org/10.1684/abc.2019.1456.
8. Pianta TJ, Pickering JW, Succar L, Chin M, Davidson T, Buckley NA, Mohamed F, Endre ZH. Dexamethasone modifies cystatin c-based diagnosis of acute kidney injury during cisplatin-based chemotherapy. Kidney Blood Press Res 2017;42(1):62-75. https://doi.org/1159/000469715.
9. Griffin BR, Faubel S, Edelstein CL. Biomarkers of drug-induced kidney toxicity. Ther Drug Monit 2019;41(2):213-226. https://doi.org/10.1097/ FTD.0000000000000589.
10. Skowron B, Baranowska A, Dobrek L, Ciesielczyk K., Kaszuba-Zwoinska J, Wiecek G, Malska-Wozniak A, Strus M, Gil K. Urinary neutrophil gelatinaseassociated lipocalin, kidney injury molecule-1, uromodulin, and cystatin C concentrations in an experimental rat model of ascending acute kidney injury induced by pyelonephritis. J Physiol Pharmacol 2018 Aug;69(4). https://doi.org/10.26402/jpp.2018.4.13.
11. Bell M, Granath F, Mårtensson J, Löfberg E, Ekbom A, Martling CR; Cystatin C is correlated with mortality in patients with and without acute kidney injury. Nephrol Dial Transplant 2009;24(10):3096-102. https://doi.org/10.1093/ ndt/gfp196.
12. Nakhjavan-Shahraki B, Yousefifard M, Ataei N, Baikpour M, Ataei F, Bazargani B, Abbasi A, Ghelichkhani P, Javidilarijani F, Hosseini M. Accuracy of cystatin C in prediction of acute kidney injury in children; serum or urine levels: which one works better? A systematic review and meta-analysis. BMC Nephrol 2017;18(1):120. https://doi.org/10.1186/s12882-017-0539-0.
13. Bagshaw SM, Bellomo R. Cystatin C in acute kidney injury. Curr Opin Crit Care 2010;16(6):533-9. https://doi.org/10.1097/MCC.0b013e32833e8412.
14. Choudhary A, Basu S, Dey SK, Rout JK, Das RK, Dey RK. Association and prognostic value of serum Cystatin C, IL-18 and Uric acid in urological patients with acute kidney injury. Clin Chim Acta 2018(482):144-148. https://doi.org/10.1016/j.cca.2018.04.005.
15. Кирпатовский В.И., Сивков А.В., Голованов С.А., Дрожжева В.В., Самойлова С.И., Рабинович Э.З., и др. Профилактика развития острой постишемической почечной недостаточности с использованием белково-пептидного комплекса эмбриональной ткани. Экспериментальная и клиническая урология 2019(3):32-39. [Kirpatovskiy V.I., Sivkov A.V., Golovanov S.A., Drozhzheva V.V., Samojlova S.I., Rabinovich E.Z., et al. Prevention of acute postischemical renal failure using protein-peptide complex from embryonal tissue. Eksperimentalnaya i klinicheskaya urologiya= Experimental and Clinical Urology 2019(3):32-39. (In Russian)].
16. Vizoso FJ, Eiro N, Cid S, Schneider, Perez-Fernandez R. Mesenchymal stem cell secretome: toward cell-free therapeutic strategies in regenerative medicine. Int J Mol Sci 2017(18):1852. https://doi.org/10.3390/ijms18091852.
17. Beer L, Mildner M, Ankersmit HJ. Cell secretome based drug substances in regenerative medicine: When regulatory affairs meet basic science. Ann Transl Med 2017(5):170.
18. Li JS, Li B. Renal injury repair: how about the role of stem cells. Adv Exp Med Biol 2019(1165):661-670. https://doi.org/10.1007/978-981-13-8871-2_32.
19. Selim RE, Ahmed HH, Abd-Allah SH, Sabry GM, Hassan RE, Khalil WKB, Abouhashem NS. Mesenchymal stem cells: a promising therapeutic tool for acute kidney injury. Appl Biochem Biotechnol 2019;189(1):284-304. https://doi.org/10.1007/s12010-019-02995-2.
20. Shen SJ, Hu ZX, Li QH, Wang SM, Song CJ, Wu DD, et al. Implications of the changes in serum neutrophil gelatinase-associated lipocalin and cystatin C in patients with chronic kidney disease. Nephrology (Carlton) 2014;19(3):129-35. https://doi.org/10.1111/nep.12203.
21. Meersch M, Schmidt C, Zarbock A. Patient with chronic renal failure undergoing surgery. Curr Opin Anaesthesiol 2016;29(3):413-20. https://doi.org/10.1097/ACO.0000000000000329.
22. Кушниренко С.В. Цистатин С: оценка и прогноз почечной функции у детей с хронической болезнью почек. Урология 2019;23(3):257-263. [Kushnirenko S.V. Cystatin C: evaluation and prognosis kidney function in childrens with chronic kidney desiases. Urologiya = Urologiia 2019;23(3):257-263. (In Russian)].
23. Нагибович О.А., Шипилова Д.А. Диагностическое значение цистатина С в оценке хронического повреждения почек у больных сахарным диабетом 2 типа. Известия российской военно-медицинской академии 2020;39(3- 3):142-146. [Nagibovich O.A., Shipilova D.A. [Diagnostic value of Cystatin C in chronic kidney disease in patients with diabetis mellitus type 2. Izvestija rossi`skoj voenno-meditsinskoj akademii = Russian Military Medical Academy Reports 2020;39(3-3):142-146. (In Russian)].
24. Муркамилов И.Т., Айтбаев К., Фомин В.В, Муркамилова Ж.А. Цистатин С как маркер хронической болезни почек. Терапия. 2019;5(4):57-62. [Murkamilov I.T., Aitbaev K., Fomin V.V., Murkamilova ZH.A. Cystatin C as a marker of chronic kidney desease. Terapiya = Therapy 2019;5(4):57-62. (In Russian)].
25. Rimes-Stigare C, Ravn B, Awad A, Torlén K, Martling CR, Bottai M, et al. Creatinine- and Cystatin C-Based incidence of chronic kidney disease and acute kidney disease in AKI survivors. Crit Care Res Pract 2018(2018):7698090. https://doi.org/10.1155/2018/7698090.
26. Ravn B, Prowle JR, Mårtensson J, Martling CR, Bell M. Superiority of Serum Cystatin C Over Creatinine in Prediction of Long-Term Prognosis at Discharge From ICU. Crit Care Med 2017;45(9):e932-e940. https://doi.org/10.1097/ CCM.0000000000002537.
27. Sinna MM, Altaf FMN, Mosa OF. Serum and Urinary NGAL and Cystatin C levels as diagnostic tools for acute kidney injury and chronic kidney disease: a histobiochemical comparative study. Curr Pharm Des 2019;25(10):1122-1133. https://doi.org/10.2174/1381612825666190516080920.







