ВВЕДЕНИЕ
IgG4-ассоцированная болезнь (IgG4-АБ) представляет собой системную иммунозависимую патологию, характеризующуюся диффузной или очаговой инфильтрацией пораженных тканей лимфоцитами и плазматическими клетками, экспрессирующими IgG4 в отсутствии нейтрофилов (может присутствовать умеренное количество эозинофилов), с последующим развитием флебита и фибросклероза в пораженных тканях, а также таким лабораторным признаком, как повышение содержания IgG4 в сыворотке крови [1-4].
В 2003 году группой японских исследователей IgG4-ассоцированная болезнь была выделена в качестве самостоятельного заболевания, охватывающего большое разнообразие клинических и морфологических проявлений, которые ранее рассматривались как отдельные заболевания [5]. Современные представления об IgG4-АБ подразумевают системность поражения, IgG4-ассоциацию и общность морфологических проявлений, таких, как лимфоплазмоцитарная инфильтрация и фиброз.
В 2011 году впервые были предложены диагностические критерии и трехуровневая классификация IgG4-АБ [6]. В качестве ключевых критериев принято считать: 1) клиническую картину локального или множественного поражения, характеризующегося опухолевоподобной воспалительной инфильтрацией очагового или диффузного характера; 2) увеличение сывороточной концентрации IgG4 более 1,35 г/л; 3) гистологическую картину, включающую лимфоплазмоцитарную инфильтрацию с фиброзом и облитерирующим флебитом, инфильтрацию IgG4-позитивными клетками (более 10 клеток в поле зрения при увеличении х400 и соотношение IgG4/ IgG–плазмоцитов, превышающее 40%). При этом для установления «достоверного» диагноза IgG4-АБ необходимо сочетание клинических критериев с результатами лабораторного и гистологического исследований. Наличие клинических и гистологических критериев позволяет говорить о «вероятном» IgG4-ассоцированном заболевании, а сочетание клинического и лабораторного критериев – о «возможном» IgG4-ассоцированном заболевании. В 2012 году была предложена первая международная номенклатура данного заболевания [7].
IgG4-АБ встречаются в различных органах. На сегодняшний день описаны IgG4-АБ поджелудочной железы, желчевыводящих путей, печени, желудка, клетчатки забрюшинного пространства, молочных, слезных и слюнных желез, предстательной железы и щитовидной железы, кожи [8].
В мочевыводящих путях IgG4-АБ встречаются редко и чаще описаны в почках и мочевом пузыре [9], в то время как случаи поражения мочеточника представлены единичными наблюдениями [10]. В связи с тем, что IgG4-ассоцированное заболевание только недавно было классифицировано в качестве самостоятельного, поражения мочеточников, демонстрирующие типичные клинико-морфологические особенности, в прошлом определяли термином «воспалительная псевдоопухоль» или «идиопатический сегментарный уретерит». Первое описание такого поражения было опубликовано N.K. Bissada и соавт. в 1978 году [11], и с тех пор в литературе было описано 18 аналогичных наблюдений [12].
Клинические проявления IgG4-АБ неспецифичны, что определяет трудности дифференциальной диагностики, в том числе с различными инфекционновоспалительными заболеваниями и опухолями, а также увеличивает срок от первых клинических проявлений до постановки диагноза до 2 лет [13]. И если врачи других специальностей, к примеру, терапевты и хирурги, в клинической практике сталкиваются с IgG4-АБ, то в урологической практике эта нозология встречается крайне редко.
Диагностика IgG4-АБ мочеточника на дооперационном этапе бывает затруднена, поскольку рентгенологические методы исследования описывают наличие новообразования в органе, иногда сопровождаемого регионарной лимфоаденопатией [14]. Нередко это приводит к ошибочной трактовке результатов в пользу злокачественного новообразования и влечет за собой выбор неправильной лечебной тактики в отношении таких пациентов [15].
В настоящей статье мы приводим клиническое наблюдение IgG4-АБ мочеточника, которое было принято за уротелиальную карциному, что предопределило выполнение оперативного вмешательства у пациента.
МАТЕРИАЛЫ И МЕТОДЫ
Клинический случай
Больной П., 64 года, поступил в онкологическое (урологическое) отделение ЧУЗ «ЦКБ «РЖД-Медицина» с жалобами на боль в левой поясничной области в течение 2 месяцев, снижение массы тела на 4 кг за последние 2 месяца. За месяц до поступления при обследовании по поводу данных жалоб в урологическом отделении районной клинической больницы по данным ультразвукового исследования и компьютерной томографии органов брюшной полости от 09.12.2020 года на границе средней и нижней трети левого мочеточника выявлены опухоль, протяженностью до 70 мм, стенозирующая его просвет, с развитием уретеропиелокаликоэктазии слева (чашечки 6 мм, лоханка 28 мм, мочеточник до 9 мм), а также увеличенные до 10-13 мм лимфатические узлы в левой подвздошной области. Пациенту была выполнена уретероскопия. Из протокола исследования: тубус уретероскопа проведен до границы нижней и средней трети левого мочеточника, где отмечено непреодолимое для инструмента сужение просвета мочеточника ввиду разрастания белесоватой ткани, покрытой фибрином. Выполнена биопсия описанной ткани. При морфологическом исследовании в представленных биоптатах было обнаружено хроническое слабоактивное воспаление без признаков опухолевого роста. Выполнена тонкоигольная аспирационная биопсия увеличенного подвздошного лимфатического узла слева. При цитологическом исследовании пунктата найдены зрелые лимфоциты. С целью ликвидации гидронефроза больному было выполнено стентирование левого мочеточника. Однако через 2 недели после удаления стенткатетера вновь возникло нарушение уродинамики слева. Заподозрена злокачественная опухоль мочеточника, в связи с чем, больному была рекомендована консультация онкоуролога для определения дальнейшей лечебной тактики.
В онкологическом (урологическом) отделении ЧУЗ «ЦКБ «РЖД-Медицина», проведено комплексное обследование. При компьютерной томографии органов брюшной полости и малого таза от 14.01.2021 года на границе средней и нижней третей левого мочеточника выявлена циркулярная гиперваскулярная опухоль, стенозирующая его просвет, протяженностью 111 мм, (ранее – до 70 мм), распространяющаяся в стенку мочеточника до 8 мм с развитием гидронефроза слева (мочеточник в верхней трети расширен до 18 мм (ранее – 9 мм), лоханка левой почки 27 мм). Имело место нарушение концентрационной и выделительной функции левой почки. Наружные подвздошные лимфатические узлы слева увеличены до 18 мм в диаметре, левые запирательные – до 13 мм (рис. 1а, б).
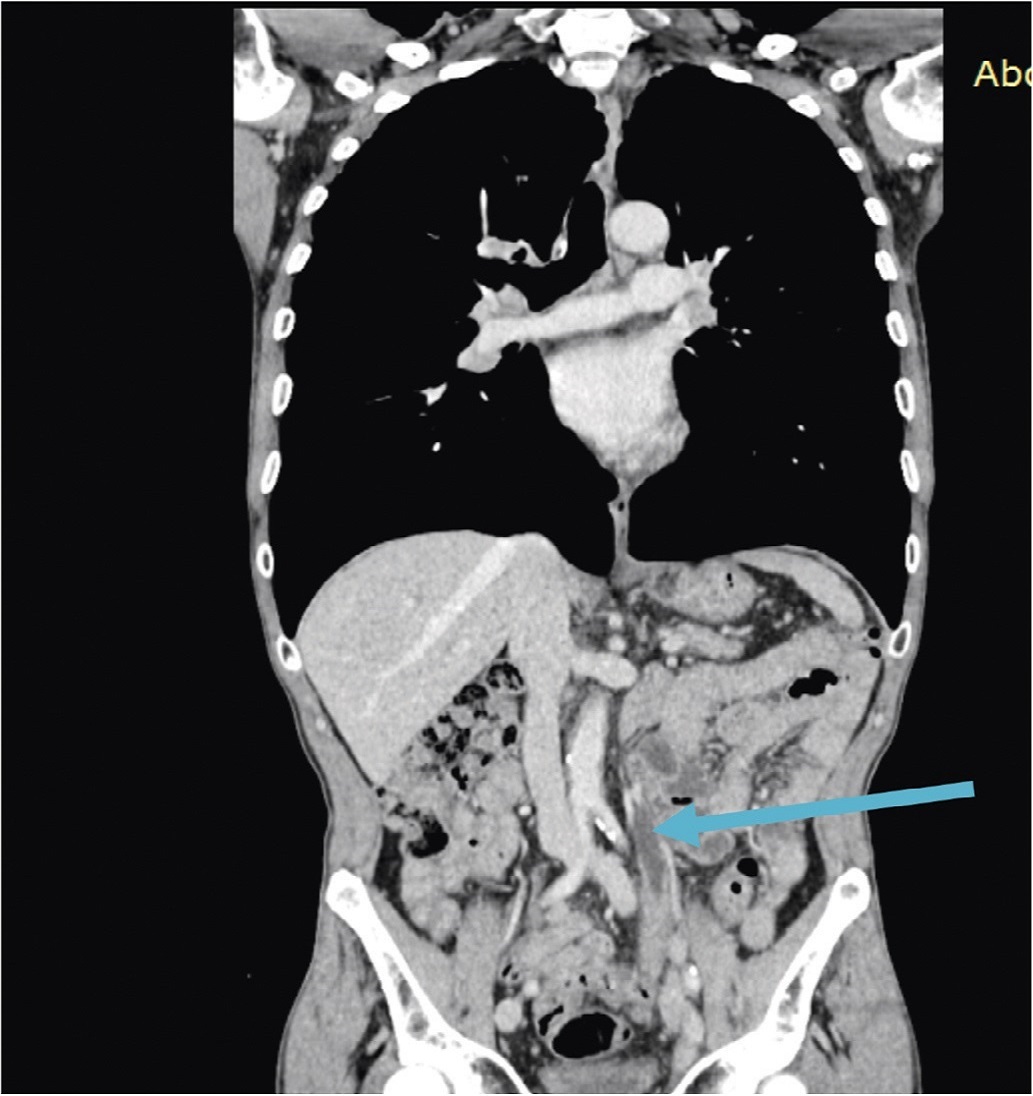
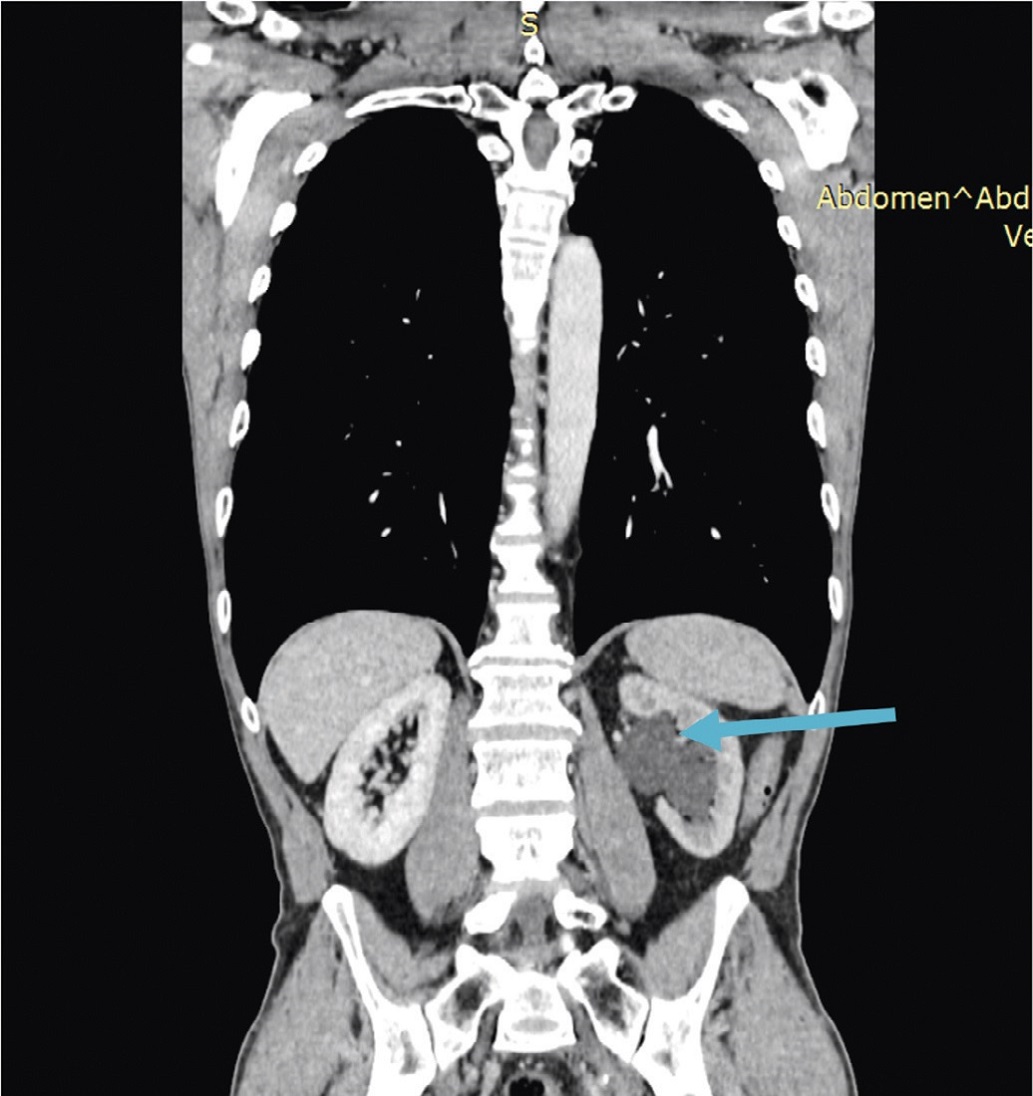
Рис. 1а. Протяженная опухоль в средней и нижней трети левого мочеточника (указано стрелкой); б – расширение полостной системы левой почки (указано стрелкой)
Fig. 1a. Extended tumor in the middle and lower part of the left ureter (indicated by the arrow); b – pyelocalycoectasy of the left kidney (indicated by the arrow)
Пациенту повторно выполнена уретероскопия. Из протокола исследования: на границе нижнего и среднего отделов левого мочеточника имеется циркулярное сужение мочеточника до 2/3 его просвета за счет разрастания белесоватой ткани, покрытой фибрином. Тубус инструмента был проведен выше сужения, где определялась дилатация мочеточника. Протяженность сужения составила около 100 мм. Выполнена биопсия измененного участка мочеточника. При микроскопическом исследовании найдены мелкие фрагменты стенки мочеточника с артифициальными изменениями, частично покрытые уротелием, представленные фиброзной тканью с полнокровными сосудами и диффузно-очаговой лимфоплазмоцитарной инфильтрацией с примесью гистиоцитов и эозинофилов. Достоверных признаков роста опухоли в пределах исследованного материала не было найдено (рис. 2).
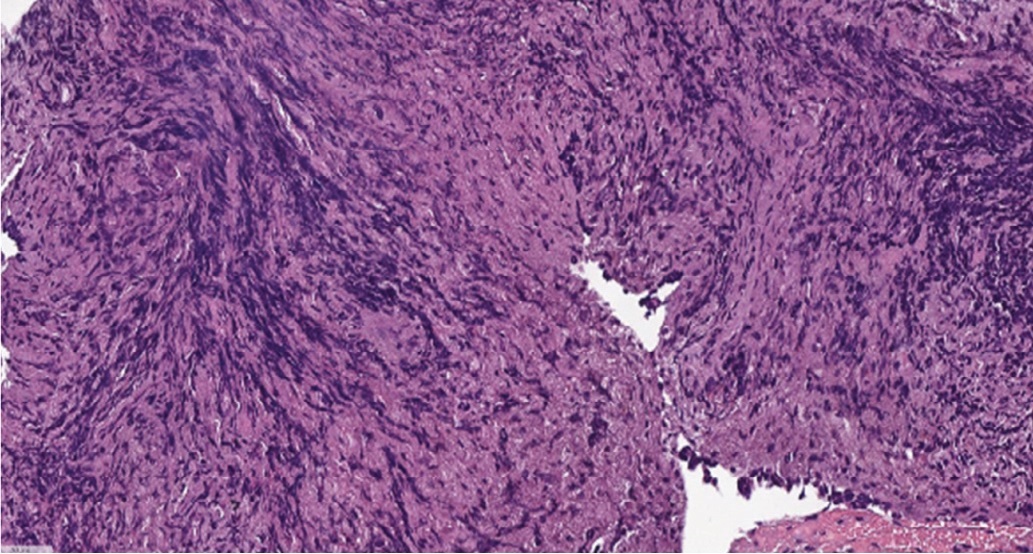
Рис. 2. Микропрепарат. Фрагмент стенки мочеточника с участком сохраненного уротелия и подлежащей фиброзной тканью с полнокровными сосудами и диффузно-очаговой лимфоплазмоцитарной инфильтрацией с примесью гистиоцитов и эозинофилов (окрашивание гематоксилином и эозином, х200)
Fig. 2. Histological sample. Ureteral wall with preserved urothelium and underlying fibrous tissue with full-blooded vessels and diffuse focal lymphoplasmocytic infiltration with histiocytes and eosinophils (hematoxylin end eosin staining, х200)
Клинические и рентгенологические данные не позволяли исключить у пациента злокачественное новообразование мочеточника. По решению онкологического консилиума больному 21.01.2021 года выполнена лапароскопическая нефруретерэктомия слева с регионарной лимфодиссекцией. Из протокола операции: после установки рабочих троакаров и наложения пневмоперитонеума выполнена мобилизация левой почки с мочеточником до мочевого пузыря. На границе средней и нижней трети мочеточника определялось опухолевое образование белесоватого цвета, протяженностью до 100 мм, каменистой плотности при инструментальной пальпации (рис. 3). На этом уровне мочеточник был интимно спаян с окружающими тканями. В левой подвздошной области были визуализированы увеличенные лимфатические узлы (рис. 4).
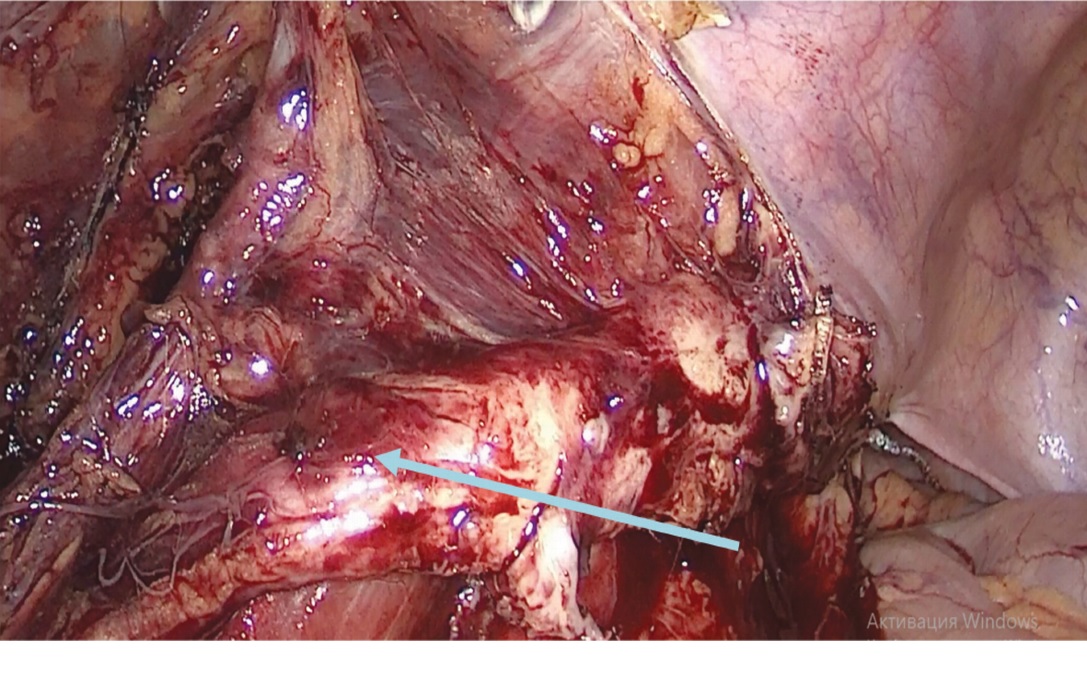
Рис. 3. Опухолевое образование на границе средней и нижней трети левого мочеточника (указано стрелкой)
Fig. 3. A tumor on the border of the middle and lower part of the left ureter (indicated by an arrow)
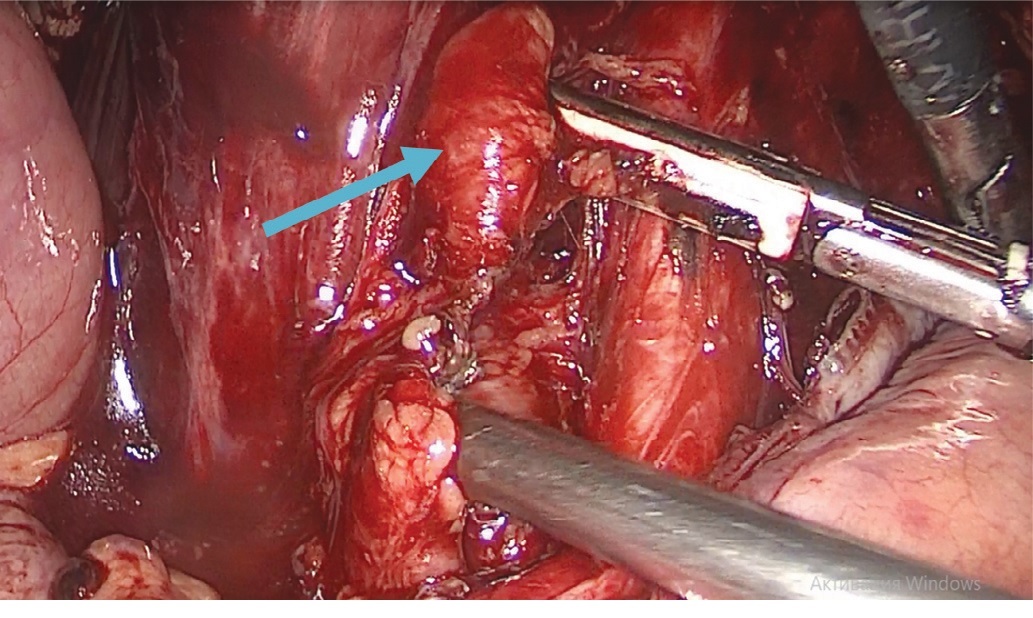
Рис. 4 .Увеличенные лимфатические узлы в левой подвздошной области (указано стрелкой)
Fig. 4 . Enlarged lymph nodes in the left iliac area (indicated by an arrow)
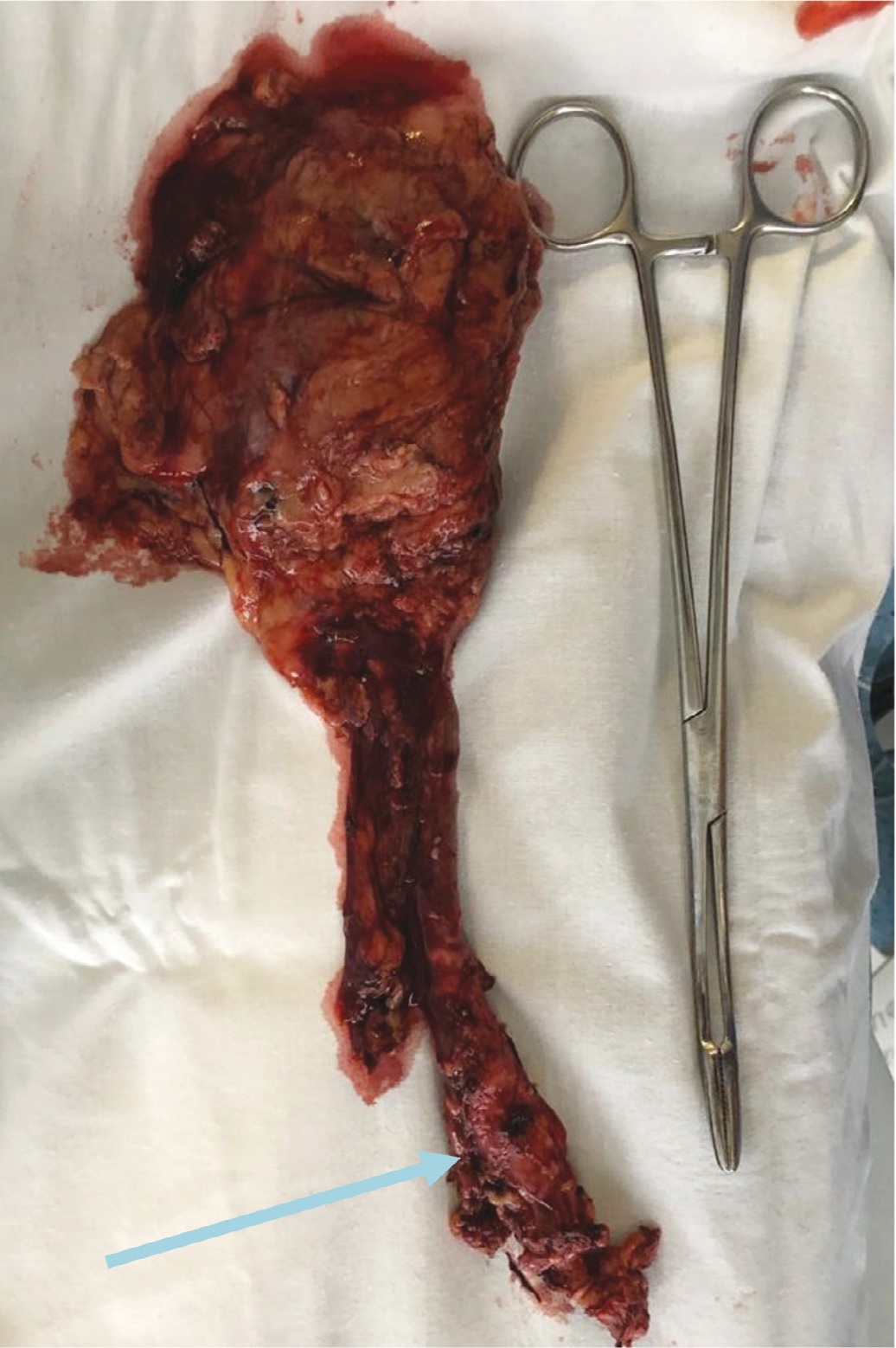
Рис. 5. Макропрепарат: удаленная левая почка с мочеточником и резецированным устьем мочевого пузыря (опухоль мочеточника указана стрелкой).
Fig. 5. Macroscopically: removed left kidney with ureter and resected mouth of the bladder (ureteral tumor is indicated by an arrow)
На рисунке 5 представлен макропрепарат удаленной левой почки и левого мочеточника с опухолью и резецированным устьем левого мочеточника. Макропрепарат был представлен удаленной левой почкой размерами 100х40х45 мм. Капсула снималась с трудом. На разрезах чашечно-лоханочная система была расширена, заполнена геморрагическим полупрозрачным содержимым, слизистая оболочка ее была гладкой, розовато-синюшного цвета. Границы коркового и мозгового слоя были выражены нечетко. Длина левого мочеточника составляла 210 мм. В средней и нижней трети мочеточника определялось сужение его просвета на протяжении 110 мм и утолщение стенки до 10 мм. Стенка мочеточника на этом уровне была представлена белесовато-серой плотной тканью. Расстояние от места сужения до дистального края резекции составляло 30 мм, от ворот почки – 90 мм. Диаметр удаленных лимфатических узлов варьировал от 6 мм до 18 мм (рис. 6 а, б).
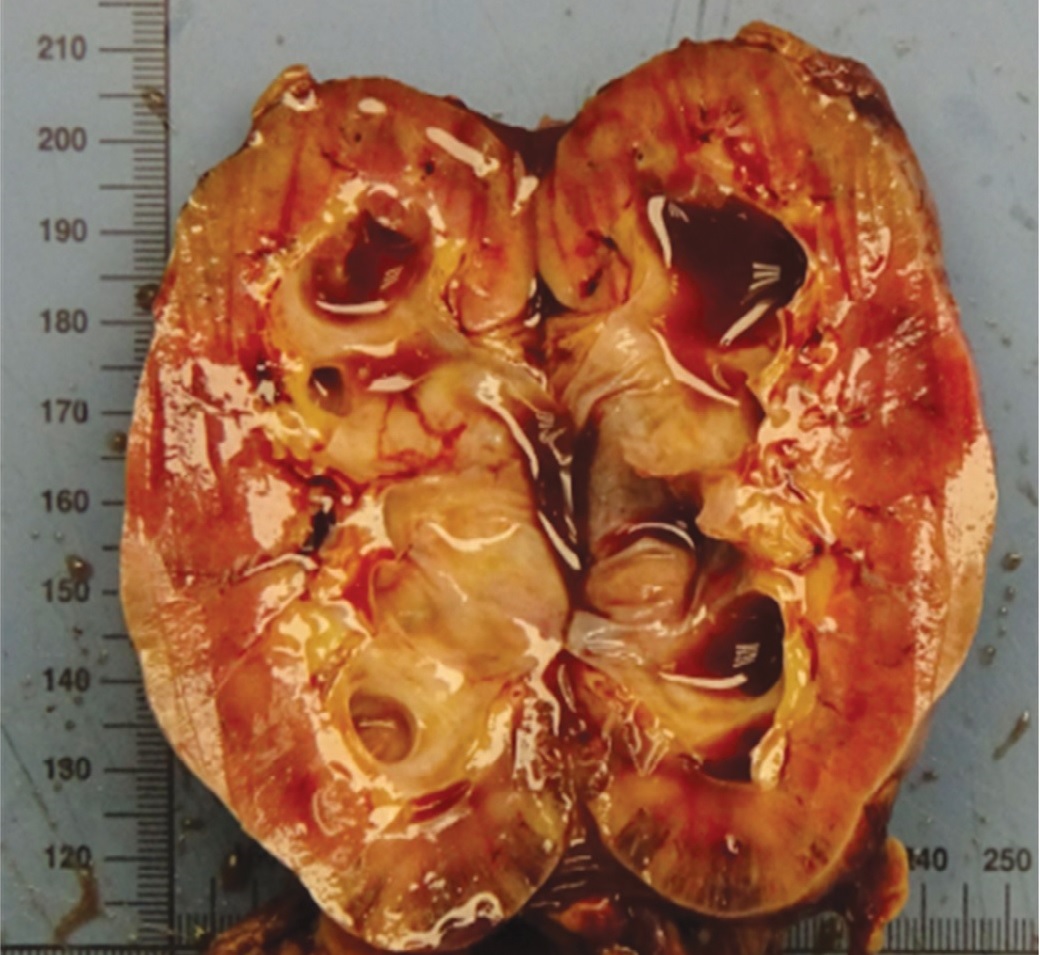
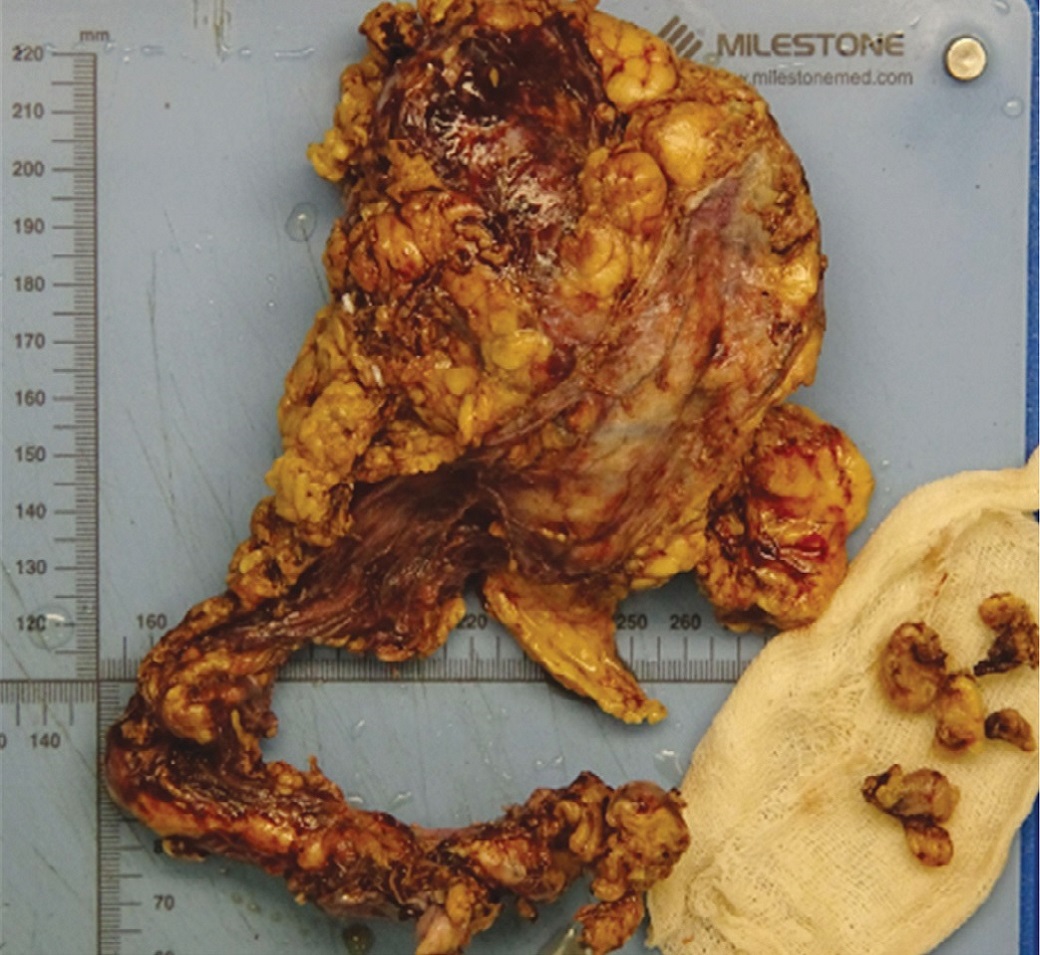
Рис. 6 (а,б). На разрезе макропрепарат удаленной левой почки и мочеточника с лимфатическими узлами.
Fig. 6 (a, b). Left kidney and left ureter dissected with lymph nodes.
При микроскопическом исследовании стенка мочеточника была опухолевидно утолщена за счет обширного муарового (сториформного) фиброза (рис. 7), с умерено выраженной диффузной лимфоплазмоклеточной инфильтрацией с примесью эозинофилов (рис. 8). Мышечная стенка была разволокнена, мышечные волокна гипертрофированы. Слизистая оболочка была покрыта уротелием обычного гистологического строения без признаков атипии (рис. 9). Отмечалось увеличенное количество сосудов венозного типа как с воспалительной инфильтрацией стенок без облитерации просвета вен, так и с участками полной облитерации их просвета (необлитерирующий и облитерирующий флебит). Воспалительный инфильтрат и фиброз распространялся на адвентицию мочеточника и прилежащую жировую клетчатку.
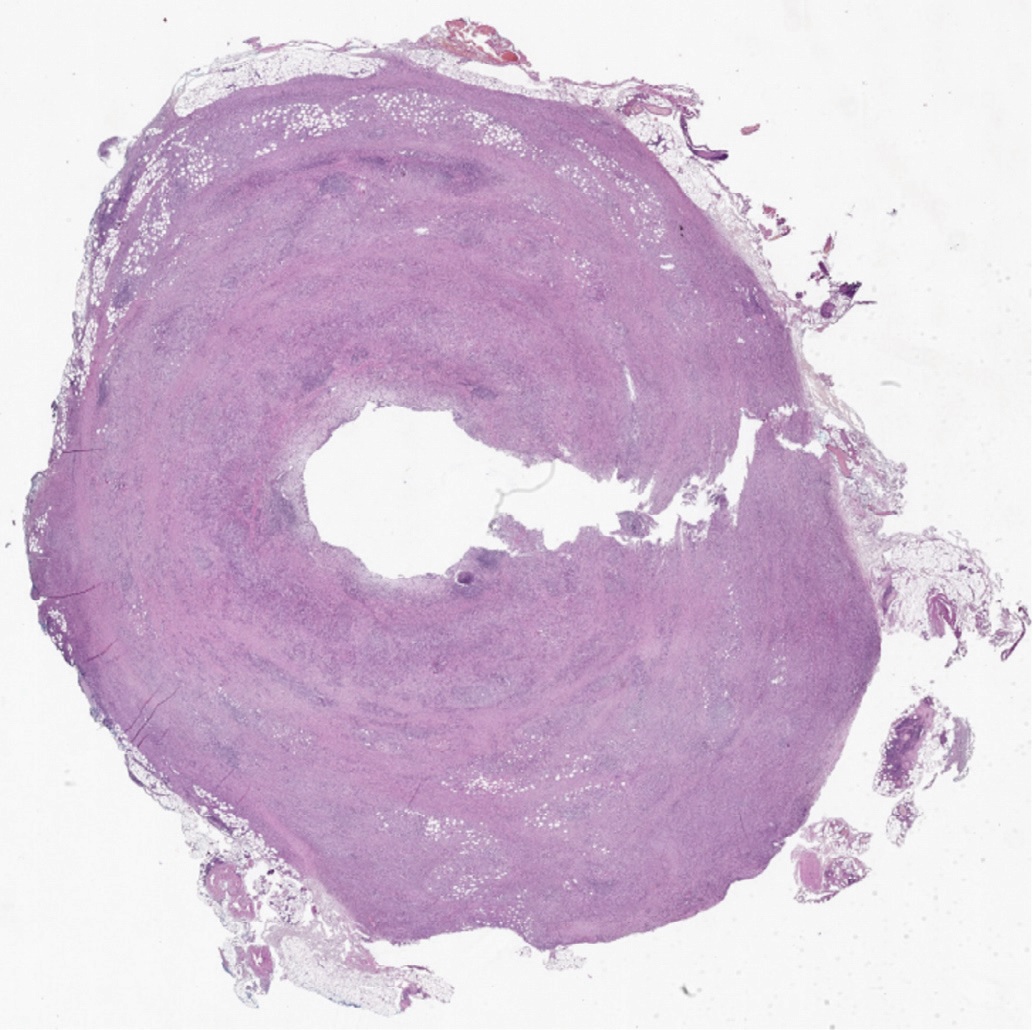
Рис. 7. Срез мочеточника на уровне его опухолевого изменения; утощление стенки мочеточника (окрашивание гематоксилином и эозином, х400)
Fig. 7. Ureteral section at the tumor level; the ureter wall is thickening (hematoxylin end eosin staining, х400)
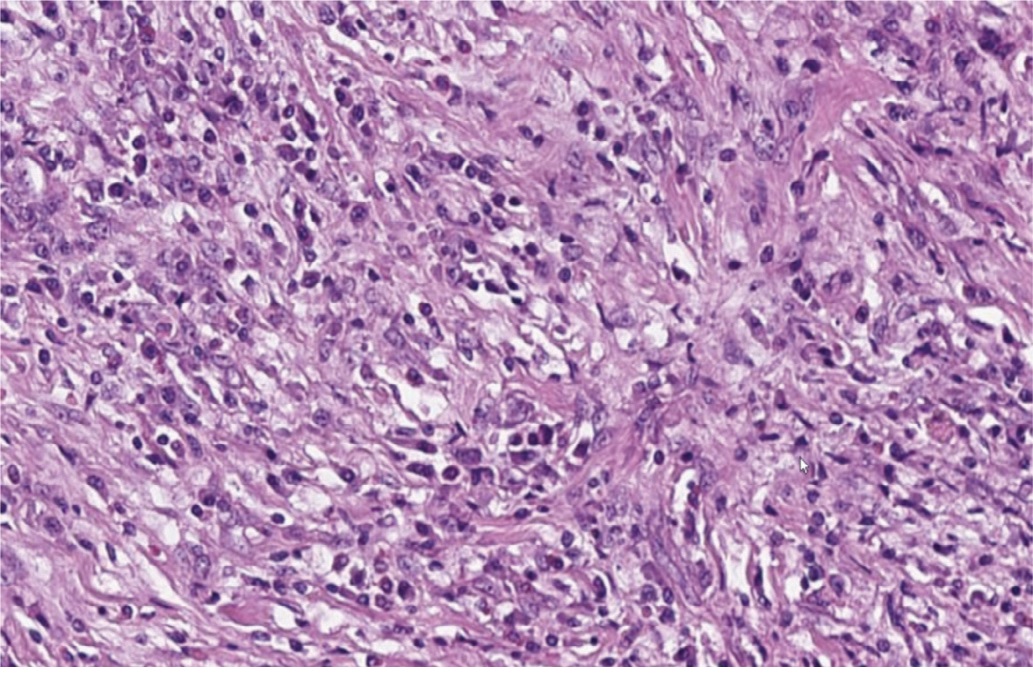
Рис. 8. Стенка мочеточника с умерено выраженной диффузной инфильтрацией лимфоцитами, плазмоцитами и эозинофилами (окрашивание гематоксилином и эозином, х400).
Fig. 8. Wall of the ureter with diffuse infiltration by lymphocytes, plasmocytes and eosinophils (hematoxylin end eosin staining, х400)
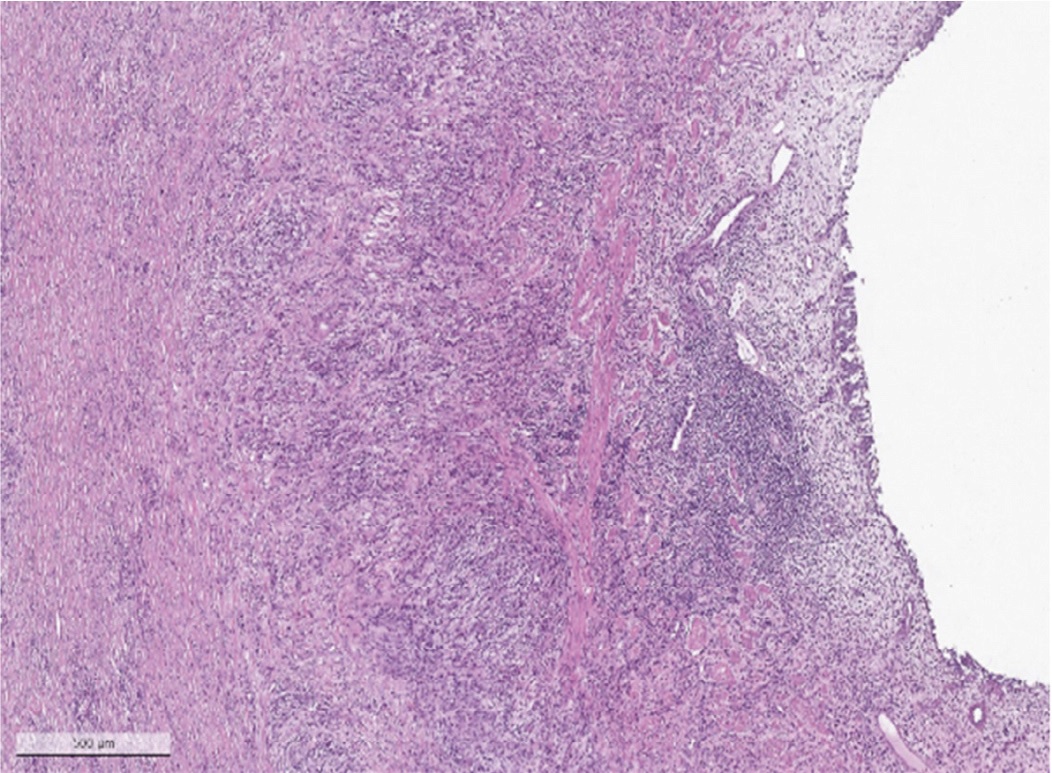
Рис. 9. Стенка мочеточника со слизистой оболочной типичного строения (окрашивание гематоксилином и эозином, х100)
Fig. 9. Wall of the ureter with a typical mucous (hematoxylin end eosin staining, х100)
Ткань удаленной почки имела типичную архитектонику с умерено выраженной лимфо-плазмоклеточной интерстициальной инфильтрацией, умеренным интерстициальным фиброзом и склерозом отдельных клубочков. Просвет почечных канальцев был расширен с дистрофическими изменениями канальцевого эпителия. В ткани лимфатических узлов отмечался легкий фиброз с плазматизацией интерфолликулярных пространств и синусов (рис. 10). Таким образом, морфологические изменения более всего соответствовали опухолеподобному фибровоспалительному поражению мочеточника, хроническому интерстициальному нефриту, синусовому гистиоцитозу лимфатических узлов.
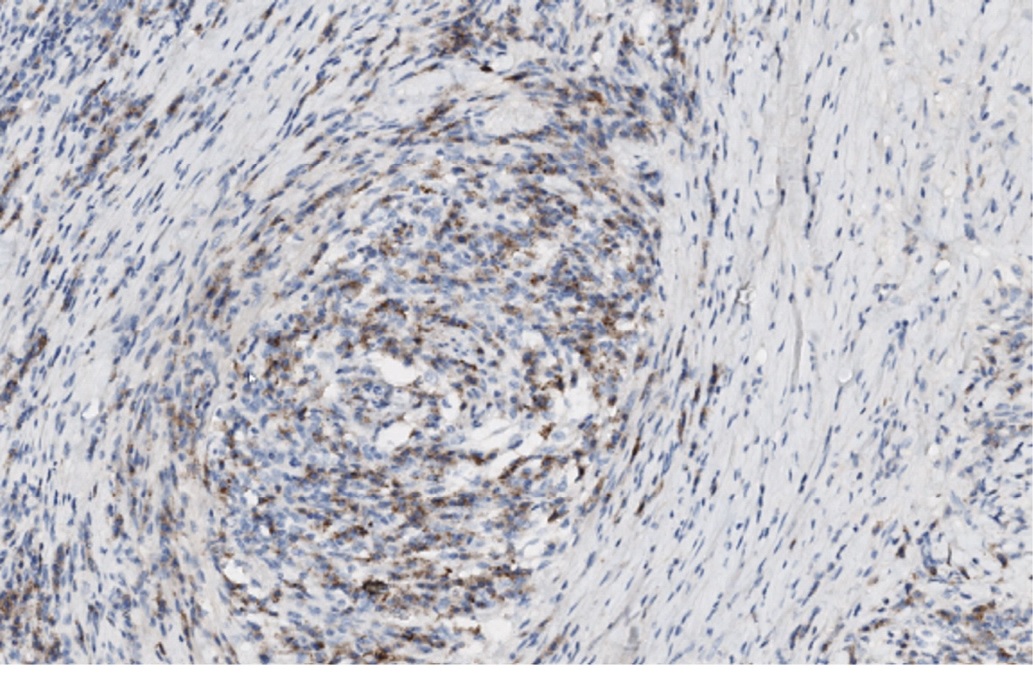
Рис. 10. Перифлебит. Реакция с антителами к CD138 позитивная в цитоплазме плазматических клеток. x200
Fig. 10. Periphlebitis. There is a positive reaction with antibodies to CD138 in the cytoplasm of plasma cells. x200
Для дифференциальной диагностики IgG4-ассоцированного заболевания было выполнено иммуногистохимическое исследование (ИГХ-исследование) с антителами к CD138, ALK, Kappa, Lambda и IgG4. В иммуногистохимических препаратах, в инфильтрате было выявлено нормальное соотношение Kappa/Lambda, отсутствовала экспрессия ALK. При окрашивании с антителами к CD138 в инфильтрате подтверждалась примесь плазматических клеток (рис. 10), большая часть из которых имела IgG4-позитивное окрашивание (рис. 11). Соотношение CD138+/IgG4+ составило более 80%. Отмечалось более 200 IgG4-позитивных плазматических клеток в поле зрения при увеличении микроскопа х400.
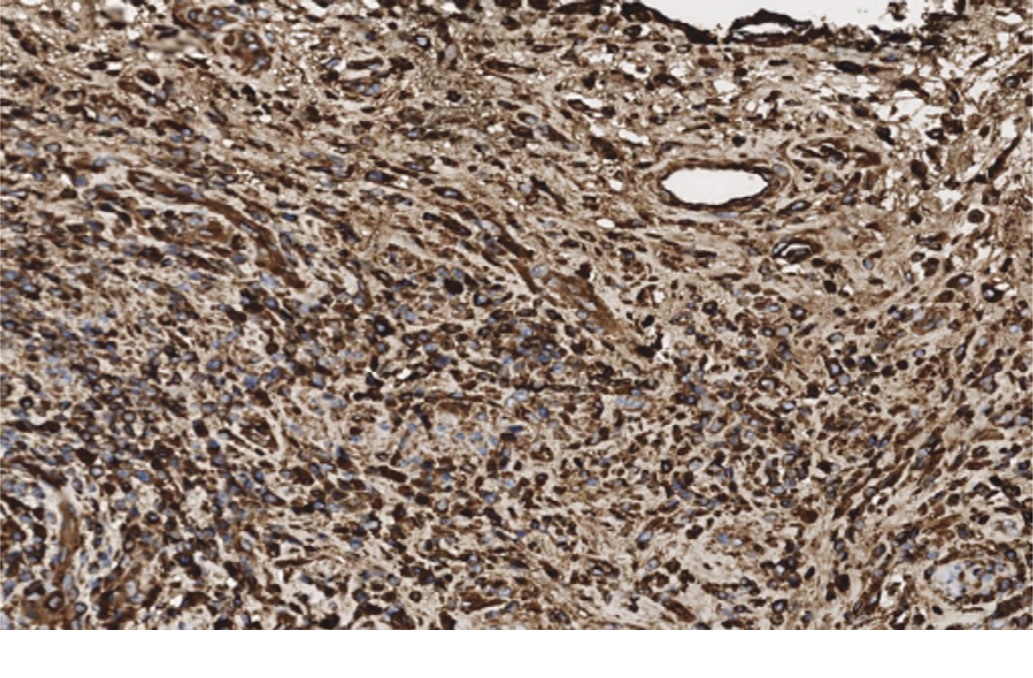
Рис. 11. Наличие позитивного окрашивания с антителами к IgG4 в опухолевом инфильтрате. x400
Fig. 11. There is a positive staining with IgG 4 antibodies in the tumor. x400
Морфологические и иммуногистохимические изменения соответствовали IgG4-ассоциированному уретериту (так называемому сегментарному уретериту) и IgG4–связанному интерстициальному нефриту. Злокачественного опухолевого роста в исследованном материале выявлено не было.
После получения результатов морфологического и ИГХ-исследования пациенту был определен уровень сывороточной концентрации IgG4, который составил 1,49 г/л (норма: 0,01-1,35 г/л).
Таким образом, на основании клинических, морфологических и лабораторных данных нами был установлен диагноз IgG4-ассоцированного заболевания левого мочеточника. В настоящее время за пациентом продолжается динамическое наблюдение совместно с ревматологами. Признаков рецидива заболевания не зарегистрировано.
ВЫВОДЫ
Нами представлено редкое клиническое наблюдение IgG4-ассоцированного заболевания мочеточника. Этот случай подчеркивает важность того, что в практической работе урологам необходимо учитывать возможность наличия данной патологии в при дифференциальной диагностике новообразований мочеточника, поскольку IgG4-АБ встречаются в различных органах и очень часто имитируют злокачественные новообразования. В подобных неоднозначных клинических ситуациях мы считаем необходимым включить в алгоритм диагностики определение сывороточной концентрации уровня IgG4. Правильное и своевременное распознание IgG4-АБ мочеточника позволит излечить пациента консервативно с помощью препаратов глюкокортикостероидного ряда и избежать агрессивного хирургического лечения.
ЛИТЕРАТУРА
1. Maritati F, Peyronel F, Vaglio A. IgG4-related disease: a clinical perspective. Rheumatology (Oxford) 2020;59(Suppl 3):123-31. https://doi.org/10.1093/rheumatology/kez667.
2. Zhang W, Stone JH. Management of IgG4-related disease. Lancet Rheumatol 2019;1:e55–65. https://doi.org/10.1016/S2665-9913(19)30017-7
3. Зыкова А.С., Новиков П.И., Бровко М.Ю., Акулкина Л.А., Моисеев С.В. IgG4- ассоциированное заболевание: что изменилось к 2020 году. Клиническая фармакология и терапия 2020; 29(3):4-13 [Zykova A, Novikov P, Brovko M, Akulkina L.A., Moiseev S.V. IgG4-related disease: the state of art. Klinicheskaia farmakologiia i terapiia = Clinical Pharmacology Therapy 2020; 29(3):4-13 (In Russian)]. https://doi.og/10.32756/0869-5490-2020-3-4-13.
4. Казанцева И.А., Лищук С.В. Новая системная патология – IgG4-связанная склерозирующая болезнь. Клиническая и экспериментальная морфология 2013;2:12-17 [Kazanceva I.A., Lishchuk S.V. A new systemic pathology is IgG4-related sclerosing disease. Klinicheskaya i Еksperimental'naya Мorfologiya = Clinical and Еxperimental Мorphology 2013;2:12-17(In Russian)].
5. Kamisawa T, Funata N, Hayashi Y, Eishi Y, Koike M, Tsuruta K, et al. A new clinicopathological entity of IgG4-related autoimmune disease. J Gastroenterol 2003;38(10):982-4. https://doi.org/10.1007/s00535-003-1175-y.
6. Umehara H, Okazaki K, Masaki Y, Kawano M, Yamamoto M, Saeki T, et al. A novel clinical entity, IgG4-related disease (IgG4RD): general concept and details. Mod Rheumatol 2012;22(1):1-14. https://doi.org/10.1007/s10165-011-0508-6.
7. Stone JH, Khosroshahi A, Deshpande V, Chan JKC, Heathcote JG, Aalberse R, et al. Recommendations for the nomenclature of IgG4-related disease and its individual organ system manifestations. Arthritis Rheum 2012;64(10):3061-7. https://doi.org/10.1002/art.34593.
8. Deshpande V, Zen Y, Chan JK, Yi EE, Sato Y, Yoshino T, et al (2012) Consensus statement on the pathology of IgG4-related disease. Mod Pathol 2012;25(9):1181–1192. https://doi.org/10.1038/modpathol.2012.72.
9. Kawano M, Saeki T. IgG4-related kidney disease an update. Curr Opin Nephrol Hypertens 2015;24(2):193-201. https://doi.org/10.1097/MNH.0000000000000102.
10. Morando A, D'Ambrosio G, Catanzaro F, La Rosa S, Sessa F. IgG4-related disease of the ureter: report of two cases and review of the literature. Virchows Arch 2013;462(6):673–678. https://doi.org/10.1007/s00428-013-1421-5.
11. Bissada NK, Finkbeiner AE. (1978) Idiopathic segmental ureteritis. Urology 1978;12(1):64–6; https://doi.org/10.1016/0090-4295(78)90370-9.
12. Tripp BM, Huttner I, Chu F, Taguchi Y. Idiopathic segmental ureteritis: clinicopathological definition. Can J Urol 1997;4(2):381–385.
13. Wallace ZS, Zhang Y, Perugino CA, Naden R, Choi HK, Stone JH. Clinical phenotypes of IgG4-related disease: an analysis of two international cross-sectional cohorts. Ann Rheum Dis 2019;78(3):406-12. https://doi.org/10.1136/annrheumdis-2018-214603.
14. Nomura H, Kinjyo T, Oida T, Yoneda S, Takezawa K, Tei N, et al. IgG4-related idiopathic segmental ureteritis which was difficult to distinguish from ureteral cancer: a case report. Hinyokika Kiyo. 2013;59(3):167-70.
15. Hosokawa C, Tsubakimoto M, Inoue Y, Goto T, Senju M, Yoshimura R. Radiologic features of inflammatory pseudotumor of the ureter. AJR Am J Roentgenol 2007;188(2):W202-5 https://doi.org/10.2214/AJR.05.0578.







