ВВЕДЕНИЕ
Малоинвазивные технологии находят все более широкое применение при лечении стрессового недержания мочи (СНМ) у женщин. Среди них особое место занимает метод трансуретрального введения объемообразующих веществ (ООВ). Это обусловлено приемлемой эффективностью данного вида лечения при неосложненных формах СНМ, запросом пациенток на относительно безопасный метод коррекции недержания, а также заинтересованностью специалистов в развитии малоинвазивного (офисного) вида медицинской помощи.
Хирургическая коррекция СНМ у ряда пациенток сопряжена с определенными рисками. Это касается как пожилых женщин с выраженной коморбидностью, так и пациенток молодого возраста, ведущих активный образ жизни и планирующих самостоятельные роды. Инъекции ООВ являются менее инвазивной альтернативой слинговым операциям и имеют меньший риск возникновения осложнений [1]. Поэтому женщины нередко предпочитают проведение менее травматичной процедуры с малой частотой осложнений, несмотря на более низкую ее эффективность [2].
Европейская ассоциация урологов (EAU) рекомендует ООВ женщинам с неосложненным СНМ, которые нуждаются в процедуре с низким риском осложнений и осознают, что возможны повторные инъекции и что долгосрочная эффективность этого вида лечения не установлена [3]. Рекомендации Американской Ассоциации урологов (AUA) предлагают ООВ в качестве варианта лечения для женщин со СНМ, которые хотят избежать инвазивного хирургического лечения, обеспокоены длительным временем восстановления после операции или у которых наблюдается недостаточное улучшение после предыдущего вмешательства по поводу СНМ [4]. Пациенток следует предупреждать о возможной необходимости повторных инъекций ООВ. Обобщая опубликованные данные, В.Ф. Беженарь и соавт. обозначили следующие показания для применения ООВ: 1. Предпочтения пациента или хирурга; 2. Тяжелые сопутствующие заболевания; 3. СНМ вследствие перенесенной лучевой терапии; 4. СНМ после формирования неоцистиса (артифициальный/новообразованный мочевой пузырь); 5. Рецидивные формы СНМ после слинговых операций; 6. СНМ, возникшее после установки пессария; 7. СНМ со значительным ургентным компонентом (при помощи ООВ можно проверить эффект повышения уретрального сопротивления перед проведением хирургического вмешательства) [5]. Не со всеми из этих положений можно безусловно согласиться, однако, широкие возможности применения ООВ несомненны.
Первым описанным в литературе ООВ стал парафин. Работы по его применению для лечения СНМ датируются 1900 г. В дальнейшем появились исследования по использованию тефлона (1973 г.), бычьего коллагена (1977 г.), аутологичного жира (1989 г.), силикона (1992 г.) [6]. В последующем были определены требования к «идеальному материалу» для ООВ: биосовместимость; отсутствие миграции; длительное сохранение в структуре ткани; минимальная воспалительная реакция и образование фиброзной ткани; канцер-негативность; отсутствие аллергических реакций, легкая проводимость через инъекционную иглу [7, 8]. Следует отметить, что идеального ООВ в настоящее время не существует.
Несмотря на имеющиеся публикации об успешной коррекции СНМ с применением объемообразующих агентов, отношение к ним неоднозначное, что связано с большим разнообразием ООВ, отличающихся по структуре и свойствам, противоречивыми данными об их эффективности и безопасности, а также недостаточным количеством сравнительных исследований (табл. 1).
Таблица 1. Результаты клинического применения различных ООВ
Table 1. Results of clinical use of various bulking agents
| Группа Group |
Наименование Name |
Состав Compound |
Эффективность (%) Efficiency (%) |
Запрос на повторное введение Reintroduction request |
Острая задержка мочеиспускания (ОЗМ) (%) Acute urinary retention (%) |
Уретральный болевой синдром Urethral pain syndrome |
|
|---|---|---|---|---|---|---|---|
| Наблюдение менее 24 месяцев Follow-up less than 24 months |
Наблюдение более 24 месяцев Observation over 24 months |
||||||
|
ООВ содержащие микрочастицы
|
Contigen | Коллаген животный, «сшитый» глутаральдегидом, взвешенный в физрастворе с добавлением фосфатного буфера Animal collagen cross-linked with glutaraldehyde, suspended in saline with the addition of phosphate buffer |
57-94% [27] | н/д | н/д | 6,6 | 5,9 |
| Coaptite | Микросферы гидроксилапатита кальция Calcium hydroxylapatite microspheres |
55-90% [28] | 60% (>37мес.) [22] 75% (>73 мес.) [29] |
16-70% [28, 29] |
4,8 | 0 | |
| Durasphere | Циркониевые микросферы с углеродным покрытием в гелевом наполнителе на водной основе Carbon-coated zirconia microspheres in a water-based gel filler |
33-66% [30] | 80% (>31мес.) [31] 21% (>36 мес.) [31] |
15% [32] | 9,5 | 13,4 | |
| Macroplastique | Термовулканизированный полидиметил-силоксан (силиконовый эластомер), суспендированный в поливинилпирролидоновом (PVP) геле-носителе. Thermovulcanized polydimethylsiloxane (silicone elastomer) suspended in a polyvinylpyrrolidone (PVP) gel carrier |
48-84% [33] | 60% (>36 мес.) [34] 46% (>46 мес.) [35] 57-80% (>60 мес.) [36] 21% (>62 мес.) [37] |
7-53% [33, 38] |
10,1 | 18,2 | |
| Vantris | Синтетический гидрогель с макрочастицами сополимера полиакрилового поливинилового спирта, растворенного в 40% растворе глицерола Synthetic hydrogel with polyacrylic polyvinyl alcohol copolymer macroparticles dissolved in 40% glycerol solution |
Вся достоверная информация только о введении при пузырно-мочеточниковом рефлюксе All reliable information only about the introduction of vesicoureteral reflux |
|||||
| Urolastic | Полидиметилсилоксановые микрочастицы в поливинилпирролидоне Polydimethylsiloxane microparticles in polyvinylpyrrolidone |
33-85% [39-42] |
17-35% [40-42] |
10,2 | 2,1 | ||
|
ООВ не содержащие микрочастиц
|
Bulkamid | Полиакриламидный (2,5%) гидрофильный гель с поперечной межмолекулярной связью Polyacrylamide (2.5%) hydrophilic cross-linked gel |
30-90% [43] | 42% (>96 мес.) [43] 70% (>38 мес.) [44] |
7-77% [45] | 3,5 | 3,7 |
| DAM± | Трехмерный водосодержащий биополимер, содержащий ионы серебра Three-dimensional water-containing biopolymer containing silver ions |
Официальные данные только при недержании мочи и кала у детей Official data only for urinary and fecal incontinence in children |
|||||
| Zuidex | Сополимер гиалуроновой кислоты и декстрана Copolymer of hyaluronic acid and dextran |
57% [46] | н/д | 43% [46] | 20% [46] | н/д | |
| Tegress | Сополимер этиленвинилового спирта Ethylene vinyl alcohol copolymer |
42-69% [47] | н/д | н/д | н/д | н/д | |
| Polytef | Политетрафторэтиленовая паста, с добавлением глицерина и полисорбата Polytetrafluoroethylene paste, with the addition of glycerin and polysorbate |
30-38% [48] | н/д | н/д | 26% [49] | н/д | |
Существуют два класса современных ООВ: дисперсные агенты, содержащие твердые микрочастицы в абсорбируемом жидком или гелевом носителе, и агенты, состоящие из гомогенного, не содержащего частиц, неабсорбируемого геля. Они имеют разные способы действия, а эффект объемообразования достигается благодаря различным механизмам. В случае ООВ с наличием твердых частиц их длительный эффект обусловлен возникновением вокруг частиц тканевой реакции на инородное тело, приводящей к образованию фиброзной капсулы [9]. Частицы, входящие в состав такого средства, должны иметь достаточный размер, чтобы предотвратить миграцию ООВ от места инъекции (диаметр > 80 мкм), и обладать необходимой прочностью, чтобы сохранять действие в течение длительного времени [8]. Эффект объемообразования, в результате, представляет собой комбинацию имплантированного материала и собственного коллагена [10, 11]. К препаратам этой группы относят: полидиметилсилоксан; оксид-циркониевые микросферы с углеродным покрытием; микросферы гидроксилапатита кальция; полиакрилатный полиспиртовый сополимер; поперечно сшитый глутаровым альдегидом коллаген, сополимер этиленвинилового спирта [8, 12]. Доклинические исследования проходит ООВ отечественной разработки на основе поли-ɛ-капролактона [13].
ООВ второго класса, не имеющие микрочастиц, обеспечивают клинический эффект только за счет создаваемого объема. Подобными материалами являются: трехмерный полиакриламидный сетчатый полимер; сополимеры гиалуроновой кислоты и декстрана [8].
G. Capobianco и соавт. в систематическом обзоре и метаанализе, в который вошло 21 исследование о применении ООВ при СНМ с периодом наблюдения ≤1 и >1 года, определили: суммарный показатель улучшения – 46,0% (95% ДИ: 37,0–57,0%) и 57,0% (95% ДИ: 39,0– 74,0%); обобщенную частоту излечения – 26,0% (95% ДИ: 21,0–32,0%) и 21,0% (95% ДИ: 16,0–27,0%); объективно-подтвержденную частоту успеха лечения – 67,0% (95% ДИ: 59,0–75,0%) и 46,0% (95% ДИ: 37,0– 55,0%) соответственно. «Сухими» себя почувствовали от 9,1% до 56,7% женщин. Нежелательные явления составили 0,4%: вагинальная инфекция, воспаление, склерозирующий лихен (lichen sclerosis), ухудшение симптомов недержания мочи [14].
С учетом выявленных в ходе клинического применения недостатков эффективности и безопасности ООВ, продолжаются поиски «идеального» имплантационного материала, к свойствам которого относят: биосовместимость; отсутствие осложнений, связанных с антигенными свойствами, токсичностью, канцерогенностью, склонностью к инфицированию; простоту применения; длительность эффекта, отсутствие биодеградации и миграции [5].
В последнее время все большее внимание обращают на применение биоматериалов нового поколения на основе природных биорезорбируемых полимеров (биополимеров) с набором уникальных качеств, позволяющих целенаправленно осуществлять мобилизацию собственных ресурсов организма на восстановление поврежденных органов и тканей. К таким относят продукты гиалуроновой, полимолочной, гликолиевой кислот, коллаген и другие природные субстанции.
К этим материалам предъявляют особые требования:
• биосовместимость изделия и продуктов его деструкции;
• наличие биостимулирующих свойств;
• возможность регулировать время биодеградации;
• способность к неоваскуляризации и неоиннервации;
• выполнение функций каркаса и питательной среды для клеточных компонентов тканеинженерных конструкций;
• хорошие адгезивные свойства к клеточным культурам;
• стимулирование процессов пролиферации и дифференциации клеток;
• возможность стерилизации без изменения медико-технических свойств конечного продукта.
Однако имплантатов с полным набором перечисленных свойств практически не существует. Поэтому предлагаются продукты с более узким направленным действием, например, материалы для временного поддержания объема тканей или внесение витаминного комплекса для стимулирования метаболических процессов [15].
Учитывая вышеизложенное, сохраняется потребность в разработке объемобразующих препаратов, максимально соответствующих требованиям к «идеальному» агенту, среди которых биополимеры с высоким профилем безопасности, хорошей клинической эффективностью и продолжительностью эффекта, имеют явные перспективы.
Цель исследования: оценить эффективность и безопасность введения «Композиции гетерогенного имплантируемого геля «Сферо®ГЕЛЬ LONG» для коррекции стрессового недержания мочи у женщин.
МАТЕРИАЛЫ И МЕТОДЫ
Исследуемый препарат
В настоящем исследовании использован отечественный объемообразующий препарат, зарегистрированный в РЗН рег. уд. № ФСР 2012/13033 от 26.11.2021 г. как «Композиция гетерогенного имплантируемого геля «Сферо®ГЕЛЬ» в варианте исполнения LONG (АО «БИОМИР сервис», Россия), относящийся к биодеградируемым имплантатам, полученным из тканей животного происхождения.
«Сферо®ГЕЛЬ» (СГ) представляет собой новый продукт, принципиально отличающийся от своих предшественников. Это – в инъекционных шприцах гетерогенный гель, имеющий зернистую плотную структуру сероватого цвета, применяемый для замещения дефектов тканей в восстановительной и заместительной хирургии. Композиция являет собой миметик внеклеточного матрикса. В редко сшитом прозрачном геле, состоящем из протеогликанов, гликопротеинов, гиалуроновой кислоты, находятся микронизированные частицы сильно сшитого коллагена в процентном соотношении 30 к 70. Гелевая составляющая стимулирует выработку собственного внеклеточного матрикса фибробластами, а твердые частицы являются пролонгированным поставщиком аминокислот для выработки собственного коллагена.
Формирование гетерогенной структуры гидрогеля позволило увеличить время его биодеградации до нескольких месяцев, по сравнению с биоимплантатами из коллагена, рассасывающимися в течение 3-4 недель и повышающих риск формирования рубцовой ткани. СГ обладает развитой структурой диффузионных пор (200-400 мкм), что позволяет клеткам свободно прикрепляться к поверхности микрочастиц. Варьируя степень сшивки, размер микрочастиц в геле и отношение твердой (микрочастицы) и жидкой фаз, был создан линейный ряд имплантатов, отличающихся размером микрочастиц и временем биодеградации: LIGHT; MEDIUM; LONG.
Сферо®ГЕЛЬ LONG (СГЛ) содержит микрочастицы (200-360 мкм), имеет время биодеградации – от 6 месяцев до 1 года и характеризуется: содержанием связанной воды – не менее 32,8 ± 0,5 мас.%; набухаемостью – не ниже 86,6 ± 3,0 мас.%; рН – 6,8–7,2; упругостью в 1170±12 Па и вязкостью в 62,9±7,9 Па. То есть, образец в большей степени обладает упругими, чем вязкими свойствами. Преобладание упругих свойств над вязкостными свойствами позволяют СГ оставаться в области его имплантации в мягкие ткани до полной резорбции, что было доказано в экспериментах на крысах.
СГ – биоактивный биомиметик – гидрогель, содержащий практически все компоненты внеклеточного матрикса тканей животного происхождения. Его несшитая фракция включает комплекс пептидов (30-50 мг/г), уроновых кислот (0,8-1,2 мг/г) и гексозаминов (2,0-3,0 мг/г). Препарат содержит: экстракт коллагенсодержащий 30% (пептиды частично гидролизованного коллагена; протеогликаны (гиалуроновую кислоту, хондроитин-4-сульфат, хондроитин-6-сульфат, дерматансульфат, гепарин, гепарансульфат, гликопротеины, белки — антитела, интерфероны, белки системы комплемента и плазмы крови, рецепторные белки; моносахариды (глюкозу, фруктозу, маннозу, глюкозамин, галактозамин, фруктозамин, сиаловую кислоту) и сшитые и микронизированные частицы коллагена 70% [15, 16].
Биологическая безопасность СГ была доказана в экспериментах in vitro и in vivo, проведенных в соответствии с национальным стандартом ГОСТ Р ISO 10993 в лаборатории, аккредитованной для доклинических испытаний медицинских изделий. Имплантируемый материал показал себя как безопасное и биосовместимое медицинское изделие, не имеющее как общетоксических эффектов, так и специфических видов токсичности. При этом, были выявлены его пролиферативные свойства, соответствующие полноценной культуральной среде. В экспериментах in vitro на стволовых клетках человека было показано достоверное увеличение количества дифференцированных клеток, продуцирующих собственный внеклеточный матрикс [15].
Конечный продукт СГ представляет собой находящийся в шприце стерильный прозрачный, слегка опалесцирующий, рН сбалансированный вязкоупругий гидрогель, в ряде случаев имеющий видимую зернистую структуру. На территории Российской Федерации в качестве медицинского изделия СГ зарегистрирован с 2006 года и нашел применение в эстетической медицине, травматологии, ортопедии и других областях для замещения недостающих или поврежденных тканей.
На базе АО «БИОМИР сервис» (г. Краснознаменск) налажен выпуск трех видов препарата под торговым знаком Сферо®ГЕЛЬ, отличающихся размером микрочастиц «сшитого» коллагена и вязкостью «несшитого» гидрогеля [15, 17, 18].
Пациенты
В открытое проспективное исследование было включено 20 пациенток со СНМ легкой или умеренной степени, подписавших информированное согласие на данный вид лечения. Возраст пациенток составил 41–76 лет.
Предварительно (визит 0) всем пациенткам выполнили клинико-уродинамическое обследование, включавшее: сбор анамнеза, оценку жалоб, регистрацию демографических данных, заполнение визуальной аналоговой шкалы выраженности недержания мочи (ВАШ), опросника качества жизни QOL. При осмотре на гинекологическом кресле обращали внимание на состояние уретры, признаки воспаления половых органов, наличие и выраженность пролапса гениталий и/или цистоцеле, результат кашлевой пробы. Выполняли ультразвуковое исследование органов мочеполовой системы, общий анализ мочи, одночасовой тест с прокладкой (PadTest), урофлоуметрию с определением остаточной мочи и комбинированное уродинамическое исследование (КУДИ), включая цистометрию и профилометрию уретры. В ходе КУДИ оценивали следующие показатели:
• максимальная цистометрическая емкость (MCC, мл);
• наличие детрузорной гиперактивности;
• максимальная скорость мочеиспускания (Qmax, мл/сек);
• объем выделенной мочи (VV, мл);
• объем остаточной мочи (PVR, мл).
• максимальное давление закрытия уретры (MUCP, см Н2О);
• функциональная длина уретры (FUL, мм).
Основными параметрами, определяющими степень выраженности недержания мочи у женщин, были: стандартизированная оценка жалоб и качества жизни, PadTest и данные профилометрии уретры. Легкой степенью СНМ считали потерю мочи за час до 10 г по данным PadTest’а, на фоне снижения давления в зоне внутреннего сфинктера уретры до 50 см H2O. За умеренную степень СНМ принимали потерю мочи от 11 до 20 г, при снижении давления в зоне сфинктера от 49 до 35 см H2O.
Критериями исключения были: императивное и смешанное недержание мочи; гиперактивный мочевой пузырь; инфравезикальная обструкция; нестабильная уретра и нарушение анатомии тазовых органов; пролапс гениталий выше II степени (по классификации POP-Q – pelvic organ prolapse quantifications); активный воспалительный процесс мочевого пузыря и/или половых органов; острый инфекционный процесс любой локализации; некоррегируемая коагулопатия; тяжелые сопутствующие заболевания (сахарный диабет в фазе декомпенсации, ишемическая болезнь сердца, тяжелая недостаточность кровообращения); наличие онкологических заболеваний; аутоиммунное заболевание в анамнезе или иммунотерапия; индивидуальная непереносимость (в т.ч. гиперчувствительность на белок, препараты гиалуронового ряда в анамнезе); наличие беременности или планируемая беременность; острые общие состояния; прием лекарственных препаратов, способных повлиять на результаты исследования; нахождение в состоянии или ситуации, которая, по мнению врача, сопровождается значительным риском для здоровья пациента, может исказить результаты клинического исследования или существенно повлиять на участие пациента в клиническом исследовании; неспособность женщины выполнять рекомендации и/или посещать врача в указанное время; отказ больной от участия в исследовании.
Процедура введения ООВ
Введение препарата «Сферо®ГЕЛЬ» LONG (визит 1) осуществляли на фоне физиологического наполнения мочевого пузыря (200-300 мл) трансуретральным методом, с использованием фибро- или ригидного уретроцистоскопа № 18-22 Ch под местной аппликационной анестезией лидокаин-содержащим гелем. Имплантацию ООВ проводили под контролем зрения специальной гибкой эндоскопической иглой, диаметром 0,8/1,66 мм на глубину 2-4 мм (в зависимости от складчатости уретры), в подслизистый и мышечный слои мочеиспускательного канала, в три точки, разноудаленные от шейки мочевого пузыря, по боковым и нижней стенкам уретры на 2, 6 и 10 часах условного циферблата, до формирования папул, закрывающих просвет уретры и шейки мочевого пузыря (рис. 1). Суммарно за манипуляцию пациенткам вводили от 2,0 до 4,5 мл препарата. После введения ООВ женщина самостоятельно опорожняла мочевой пузырь. В дренировании мочевого пузыря необходимости нет.
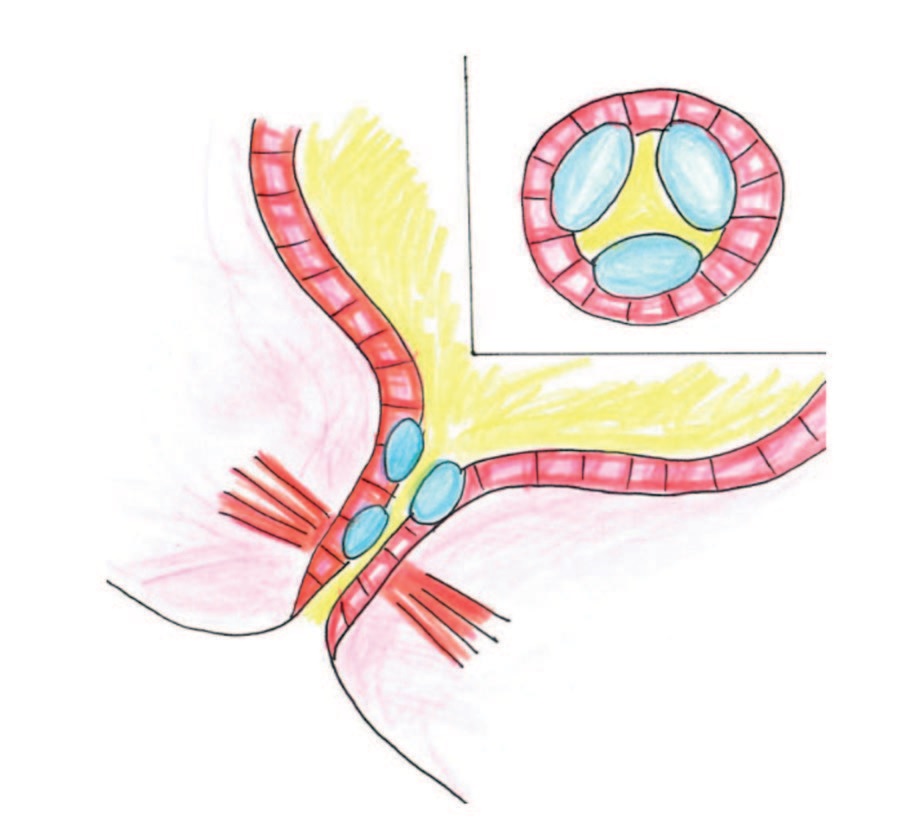
Рис. 1. Оригинальная схема введения ООВ
Fig 1. The original scheme for the injection of a bulking agent
Динамическое наблюдение и повторное введение ООВ
При контрольном визите через 14 дней после введения ООВ (визит 2) оценивали качество мочеиспускания, проявления недержания мочи и наличие нежелательных явлений. При отсутствии положительного эффекта выполняли повторное ведение СГЛ по методике, описанной выше, в те зоны уретры, где по данным уретроцистоскопии выраженность папул ООВ была недостаточной. При этом, объем вводимого препарата был, соответственно, ниже.
Следующие контрольные обследования проводили через 3 и 6 месяцев после первичного введения СГЛ (визиты 3 и 4). Оценивали выраженность СНМ по ВАШ, качество жизни, выполняли PadTest, урофлоуметрию с измерением остаточной мочи и КУДИ. Результаты лечения 9 пациенток удалось отследить через один год.
Статистический анализ
Статистическую обработку полученных в ходе исследования данных провели с помощью программы Statistica for Windows 6.1 (StatSoft Inc.). Качественные признаки описывали в абсолютных и относительных (%) показателях, количественные – с помощью среднего арифметического и стандартного отклонения. Для оценки статистической достоверности различий между количественными показателями и двумя связанными группами использовали связанный критерий Стьюдента (парный t-критерий). Уровень достоверности был принят как достаточный при p<0,05.
РЕЗУЛЬТАТЫ
По данным предварительного обследования СНМ легкой степени было выявлено у 13 (65%) женщин, а умеренной выраженности – у 7 (35%). Средние величины основных клинических показателей до лечения представлены в таблице 2.
При оценке состояния больных через 14 дней после процедуры, у 17 (85%) эффект оценили, как удовлетворительный. При этом, у 6 женщин (30%) наблюдали полное удержание мочи. Потребность в дополнительном введении СГЛ возникла у 11 женщин (55%), что и было выполнено. В ходе проведения имплантаций ООВ осложнений не было ни у одной из женщин.
Через 3 и 6 месяцев после введения ООВ отмечено улучшение ключевых параметров по сравнению с исходными данными: достоверное уменьшение показателя ВАШ на 70,1 и 63,6%; увеличение MUCP – на 8,9 и 7,9%; увеличение FUL – на 14,3 и 18,2%; статистически-значимое уменьшение показателя PadTest’а – на 61,0 и 53,7%; улучшение показателя QOL – на 60,6 и 48,5%, соответственно. Отмечено некоторое снижение Qmax – на 11,2 и 8,3%. Изменения других показателей не вышли за рамки нормальных значений (табл. 2).
Таблица 2. Динамика основных клинических показателей в течение 6 месяцев (n = 20)
Table 2. Dynamics of the main clinical parameters during 6 months (n = 20)
| Показатель Index |
До лечения (Визит 0) Before treatment (Visit 0) |
Через 3 мес. (Визит 2) 3 months later (Visit 2) |
Через 6 мес. (Визит 3) 6 months later (Visit 3) |
|---|---|---|---|
| ВАШ / VAS | 7,7 ±2,0 | 2,3 ± 1,3 (- 70,1%) * | 2,8 ± 1,3 (- 63,6%) * |
| QOL (балл / points) | 3,3 ±1,2 | 1,3 ± 1,0 (- 60,6%) | 1,7 ± 1,2 (- 48,5%) |
| Qmax (мл/с / ml/s ) | 20,5 ± 5,3 | 18,2 ± 5,8 (- 11,2%) | 18,8 ± 5,6 (- 8,3%) |
| PVR (мл / ml) | 7,0 ± 2,1 | 19,2 ± 8,6 (± 174,3%) | 23,8 ± 6,2 (± 240%) |
| VV (мл / ml ) | 297,2 ± 65,6 | 305,0 ± 69,6 (± 2,6%) | 294,2 ± 70,9 (- 1,0%) |
| МСС (мл / ml) | 312,1 ± 83,3 | 320,1 ± 99,7 (± 2,6%) | 325,9 ± 76,0 (± 4,4%) |
| MUCP (см Н2О / sm Н2О ) | 48,4 ±11,9 | 52,7 ± 12,5 (± 8,9%) | 51,9 ± 12,1 (± 7,9%) |
| FUL (мм / mm ) | 20,3 ± 8,2 | 23,2 ± 8,3 (± 14,3%) | 24,0 ± 8,4 (± 18,2%) |
| PadTest (г) / (g) | 8,2 ± 1,9 | 3,2 ± 1,1 (- 61,0%) * | 3.8± 1,1 (- 53,7%) * |
* Статистически значимое различие (p < 0,05); * Statistically significant difference (p < 0.05)
При оценке результата через 6 мес., у 17 пациенток (85%) эффект лечения и качество жизни оценили, как удовлетворительные: по данным теста с прокладкой потеря мочи за 1 час составляла менее 5 г. Причем, у 11 (55%) недержание мочи исчезло, то есть был достигнут полный эффект. Отсутствие удовлетворительного эффекта отметили у трех женщин (15%), им было предложено оперативное лечение СНМ.
Отдаленные результаты до 12 месяцев удалось проследить в группе 9 женщин с хорошим эффектом имплантации ООВ. Динамика основных показателей через год после имплантации составила: по показателю ВАШ – снижение на 52,8%; по часовому тесту с прокладкой – уменьшение на 41,1%; улучшение качества жизни по QOL – на 48,3% (табл. 3, рис. 2).
Таблица 3. Динамика основных клинических показателей в течение 12 месяцев (n = 9)
Table 3. Dynamics of the main clinical indicators within 12 months (n = 9)
| Показатель Index |
До лечения Before treatment |
Через 3 мес. 3 months later |
Через 6 мес. 6 months later |
Через 12 мес. 12 months later |
|---|---|---|---|---|
| ВАШ / VAS | 5,3 ± 1,3 | 2,7 ± 0,9 (- 49,1%) | 2,8 ± 1,9 (- 47,2%) | 2,5 ± 1,7 (-52,8%) |
| QOL (балл / points) | 2,9 ± 0,8 | 1,8 ± 0,6 (- 37,9%) | 1,7 ± 1,2 (- 41,4%) | 1,5 ± 1,1 (- 48,3%) |
| Qmax (мл/с / ml/s) | 20,1 ± 4,7 | 17,7 ± 5,0 (- 11,9%) | 18,6 ± 5,5 (- 7,5%) | 16,9 ± 5,0 (-15,9%) |
| PVR (мл / ml) | 8,1 ± 2,2 | 22,5 ± 5,8 (± 177,8%) | 23,6 ± 6,1 (± 291,4%) | 21,4 ± 5,6 (± 164,2%) |
| VV (мл / ml) | 315,0 ± 90,0 | 305,8 ± 73,7 (- 2,9%) | 291,3 ± 70,2 (- 7,5%) | 264,8 ± 63,8 (- 15,9%) |
| МСС (мл / ml) | 333,0 ± 45,9 | 306,1 ± 71,9 (- 8,1%) | 322,6 ± 75,2 (- 3,1%) | 293,3 ± 68,4 (- 11,9%) |
| MUCP (см Н2О / sm Н2О) | 47,1 ± 6,7 | 56,5 ± 10,7 (20,0%) | 51,4 ± 11,9 (± 9,1%) | 46,7 ± 10,9 (- 0,9%) |
| FUL (мм / mm) | 19,5 ± 1,1 | 20,3 ± 7,0 (± 4,1%) | 21,5 ± 7,4 (± 10,3%) | 21,6 ± 7,6 (± 10,8%) |
| PadTest (г) / (g) | 7,3 ± 2,3 | 3,4 ± 1,8 (- 53,4%) | 3,8 ± 2,0 (- 47,9%) | 4,2 ± 2,9 (- 41,1%) |
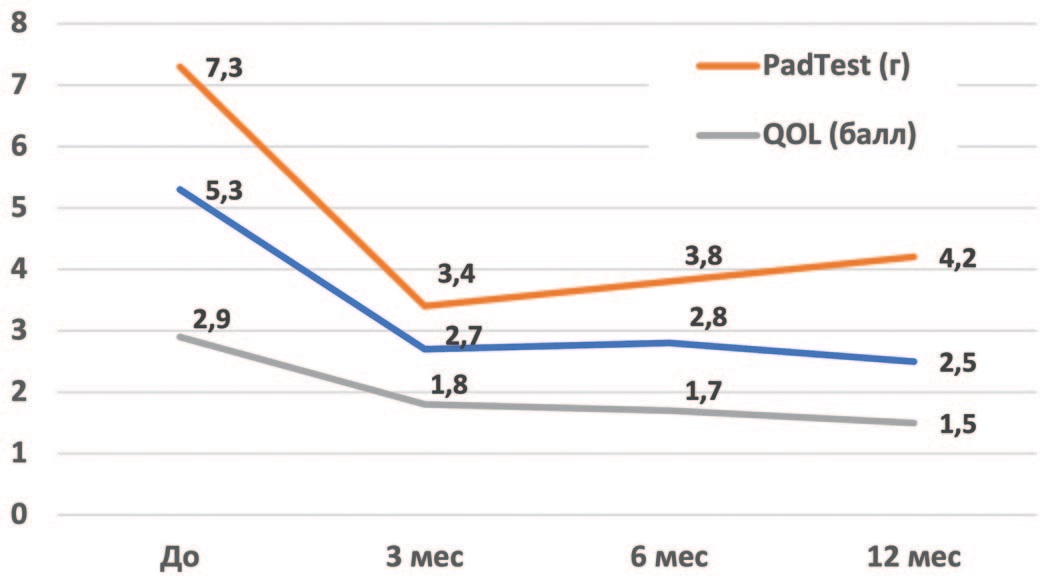
Рис. 2. Динамика основных клинических показателей в течение 12 месяцев (n = 9)
Fig. 2. Dynamics of the main clinical indicators within 12 months (n = 9)
У данных 9 пациенток через 6 месяцев наблюдали полный эффект – отсутствие СНМ. Через год наблюдения недержание мочи также отсутствовало у всех пациенток. Запрос на повторное введение ООВ поступил от 3 из 8 оставшихся женщин, хотя потеря мочи у них и не превышала 5 г в час.
После процедуры имплантации СГЛ задержки мочеиспускания и необходимости катетеризации мочевого пузыря не отмечено ни у одной из пациенток. Аллергических реакций, боли, выраженной гематурии, инфекции, эрозии тканей в месте инъекции ООВ, как и гиперактивности мочевого пузыря «de novo» не наблюдали.
Клиническое наблюдение
Пациентка Д., 41 год, обратилась с жалобами на подтекание мочи при физических нагрузках, особенно при беге и занятиях в тренажерном зале. Данные жалобы возникли после вторых самостоятельных родов 1,5 года назад. В первый год после родоразрешения женщина в домашних условиях выполняла упражнения Кегеля без эффекта. В анамнезе также – курс БОС-терапии №10 с незначительным клиническим эффектом. Использует одну урологическую прокладку в сутки.
Пациентке проведено обследование, включавшее: заполнение опросников (ВАШ, QoL), одночасовой тест с прокладкой, ультразвуковое исследование органов мочевой системы и таза, уродинамическое исследование (урофлоуметрия, цистометрия, профилометрия уретры). Результаты обследования: ВАШ – 5 баллов; QOL – 3 балла; одночасовой PadTest – потеря мочи 6 г. При «свободной» урофлоуметрии – необструктивный тип кривой мочеиспускания (рис. 3).
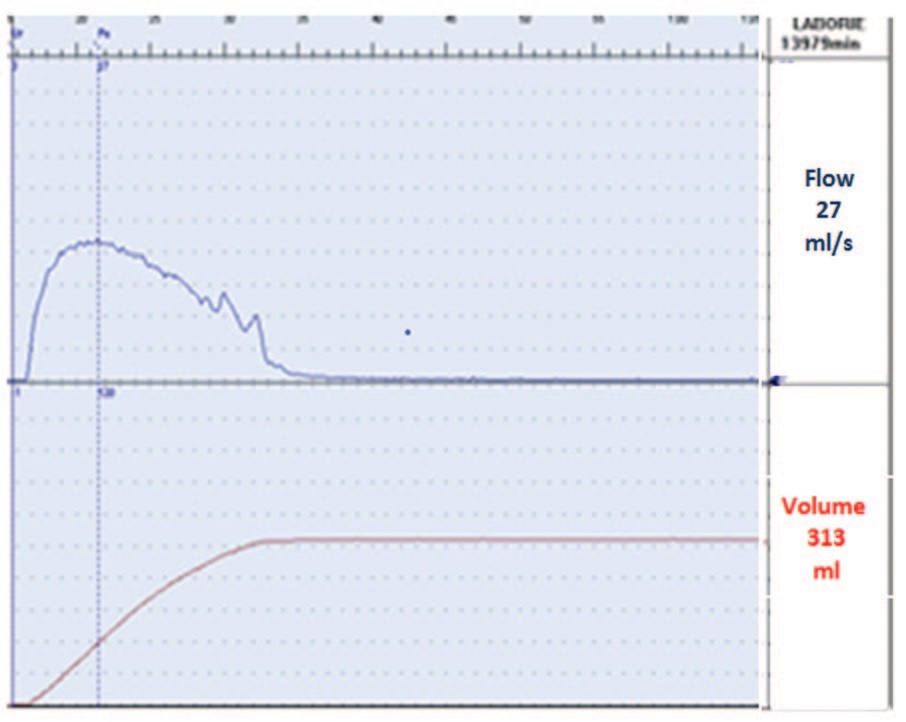
Рис. 3. Урофлоуграмма больной Д. до лечения
Fig. 3. Uroflowgram of patient D. before treatment
По данным цистометрии: чувствительность мочевого пузыря не нарушена; детрузорной гиперактивности, спонтанной и спровоцированной на протяжении всей фазы наполнения не зарегистрировано; максимальная цистометрическая емкость – 295 мл; кашлевые пробы положительные (рис. 4). При исследовании функции уретры выявлена недостаточность сфинктерного аппарата мочевого пузыря, MUCP – 49 cм H2O (рис. 5).
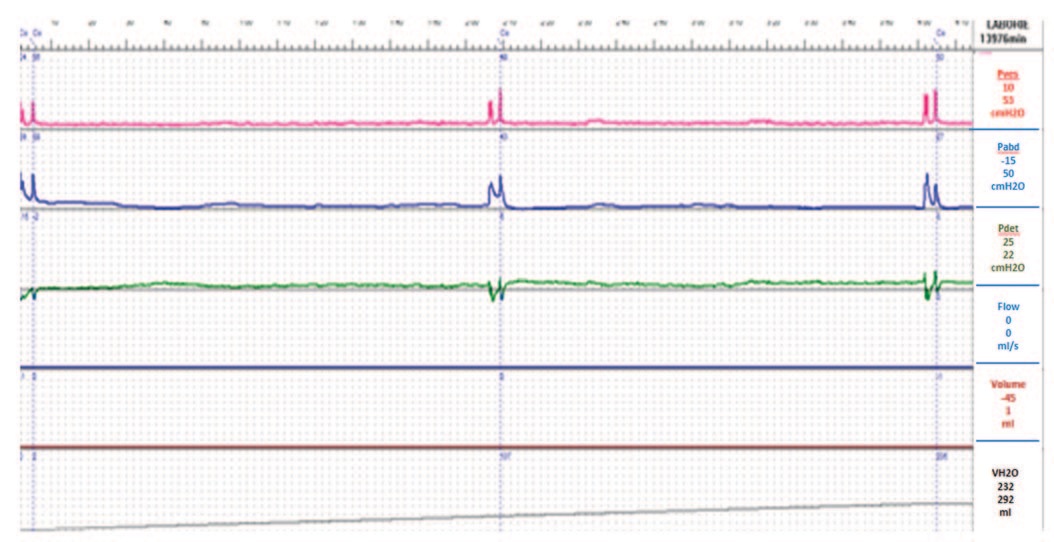
Рис. 4. Цистометрограмма больной Д. до лечения
Fig. 4. Cystometrogram of patient D. before treatment
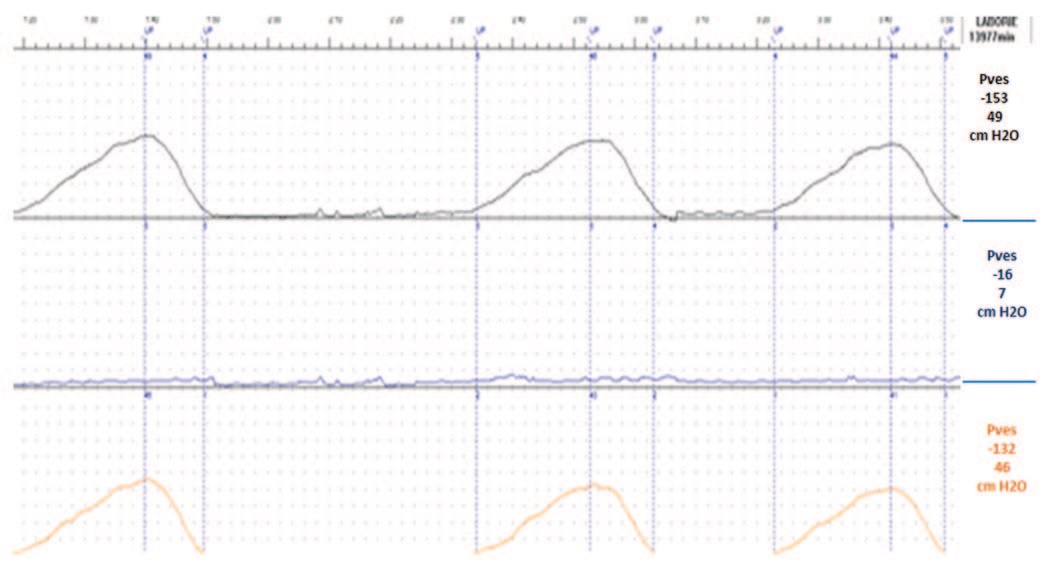
Рис. 5. Профилометрограмма уретры больной Д. до лечения
Fig. 5. Profilometrogramm of the urethra of patient D. before treatment
По результатам проведенного обследования пациентке поставлен диагноз «стрессовое недержание мочи легкой степени», в связи с чем, ей дважды с двухнедельным интервалом проведена трансуретральная имплантация СГЛ суммарным объемом 6,5 мл (4 мл и 2,5 мл) соответственно. Введение ООВ проводилось двукратно по описанной выше методике, так как после первой процедуры необходимого эффекта достигнуто не было. После второй имплантации СГЛ у пациентки наступил хороший клинический эффект, который прослежен через 12 месяцев: ВАШ – 1 балл; PadTest – 0 г.; QOL – 1 балл; при урофлоуметрии – необструктивный тип мочеиспускания, MUCP – 54 cм H2O (рис. 6-8). По данным магнитно-резонансной томографии (МРТ) органов таза по ходу уретры определяются участки уплотнения до 10 мм, которые могут соответствовать положению ООВ (рис. 9).
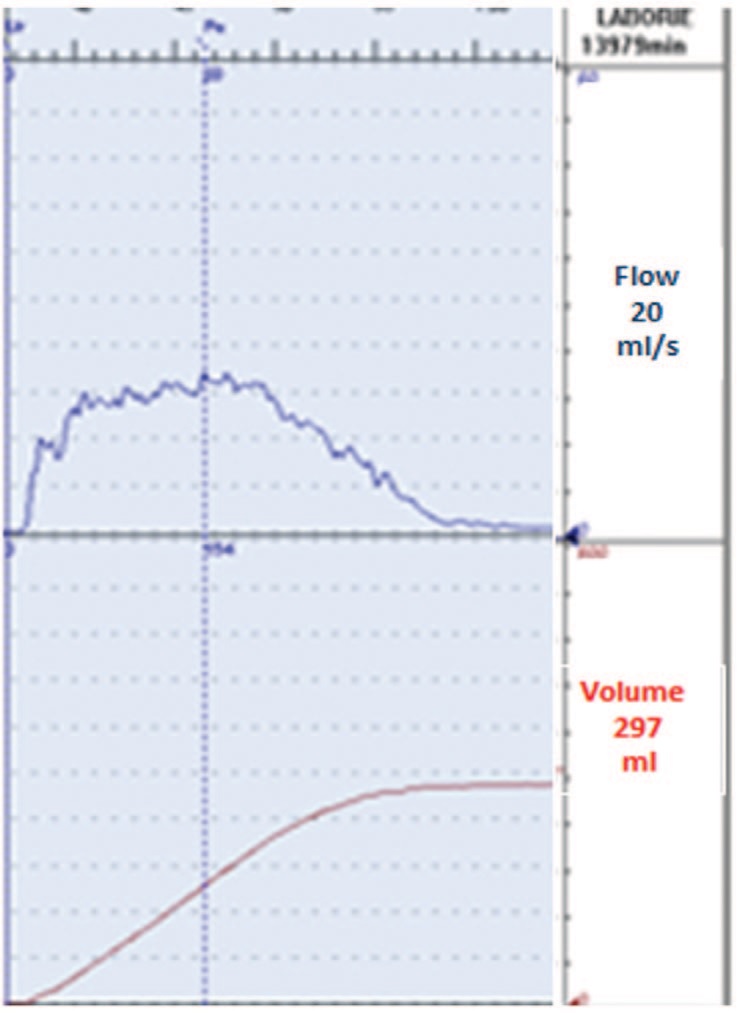
Рис. 6. Урофлоуграмма пациентки Д. через 12 мес. после лечения
Fig. 6. Uroflowgram of patient D. 12 months after treatment
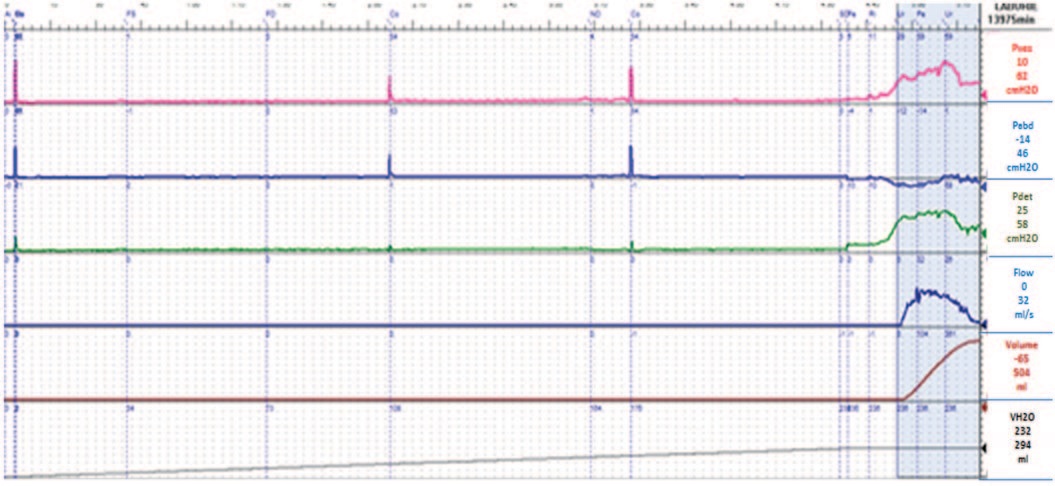
Рис. 7. Микционная цистометрограмма пациентки Д. через 12 мес. после лечения
Fig. 7. Voiding cystometrogram of patient D. 12 months after treatment
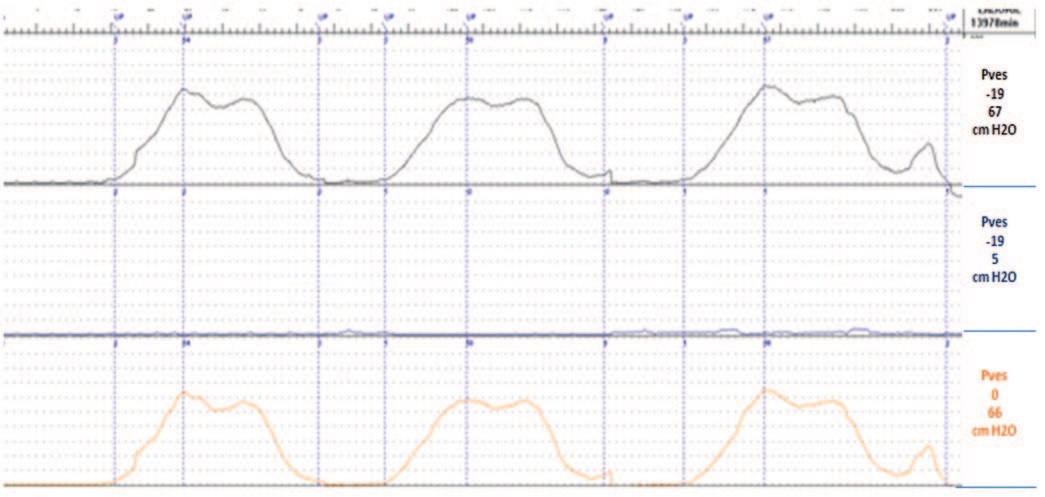
Рис. 8. Профилометрограмма уретры пациентки Д. через 12 мес. после лечения
Fig. 5. Profilometrogramm of the urethra of patient D. 12 months after treatment
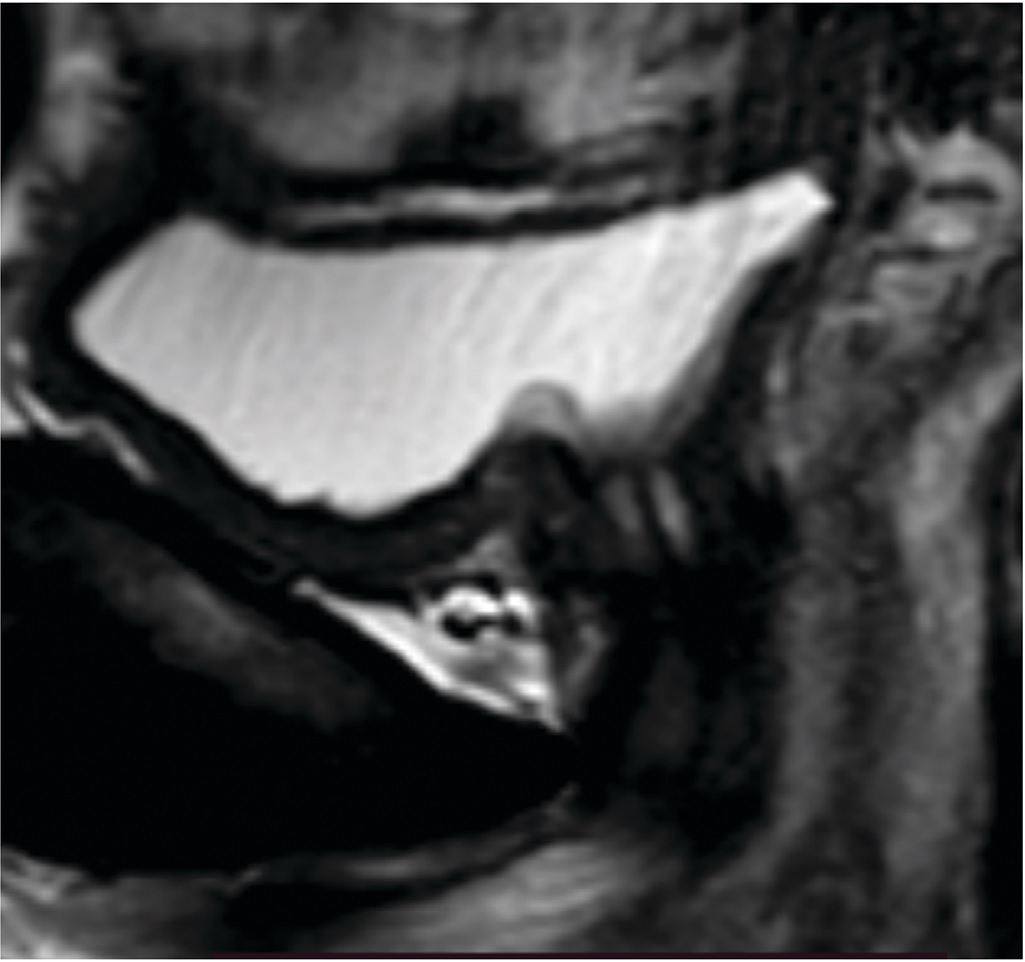
Рис. 9. МРТ органов таза пациентки Д. после лечения
Fig. 9. MRI of the pelvic organs of patient D. after treatment
Таким образом в данном клиническом случае у пациентки достигнута полная эффективность лечения, которая сохранилась до года наблюдения.
ОБСУЖДЕНИЕ
В настоящее время в клинике используют ряд ООВ, основное различие между которыми заключается в их структуре – наличию или отсутствию микрочастиц. Проведенные исследования по применению различных ООВ для коррекции СНМ показали противоречивые данные по эффективности (30 – 94%) и безопасности, которые колебались в широких пределах [12].
Вероятно, это связано c различным составом примененных ООВ, «несимметричностью» групп пациенток, отобранных для лечения, различными методиками введения ООВ, неодинаковой длительностью наблюдения и разными подходами при определении эффективности. По результатам клинического применения ряд препаратов был исключен из использования в связи с развитием выраженных побочных эффектов (табл. 1).
Препарат из бычьего коллагена (Contigen) продемонстрировал хороший клинический эффект: 57-94% при сроках наблюдения до 12 месяцев. Этот препарат стал эталоном сравнения для трех других ООВ. Для всех агентов было показано достоверное уменьшение веса прокладок и выраженности недержания мочи по ВАШ. После лечения PadTest оказался негативным у 73,2% больных. Общий уровень осложнений был низким для всех агентов. Согласно результатам исследования, за повторной инъекцией коллагена через 1 год обратились 71% пациенток, через 2 года — 58%, через 3 года — 46%. По итогам сравнительного анализа четырех ООВ (Contigen, Zuidex, Tegress, Bulkamid) не было выявлено значимых различий в эффективности и безопасности изучаемых препаратов [19].
V. Kirchin и соавт. в кохрановском систематическом обзоре 13 исследований различных ООВ с участием 2004 женщин, при анализе 8 работ, где сравнивали разные объемообразующие агенты, отметили, что силиконовые частицы, гидроксилапатит кальция, этиленвиниловый спирт, углеродные сферы, как и сополимер гиалуроновой кислоты и декстрана, убедительно не показали большей эффективности, чем коллаген [8].
Систематический обзор V. Hoe и соавт. показал, что синтетические ООВ не уступали коллагену (Contigen) в краткосрочной перспективе. Кроме этого, не было обнаружено статистически значимых различий в эффективности коллагена и других ООВ. Таким образом, качественно, все ООВ, по‐видимому, имеют сходные результаты, со средними показателями успеха в диапазоне от 30% до 80% при наблюдении менее 24 месяцев. Однако долгосрочных данных, сравнивающих различные ООВ с препаратом из коллагена, недостаточно [20].
При этом, использование бычьего коллагена, сшитого глутаровым альдегидом (Contigen), несмотря на приемлемую эффективность, сопровождалось кожными реакциями повышенной чувствительности и поздними осложнениями в виде замедленных кожных реакций, артралгии, эмболии легочной артерии и лобкового остеита, что привело к снятию продукта с производства. Сравнение альтернативных ООВ не позволило сделать четких выводов в пользу большей безопасности того или иного препарата, хотя декстраномер гиалуроновой кислоты был связан с большим количеством местных побочных эффектов и сегодня ограничен в применении для лечения СНМ [8].
В настоящем исследовании был применен препарат СГЛ на основе животного коллагена (куриного и склерального от сельскохозяйственных животных) высокой степени очистки, в связи с чем на фоне достижения удовлетворительной эффективности (улучшение – 85%, исчезновение недержания – 55% через 6 месяцев), соответствующей лучшим показателям других ООВ при умеренном и незначительном СНМ, продемонстрирован высокий профиль безопасности. Каких- либо осложнений, встречавшихся при использовании прочих агентов, не наблюдали.
В литературе, помимо характерных для коллагена, описаны другие побочные эффекты введения ООВ: боль в месте инъекции, инфекция, временная задержка мочи, гематурия, ургентность «de novo», периуретральный абсцесс, формирование псевдокист, эрозия уретры, формирование фистул, миграция ООВ, миграция микрогранул в лимфоузлы и др. [21, 22]. Ни одного из перечисленных осложнений в нашем исследовании зарегистрировано не было.
Запрос на повторное введение ООВ после 6 месяцев наблюдения поступил от 16,7% женщин нашей группы, хотя потеря мочи у них была незначительной. Этот показатель также не превышает известные данные по другим ООВ (табл. 1).
Двумя наиболее распространенными способами введения ООВ являются периуретральный и трансуретральный, целью последнего является имплантация субстанции в подслизистую оболочку в проксимальном или среднем отделе мочеиспускательного канала. Сравнение этих методов показало сходные результаты удержания мочи, но несколько более высокую (хотя и статистически незначимую) частоту ранних осложнений при периуретральных инъекциях ООВ [8]. В одном исследовании с участием 30 женщин было показано слабое (клинически незначимое) преимущество в удовлетворенности пациенток после введения ООВ в среднюю уретру, по сравнению с инъекциями в шейку мочевого пузыря, но без очевидной разницы в уровне удержания мочи [23]. А.Ю. Цуканов и соавт. предложили трансвагинальный пункционный доступ введения ООВ в парауретральные ткани проксимальной части уретры и шейки мочевого пузыря под ультразвуковым контролем [24]. В настоящем исследовании мы применили оригинальный модифицированный метод трансуретрального введения ООВ в подслизистый и мышечный слои уретры в три точки по боковым и нижней стенкам, разноудаленные от шейки мочевого пузыря, который продемонстрировал удовлетворительные результаты (рис. 1).
Комбинированное уродинамическое исследование – объективный метод оценки функциональных нарушений мочевого пузыря и уретры. S. Mohr и соавт. по результатам применения четырех ООВ отметили достоверное увеличение MUCP, без существенной разницы между отдельными агентами [19]. Примечательно, что в настоящем исследовании не удалось продемонстрировать достоверного увеличения MUCP и функциональной длины уретры. Подобные наблюдения отмечают и исследователи, проводившие изучение функции уретры до и после «слинговых» операций при СНМ. Это связано с патогенетическим механизмом послеоперационного улучшения удержания мочи, который, во многом, заключается в компрессии уретры и ее анатомическом изменении, а не в прямом влиянии на ее функциональный статус, который отражают уродинамические уретральные показатели. Увеличение FUL в среднем на 3 мм после введения ООВ не является существенным, но может свидетельствовать об удлинении «зоны удержания», что не характерно для «слинговой» уретропексии [25, 26].
ЗАКЛЮЧЕНИЕ
Таким образом первый опыт применения имплантируемого гетерогенного объемообразующего материала «Сферо®ГЕЛЬ LONG» у женщин со стрессовым недержанием мочи умеренной и легкой степени свидетельствует о высокой эффективности технологии, не уступающей другим образцам ООВ, при высоком профиле безопасности, превосходящим многие из них. Необходимо продолжить клинические исследования в данном направлении для внедрения метода в широкую практику, в том числе, в рамках импортзамещения.
ЛИТЕРАТУРА
1. Kocjancic E, Mourad S, Acar Ö. Complications of urethral bulking therapy for female stress urinary incontinence. Neurourol Urodyn 2019;38(Suppl 4):S12‒S20. https://doi.org/10.1002/nau.23877.
2. Robinson D, Anders K, Cardozo L, Bidmead J, Dixon A, Balmforth J, Rufford J. What do women want? Interpretation of the concept of cure. J Pelvic Med Surg 2003;9(6):273‒7. https://doi.org/10.1097/01.spv.0000095060.05452.3f.
3. Nambiar AK, Bosch R, Cruz F, Lemack GE, Thiruchelvam N, Tubaro A, et al. EAU Guidelines on Assessment and Nonsurgical Management of Urinary Incontinence. Eur Urol 2018;73(4):596-609. https://doi.org/10.1016/j.eururo.2017.12.031. and granulomatous reaction after periurethral injection of polytef (Teflon). JAMA 1984;251(24):3277-81.
4. Kobashi KC, Albo ME, Dmochowski RR, Ginsberg DA, Goldman HB, Gomelsky A, et al. AUA/SUFU Guideline 2017; Accessed May, 2019. URL: https://www.auanet.org/guidelines/stress-urinaryincontinence-(sui)-guideline#x4490.
5. Беженарь В.Ф., Аракелян Б.В., Крутова В.А., Тарабанова О.В., Хачецукова А.А., Турлак А.С. Применение объемообразующих веществ в лечении стрессового недержания мочи. Кубанский научный медицинский вестник 2019;26(4):84–93. https://doi.org/10.25207/1608-6228-2019-26-4-84-93. [Bezhenar V.F., Arakelyan B.V., Krutova V.A., Tarabanova O.V., Khachetsukova A.A., Turlak A.S. Urethral bulking agents in the treatment of stress urinary incontinence. Kubanskiy nauchnyy meditsinskiy vestnik = Kuban Scientific Medical Bulletin 2019;26(4):84–93. https://doi.org/10.25207/1608-6228-2019-26-4-84-93. (In Russian)].
6. Русина Е.И., Желвакова М.М. Объемообразующие вещества при малоинвазивной коррекции стрессового недержания мочи у женщин. Журнал акушерства и женских болезней 2021;70(4):115-24. [Rusina E.I., Zhevlakova M.M. Bulking agents for minimally invasive correction of stress urinary incontinence in women. Zhurnal akusherstva i zhenskikh bolezney = Journal of obstetrics and women's diseases 2021;70(4):115-24. (In Russian)]. https://doi.org/10.17816/JOWD61994.
7. Herschorn S. Current use of injectable agents for female stress urinary incontinence. Rev Urol 2005;7(Suppl1):S12–S21.
8. Kirchin V, Page T, Keegan PE, Atiemo KO, Cody JD, McClinton S, et al. Urethral injection therapy for urinary incontinence in women. Cochrane Database Syst Rev 2017;7:CD003881. https://doi.org/10.1002/14651858.CD003881.pub4.
9. Christensen LH. Host tissue interaction, fate, and risks of degradable and nondegradable gel fillers. Dermatol Surg 2009;35(Suppl 2):1612-1619. https://doi.org/10.1111/j.1524-4725.2009.01338.x.
10. Food and drug administration summary of safety and effectiveness data: carbon-coated zirconium oxide injectable bulking agent 1999. URL: https://www.accessdata.fda.gov/ cdrh_docs/pdf/ P980053B.pdf. Accessed April 2019.
11. Food and drug administration summary of safety and effectiveness data: polydimethylsiloxane 2006. URL: https://www.accessdata.fda.gov/cdrh_docs/pdf4/p040050b.pdf. Accessed April 2019.
12. Chapple C, Dmochowski R. Particulate versus non-particulate bulking agents in the treatment of stress urinary incontinence. Res Rep Urol 2019;(11):299-310. https://doi.org/10.2147/RRU.S220216.
13. Исмаилова А.М., Макаров А.В., Туховская Е.А., Белоус Г.И., Аполихина И.А., Саидова А.С., и др. Новый объемобразующий препарат для лечения стрессового недержания мочи на основе поли-ɛ-капролактона. Экспериментальная клиническая урология 2019(1):18-23. https://doi.org/10.29188/2222-8543-2019-11-1-18-23. [Ismailova A.M., Makarov A.V., Tukhovskaya E.A., Belous G.I., Apolikhina I.A., Saidova A.S., et al. New volume-forming drug for the treatment of stress urinary incontinence based on poly-ε-caprolactone particles. Eksperimentalnaya i klinicheskaya urologiya = Experimental and Clinical Urology 2019(1):18-23. (In Russian)]. https://doi.org/10.29188/2222-8543-2019-11-1-18-23.
14. Capobianco G, Saderi L, Dessole F, Petrillo M, Dessole M, Piana A, et al. Efficacy and effectiveness of bulking agents in the treatment of stress and mixed urinary incontinence: A systematic review and meta-analysis. Maturitas 2020(133):13-31. https://doi.org/10.1016/j.maturitas.2019.12.007.E
15. Севастьянов В.И., Перова Н.В. Биополимерный гетерогенный гидрогель Сферо®ГЕЛЬ – инъекционный биодеградируемый имплантат нового поколения для заместительной и регенеративной медицины. Практическая медицина 2014;8(84):110-6. [Sevastyanov V.I., Perova N.V. Biopolymer heterogeneous hydrogel Sphero®gel is an injectable biodegradable implant of a new generation for replacement and regenerative medicine. Prakticheskaya meditsina = Practical medicine 2014;8(84):110-6. (In Russian)].
16. Севастьянов В.И. Технологии тканевой инженерии и регенеративной медицины. Вестник трансплантологии и искусственных органов 2014;16(3):93-108. https://doi.org/10.15825/1995-1191-2014-3-93-108. [ Sevastianov V.I. Technologies of tissue engineering and regenerative medicine. Vestnik transplantologii i iskusstvennykh organov = Russian Journal of Transplantology and Artificial Organs 2014;16(3):93-108. (In Russian)]. https://doi.org/10.15825/1995-1191-2014-3-93-108.
17. Композиция гетерогенного имплантируемого геля Сферо®ГЕЛЬ для травматологии и ортопедии. [Официальный сайт]. URL: www.biomir.biz. [Composition of a heterogeneous implantable gel Sphero®gel for traumatology and orthopedics. [Official site]. URL: www.biomir.biz. (In Russian)].
18. Сферо®ГЕЛЬ – композиция гетерогенного имплантируемого геля. Инструкция по применению медицинского изделия. Регистрационное удостоверение № ФСР 2012/13033 от 26.11.2021 г. [Sphero®GEL - a composition of a heterogeneous implantable gel. Instructions for the use of a medical product. Registration certificate No. FSR 2012/13033 dated November 26, 2021. (In Russian)].
19. Mohr S, Siegenthaler M, Mueller MD, Kuhn A. Bulking agents: an analysis of 500 cases and review of the literature. Int Urogynecol J 2013;24(2):241-7. https://doi.org/10.1007/s00192-012-1834-8.
20. Hoe V, Haller B, Yao HH, O'Connell HE. Urethral bulking agents for the treatment of stress urinary incontinence in women: A systematic review. Neurourol Urodyn 2021;40(6):1349-88. https://doi.org/10.1002/nau.24696.
21. de Vries AM, Wadhwa H, Huang J, Farag F, Heesakkers JPFA, Kocjancic E. Complications of urethral bulking agents for stress urinary incontinence: an extensive review including case reports. Female Pelvic Med Reconstr Surg 2018;24(6):392‒398. https://doi.org/10.1097/SpV.0000000000000495.
22. Mayer RD, Dmochowski RR, Appell RA, Sand PK, Klimberg IW, Jacoby K, et al. Multicenter prospective randomized 52-week trial of calcium hydroxylapatite versus bovine dermal collagen for treatment of stress urinary incontinence. Urology 2007;69(5):876-80. https://doi.org/10.1016/j.urology.2007.01.050.
23. Kuhn A, Stadlmayr W, Lengsfeld D, Mueller MD. Where should bulking agents for female urodynamic stress incontinence be injected? Int Urogynecol J Pelvic Floor Dysfunct 2008;19(6):817-821. https://doi.org/10.1007/s00192-007-0535-1.
24. Цуканов А.Ю., Мирзакадиев А.А., Дункурс А.В. Объём-образующие вещества в лечении стрессового недержания мочи у женщин. Вестник урологии 2020;8(2):99-106. [Tsukanov A.Yu., Mirzakadiev A.A., Dunkurs A.V. Bulking agents in case of treatment of female stress urinary incontinence. Vestnik urologii = Urology Herald 2020;8(2):99-106. (In Russian)].
25. Vij M, Dua A, Freeman RM. Should maximal urethral closure pressure be performed before midurethral sling surgery for stress incontinence? A time to revisit. Int Urogynecol J 2016;27(10):1491-5. Epub 2016 Mar 24. https://doi.org/10.1007/s00192-016-3007-7.
26. Wasenda EJ, Kirby AC, Lukacz ES, Nager CW. The female continence mechanism measured by high resolution manometry: Urethral bulking versus midurethral sling. Neurourol Urodyn 2018;37(5):1809-14. Epub 2018 Feb 21. https://doi.org/10.1002/nau.23529.
27. Elzayat EA, Corcos J. Urethral injectables in the management of stress urinary incontinence. In: Female Urology, edited by R. Raz. Philadelphia: Elsevier Saunders 2008(31):348–361.
28. Griffin MA, Janosek‐Albright KJ, Diaz‐Insua M, Elshatanoufy S, Atiemo HO. Quality of life outcomes in peri‐ urethral calcium hydroxylapatite injection. Int Urogynecol J 2016;27(12):1879‐87.
29. Ener K, Okulu E, Aldemir M, Onen E, Kayigil O. Efficiency of injection therapy for stress incontinence: a retrospective evaluation of 8 years results. J Clinic Analytic Med 2013;4(5):363-368.
30. Madjar S, Covington‐Nichols C, Secrest CL. New periurethral bulking agent for stress urinary incontinence: modified technique and early results. J Urol 2003;170(6 Pt 1):2327‐29.
31. Andersen RC. Long‐term follow‐up comparison of Durasphere and Contigen in the treatment of stress urinary incontinence. J Low Genit Tract Dis 2002;6(4):239‐243.
32. Pannek J, Brands FH, Senge T. Particle migration after transurethral injection of carbon coated beads for stress urinary incontinence. J Urol 2001;166(4):1350‐1353.
33. Carroll TF, Christie A, Foreman M, Khatri G, Zimmern PE. Macroplastique for women with stress urinary incontinence secondary to intrinsic sphincter deficiency. Int Braz J Urol 2019;45(5):989‐98.
34. Serati M, Soligo M, Braga A., Cantaluppi S, Coluccia AC, Di Dedda MC, et al. Efficacy and safety of polydimethylsiloxane injection (Macroplastique) for the treatment of female stress urinary incontinence: results of a series of 85 patients with >=3 years of follow‐up. BJU Int 2019;123(2):353‐59. https://doi.org/10.1111/bju.14550.
35. Tamanini JT, D'Ancona CA, Netto NR. Macroplastique implantation system for female stress urinary incontinence: long‐term follow‐up. J Endourol 2006;20(12):1082‐86. https://doi.org/10.1089/end.2006.20.1082.
36. Gurdal M, Tekin A, Erdogan K, Sengor F. Endoscopic silicone injection for female stress urinary incontinence due to intrinsic sphincter deficiency: impact of coexisting urethral mobility on treatment outcome. Urology 2002;60(6):1016‐19. https://doi.org/10.1016/s0090-4295(02)01996-9.
37. Barranger E, Fritel X, Kadoch O, Liou Y, Pigne A. Results of transurethral injection of silicone micro‐implants for females with intrinsic sphincter deficiency. J Urol 2000;164(5):1619‐22.
38. Rodriguez D, Carroll T, Alhalabi F, Carmel M, Zimmern PE. Outcomes of Macroplastique injections for stress urinary incontinence after suburethral sling removal. Neurourol Urodyn 2020;39(3):994‐1001. https://doi.org/10.1002/nau.24321.
39. de Vries AM, van Breda HMK, Fernandes JG, Venema PL, Heesakkers J. Para‐urethral injections with Urolastic R for treatment of female stress urinary incontinence: subjective improvement and safety. Urol Int 2017;99(1):91‐97. https://doi.org/10.1159/000452450.
40. Kowalik CR, Casteleijn FM, van Eijndhoven HWF, Zwolsman SE, Roovers JPWR. Results of an innovative bulk- ing agent in patients with stress urinary incontinence who are not optimal candidates for mid‐urethral sling surgery. Neurourol Urodyn 2018;37(1):339‐45. https://doi.org/10.1002/nau.23299.
41. Futyma K, Miotła P, Gałczyński K., Baranowski W, Doniec J, Wodzisławska A, et al. An open multicenter study of clinical efficacy and safety of Urolastic, an injectable implant for the treatment of stress urinary incontinence: one‐ year observation. BioMed Res Int 2015;2015:851823. https://doi.org/10.1155/2015/851823.
42. Zajda J, Farag F. Urolastic for the treatment of women with stress urinary incontinence: 24‐month follow‐up. Cent European J Urol 2015;68(3):334‐8. https://doi.org/10.5173/ceju.2015.541.
43. Pai A, Al‐Singary W. Durability, safety and efficacy of polyacrylamide hydrogel (Bulkamid) in the management of stress and mixed urinary incontinence: three years follow up outcomes. Cent European J Urol 2015;68(4):428‐433. https://doi.org/10.5173/ceju.2015.647.
44. Mouritsen L., Lose G., Møller‐Bek K. Long‐term follow‐up after urethral injection with polyacrylamide hydrogel for female stress incontinence. Acta Obstet Gynecol Scand 2014;93(2):209‐212.
45. Trutnovsky G, Tamussino K, Greimel E, Bjelic‐Radisic V. Quality of life after periurethral injection with polyacrylamide hydrogel for stress urinary incontinence. Int Urogynecol J 2011;22(3):353‐356. https://doi.org/10.1007/s00192-010-1296-9.
46. Ferchaud J, Girard F, Ciofu C, Peyrat L, Haab F. Intraurethral injections of Zuidex: evaluation of the morbidity of the technique in the treatment of female urinary incontinence. Prog Urol 2005;15(3):494-7.
47. Kuhn A, Stadlmayr W, Sohail A, Monga A. Long-term results and patients’ satisfaction after transurethral ethylene vinyl alcohol (Tegress®) injections: a two-centre study. Int Urogynecol J Pelvic Floor Dysfunct 2008;19(4):503-7. https://doi.org/10.1007/s00192-007-0479-5.
48. Malizia AA Jr, Reiman HM, Myers RP, Sande JR, Barham SS, Benson RC, et al. Migration and granulomatous reaction after periurethral injection of polytef (Teflon). JAMA 1984;251(24):3277-81.
49. Yamada T, Arai G, Masuda H, Tsukamoto T, Nagahama K, Nagamatsu H. The correction of type 2 stress incontinence with a polytetrafluoroethylene patch sling: 5-year mean followup. J Urol 1998;160(3 Pt 1):746-9. https://doi.org/10.1097/00005392-199809010-00030.







