ВВЕДЕНИЕ
Исследование микробиома человека стало темой, вызывающей большой научный и общественный интерес. Человеческое тело – это экосистема, в которой хозяин взаимодействует с огромным количеством микроорганизмов [1]. Эта связь может быть положительной, нейтральной или патогенной. Поэтому микроорганизмы играют важную роль в здоровье человека. Как правило, микробный состав варьирует в зависимости от расположения органов и систем, их функции и взаимодействия с внешней средой [2], а также связан с генетикой человека, возрастом, типом питания и приемом лекарственных препаратов. Тем не менее, различные профили микробиома были связаны с конкретными заболеваниями путем сравнения различий между пациентами и здоровыми людьми. Эти различия могут возникать на любом уровне таксономического ранга [3] и проявляются увеличением количества конкретных микроорганизмов или снижением микробиомного разнообразия [4]. Одним из основных факторов, вызывающих снижение разнообразия и богатства микробиома человека, является прием антибактериальных лекарственных препаратов. Антибактериальная химиотерапия изменяет таксономическую структуру микробиома. Данная ситуация связана с повышенной восприимчивостью к другим патогенам, нарушением регуляции иммунитета и появлением генов резистентности [5, 6].
Мужская репродуктивная система, которая когда-то считалась в значительной степени стерильной, теперь признана сложной мозаикой микробных сообществ [7, 8]. Новые данные свидетельствуют о ключевой роли микробиома в мужской фертильности [9]. Сбалансированная и разнообразная микробиота мужской половой системы необходима для оптимального репродуктивного здоровья. В настоящее время нет тестов, позволяющих определить порог и предсказать влияние конкретных микроорганизмов на качество семенной жидкости, а также признать ее непригодной для оплодотворения. Однако достижения в области молекулярно-генетической идентификации микробиома, в частности, применение секвенирования нового поколения (NGS), предоставляет нам возможность понять всю сложность взаимоотношений микробиома и его хозяина. Последовательность гена 16S рРНК широко используется в качестве молекулярного маркера в независимых от культуры методах идентификации и классификации разнообразных бактериальных сообществ [10]. Последовательности бактериальной 16S рРНК в настоящее время используются для изучения эволюции, филогенетических взаимоотношений и распространенности различных таксонов в окружающей среде [11]. Идентификация конкретных групп бактерий, позволяющих отнести мужчин к бесплодным, требует дальнейших исследований.
Цель исследования. Провести сравнительный анализ таксономической структуры микробиоты пациентов с обструктивной и необструктивной азооспермией и группой фертильности (пациенты с рожденными детьми в анамнезе).
МАТЕРИАЛЫ И МЕТОДЫ
Материалом исследования послужили образцы тестикулярной ткани и урогенитального тракта инфертильных пациентов с азооспермией (n=57). Исследование одобрено Этическим комитетом (выписка из протокола №4 заседания Комитета по Этике Медицинского института РУДН им. Патриса Лумумбы от 18 января 2024 г. об одобрении научного исследования «Тестикулярный микробиом как фактор прогноза мужского бесплодия»).
Критериями включения служили: добровольное информированное согласие пациента на участие в исследовании, возраст старше 18 лет, бесплодие в браке более 1 года при регулярной половой жизни без использования средств контрацепции, подтвержденная необструктивная азооспермия, отсутствие в анамнезе двусторонних поражений яичек, их гипоплазии, онкологической патологии, а также отсутствие антибактериальной терапии и инфекций, передаваемых половым путем (ИППП) в течение 3 месяцев.
В свою очередь, критериями исключения явились: возраст до 18 лет, наличие онкологической патологии, ИППП, генетические и эндокринные факторы бесплодия, тяжелая соматическая патология на момент обследования, регулярный прием лекарственных средств, приводящих к развитию бесплодия и гипогонадизма, повышение концентрации простатспецифического антигена (PSA) в сыворотке крови более 4 нг/мл и/или его свободной фракции более 5 нг/мл, психические заболевания, хронический алкоголизм и наркомания, наличие ВИЧ инфекции.
Для реализации репродуктивного потенциала всем пациентам, вошедшим в исследование, была выполнена микроскопическая биопсия яичка (micro-TESE) с последующим проведением экстракорпорального оплодотворения по технологии интрацитоплазматической инъекции сперматозоида (ИКСИ), либо криоконсервации биологического материала.
Все пациенты ретроспективно были распределены на три группы: группа 1 (n=29) – пациенты с необструктивной азооспермией (НОА) и отсутствием детей; группа 2 (n=19) – пациенты с обструктивной азооспермией (ОА); группа 3 (n=9) – фертильные пациенты (ФЕРТ).
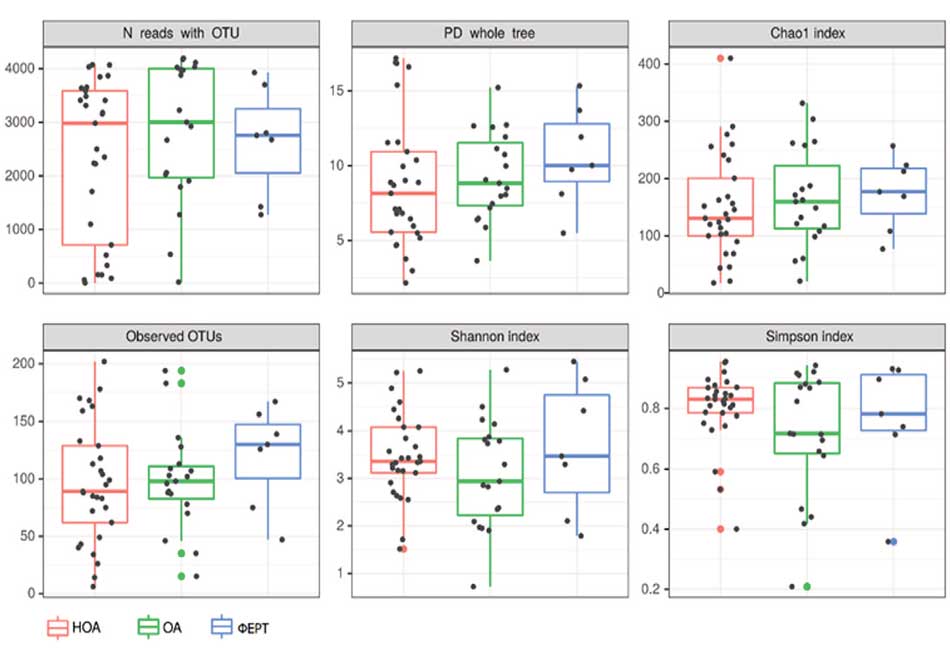
Рис. 1. Альфа-разнообразие бактериального сообщества уретры. Примечание: статистически достоверных отличий не обнаружено
Fig. 1. Alpha diversity of the urethral bacterial community. Note: no statistically significant differences were found
Для исследования бактериального разнообразия тестикулярной ткани был проведен анализ ампликонов бактериального гена 16S pРНК с использованием высокопроизводительного секвенирования нового поколения (NGS) [12]. Выделение ДНК из образцов проводили колоночным методом (ReliaPrep™ gDNA Tissue Miniprep System, Promega USA) с предварительной обработкой лизоцимом. Также для исследования бактериального пейзажа урогенитального тракта и контроля чистоты метода был произведен забор биологического материала из уретры у каждого пациента, которому проводилась биопсия яичка. Данные обрабатывали с помощью программы QIIME (версия 1.9.1).
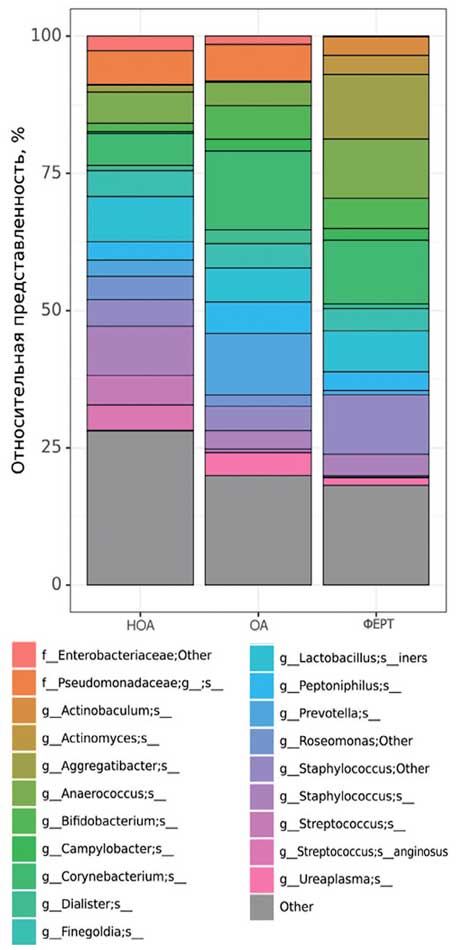
Рис. 2. Наиболее представленные виды микробиоты уретры в группах сравнения
Fig. 2. The most represented types of urethral microbiota in comparison groups
РЕЗУЛЬТАТЫ
В ходе исследования был проведен сравнительный анализ таксономического состава микробиоты уретры и тестикулярной ткани в исследуемых группах.
Таксономический состав микробиоты уретры
На первом этапе был проведен сравнительный анализ таксономической структуры и разнообразия микробиоты уретры. Альфа-разнообразие оценивалось по индексу Шенона и Симпсона, который описывает видовое разнообразие, а также количество операционных таксономических единиц (OTU) и индекс Chao1 исследуемых бактериальных сообществ уретры. Результат показал, что достоверных отличий в группах сравнения обнаружено не было (рис. 1). Видовое разнообразие в группах, представленное на рисунке 2, демонстрирует отличия только для видов, представленных в малом количестве (не более 3% в среднем, рис. 3), то есть микробиота уретры данных групп пациентов отличается незначительно.
Таксономический состав микробиоты тестикулярной ткани
Далее была произведена оценка альфа-разнообразия исследуемых бактериальных сообществ ткани яичка (рис. 4). Выявлено, что индексы филогенетического разнообразия, Chao1, Шеннона и Симпсона, а также общее количество обнаруженных таксономических единиц (ОТЕ) в группах НОА и ОА достоверно ниже, чем в группе ФЕРТ. То есть, у пациентов с азооспермией бактериальное сообщество ткани яичка более обедненное.
При анализе данных микробных сообществ ткани яичка были выявлены достоверные различия в представленности микробных фил исследуемых групп сравнения (рис. 5).
Так, например, у пациентов с НОА достоверно повышена представленность филы Proteobacteria, а группа пациентов ФЕРТ имела повышенную относительную представленность фил Firmicutes и Bacteroidetes, которые обычно превалируют в микробиоте кишечника. Таким образом, микробиота яичка отличается между группами сравнения даже на крупных таксонах, чего не было выявлено для микробиоты уретры данных пациентов (рис. 6).
Наибольшее различие в группах сравнения мы выявили, анализируя отдельные виды микробиома ткани яичка (рис. 7).
Интересно, что группы НОА и ОА отличаются друг от друга в основном представленностью вида Bifidobacterium adolescentis, в то время как от группы ФЕРТ группы НОА и ОА отличаются в основном сниженной представленностью таксонов бактерий, которые являются нормальными представителями микробиоты кишечника.
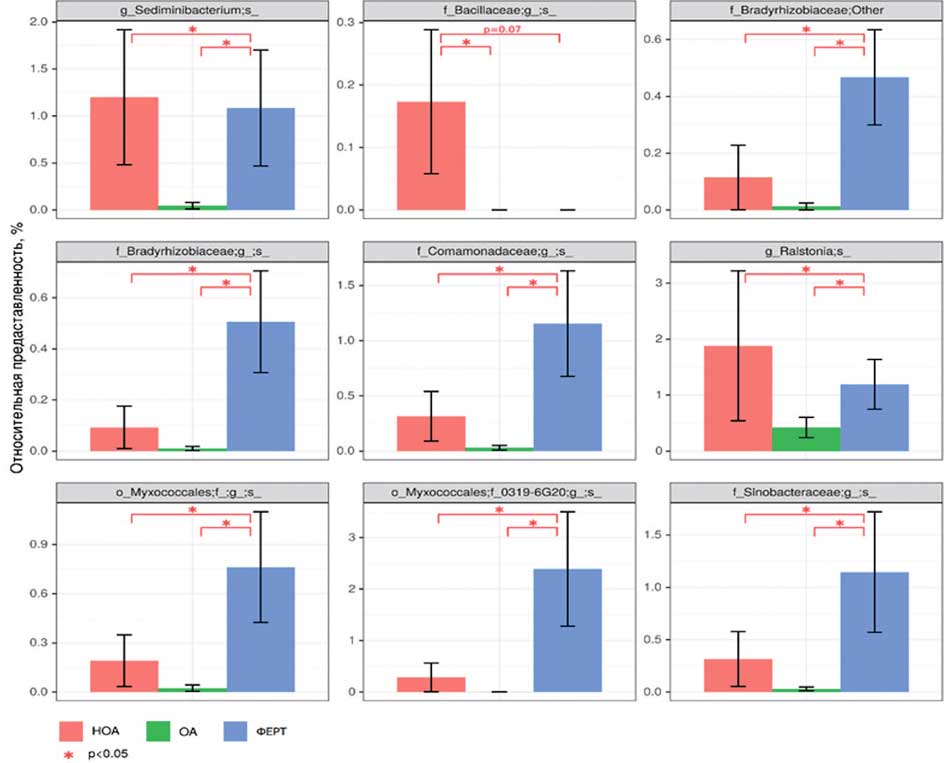
Рис. 3. Статистически значимо отличающиеся между группами сравнения виды, обнаруженные в микробиоте уретры
Fig. 3. Statistically significantly different species found in the urethral microbiota between comparison groups
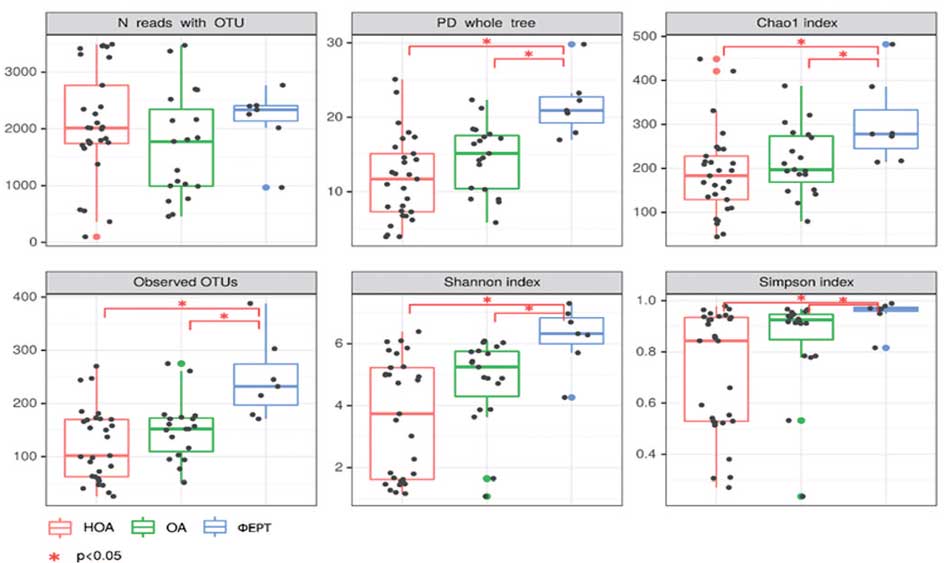
Рис. 4. Альфа-разнообразие бактериального сообщества ткани яичка. Примечания: * достоверность различий между группами p<0,05
Fig. 4. Alpha diversity of testicular tissue bacterial community. Notes: * significance of differences between groups p<0.05
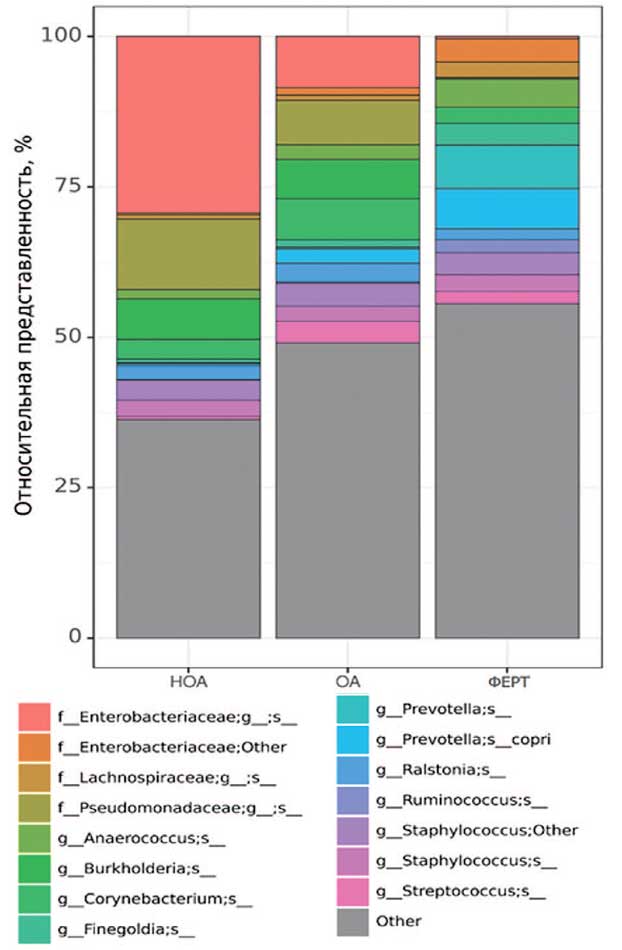
Рис. 5. Наиболее представленные виды микробиоты яичка в группах сравнения
Fig. 5. The most represented types of testicular microbiota in comparison groups
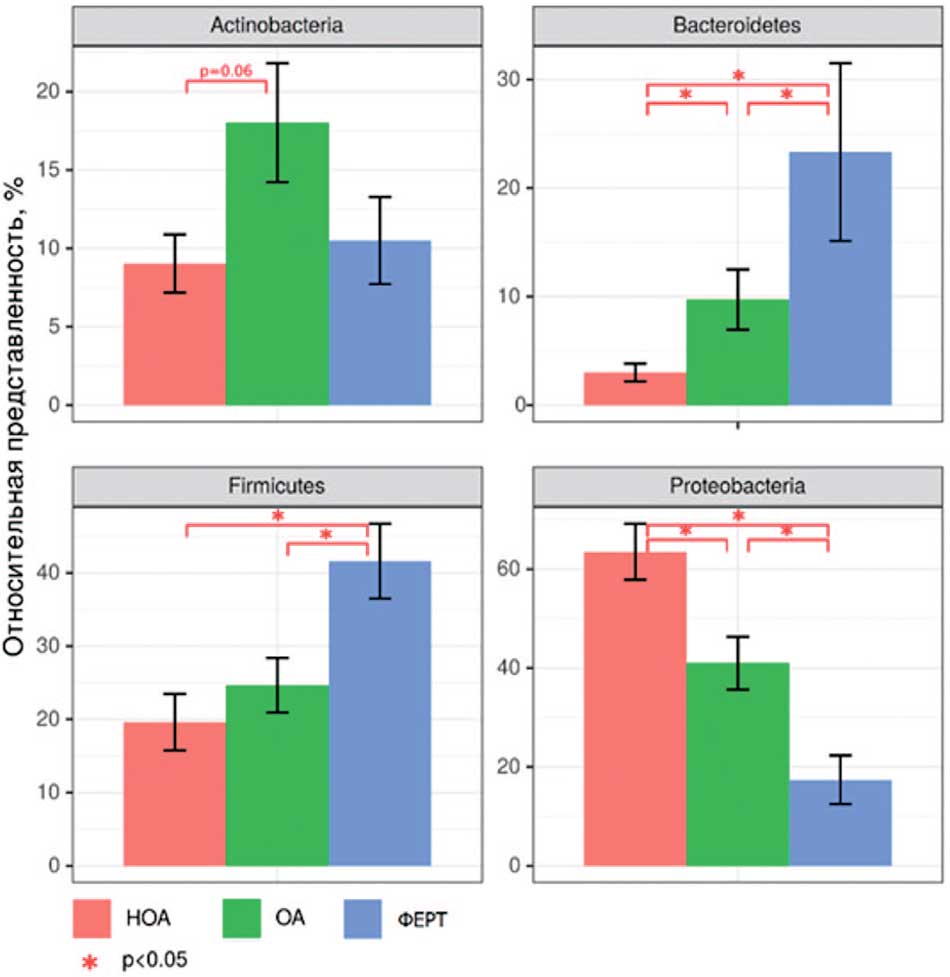
Рис. 6. Филы, обнаруженные в микробиоте ткани яичка, статистически значимо отличающиеся между группами сравнения. Примечания: достоверность различий между группами p<0,05 (тест Краскела-Уоллиса с поправкой на множественное сравнение методом Бенджамини-Хохберга).
Fig. 6. Statistically significantly different phyla between comparison groups found in the microbiota of testicular tissue. Notes: significance of differences between groups p<0.05 (Kruskal-Wallis test corrected for multiple comparisons by the Benjamini-Hochberg method)
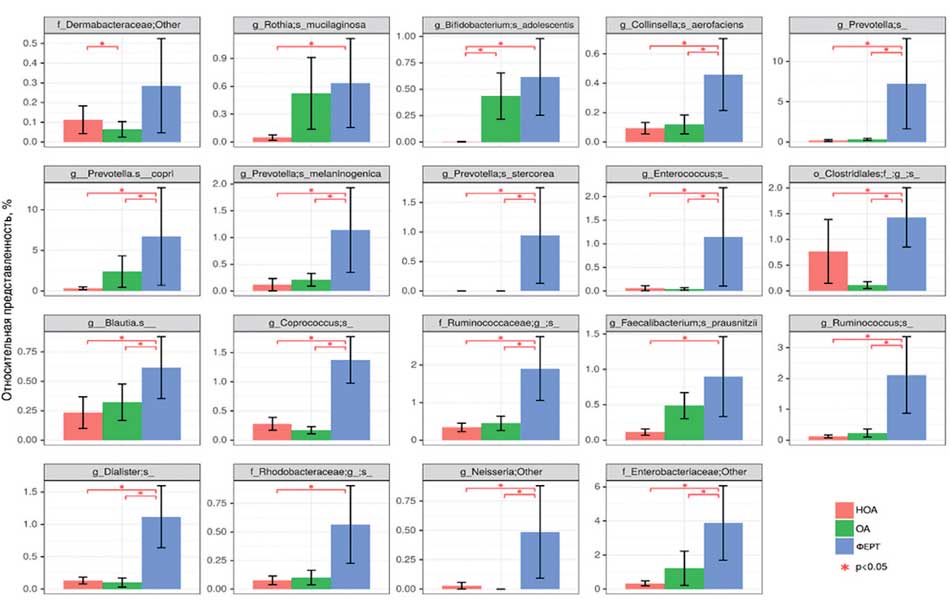
Рис. 7. Статистически значимо отличающиеся между группами сравнения виды, обнаруженные в микробиоте ткани яичка
Fig. 7. Statistically significantly different species found in the microbiota of testicular tissue between comparison groups
Таким образом, группы НОА и ОА близки друг к другу представленностью обнаруженных видов в ткани яичка.
При сравнении частоты встречаемости бактерий и для уретры, и для ткани яичка выявлено только тривида (использовался точный критерий Фишера с поправкой на множественное сравнение методом Бенджамини-Хохберга). В группе НОА по сравнению с группой ОА достоверно реже обнаруживается неопределенный представитель рода Prevotella, а в сравнении с группой ФЕРТ достоверно реже обнаруживается неопределенный представитель семейства Comamonadaceae, неопределенный представитель рода Prevotella и вид Veillonella dispar. В свою очередь в группе ОА достоверно реже обнаруживается неопределенный представитель семейства Comamonadaceae по сравнению с группой ФЕРТ (рис. 8).
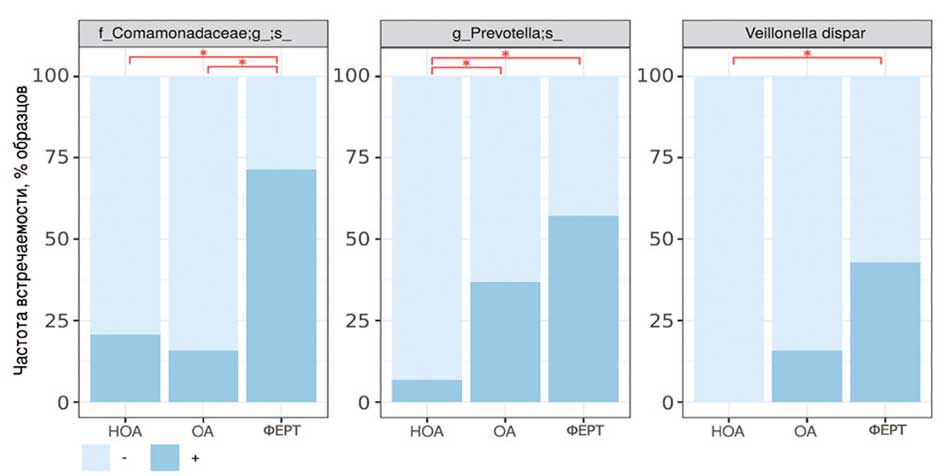
Рис. 8. Частота встречаемости бактерий и для уретры, и для ткани яичка
Fig. 8. Frequency of occurrence of bacteria for both urethra and testicular tissue
ОБСУЖДЕНИЕ
Передовые методы секвенирования нового поколения (NGS) позволили проанализировать микробиом мужской половой системы, определить его уникальный состав. Точное происхождение бактерий в ткани яичка человека остается неясным, и неизвестно, представляют ли они временную колонизацию или статичную резидентную флору. Хотя существует сходство между тестикулярным и уретральным микробиомом, большее альфа-разнообразие бактериального сообщества в группах сравнения выявлено в тестикулярной ткани [13]. В нашем исследовании при сравнении таксономической структуры микробиоты мужчины с НОА имели большую бактериальную нагрузку ткани яичка по сравнению с мужчинами с ОА и ФЕРТ, с преобладанием актинобактерий и фирмикутов. В то время как в уретре наибольшую бактериальную представленность имели пациенты группы ФЕРТ. В свою очередь, мужчины с НОА имели пониженное таксономическое разнообразие вследствие истощения Bacteroidetes и Proteobacteria и преобладания филы Proteobacteria. Международный опыт в данной области также подтверждает, что различия в таксономической структуре микробиоты могут быть связаны с патологическими изменениями репродуктивной системы у мужчин. Некоторые исследования установили связь микробиоты яичка с различными аспектами мужской фертильности, включая сперматогенез и качество спермы [14].
Результаты исследования позволяют обсудить связь между составом микробиоты и фертильностью, а также пролить свет на патологические изменения при азооспермии. В результате анализа частоты встречаемости видов бактерий в уретре и тестикулярной ткани были выявлены достоверные различия между группами. В группе НОА по сравнению с группой ОА реже обнаруживался неопределенный представитель рода Prevotella. Эти данные говорят о потенциальном влиянии данного представителя рода Prevotella на развитие азооспермии и могут указывать на возможную причину необструктивной формы заболевания.
G. Campisciano и соавт. описывают нарушение подвижности сперматозоидов в группе пациентов с выявленной Prevotella, а также данный микроорганизм был выявлен в группе пациентов с идиопатическим мужским бесплодием [15]. Также были выявлены интересные различия между группой НОА и группой Ферт. В группе НОА реже обнаруживались неопределенные представители семейства Comamonadaceae, неопределенных видов Prevotella и вида Veillonella dispar по сравнению с группой ФЕРТ. В группе ОА также было обнаружено снижение обнаружения неопределенного представителя семейства Comamonadaceae по сравнению с группой ФЕРТ. Эти результаты согласуются с данными международных исследований, которые показывают, что микробиота уретры и микробиота яичка имеют своеобразные составы и могут отличаться. Данная ситуация свидетельствует о различии в таксономической структуре микробиоты в этих двух группах и указывает на возможную связь данного представителя семейства Comamonadaceae с обструктивной формой азооспермии. I. Veneruso и соавт. отмечают изменения свойств спермы, ассоциирующиеся с наличием Comamonadaceae [16]. Таким образом, результаты проведенного исследования подтверждают наличие различий в таксономической структуре микробиоты ткани яичка у пациентов с обструктивной и необструктивной азооспермией, а также у пациентов с нормальной фертильностью.
ЗАКЛЮЧЕНИЕ
Наши данные подтверждают, что тестикулярная ткань нестерильна и имеет свой неповторимый микробный пейзаж. Таксономическая структура микробиоты яичка различается у пациентов с обструктивной азооспермией, необструктивной азооспермией и фертильных мужчин. Бактериальные сообщества ткани яичка у пациентов с азооспермией характеризуются пониженным разнообразием и специфическим составом, отличающимся от микробиоты уретры. Индексы филогенетического разнообразия (Chао1, Шеннона и Симпсона) и общее количество ОТЕ были достоверно ниже у пациентов с НОА и ОА по сравнению с пациентами группы фертильности. Таким образом, можно предположить, что у пациентов с азооспермией имеет место снижение разнообразия бактериального сообщества тестикулярной ткани. Эти результаты могут быть полезны для дальнейшего изучения роли микробиоты в патологии сперматогенеза и разработки новых подходов к лечению и диагностике мужского бесплодия.
ЛИТЕРАТУРА
- Berg G, Rybakova D, Fischer D, Cernava T, Vergès MC, Charles T, et al. Microbiome definition re-visited: old concepts and new challenges. Microbiome 2020;8(1):103. https://doi.org/10.1186/s40168-020-00875-0.
- Simon JC, Marchesi JR, Mougel C, Selosse MA. Host-microbiota interactions: from holobiont theory to analysis. Microbiome 2019;7(1):5. https://doi.org/10.1186/s40168-019-0619-4.
- Gilbert JA, Quinn RA, Debelius J, Xu ZZ, Morton J, Garg N, et al. Microbiome-wide association studies link dynamic microbial consortia to disease. Nature 2016;535(7610):94-103. https://doi.org/10.1038/nature18850.
- Manor O, Dai CL, Kornilov SA, Smith B, Price ND, Lovejoy JC, et al. Health and disease markers correlate with gut microbiome composition across thousands of people. Nat Commun 2020;11(1):5206. https://doi.org/10.1038/s41467-020-18871-1.
- Francino MP. Antibiotics and the Human Gut Microbiome: Dysbioses and Accumulation of Resistances. Front Microbiol 2016;6:1543. https://doi.org/10.3389/fmicb.2015.01543.
- Raymond F, Ouameur AA, Déraspe M, Iqbal N, Gingras H, Dridi B, et al. The initial state of the human gut microbiome determines its reshaping by antibiotics. ISME J 2016;10(3):707-20. https://doi.org/10.1038/ismej.2015.148.
- Zuber A, Peric A, Pluchino N, Baud D, Stojanov M. Human Male Genital Tract Microbiota. Int J Mol Sci 2023;24(8):6939. https://doi.org/10.3390/ijms24086939.
- Tomaiuolo R, Veneruso I, Cariati F, D'Argenio V. Microbiota and Human Reproduction: The Case of Male Infertility. High Throughput 2020;9(2):10. https://doi.org/10.3390/ht9020010.
- Magill RG, MacDonald SM. Male infertility and the human microbiome. Front Reprod Health 2023;5:1166201. https://doi.org/10.3389/frph.2023.1166201.
- Clarridge JE 3rd. Impact of 16S rRNA gene sequence analysis for identification of bacteria on clinical microbiology and infectious diseases. Clin Microbiol Rev 2004;17(4):840-62. https://doi.org/10.1128/CMR.17.4.840-862.2004.
- Větrovský T, Baldrian P. The variability of the 16S rRNA gene in bacterial genomes and its consequences for bacterial community analyses. PLoS One 2013;8(2):e57923. https://doi.org/10.1371/journal.pone.0057923.
- Фаниев М.В., Кадыров З.А., Гудков Г.В., Крутенко Д.В., Прокопьев Я.В., Водолажский Д.И. Способ малоинвазивного выделения бактериальной ДНК из биоптата тестикулярной ткани у инфертильных мужчин. Патент на изобретение № 2 810 467 от 27.12.2023. [Faniev M.V., Kadyrov Z.A., Gudkov G.V., Krutenko D.V., Prokopyev Ya.V., Vodolazhsky D.I. A method for minimally invasive isolation of bacterial DNA from testicular tissue biopsy in infertile men. Patent for invention No. 2,810,467 dated December 27, 2023. (In Russian)].
- Фаниев М.В., Кадыров З.А., Дружинина Н.К., Степанов В.С., Прокопьев Я.В., Федоренко Т.В. Сравнительная характеристика тестикулярной и уретральной микробиоты у пациентов с различными видами азооспермии и сопутствующим варикоцеле. Экспериментальная и клиническая урология 2023;16(4):80-91. [Faniev M.V., Kadyrov Z.A., Druzhinina N.K., Stepanov V.S., Prokopyev Ya.V., Fedorenko T.V. Comparative characteristics of testicular and urethral microbiota in patients with various types of azoospermia and concomitant varicocele. Eksperimental'naya i klinicheskaya urologiya = Experimental and Clinical Urology 2023;16(4):80-91. (In Russian)]. https://doi.org/10.29188/2222-8543-2023-16-4-80-91.
- Alfano M, Ferrarese R, Locatelli I, Ventimiglia E, Ippolito S, Gallina P, et al. Testicular microbiome in azoospermic men-first evidence of the impact of an altered microenvironment. Hum Reprod 2018;33(7):1212-7. https://doi.org/10.1093/humrep/dey116.
- Campisciano G, Iebba V, Zito G, Luppi S, Martinelli M, Fischer L, et al. Lactobacillus iners and gasseri, Prevotella bivia and HPV Belong t o the Microbiological Signature Negatively Affecting Human Reproduction. Microorganisms 2020;9(1):39. https://doi.org/10.3390/microorganisms9010039.
- Veneruso I, Cariati F, Alviggi C, et al. Metagenomics Reveals Specific Microbial Features in Males with Semen Alterations. Genes (Basel) 2023;14(6):1228. https://doi.org/10.3390/genes14061228.







