ВВЕДЕНИЕ
Первые трехмерные (3D) системы визуализации для лапароскопических операций были разработаны в 1990-х годах. В дальнейшем эти системы совершенствовались и в настоящее время они являются передовой технологией визуального контроля при проведении эндохирургических вмешательств.
Выделим принципиальные различия между видеоизображениями в двухмерном (2D) и 3D форматах. Если на первых из них возможна оценка только внешнего вида анатомических структур и инструментов, их линейных размеров и взаиморасположения на плоскости, то на вторых, за счет трехмерности изображений, имеет место единый объемный зрительный образ с эффектом восприятия «ближе-дальше». В своем сообщении от 2011 г. Ю.Г. Старков и соавт. отмечают, что использование 3D-визуализации «…позволяет хирургу точно ориентироваться в пространстве при хирургическом вмешательстве, оценивать не только размеры органов, но и глубину их расположения, что упрощает координацию движений инструментами, повышает точность этих движений…» [1]. Визуализационные 3D-системы являются обязательной составляющей роботического комплекса DaVinci [2]. Именно с этим обстоятельством, как подчеркивают Д.Н. Панченков и соавт., связано одно из основных преимуществ робот-ассистированной хирургии перед технологией обычного лапароскопического вмешательства с двухмерным форматом изображений: стереоскопическая визуализация зоны операционных действий позволяет нивелировать такие стандартные затруднения интраоперационной 2D-навигации, как «…отсутствие бинокулярной визуализации топографо-анатомических взаимоотношений в зоне операции, ограничение возможностей для интраоперационной ревизии, ориентации в операционном поле, манипулирования инструментами…» [3].
Внедрение роботических систем оперирования существенно ограничивается их высокой стоимостью. Так, финансовые затраты на приобретение и эксплуатацию комплекса DaVinci равняются примерно 1,0–2,3 миллионов и 180 тысяч долларов США соответственно [4]. Кроме того, при робот-ассистированных вмешательствах отсутствуют обратная тактильная связь и возможность изменения положения пациента на операционном столе. Логичным решением этих проблем является проведение лапароскопических операций под трехмерным визуализационным контролем [5].
В конце ХХ и начале ХХI столетий системы 3D-визуализации в традиционной (нероботической) лапароскопической хирургии не получили широкого распространения. Исследователи называют несколько причин данного обстоятельства: технические и эргономические недостатки 3D-мониторов, высокая стоимость оборудования, ухудшение самочувствия хирурга во время операции (появление головной боли и головокружения, тошноты, размытости и двоения зрения, усталости глаз) [6-8].
Тем не менее, как подчеркивают H. Liang и соавт., опубликовавшие в 2018 г. результаты кумулятивного метаанализа 23 исследований о сравнении эффективности использования 2D- и 3D-визуализационных систем, более предпочтительным при лапароскопических вмешательствах следует считать применение 3D-интраоперационной навигации. Также авторы отмечают необходимость дальнейшего совершенствования 3D-установок, направленного на уменьшение побочных эффектов и снижение себестоимости оборудования [9]. В России и за рубежом при сравнительном изучении результативности 2D- и 3D-визуализационных систем обычно рассматриваются такие параметры, как продолжительность лапароскопических вмешательств, частота осложнений, объем кровопотери, длительность дренирования, число послеоперационных койко-дней, производительность труда хирурга и др. Согласно зарубежным исследованиям, при лапароскопических вмешательствах по таким критериям, как продолжительность операции, объем кровопотери, длительность пребывания в стационаре и производительность труда хирурга лучшие результаты регистрировались при использовании 3D-визуализации [9–12].
В 2019 г. A. Arezzo и соавт. выполнили систематический обзор 9967 публикаций, посвященных применению трехмерной визуализации в лапароскопической хирургии и задокументированных в англоязычной текстовой базе данных Национального центра биотехнологической информации (NCBI) США (библиотека PubMed) и в биомедицинской и фармакологической библиографической базе Embase. На основании результатов анализа рассмотренных публикаций авторы, во-первых, отметили тот факт, что использование 3D-визуализационных систем при лапароскопических вмешательствах, по-видимому, способствует уменьшению продолжительности операции и снижению уровня интраоперационной травматичности; во-вторых, рекомендовали (уровень рекомендаций – высокий) продолжить исследования, направленные на изучение «…потенциальной пользы 3D-лапароскопической системы…» [13]. На актуальность дальнейших изысканий также указывали в своих сообщениях R. Smith и соавт., S. Sakata и соавт. и др. [14, 15].
Одним из наиболее распространенных онкологических заболеваний является рак предстательной железы (РПЖ). В 2009 г. в России на учете по поводу РПЖ состояло 68,1 человек на 100 000 населения. С каждым последующим годом этот показатель неуклонно увеличивался на 7,5–10,5% и в 2019 г. составил уже 176,3 человек [16]. При этом растет потребность в специализированной медицинской помощи, «золотым стандартом» которой при локализованных формах РПЖ является радикальная простатэктомия (РПЭ). По онкологическим результатам «открытая» и лапароскопическая РПЭ полностью сопоставимы, однако последняя техника менее травматична. Фактором, способным повысить качество лапароскопических вмешательств, является трехмерная система интраоперационной визуализации, поэтому актуальной задачей является изучение визуализационных технологий, применяемых при хирургическом лечении пациентов с РПЖ.
Цель работы: сравнить периоперационные результаты лапароскопической РПЭ, выполненной в условиях 3D и 2D-визуализации.
МАТЕРИАЛЫ И МЕТОДЫ
Отбор участников исследования. Работа выполнялась на базе урологического отделения ГБУЗ Клиническая больница Святителя Луки (г. Санкт-Петербург) с марта 2014 г. по август 2020 г. В исследование были включены 146 пациентов в возрасте от 59 до 74 лет (медиана – 66 лет), у которых был проведен ретроспективный анализ периоперационных результатов радикального хирургического лечения локализованного РПЖ стадий T1c-T2cN0M0 в условиях двух- или трехмерного визуализационного контроля. Диагноз локализованного РПЖ всем пациентам был выставлен на основании результатов гистологического исследования биопсийного материала предстательной железы (ПЖ). Показанием к проведению биопсии ПЖ послужило повышение уровня общего простатспецифического антигена (ПСА) в сыворотке крови до ≥4 нг/мл и/или наличие признаков нарушения структуры ПЖ при пальцевом ректальном исследовании. При отборе медицинских карт для анализа соблюдали следующие критерии исключения: 1) предшествующие вмешательству лучевое или/и гормональное лечение, операции на органах брюшной полости или/и малого таза; 2) наличие в анамнезе травматических повреждений органов малого таза, поражений центральной нервной системы, тяжелых сердечно-сосудистых заболеваний, сахарного диабета, алкоголизма; 3) объем ПЖ более 100 см3; 4) недержание мочи до рассматриваемого вмешательства. Таким образом было отобрано 146 медицинских карт.
Разделение участников исследования на группы сравнения производили по следующим критериям: 1) применение/не применение в процессе вмешательства техники сохранения сосудисто-нервных пучков (ТССНП) ПЖ; 2) использование 2D- или 3D-формата визуализации. Так были сформированы 4 группы участников. В группах 1 и 2 хирургическое лечение осуществляли под 2D-визуализационным контролем; ТССНП применяли у 52 участников (группа 1), не применяли у 46 человек (группа 2). В группах 3 и 4 (n=23 и n=25, соответственно) операцию проводили в условиях 3D-визуализации, ТССНП использовали в группе 3 и не использовали в группе 4.
Этапы и техника оперативного вмешательства. Все этапы радикального хирургического лечения локализованного РПЖ (простатэктомия, формирование шейки мочевого пузыря и наложение пузырно-уретрального анастомоза) проводили под эндотрахеальным наркозом в положении пациента лежа на спине с разведенными на 300 ногами (как для открытой простатэктомии) с наклоном стола в положение Тренделенбурга на 30–350. На первом этапе выполняли трансумбиликальный разрез кожи длиной 2,5 см. Далее послойно осуществляли доступ в брюшную полость, в которую после установки стандартного 10 мм троакара вводили лапароскоп и инсуффлировали СО2 до 12 мм рт. ст. Производили осмотр всех отделов брюшной полости. Отступив на 2 см медиальнее от передневерхней ости гребня подвздошной кости, с двух сторон под визуальным контролем размещали два порта – слева диаметром 10 мм, справа – 5 мм. По латеральному краю передней мышцы живота с обеих сторон на уровне пупка под визуальным контролем устанавливали два 5 мм троакара для рабочих инструментов оператора и ассистента. Выделяли переднюю стенку мочевого пузыря. С обеих сторон от ПЖ вскрывали тазовую фасцию и выделяли боковые стенки ПЖ. Пересекали пубопростатические связки, дорзальный венозный комплекс ушивали непрерывным швом с использованием нити V-Loc. ПЖ отсекали от мочевого пузыря, выделяли семенные пузырьки, пересекали семенные протоки, субфасциально тупо и остро выделяли ПЖ до апикальной части; таким образом, ПЖ была полностью мобилизирована. ПЖ дистально отсекали от уретры и отделяли от фасции Денонвилье. ПЖ и семенные пузырьки удаляли единым блоком в контейнере через доступ центрального порта. Формировали анастомоз между мочевым пузырем и уретрой шестью узловыми швами монофиламентной нитью. Устанавливали профилированный уретральный катетер Фолея 18 Ch, баллон раздували на 10 мл. Выполняли контроль герметичности анастомоза и контроль гемостаза. Устанавливали полихлорвиниловый дренаж к зоне анастомоза и в малый таз. Накладывали швы на кожу, производили обработку спиртом и фиксацию асептической повязки.
Технологии визуализации. Интраоперационный двухмерный визуальный контроль (группы 1 и 2) осуществляли, используя в 2D-режиме видеопроцессор EVIS EXERA III CV-190 и световодный блок EVIS EXERA CLV-190. Для получения изображений в трехмерном формате (группы 3 и 4) также применяли видеосистему EVIS EXERA III CLV-190, при этом использовали два видеоцентра EVIS EXERA CLV-190 и блок 3DV-190.
Периоперационные показатели, сравнение которых производилось в группах участников исследования: общая продолжительность вмешательства (мин), объем интраоперационной кровопотери (мл), продолжительность дренирования мочевого пузыря после вмешательства (сутки), частота выявления положительного хирургического края (ПХК, %), длительность лечения в стационаре после операции (сутки). У всех пациентов изучали состоятельность функции удержания мочи (ФУМ) через 6 и 12 месяцев после операции и восстановление эректильной функции (ЭФ) через 3 и 12 месяцев после операции. ФУМ считали восстановленной, если у пациента отсутствовала необходимость использования даже одной страховочной прокладки в день. Под восстановлением ЭФ понимали способность достигать и поддерживать эрекцию, достаточную для совершения полового акта.
Статистическую обработку результатов выполняли с помощью программ «Excel 2010» (Microsoft, США) и «SPSS Statistics 19» (IBM, США). Для сравнительного анализа количественных непрерывных независимых переменных (возраст, индекс массы тела, концентрация ПСА в сыворотке крови, сумма баллов по шкале Глисона, объем ПЖ, объем кровопотери, общее время вмешательства, продолжительность дренирования мочевого пузыря после вмешательства, частота выявления ПХК, продолжительность стационарного лечения после операции) использовали одномерный статистический анализ с применением двухвыборочного двустороннего t-теста; для сравнительного анализа категориальных переменных (частота восстановления ЭФ) – метод построения таблиц сопряженности с расчетом критерия χ2 Пирсона с поправкой Йейтса. Средние значения количественных непрерывных переменных представляли в виде М±σ, где М – среднее арифметическое, σ – стандартное отклонение. Различия считали статистически значимыми при уровне вероятности р≤0,050.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Общая характеристика пациентов, включенных в исследование, приведена в таблице 1; результаты статистического анализа свидетельствуют о сопоставимости изученных показателей во всех группах (отсутствие статистически значимых различий между группами) перед началом хирургического лечения.
Как показано в таблице 2, при радикальном хирургическом лечении локализованного рака ПЖ в группах 1 и 2, где использовался 2D-визуальный контроль, продолжительность вмешательства была равна 171,4±21,1 и 168,3±23,2 мин, соответственно, а в группах 3 и 4 (при трехмерной визуализации) этот показатель был меньше на 42–45%, и это различие статистически значимо (р0,05). Для всех рассмотренных показателей связь между их значениями и применением/неприменением ТССНП отсутствовала (p>0,05). Через 6 и 12 месяцев после вмешательства у всех пациентов 1, 2, 3 и 4 групп была зарегистрирована полная состоятельность ФУМ.
Способность достигать и поддерживать эрекцию, достаточную для совершения полового акта, через 3 месяца после лапароскопической РПЭ подтвердила примерно треть всех пациентов: 38,4% мужчин из группы 1; 28,3% — из группы 2; 34,8% — из группы 3 и 28,0% — из группы 4. По сравнению с этими данными, через 12 месяцев после операции относительная численность мужчин с восстановленной ЭФ возросла в группе 1 в 1,6 раз (до 59,6%); в группе 2 – в 1,5 раз (до 41,3%); в группе 3 – в 2,4 раз (до 82,6%); в группе 4 – в 2,0 раза (до 56,0%) (рис. 1).
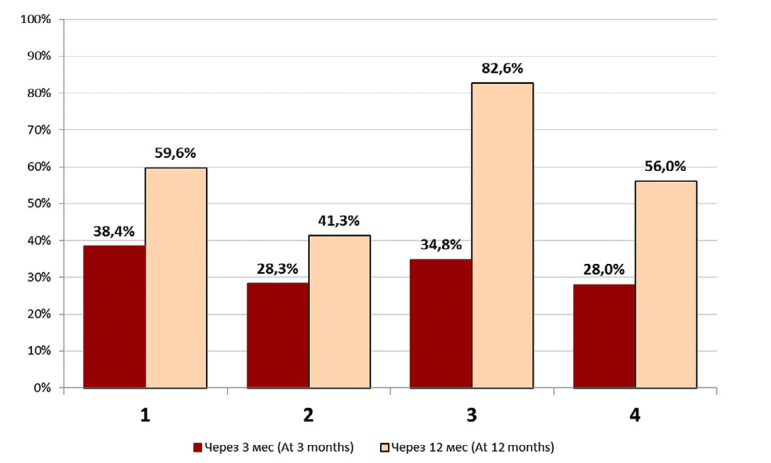
Рис. 1. Относительная численность пациентов с восстановленной эректильной функцией через 3 и 12 месяцев после лапароскопической радикальной простатэктомии, выполненной с применением: 1 – 2D-визуализации и техники сохранения сосудисто-нервных пучков предстательной железы (ТССНП); 2 – 2D-визуализации без ТССНП; 3 – 3D визуализации и ТССНП; 4 – 3D-визуализации без ТССНП.
Fig. 1. Relative number of patients with recovered erectile function at 3 and 12 months after laparoscopic radical prostatectomy performed with: 1 – 2D imaging with the technique for neurovascular bundles preservation (TNVBP); 2 – 2D imaging without TNVBP; 3 – 3D imaging with TNVBP; 4 – 3D imaging without TNVBP
В таблице 3 представлены результаты проведенного χ2 – тестирования с учетом поправки Йейтса. Согласно полученным данным, через 3 месяца после операции частота восстановления ЭФ не зависела от применявшейся системы визуализации и использования/неиспользования ТССНП (для всех попарных сравнений групп χ2< χ2кр; p>0,05). Однако через 12 месяцев после операции была зарегистрирована более высокая частота восстановления ЭФ у пациентов группы 3 по сравнению с группами 1, 2 и 4: 82,6% vs 59,6% (χ2=4,00; df=1; p=0,046), 82,6% vs 41,3% (χ2=10,69; df=1; p=0,001), 82,6% vs 56,0% (χ2 =4,06; df=1; p=0,044), соответственно. Таким образом, результаты χ2 -тестирования продемонстрировали статистически значимую позитивную роль как трехмерного визуального контроля, так и ТССНП для восстановления ЭФ после лапароскопической РПЭ, причем наилучшие результаты были достигнуты при одновременном применении 3D-визуализации и ТССНП (то есть у пациентов группы 3). Полученные нами результаты согласуются с данными зарубежных исследователей [17, 18].
Таблица 1. Общая характеристика исследованных групп пациентов перед началом радикального хирургического лечения рака предстательной железы
Table 1. General characteristics of investigated groups of patients before the start of radical surgical treatment of prostate cancer
|
Показатели |
Исследованные группы пациентов / Investigated groups of patients |
P |
|||
|---|---|---|---|---|---|
|
Группа 1Group 1, (n=52) |
Группа 2Group 2, (n=46) |
Группа 3Group 3, (n=23) |
Группа 4Group 4, (n=25) |
||
|
Возраст, годыAge, years |
64,2±3,3 |
66,3±4,3 |
65,1±4,5 |
67,4±3,1 |
0,362 |
|
Индекс массы тела, кг/м2Body mass index, kg/m2 |
27,2±1,4 |
26,1±1,1 |
27,8±2,1 |
26,5±1,2 |
0,123 |
|
ПСА общий в сыворотке, нг/млTotal PSA in serum, ng/mL |
13,4±1,4 |
14,3±1,5 |
13,9±1,4 |
14,6±1,7 |
0,258 |
|
Сумма баллов по шкале ГлисонаGleason score |
6,3±0,3 |
6,1 ±0,2 |
6,4±0,2 |
6,2±0,2 |
0,098 |
|
Объем предстательной железы, см3Prostate volume, cm3 |
54,7±4,2 |
53,4±4,6 |
52,9±3,6 |
51,7±3,4 |
0,492 |
Примечание: n – число наблюдений; p – уровень вероятности; ПСА – простатспецифический антиген
Note: n – number of observations; p – probability value; PSA – prostate-specific antigen
Таблица 2. Периоперационные показатели в исследованных группах пациентов
Table 2. Perioperative parameters in the investigated groups of patients
|
Показатели |
Исследованные группы пациентов / Investigated groups of patients | |||
|---|---|---|---|---|
|
Группа 1Group 1, (n=52) |
Группа 2Group 2, (n=46) |
Группа 3Group 3, (n=23) |
Группа 4Group 4, (n=25) |
|
|
Продолжительность вмешательства, минOperative time, min |
171,4±21,1 |
168,3±23,2# |
98,7±17,3 |
92,2±22,2* |
|
Объем интраоперационной кровопотери, млIntraoperative blood loss volume, mL |
294,2±62,1 |
281,2±53,2# |
144,2±31,7 |
148,5±33,0* |
|
Длительность дренирования мочевого пузыря, суткиDuration of the bladder drainage, days |
6,0±1,0 |
6,0±1,0# |
6,0±1,0 |
6,0±1,0* |
|
Частота выявления положительного хирургического края, %Positive surgical margin detection rate, % |
1,9±0,1 |
2,17±0,04# |
0 |
0* |
|
Длительность нахождения в стационаре после операции, суткиDuration of the postoperative inpatient period, days |
9,1±1,0 |
9,8±1,0# |
8,5±1,0 |
8,8±1,0* |
Примечание: n – число наблюдений; # и * – отсутствие статистически значимых различий между показателями в группах 1 и 2 и в группах 3 и 4, соответственно; 1 – статистически значимые различия с результатами измерений в группе 1, 2 – в группе 2
Note: n – number of observations; # and * – absence of statistically significant differences between the parameters in groups 1 vs 2 and 3 vs 4, respectively; 1 – statistically significant differences with the results in group 1, 2 – in group 2
ЗАКЛЮЧЕНИЕ
По результатам данного исследования, выявлены следующие особенности периоперационного периода лапароскопической РПЭ, выполненной в условиях 3D-визуализации, по сравнению с 2D-технологией:
- Продолжительность операции меньше на 42–45% (р0,05);
- Объем интраоперационной кровопотери меньше на 47–51% (р<0,05);
- Отсутствие случаев выявления ПХК;
- Тенденция к меньшей длительности нахождения в стационаре после операции (8–9 и 8–10 суток, соответственно; p>0,05);
- В 1,3–1,4 раза более высокая частота восстановления ЭФ через 12 месяцев после операции (р<0,050), при этом наилучшие результаты восстановления ЭФ были достигнуты при одновременном применении 3D-визуализации и ТССНП.
Таким образом, наше исследование свидетельствует о целесообразности применения технологий 3D-визуализации и ТССНП при выполнении лапароскопической РПЭ.
Таблица 3. Частота восстановления эректильной функции через 3 и 12 месяцев после операции
Table 3. Erectile function recovery rate at 3 and 12 months after the surgery
| Группы пациентов Groups of patients |
Кол-во больных |
Результаты χ2-тестирования с поправкой Йейтса |
||
|---|---|---|---|---|
|
Восстановлена |
He восстановлена |
|||
|
Абсолютное число пациентов |
||||
|
Через 3 месяца после операции / At 3 months after the surgery |
||||
|
1 (n=52) |
20 |
32 |
df=1 |
χ2=1,19 |
|
2 (n=46) |
13 |
33 |
χ2кр=3,84 |
p=0,275 |
|
1 (n=52) |
20 |
32 |
df=1 |
χ2=0,17 |
|
3 (n=23) |
8 |
15 |
χ2кр=3,84 |
p=0,676 |
|
2 (n=46) |
13 |
33 |
df=1 |
χ2=0,34 |
|
3 (n=23) |
8 |
15 |
χ2кр=3,84 |
p=0,557 |
|
1 (n=52) |
20 |
32 |
df=1 |
χ2=0,92 |
|
4 (n=25) |
7 |
18 |
χ2кр=3,84 |
p=0,336 |
|
2 (n=46) |
13 |
33 |
df=1 |
χ2=0,26 |
|
4 (n=25) |
7 |
18 |
χ2кр=3,84 |
p=0,612 |
|
3 (n=23) |
8 |
15 |
df=1 |
χ2=0,35 |
|
4 (n=25) |
7 |
18 |
χ2кр=3,84 |
p=0,555 |
|
Через 12 месяцев после операции/At 12 months after the surgery |
||||
|
1 (n=52) |
31 |
21 |
df=1 |
χ2=3,32 |
|
2 (n=46) |
19 |
27 |
χ2кр=3,84 |
p=0,069 |
|
1 (n=52) |
31 |
21 |
df=1 |
χ2=4,00 |
|
3 (n=23) |
19 |
4 |
χ2кр=3,84 |
p=0,046 |
|
2 (n=46) |
19 |
27 |
df=1 |
χ2= 10,69 |
|
3 (n=23) |
19 |
4 |
χ2кр=6,64 |
p=0,001 |
|
1 (n=52) |
31 |
21 |
df=1 |
χ2=0,14 |
|
4 (n=25) |
14 |
11 |
χ2кр=3,84 |
p=0,705 |
|
2 (n=46) |
19 |
27 |
df=1 |
χ2=1,46 |
|
4 (n=25) |
14 |
11 |
χ2кр=3,84 |
p=0,228 |
|
3 (n=23) |
19 |
4 |
df=1 |
χ2=4,06 |
|
4 (n=25) |
14 |
11 |
χ2кр=3,84 |
p=0,044 |
ЛИТЕРАТУРА
1. Старков Ю.Г., Шишин К.В., Выборный М.И., Недолужко И.Ю. Первый опыт стереолапароскопии в абдоминальной хирургии. Эндоскопическая хирургия 2011;17(1):39-40. [Starkov Iu.G., Shishin K.V., Vybornyi M.I., Nedoluzhko I.Iu. First experience of stereolaparoscopy in abdominal surgery. Endoskopicheskaya Khirurgiya = Endoscopic Surgery 2011;17(1):39-40. (In Russian)].
2. Talamini MA, Chapman S, Horgan S, Melvin WS. Academic Robotics Group. A prospective analysis of 211 robotic-assisted surgical procedures. Surg Endosc 2003;17(10):1521-1524. https://doi.org/10.1007/s00464-002-8853-3.
3. Панченков Д.Н., Иванов Ю.В., Шабловский О.Р., Колединцев О.Р., Соловьев Н.А., Кузьмичев К.А. и др. Влияние трехмерной визуализации в эндоскопической хирургии на функцию зрительного анализатора. Эндоскопическая хирургия 2012;18(1):22-24. [Panchenkov D.N., Ivanov Yu.V., Shablovsky O.R., Koledintsev O.R., Soloviev N.A., Kuzmichev K.A., et al. The influence of three-dimensional visualization in endoscopic surgery on the function of the visual analyzer. Endoskopicheskaya Khirurgiya = Endoscopic Surgery 2012;18(1):22-24. (In Russian)].
4. Sinha R, Sundaram M, Raje S, Rao G, Sinha M, Sinha R. 3D laparoscopy: technique and initial experience in 451 cases. Gynecol Surg 2013;(10):123-8. https://doi.org/10.1007/s10397-013-0782-8.
5. Nezhat C, Lavie O, Lemyre M, Unal E, Nezhat CH, Nezhat F. Robot-assisted laparoscopic surgery in gynecology: scientific dream or reality? Fertil Steril 2009;91(6):2620-2. https://doi.org/10.1016/j.fertnstert.2008.03.070.
6. Козлов Ю.А., Новожилов Е.А., Ус Г.П., Сыркин Н.В., Барадиева П.А., Ковальков К.А. и др. Первый опыт использования 3D-лапароскопии у детей. Эндоскопическая хирургия 2015;21(3):13-18. [Kozlov Yu.A., Novozhilov E.A., Us G.P., Syrkin N.V., Baradieva P.A., Kovalkov K.A., et al. The first experience of using 3D laparoscopy in children. Endoskopicheskaya Khirurgiya = Endoscopic Surgery 2015;21(3):13-18. (In Russian)].
7. Goh P, Tekant Y, Krishnan SM. Future developments in high-technology abdominal surgery: ultrasound, stereo imaging, robotics. Baillieres Clin Gastroenterol 1993;7(4):961-87. https://doi.org/10.1016/0950-3528(93)90025-n.
8. Taffinder N, Smith SG, Huber J, Russell RC, Darzi A. The effect of a second-generation 3D endoscope on the laparoscopic precision of novices and experienced surgeons. Surg Endosc 1999;13(11):1087-92. https://doi.org/10.1007/s004649901179.
9. Liang H, Liang W, Lei Z, Liu Z, Wang W, He J, et al. Three-dimensional versus two-dimensional video-assisted endoscopic surgery: a meta-analysis of clinical data. World J Surg 2018;42(11):3658- 68. https://doi.org/10.1007/s00268-018-4681-z.
10. Byrn JC, Schluender S, Divino CM, Conrad J, Gurland B, Shlasko E, et al. Three-dimensional imaging improves surgical performance for both novice and experienced operators using the da Vinci Robot System. Am J Surg 2007;193(4):519-522. https://doi.org/10.1016/j.amjsurg.2006.06.042.
11. Wagner OJ, Hagen M, Kurmann A, Horgan S, Candinas D, Vorburger SA. Threedimensional vision enhances task performance independently of the surgical method. Surg Endosc 2012;26(10):2961-8. https://doi.org/10.1007/s00464-012-2295-3.
12. Bilgen K, Ustün M, Karakahya M, Işik S, Sengül S, Cetinkünar S, et al. Comparison of 3D imaging and 2D imaging for performance time of laparoscopic cholecystectomy. Surg Laparosc Endosc Percutan Tech 2013;23(2):180-3. https://doi.org/10.1097/SLE.0b013e3182827e17.
13. Arezzo A, Vettoretto N, Francis NK, Bonino MA, Curtis NJ, Amparore D, et al. The use of 3D laparoscopic imaging systems in surgery: EAES consensus development conference 2018. Surg Endosc 2019;33(10):3251-74. https://doi.org/10.1007/s00464-018-06612-x
14. Smith R, Schwab K, Day A, Rockall T, Ballard K, Bailey M, et al. Effect of passive polarizing three-dimensional displays on surgical performance for experienced laparoscopic surgeons. Br J Surg 2014;101(11):1453-9. https://doi.org/10.1002/bjs.9601.
15. Sakata S, Watson MO, Grove PM, Stevenson AR. The conflicting evidence of three-dimensional displays in laparoscopy: a review of systems old and new. Ann Surg 2016;263(2):234-9. https://doi.org/10.1097/SLA.0000000000001504.
16. Каприн А.Д., Старинский В.В., Шахзадова А.О. Состояние онкологической помощи населению России в 2019 году; М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России 2020;239 с. [Kaprin A.D., Starinsky V.V., Shakhzadova A.O. The state of oncological care to the population of Russia in 2019; M.: P.A. Herzen Moscow State Medical Research Institute − Branch of the Federal State Budgetary Institution «NMIC of Radiology» of the Ministry of Health of Russia, 2020. 239 p. (In Russan)].
17. Aykan S, Singhal P, Nguyen DP, Yigit A, Tuken M, Yakut E, et al. Perioperative, pathologic, and early continence outcomes comparing three-dimensional and two-dimensional display systems for laparoscopic radical prostatectomy – a retrospective, single-surgeon study. J Endourol 2014;28(5):539-43. https://doi.org/10.1089/end.2013.0630.
18. Kinoshita H, Nakagawa K, Usui Y, Iwamura M, Ito A, Miyajima A, et al. High-definition resolution three-dimensional imaging systems in laparoscopic radical prostatectomy: randomized comparative study with high-definition resolution two-dimensional systems. Surg Endosc 2015;29(8):2203-9. https://doi.org/10.1007/s00464-014-3925-8.







