ВВЕДЕНИЕ
Гемангиома (доброкачественное сосудистое образование) мочеполовой системы встречается редко, и частота встречаемости этой патологии составляет около 2% от всех случаев гемангиом, локализация ее на мошонке и головке полового члена является наиболее редкой и составляет менее 1% [1, 2].
В научной литературе описаны различные подходы к лечению гемангиомы полового члена: применяются препараты, подавляющие рост кровеносных сосудов и сужающие существующие кровеносные сосуды (пропранолол), хирургическое иссечение, склерозирование с использование неодимового лазера, склерозирование с использованием полидоканола [1-9]. Хирургическое иссечение гемангиомы может привести к неудовлетворительным косметическим и функциональным результатам. Склерозирование с использование неодимового лазера является высокоэффективным методом, но требует дорогостоящего оборудования. Склерозирование с использование полидоканола показало себя как эффективный, недорогой и простой в исполнении метод, более того, он позволяет проводить процедуру повторно при неудовлетворительном результате [7]. На сегодняшний день литературные сообщения по данному вопросу представлены в небольшом количестве в основном малыми сериями или единичными наблюдениями, ввиду чего выбор метода лечения остается за лечащим врачом [10].
Целью нашей работы является представление редкого клинического случая гемангиомы головки полового члена у пациента 17 лет и результаты лечения этой патологии методом склеротерапии 2% полидоканолом (Этоксисклерол).
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
Пациент 17 лет, поступил в ГБУЗ «Детская городская больница №22» г. Санкт-Петербурга для оперативного лечения в плановом порядке по поводу рубцового фимоза. При выполнении обрезания крайней плоти выявлено сосудистое образование, представленное гемангиомой головки полового члена размерами 3х3х4 см, выполняющей около 2/3 размера головки полового члена, смещающей меатус. Операция circumcision завершена, заживление операционной раны первичным натяжением. Через месяц пациент был вновь госпитализирован для лечения гемангиомы головки полового члена. Под ингаляционным наркозом установлен катетер Фолея 14 Fr в мочевой пузырь. После компрессии головки полового члена на основание наложен жгут. С использованием инъекционной иглы 26 G в ткань гемангиомы было введено 1,5 мл 2% полидоканола (Этоксисклерол) из 3 точек по 0,5 мл соответственно. Макроскопически изменений в тканях не отмечалось. После инъекций на головку полового члена наложена давящая повязка из адгезивного бинта на 1 сутки. Спустя 6 дней после выполнения первой процедуры склерозирования отмечено уменьшение в размерах патологического образования, циркуляторных и трофических осложнений не отмечено. На 12 сутки после проведения первого склерозирования данная процедура была проведена повторно аналогичным образом. На 6 сутки после выполнения второй процедуры было отмечено уменьшение размеров патологического образования примерно вдвое, циркуляторных и трофических осложнений не отмечалось. Спустя 2 месяца после второй процедуры, при контрольном осмотре отмечено, что головка полового члена умеренно деформирована за счет гемангиомы, преимущественного в глубине тканей. При этом поверхностные ткани макроскопически не отличались от тканей здоровой части головки полового члена. Рубцовых изменений не было. Однако сохранялись участки гемангиомы сине-вишневого цвета размерами 5 х 6 мм. Процедура склерозирования была выполнена в третий раз по описанной выше методике через 8 месяцев после второй процедуры. После 3-х кратного введения 2% полидоканола получен хороший косметический и функциональный результат (рис. 1).
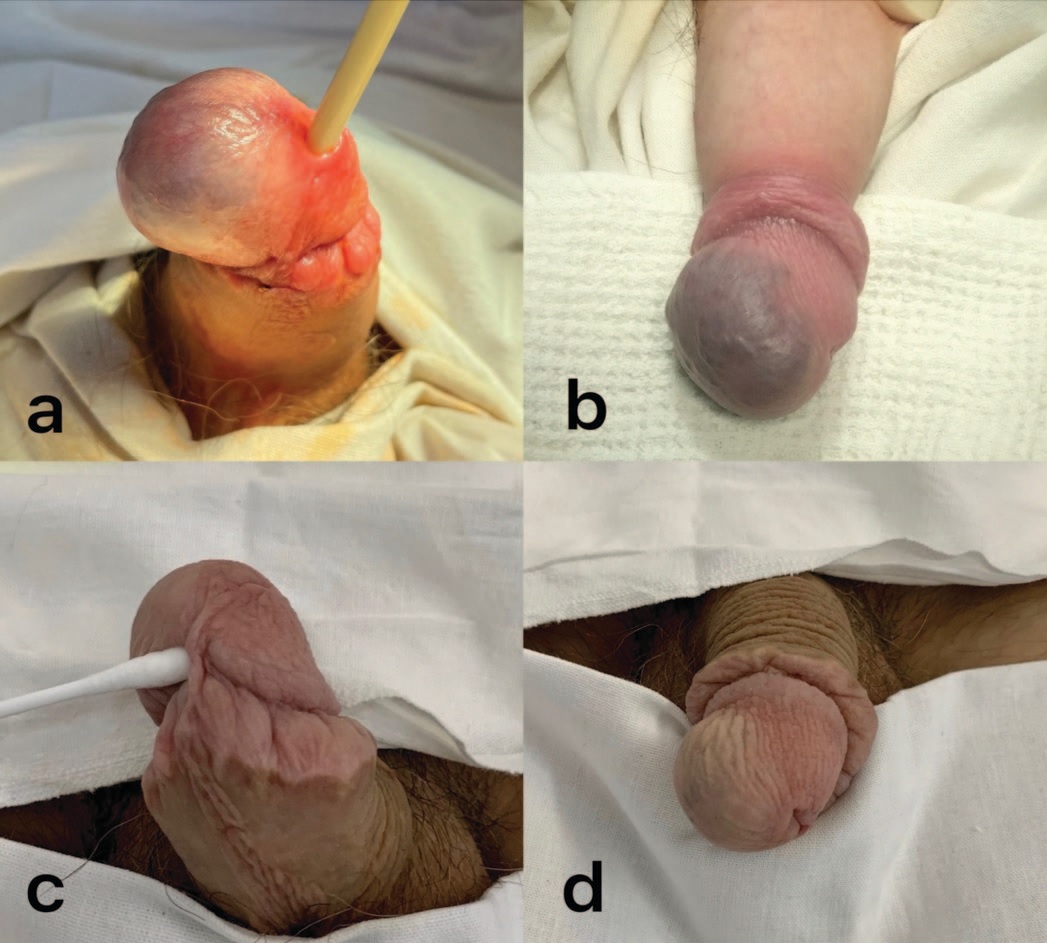
Рис. 1. a, b – вид гемангиомы головки полового члена до склеротерапии 2% полидоканолом. c, d – результат лечения после трех процедур склеротерапии 2% полидоканолом
Fig. 1. a, b – type of hemangioma of the glans penis before sclerotherapy with 2% polydocanol. c, d – the result of treatment after 3 procedures of sclerotherapy with 2% polydocanol
ОБСУЖДЕНИЕ
В научной литературе описано достаточно много заболеваний, поражающих головку полового члена у детей. В обзоре A.C. Papali и соавт. представлено 137 случаев различных поражений головки полового члена, за исключением случаев дифаллии и гипоспадии. По данным авторов наиболее часто отмечены различные кистозные образования (44%), сосудистые (24%), дерматологические (15%), инфекционные (15%) заболевания полового члена. Основными симптомами, характерными для образований головки полового члена, являются различной выраженности дизурические явления, больных также настораживают внешние изменения органа. В литературе отсутствуют сообщения об изолированном злокачественном поражении головки полового члена у детей. Из 33 описанных сосудистых мальформаций головки полового члена гемангиома была отмечена у 15 мальчиков [11].
В настоящее время не существует единой классификации гемангиом и сосудистых мальформаций полового члена. L.M. Ramos и соавторы считают, что гемангиома ограничена в размерах и обычно разрешается спонтанно, тогда как сосудистая мальформация имеет тенденцию сохраняться или прогрессировать [6]. T.E. Gibson классифицировал сосудистые поражения гениталий как два типа: те, которые возникают на коже (гемангиомы), и те, которые присутствуют в подкожных тканях [12].
J.B. Mulliken и J. Glowacki предложили классификацию мальформации пениса у детей в соответствии с естественным течением заболевания, данными физикального исследования и клеточными особенностями поражений. Авторами выделено 2 группы поражений: гемангиомы и пороки развития. Первая характеризуется быстрым ростом в постнатальном периоде (с последующей медленной инволюцией) с гиперплазией эндотелия, повышенным количеством тучных клеток и многослойными базальными мембранами при гистологическом исследовании. Показано, что у 30% детей имеется красное пятно или пятно «предвестник» в месте будущей гемангиомы. Сосудистые мальформации, с другой стороны, присутствуют при рождении и имеют тенденцию увеличиваться по мере роста пациента, они могут увеличиваться вторично в результате травмы, сепсиса или гормональной модуляции. В этих образованиях наблюдается плоский эндотелий с очень медленным обновлением клеток, нормальным уровнем тучных клеток и тонкими базальными пластинками. Мальформации можно разделить на поражения с медленным потоком (капиллярные, лимфатические, венозные) или с быстрым потоком (артериальные, артериально-венозные) [13].
Сосудистые мальформации проявляются в виде слабого синего пятна или нежно-голубой массы. Синий цвет для них является патогномоничным. Нет повышения локальной температуры, вибрации или сосудистого шума, образования легко сдавливаются. Поражения медленно прогрессируют и часто увеличиваются в детстве и в период полового созревания [14].
При диагностике сосудистых мальформаций у детей рекомендуется неинвазивный подход. Ультразвуковое исследование (УЗИ) с допплеровским потоком - наименее затратный метод, хотя его диагностическая ценность весьма зависит от опыта врача специалиста. Однако отсутствие потока крови в патологическом образовании при допплеровском исследовании не исключает диагноз. Проведение компьютерной и магнитно-резонансной томографии возможно, однако находки исследований неспецифичны и не позволяют провести различие между доброкачественными и злокачественными процессами. Ангиография ясно показывает сосудистую природу этих образований, но ее рутинное использование неоправданно. Данный метод следует использовать только для документирования или лечения артериовенозных мальформаций или фистул. При диагностировании венозной мальформации головки полового члена некоторые исследователи предлагают использовать УЗИ, внутривенную урографию и цистоскопию, чтобы исключить сопутствующие поражения мочевыводящих путей. Однако при отсутствии симптомов (например, гематурии) необходимость этих исследований сомнительна, учитывая низкую вероятность ассоциации поражения наружных половых органов и внутренних мочевыводящих путей [6, 4, 11].
Сосудистые поражения головки полового члена у детей лечатся с применением неодимового лазера, использованием склеротерапии или с помощью оперативного иссечения образования. Отметим, что до настоящего времени не существует четких рекомендаций относительно наиболее эффективной терапии сосудистых поражений полового члена у детей [15]. В каждом конкретном случае подход к выбору метода лечения должен быть индивидуальным, с учетом данных, полученных на этапе предоперационной подготовки.
Хирургическое иссечение достаточно долго являлось обычным методом лечения сосудистой мальформации, однако этот метод часто может осложняться кровотечением и иметь неудовлетворительные косметические результаты в отдаленном периоде [16]. Кроме того, если поражение расположено рядом с меатусом, может произойти ретракция уретры [17]. Тем не менее, имеются сообщения об успешном хирургическом удалении небольших сосудистых образований головки полового члена у детей. Данный подход, по мнению авторов, оправдан при малых размерах образования, преимуществами же является одноэтапность и экономическая целесообразность [18].
С появлением медицинских лазеров стали появляться сообщения об использовании их при лечении гемангиом и сосудистых мальформаций, локализующихся в том числе и на половых органах. Первый случай венозной мальформации головки полового члена, обработанный с помощью Nd:YAG-лазера, был описан J.F. Jimenez-Cruz и J.M. Osca [17]. Nd:YAG-лазер вызывает коагуляционный некроз, который распространяется на глубину от 4 до 6 мм от поверхности поражения. Его следует использовать с осторожностью, поскольку даже при стандартных настройках мощности и мерах предосторожности коагуляционный некроз может возникать глубже, чем допустимый диапазон [19]. Nd:YAG лазер можно считать методом выбора при лечении сосудистых мальформаций половых органов даже достаточно больших размеров, при этом отмечаются удовлетворительные косметические результаты и отсутствие рецидивов [1, 4-6]. Однако самым главным недостатком данного метода лечения является высокая стоимость оборудования.
Склеротерапия успешно использована в 1981 г. K. Senoh и соавторами. Они успешно пролечили двух пациентов с ангиоматозом головки полового члена склеротерапией с использованием 30% гипертонического раствора [20]. В дальнейшем в качестве препарата для склеротерапии сосудистых мальформаций головки полового члена было описано применение тетрадецилсульфата натрия, 30% гипертонического раствора и 2% полидоканола, блеомицина [21-23]. Предполагается, что склерозирующее вещество действует путем разрушения эндотелия сосудов в результате тромбообразования в их просвете с последующим фиброзом и склерозом. [24]. Однако, несмотря на свою доступность и низкую стоимость, склеротерапия может привести к некрозу прилегающих тканей, изъязвлению и гиперпигментации [25, 26].
Полидоканол состоит из 95% гидроксиполиэтоксидодекана и 5% этилового спирта. Этиловый спирт служит консервантом. Гидроксиполиэтоксидодекан представляет собой неионное поверхностно-активное вещество, состоящее из гидрофобной части (додецильной группы) и гидрофильной части (полиоксиэтиленовой группы) в молекуле. Это анионное поверхностноактивное вещество, которое цитотоксично для эндотелиальных клеток и может лизировать эритроциты, лейкоциты и тромбоциты [27, 28]. Он активирует внутриклеточные сигнальные пути, которые регулируют внутриклеточное высвобождение кальция и выработку оксида азота, дополнительно вызывая цитотоксичность или гибель клетки. Индуцированная полидоканолом гибель клеток также может быть результатом активации апоптотического пути или прямой химической токсичности для клеточной мембраны [29]. Кроме того, ионные свойства полидоканола могут влиять на синтез плазмы и мембранных белков. Полидоканол также обладает антиангиогенным действием [30]. Со временем это вызывает гемолиз и повреждение фиброзной ткани. Полидоканол используется при лечении варикозного расширения вен в дополнение к склеротерапии гемангиом, используя его действие [31].
Поскольку случаи сосудистой мальформации головки полового члена очень редки, особенно у детей, точная доза и методика проведения склеротерапии все еще находятся на стадии оценки. В нашем клиническом наблюдении получен хороший косметический и функциональный результат использования 3-х кратного введения 2% полидоканола (Этоксисклерола).
ВЫВОДЫ
Склеротерапия гемангиомы полового члена с использованием 2% полидоканола (Этоксисклерол) показала себя как эффективный, недорогой и технически не сложный метод лечения, которая может являться методом выбора при лечении данной патологии у детей.
ЛИТЕРАТУРА
1. Amaro JL, Agostinho AD, Polido Júnior A, Costa RP, Trindade Filho JC, Trindade JC. Traitement de l'hémangiome du gland par laser Nd:Yag. A propos d'un cas. J Urol (Paris) 1997;103(1-2):62-3. [Amaro JL, Agostinho AD, Polido Júnior A, Costa RP, Trindade Filho JC, Trindade JC. Treatment of hemangioma of the glans penis using Nd:Yag laser. Apropos of a case. Zh Urologiya = J Urol (Paris) 1997;103(1-2):62-3. (in English)].
2. Lin CY, Sun GH, Yu DS, Wu CJ, Chen HI, Chang SY. Intrascrotal hemangioma. Arch Androl 2002;48(4):259-65. https://doi.org/10.1080/01485010290031565.
3. Катибов М.И., Богданов А.Б. Врожденные аномалии полового члена: мировые и отечественные данные. Экспериментальная и клиническая урология 2021;14(1):44-54. [Katibov M.I., Bogdanov A.B. Congenital anomalies of the penis: world and national data. Eksperimental'naya i klinicheskaya urologiya = Experimental and Clinical Urology 2021;14(1):44-54. (In Russian)]. https://doi.org/10.29188/2222-8543-2021-14-1-44-54.
4. Heidenreich A, Rothe H, Derschum W, von Vietsch H. Hämangiom der Glans penis. Therapie mittels Neodym:YAG-Laser. Urologe A 1992:31(2):94-5. [Heidenreich A, Rothe H, Derschum W, von Vietsch H. Hemangioma of the glans penis. Its therapy by neodymium: YAG laser. Urologiya A = Urology A 1992:31(2):94-5. (in English)].
5. Ulker V, Esen T. Hemangioma of the glans penis treated with Nd:YAG laser. Int Urol Nephrol 2005;37(1):95-6. https://doi.org/10.1007/s11255-004-4695-3.
6. Ramos LM, Pavón EM, Barrilero AE. Venous malformation of the glans penis: efficacy of treatment with neodymium: yttruim-aluminum-garnet laser. Urology 1999;53(4):779-83. https://doi.org/10.1016/s0090-4295(98)00578-0.
7. Savoca G, De Stefani S, Buttazzi L, Gattuccio I, Trombetta C, Belgrano E. Sclerotherapy of hemangioma of the glans penis. Urology 2000;56(1):153. https://doi.org/10.1016/s0090-4295(00)00481-7.
8. Weiss RA, Goldman MP. Advances in sclerotherapy. Dermatol Clin 1995;13(2):431-45.
9. Manerikar K, Singh G, Ali I. Intralesional Sclerotherapy in Hemangiomas of the Glans Penis. Int J Sci Stud 2015;3(6):207-209.
10. Sharma GR. Hemangioma of glans penis. Internet J Urol 2005;3(1). URL: https://ispub.com/IJU/3/1/3235.
11. Papali AC, Alpert SA, Edmondson JD, Maizels M, Yerkes E, Hagerty J, et al. A review of pediatric glans malformations: a handy clinical reference. J Urol 2008;180(4 Suppl):1737-42. https://doi.org/10.1016/j.juro.2008.04.079.
12. Gibson TE: Hemangioma of the scrotum. Urol Cutan Rev 1937;(41):843–844.
13. Mulliken JB, Glowacki J. Hemangiomas and vascular malformations in infants and children: a classification based on endothelial characteristics. Plast Reconstr Surg 1982;69(3):412-22. https://doi.org/10.1097/00006534-198203000-00002.
14. Enjolras O, Mulliken JB. The current management of vascular birthmarks. Pediatr Dermatol 1993;10(4):311-3. https://doi.org/10.1111/j.1525-1470.1993. tb00393.x.
15. Saito T. Glomus tumor of the penis. Int J Urol 2000;(7):115.
16. Akyol I, Jayanthi VR, Luquette MH. Verrucous hemangioma of the glans penis. Urology 2008;72(1):230.e15-6. https://doi.org/10.1016/ j.urology.2007.11.120.
17. Jimenez-Cruz JF, Osca JM. Laser treatment of glans penis hemangioma. Eur Urol 1993;24(1):81-3. https://doi.org/10.1159/000474268.
18. Kim KS, Lee H, Hwang JH, Lee SY. Incidentally detected cavernous hemangioma of the glans penis after circumcision: A case report. Medicine (Baltimore) 2020:22;99(21):e20217. https://doi.org/10.1097/MD.0000000000020217.
19. Hrebinko RL. Severe injury from neodymium: yttrium-aluminum-garnet laser therapy for penile condylomata acuminata. Urology 1996;48(1):155-6. https://doi.org/10.1016/s0090-4295(96)00106-9.
20. Senoh K, Miyazaki T, Kikuchi I, Sumiyoshi A, Kohga A. Angiomatous lesions of glans penis. Urology 1981;17(2):194-6. https://doi.org/10.1016/0090-4295 (81)90240-5.
21. Hemal AK, Aron M, Wadhwa SN. Intralesional sclerotherapy in the management of hemangiomas of the glans penis. J Urol 1998;159(2):415-7. https://doi.org/10.1016/s0022-5347(01)63936-3.
22. Tsujii T, Iwai T, Inoue Y, Kubota T, Kihara K, Oshima H. Cutaneous hemangioma of the penis successfully treated with sclerotherapy and ligation. Int J Urol 1998;5(4):396-7. https://doi.org/10.1111/j.1442-2042.1998.tb00377.x.
23. Жуков О. Б., Синицын В. Е., Рудин Ю. Э., Романо Д. В.в, Бабушкина Е. В. Венозная трансформация спонгиозного тела уреты. Андрология и генительная хирургия 2017;18(3):37-43. https://doi.org/10.17650/2070-9781-2017-18-3-37-43. [Zhukov O.B., Sinitsyn V.E., Rudin Yu.E., Romanov D.V., Babushkina E.V. Venous malformation of the spongy body of the urethra. Andrologiya i genital'- naya khirurgiya = Andrology and genital surgery. (In Russian)].
24. Mondal S, Biswal DK, Pal DK. Cavernous hemangioma of the glans penis. Urol Ann 2015;7(3):399-401. https://doi.org/10.4103/0974-7796.152037.
25. Cheng G, Song N, Hua L, Yang J, Xu B, Li P, Yin C, Zhang W. Surgical treatment of hemangioma on the dorsum of the penis. J Androl 2012;33(5):921-6. https://doi.org/10.2164/jandrol.111.015685.
26. Lee JM, Wang JH, Kim JS. Multiple cavernous hemangiomas of the glans penis, penis and scrotum. Korean J Urol 2008;(49):92-4.
27. Doganci S, Yildirim V, Erol G, Yesildal F, Karabacak K, Kadan M. Polidocanol (Lauromacrogol 400) has anti-angiogenic effects in vitro and in vivo. Eur Rev Med Pharmacol Sci 2016;(20):1384-1389.
28. Rabe E, Pannier-Fischer F, Gerlach H, Breu FX, Guggenbichler S, Zabel M. Guidelines for sclerotherapy of varicose veins (ICD 10: I83.0, I83.1, I83.2, and I83.9). Dermatol. Surg 2004;(30):687-693.
29. Kobayashi S, Crooks S, Eckmann D.M. Dose- and time-dependent liquid sclerosant effects on endothelial cell death. Dermatol Surg 2006;(32):1444-1452.
30. Gemmete JJ, Pandey AS, Kasten SJ, Chaudhary N. Endovascular methods for the treatment of vascular anomalies. Neuroimaging Clin N Am 2013;(23):703-728. https://doi.org/10.1016/j.nic.2013.03.016
31. Yakes WF. Extremity Venous Malformations: Diagnosis and Management. Semin. Interv Radiol 1994;(11):332-339.







