Бесплодие у мужчин представляет собой актуальную проблему современной андрологии и встречается в той или иной форме в 45% бесплодных браков [1]. При диагностике мужского бесплодия (МБ) поэтапно исключают частые причины заболевания: травмы, варикоцеле, аномалии развития, системные заболевания, прием стероидов, инфекции мочеполовой системы, хронические стрессы, иммунологические нарушения и другие патологические изменения. В оставшихся случаях бесплодие у мужчин может быть обусловлено генетическими причинами в виде хромосомных аберраций (например, синдром Кляйнфельтера) или точковых мутаций, среди которых можно выделить как редкие моногенные заболевания (синдромы Кальмана, Картагенера и другие), так и более частые случаи азооспермии, обусловленные делециями локуса AZF или сочетанием мутаций CFTR [2,3]. В настоящей работе систематизированы данные о генетических нарушениях, приводящих к снижению фертильности у мужчин, и способах их определения. Основное внимание уделено молекулярно-генетической диагностике известных форм бесплодия, связанных с частыми мутациями, также охарактеризована область применения высокопроизводительного секвенирования в изучении МБ. Обзор ориентирован на андрологов, генетиков, урологов и специалистов смежных профессий, занимающихся лабораторной диагностикой бесплодия у мужчин.
МАТЕРИАЛЫ И МЕТОДЫ
При написании обзора были использованы данные о генетических нарушениях при снижении фертильности у мужчин, опубликованные в базах www.ncbi.nlm.nih.gov/pubmed/" target="_blank">PubMed, Научной электронной библиотеки Elibrary.ru и сайтах профессиональных андрологических ассоциаций. Поиск в базах данных проводили по ключевым словам «gene», «male infertility», «mutation» и «polymorphism». На первом этапе были найдены 102 источника не старше 5 лет, которые имели отношение к теме обзора. Из них были исключены тезисы конференций, короткие сообщения, дублирующиеся публикации. После чего, исходя из актуальности данных, достоверности источников, импакт-факторов журналов и последовательности изложения материала в рукописи, непосредственно для цитирования в обзоре были отобраны 49 статей в научных международных рецензируемых журналах и два практических руководства.
ХРОМОСОМНЫЕ АБЕРРАЦИИ ПРИ СНИЖЕНИИ ФЕРТИЛЬНОСТИ У МУЖЧИН
Большинство случаев МБ, связанных с анеуплоидиями, представлены синдромом Кляйнфельтера (СК).
По различным оценкам, частота СК среди бесплодных мужчин в целом составляет около 3%, в когорте пациентов с необструктивной азооспермией – до 10%. Классическая форма СК обусловлена кариотипом (47,XXY) и составляет 85% случаев этого синдрома, характеризуется низким уровнем тестостерона, гипогонадизмом, гинекомастией; в остальных случаях выявляют множественные анеуплоидии (48,XXYY; 48,XXXY; 49,XXXXY), которые выражаются в более тяжелых фенотипических проявлениях в раннем детстве при формировании наружных половых органов и умственной отсталости, или частичное увеличение копий фрагмента Х-хромосомы (47,X,iXq,Y). Частота классической формы СК составляет 1:600 новорожденных. В части случаев наблюдают мозаичную форму СК с кариотипом (47,XXY/46,XY) и стертой клинической картиной заболевания. В ряде случаев пациенты с СК могут иметь детей при использовании вспомогательных репродуктивных технологий, в частности, забора спермы с помощью TESE (microdissection testicular sperm extraction) и последующей интрацитоплазматической инъекции сперматозоида – ICSI (intracytoplasmic sperm injection) [4]. При СК в зависимости от тяжести фенотипических проявлений выявляют олиго- или азооспермию с гиалианизацией и фиброзом семенных протоков.
Большинство случаев СК манифестируют при наступлении пубертатного периода и их диагностика не вызывает затруднений, однако 10-20% пациентов имеют мозаичную форму СК со стертыми симптомами гипогонадизма [5]. В этих случах возможна гиподиагностика СК в детском и юношеском возрасте и такие мужчины могут обращаться к андрологу по поводу бесплодия. Генетическая диагностика СК заключается в кариотипировании, для оптимизации протокола ведения таких пациентов также проводят определение концентрации тестостерона, лютеинизирующего и фолликулостимулирующего гормонов, пролактина, ингибина В и некоторых других.
Поскольку при СК в область хромосомной аберрации попадает большое количество генов, то выделить какие-либо гены-кандидаты, отвечающие за фенотипические варианты проявления СК, представляется затруднительным. Так, анализ транскриптома больных СК в сравнении со здоровым контролем показал более тысячи дифференциально экспрессирующихся генов, из них десятки имели биологические функции, прямо или косвенно относящиеся к формированию половых признаков и сперматогенезу [6]. В редких случаях МБ может быть обусловлено сбалансированными транслокациями – описано около 250 таких случаев, причем часть из них представлена множественными перестройками с 4 и 6 точками разрыва [7], робертсоновскими транслокациями, инверсиями. В последних случаях наиболее информативным представляется анализ с помощью мультилокусной FISH (fluorescent in situ hybridisation) [8]. К цитогенетически обусловленным формам МБ можно отнести синдром де ля Шапеля, проявляющийся гипоспадией, микропенисом, неполным опущением яичек. При формуле кариотипа (46,ХХ) пациенты имеют мужской фенотип и несут ген SRY (sex determining region Y gene), который транслоцировался с Y-хромосомы на Х-хромосому или аутосомы. Генетическая диагностика этого синдрома заключается в кариотипировании и, при кариотипе (46,ХХ), последующем FISH или ПЦР STS-маркеров для выявления SRY [9]. C учетом сказанного выше, кариотипирование является одним из основных рутинных тестов при бесплодии у мужчин, который позволяет диагностировать СК, исключить другую хромосомную патологию. При необходимости он может быть дополнен мультилокусной FISH для поиска небольших сбалансированных перестроек или ПЦР гена SRY.
ДЕЛЕЦИИ ОБЛАСТИ AZF НА Y-ХРОМОСОМЕ
Субмикроскопические хромосомные аберрации (микроделеции) Y-хромосомы занимают лидирующую позицию по частоте встречаемости как причина МБ, выявляемая молекулярно-генетическими методами. Микроделеции Y-хромосомы, затрагивающие область AZF (azoospermia factor), могут включать субрегионы AZFa, b и/или c и приводить к утрате генов USP9Y, DBY, UTY, TB4Y и других локусов, участвующих в регуляции сперматогенеза. Одновременные делеции субрегионов AZFa, b или нескольких субрегионов приводят к азооспермии, частичные делеции субрегиона AZFc могут привести к олигозооспермии [10]. Характерной особенностью Y-хромосомы является наличие 8 инвертированных повторов в ее длинном плече. Причиной большинства делеций AZF является несбалансированная неаллельная гомологичная рекомбинация между последовательностями эндогенного ретровируса HERV15 (делеции AZFa), палиндромом P5 и проксимальным плечом палиндрома P1 (делеции AZFb); палиндромами P5 и P4, а также проксимальными и дистальными плечами палиндрома P1 (делеции AZFb+c), прямыми повторами b2 и b4 (полные делеции AZFc).
Наиболее часто встречаются делеции AZFc – 60- 70% всех делеций AZF, вторыми по частоте являются делеции AZFb и b+c (15-20%), реже встречаются делеции AZFa (5-10%), в единичных случаях обнаруживают комплексные делеции AZFa+b, a+b+c [11, 12]. Частота встречаемости делеций AZF у мужчин с бесплодием в России составляет около 10%, что близко к показателям других Восточно-Европейских стран (8-12%), несколько ниже эта частота в азиатских популяциях (6-9%) [10-12]. Как правило, диагностика делеций AZF проводится с помощью ПЦР участков Y-хромосомы (по 2-3 STS-маркера на каждый из субрегионов AZF) в районах возможных делеций и контрольных маркеров той же хромосомы. Особый интерес представляет определение частичных делеций AZFc, доля которых среди пациентов с олигозооспермией может достигать 12%; в этих случаях возможно получение потомства. При необходимости возможно тестирование дополнительных STS-маркеров Y-хромосомы, относящихся к AZFc [13, 14]. Хотя минимальный набор STS-маркеров, необходимых для диагностики делеций AZF, присутствует в каждой тест-системе и, в целом, соответствует международным рекомендациям, возможны отличия в дополнительных STS-маркерах, контрольных локусах Y-хромосомы, способах детекции (электрофорез продуктов мультиплексной ПЦР или детекция в режиме ПЦР в реальном времени). На рисунке 1 приведены данные о составе некоторых систем для выявления делеций AZF, применяемых отечественными авторами как в прикладных научно-исследовательских проектах, так и в диагностических целях [15-18]. Следует отметить, что в ДНК-диагностике представляется более целесообразным использовать тест-системы в режиме ПЦР в реальном времени, исходя из скорости получения результата и трудоемкости этапов выполнения анализа.
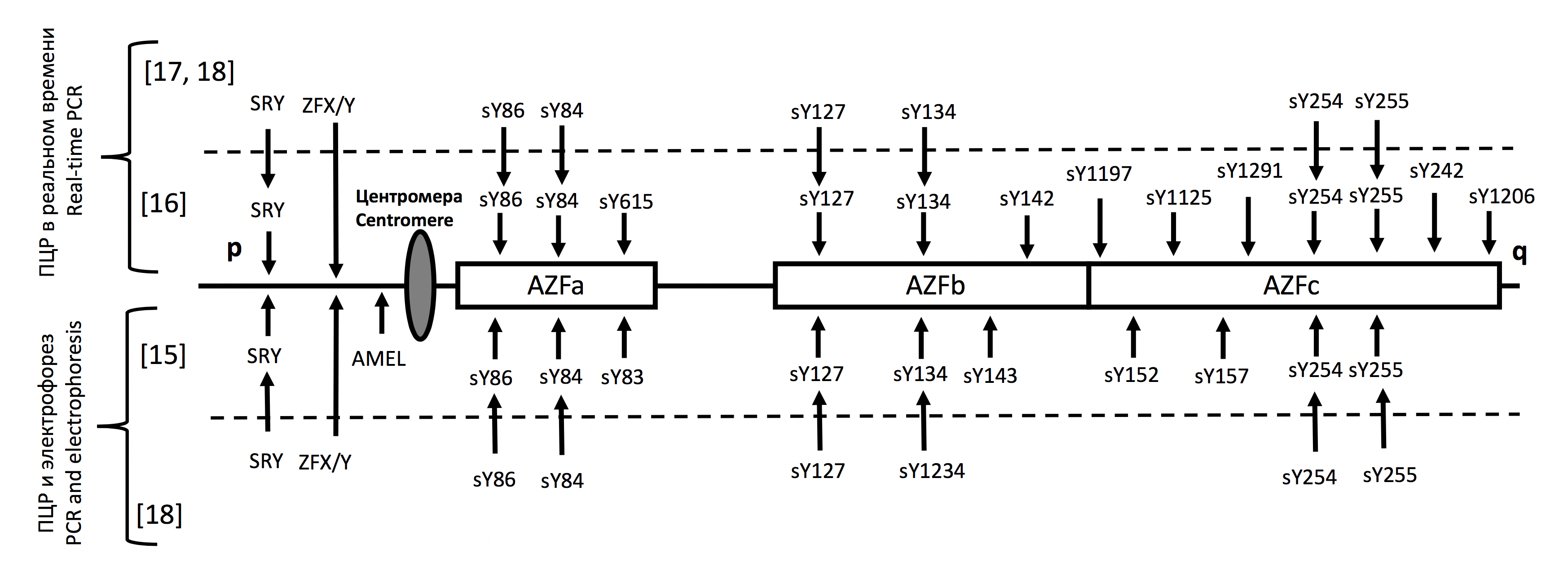
Рис. 1. Расположение STS-маркеров в области AZF и контрольных локусов в различных тест-системах для определения микроделеций Y-хромосомы
Fig. 1. Localization of STS-markers and controls in the AZF region regarding to different test systems intended for detection of Y-microdeletions
МУТАЦИИ CFTR ПРИ БЕСПЛОДИИ У МУЖЧИН
Ген CFTR кодирует трансмембранный регулятор проводимости, который участвует в транспорте ионов хлора через плазматическую мембрану и формировании секрета эпителиальных клеток. Компаунд-гетерозиготы по тяжелой и мягкой мутациям CFTR не имеют клинической картины муковисцидоза, как у пациентов с инактивацией обоих аллелей. Однако у них наблюдают проявления гаплонедостаточности – измененную концентрацию ионов хлора и электролитов, повышенную вязкость секрета в мелких протоках желез внешней секреции, что ассоциировано с агенезией семявыносящих протоков (CBAVD – congenital bilateral absence of the vas deferens) [19].
Генетическое тестирование для выявления мутаций CFTR показано пациентам с обструктивным МБ. При этом тяжелая мутация может быть выявлена с помощью тест-систем, предназначенных для поиска частых мутаций CFTR при диагностике муковисцидоза, которые включают до 18 диагностически значимых (частых) мутаций в европейской части России [20,21]. Вторая, мягкая мутация в большинстве случаев представлена аллелем 5Т. Это один из вариантов расположенного у интрон-экзонной границы мононуклеотидного тракта IVS8-Tn, который в 95% случаев представлен аллелями длиной 7 и 9Т. Короткий аллель 5Т приводит к нарушению сплайсинга, при котором образуется лишь 30% нормального транскрипта CFTR. При сравнении выборок пациентов с CBAVD и контролем европеоидного происхождения наблюдали увеличение частоты встречаемости аллеля 5Т: 3% против 21% и более [22, 23]. Отметим, что не всегда есть возможность на начальном этапе диагностики целенаправленно отделять пациентов с CBAVD. Однако по данным недавней работы, выполненной на российской популяции, частота аллеля 5Т повышена даже в гетерогенной выборке пациентов с МБ [15]. К такому же выводу приводит исследование 2146 российских мужчин с репродуктивными нарушениями, выполненное другим исследовательским коллективом [24]. Это делает целесообразным определение генотипа по локусу IVS8-Tn, в том числе, и в составе генетических тестов при первичной диагностике МБ.
Экспрессивность аллеля 5Т зависит от повтора (TG)n, располагающегося в непосредственной близости от IVS8-Tn. Показано, что недостаточность синтеза нормальной изоформы белка CFTR при прочих равных условиях обратно пропорциональна длине повтора (TG)n. Гаплотип 5Т-13TG достоверно чаще ассоциирован с недостаточностью функции гена CFTR по сравнению с 5Т-11TG в ряде популяций. В связи с этим, генотипирование локуса IVS-8Tn целесообразно дополнять определением длины повтора (TG)n [25]. Делеции AZF и компаунд-гетерозиготы по мутациям CFTR представляют собой наиболее частые молекулярно-генетические нарушения, которые тестируют при МБ. Положительный результат этих анализов позволяет установить причину МБ, в некоторых случаях – скорректировать тактику ведения пациентов в клинике.
ПОЛИМОРФИЗМ AR И ДРУГИХ ГЕНОВ, АССОЦИИРОВАННЫХ С МУЖСКИМ БЕСПЛОДИЕМ
Наряду с точковыми мутациями ряд авторов выделяют в качестве возможных причин бесплодия у мужчин неблагоприятные аллели полиморфизмов гена андрогенового рецептора (AR) и генов семейства глутатионтрансфераз. Андрогены играют важную роль в сперматогенезе, реализуя свое действие через андрогеновый рецептор. В первом экзоне гена AR расположен полиморфный CAG-повтор, соответствующий полиглутаминовому тракту вариабельной длины. Длина повтора обратно пропорциональна способности рецептора активировать транскрипцию генов-мишеней, что может иметь значение в патогенезе бесплодия у носителей длинных аллелей [26]. Ассоциация CAG-повтора AR с бесплодием подтверждалась далеко не во всех исследованиях, однако согласно результатам недавнего метаанализа 40 оригинальных работ, включающего 3858 мужчин с бесплодием и 3161 индивидуумов в контрольной группе, показана ассоциация длинных аллелей CAG-повтора с мужским бесплодием в объединенной выборке: обобщенное стандартизированное среднее различие (standardized mean difference – SMD) составило 0,14 с 95% ДИ 0,02-0,26. С учетом популяционной принадлежности ассоциация длинных аллелей показана для европейских и североамериканских популяций, но не для североафриканских представителей или популяций из юго-восточной Азии. В мета-анализе к условно длинным аллелям относились все повторы более 21 CAG-тринуклеотида, т.е. самого частого аллеля [27]. Вопрос выбора пороговой длины CAG-повтора напрямую влияет на результат таких исследований. С точки зрения повышения информативности анализа полиморфизма AR как предрасполагающего фактора МБ ряд авторов предлагают относить к группе условно длинных аллелей повторы длиной более CAG26 [15]. Исследование полиморфизма AR у российских пациентов с МБ проводили в разное время независимые исследовательские группы. Примечательно, что в одной из работ показана ассоциация нарушений сперматогенеза как с условно длинными (более CAG28), так и с короткими (менее CAG19) аллелями AR [27]. В целом, общая численность исследованных выборок российских пациентов с МБ в доступных публикациях превышает 300 образцов, для них получен результат, аналогичный наблюдаемому в других европейских популяциях: ассоциация условно длинных аллелей CAG-повтора AR с МБ [15, 28, 29].
Гены GSTM1 и GSTT1 кодируют глутатионтрансферазы – ферменты, которые участвуют в детоксикации ксенобиотиков и защите макромолекул от перекисного окисления. Гомозиготы по аллелям с делециями этих генов (нулевые генотипы) характеризуются повышенным риском развития ряда мультифакториальных заболеваний, в том числе, МБ по данным как российских, так и зарубежных авторов [30,31]. В частности, в исследовании российских пациентов показано достоверное увеличение частоты нулевых генотипов в группе 160 мужчин с бесплодием относительно 104 образцов популяционного контроля, при этом частоты делеционных генотипов у больных и в контроле соотносились как 50% vs 37% (GSTM1), 28% vs 13% (GSTT1) и 19% vs 5% (оба гена) [32]. С учетом сказанного выше, можно рассматривать длинные аллели CAG-повтора AR с аргументировано выбранным пороговым уровнем и компаунды по нулевым генотипам GSTM1 + GSTT1 как низкопенетрантные герминальные генетические варианты, предрасполагающие к развитию МБ у мужчин-европеоидов. Однако результаты генотипирования полиморфизмов сложно имплементировать в практическую плоскость: если выявление делеции AZF или компаунд-гетерозиготы CFTR позволяет установить причину бесплодия, то наличие неблагоприятных аллелей полиморфизмов говорит лишь о возможной генетической предрасположенности к МБ.
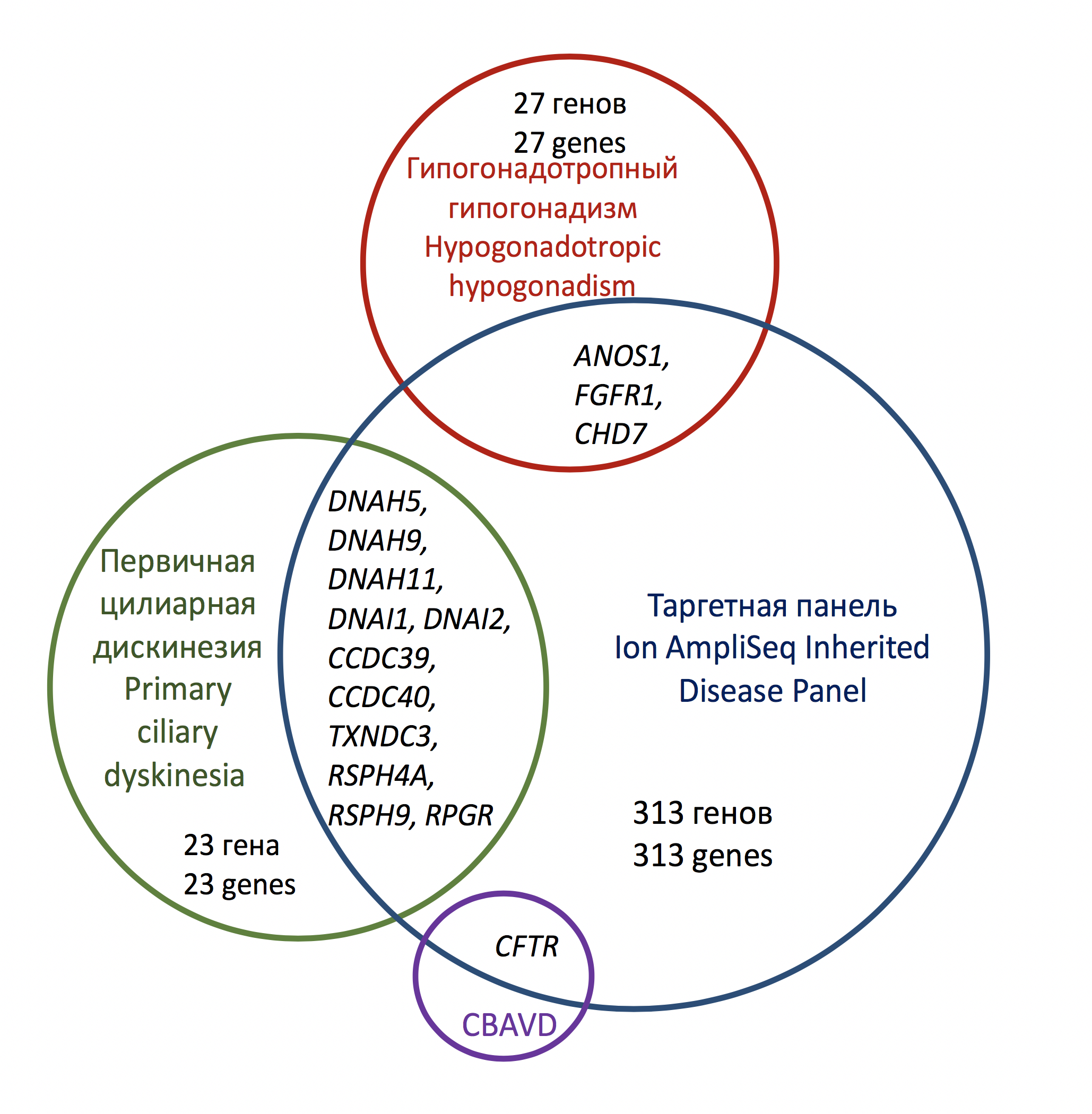
Рис. 2. Покрытие генов-кандидатов при основных моногенных формах МБ расширенной таргетной панелью AmpliSeq для NGS-диагностики наследственных заболеваний
Fig. 2. The diagram showing genes involved in the development of monogenic forms of male infertility and covered by the comprehensive Ion AmpliSeq Inherited Disease Panel
МОНОГЕННЫЕ СИНДРОМАЛЬНЫЕ ФОРМЫ МУЖСКОГО БЕСПЛОДИЯ
Кроме типичного моногенного заболевания – CBAVD с мутациями CFTR, описаны и другие синдромальные формы МБ, вызванные точковыми мутациями в протяженных генах кандидатах. Их особенностью является генетическая гетерогенность, наличие нескольких десятков генов-кандидатов и разные типы наследования.
Врожденный гипогонадотропный гипогонадизм (ГГ) – заболевание, при котором нарушен синтез, секреция или механизм действия в клетках-мишенях гонадотропин-рилизинг гормона – основного гормона, регулирующего репродукцию человека. Вследствие этого не достигается полноценная половая зрелость и наступает бесплодие. Синдром характеризуется клинической и генетической (около 30 описанных генов-кандидатов) гетерогенностью, помимо бесплодия у 50% пациентов наблюдают аносмию (эта форму заболевания называют синдромом Кальмана), у некоторых пациентов выявляют аномалии развития зубов, органов слуха, скелета [33]. ГГ – генетически гетерогенное заболевание, различные его формы наследуются по аутосомно-рециссивному, аутосомно-доминантному или Х-сцепленному рецессивному типу. Первый ген-кандидат заболевания был идентифицирован у пациента с синдромом Кальмана – ANOS1, который кодирует аносмин, участвующий в сигнальном пути рецептора фактора роста фибробластов. Другие гены-кандидаты синдрома Кальмана, в частности, при аутосомно-рецессивной форме заболевания включают FGFR1, FGF8, CHD7, SOX10, SEMA3A, WDR11, HS6ST1, IL17RD, FEZF1, PROKR2 и PROK2, некоторые минорные гены-кандидаты [34]. Нормосмический ГГ может быть обусловлен мутациями в гене GNRHR (кодирует гонадотропин-рилизинггормон), GNRH1, KISS1 и KISS1R, TAC3 и TACR3. При диагностике заболевания обращают внимание на крипторхизм и микропенис у мальчиков, которым проводят исследования гормонов (гонадотропинов, половых стероидов, ингибина В). У подростков и в более старшем возрасте важно проводить дифференциальную диагностику с функциональными нарушениями и аденомой гипофиза, однако в этом возрасте клинические признаки становятся более выраженными, в том числе, характеризующие определенные формы синдрома: аносмия у пациентов с мутациями ANOS1, нарушения скелета у пациентов с мутациями FGFR1 или FGF8, колобома и порок сердца и носителей мутаций в гене CHD7, нарушения слуха у больных с мутациями SOX10 [35,36].
Первичная цилиарная дискинезия (ЦД, синдром Картагенера, OMIM 244400) –врожденное заболевание с частотой 1:20 тыс. младенцев, при котором значительно снижено или отсутствует функционирование клеточных ресничек. Клинические признаки заболевания, обусловленные дисфункцией ресничек, включают хронические инфекции дыхательных путей, начиная с первого года жизни, бесплодие у мужчин и высокий риск эктопической беременности у женщин в более позднем возрасте; у некоторых пациентов обнаруживают врожденные заболевания сердца, бронхоэктазы, пигментацию сетчатки, поликистоз почек, патологические изменения в строении печени, пищевода. Заболевание характеризуется значительной клинической и генетической гетерогенностью, что вполне объяснимо: насчитывают 33 гена-кандидата синдрома Картагенера, мутации в каждом из них могут привести к дисфункции ресничек и сочетанным фенотипическим изменениям. При лабораторной диагностике заболевания применяли электронную микроскопию ресничек и мест их прикрепления, оценку уровня назального оксида азота и т.д., однако до недавнего времени специфическая лабораторная диагностика первичной ЦД отсутствовала [37].
РОЛЬ ВЫСОКОПРОИЗВОДИТЕЛЬНОГО СЕКВЕНИРОВАНИЯ В АНАЛИЗЕ ГЕРМИНАЛЬНЫХ МУТАЦИЙ ПРИ СНИЖЕННОЙ ФЕРТИЛЬНОСТИ У МУЖЧИН
В настоящее время можно выделить 78 генов, мутации в которых приводят к 92 различным фенотипическим вариантам МБ [38]. За исключением небольшого количества случаев с мажорными мутациями диагностика идиопатического МБ требует секвенирования протяженных кодирующих участков генов-кандидатов, что осуществляют с помощью технологий высокопроизводительного секвенирования (NGS – next generation sequencing). Прежде всего NGS незаменим при секвенировании экзома, которое целесообразно проводить у пациентов с МБ без характерных диагностических признаков описанных ранее форм заболевания. Например, секвенирование экзома позволило выявить новую нонсенс-мутацию c.112C>T, p.R38* в гене GNRHR у пациента с ГГ [39]. Другой пример: при первичной ЦД с помощью секвенирования экзома выявили компаунд-гетерозиготу в гене LRRC6: c.183T>G (p.N61K); c.179-1G>A) [40].
Тем не менее, секвенирование специально подобранной генной панели представляется более целесообразным с позиции соотношения себестоимости и клинической чувствительности анализа для диагностики моно- и олигогенных форм МБ – CBAVD, ГГ и ЦД. Например, секвенирование 69 генов-кандидатов ГГ на платформе MiSeq (Illumina) позволило выявить патогенную мутацию у 11 из 28 неродственных пациентов, т.е. в 40% случаев, что является достаточно высоким показателем для прямой ДНК-диагностики этого заболевания [41]. Секвенирование 32 генов-кандидатов первичной ЦД у 46 пациентов с подозрением на это заболевание позволило выявить герминальную мутацию у 10 из них при использовании технологии IonTorrent [42]. Довольно высокая доля подтвержденных случаев врожденной ЦД была отмечена среди 51 итальянского пациента. Секвенирование 24 генов-кандидатов по технологии AmpliSeq на платформе IonTorrent выявило 5 гомозигот и 27 компаунд-гетерозигот, которые вместе составили 43% подтвержденных случаев заболевания [43]. Большей клинической чувствительности удавалось достичь только при секвенировании редуцированной версии экзома (клинического экзома) на платформе Illumina – герминальные мутации были выявлены у 52% пациентов (11/21) [44]; либо при секвенировании расширенных генных панелей, включающих не десятки, а сотни генов: секвенирование кодирующих частей 284 генов, имеющих прямое и косвенное отношение к патогенезу ЦД, у 74 датских пациентов позволило выявить патогенные герминальные генетические варианты в 67% случаев [45]. Однако в составе таких широких панелей подавляющее большинство локусов не имеет отношения к патогенезу МБ и их амплификация избыточна как с генетической, так и с экономической точек зрения. Это можно проиллюстрировать покрытием генов-кандидатов моногенных форм МБ в модифицируемой сейчас амплификационной панели Ion AmpliSeq™ Inherited Disease Panel (IonTorrent), включающей 328 генов (рис. 2). Панель содержала 95% избыточных генов и лишь 3 из 30 генов-кандидатов гипогонадотропного гипогонадизма. Еще больше доля избыточных генов в предлагаемой сейчас конечным пользователям панели другого производителя TruSight Inherited Disease Sequencing Panel (Illumina, содержит 552 гена) [46,47]. В недавнем обзоре 23 оригинальных исследований нарушений фертильности у мужчин с применением NGSтехнологий, а также в некоторых других работах ряд авторов сходятся во мнении о том, что для диагностики МБ было бы актуально использовать специальную таргетную панель, объединяющую различные гены-кандидаты сниженной фертильности у мужчин [48,49]. В состав такой генной панели NGS для диагностики МБ могут войти гены врожденных форм ГГ и ЦД, ген CFTR, другие гены-кандидаты МБ, выявленные в ходе секвенирования экзомов мужчин со сниженной фертильностью.
ЗАКЛЮЧЕНИЕ
Таким образом, генетическая патология ответственна за значительную часть МБ и представлена различными генетическими нарушениями: хромосомными аберрациями в виде анеуплоидий и делеций различной протяженности, точковых мутаций в кодирующих частях генов, низкопенетрантыми генетическими вариантами. В большинстве случаев МБ с предположительно генетическими причинами проводят кариотипирование для исключения хромосомных аберраций, выполняют анализ делеций AZF, при обструктивной форме МБ – анализ частых мутаций CFTR. Генотипирование полиморфизмов (CAG-повтора AR, генов семейства GST) в настоящее время имеет невысокую диагностическую ценность. Напротив, все большее значение приобретают технологии NGS: оптимальным методом прямой ДНК-диагностики моно- и олигогенных форм МБ в рамках одного теста представляется секвенирование кодирующих частей соответствующих генов-кандидатов в составе специально подобранной таргетной панели. Обоснованное направление пациента на тот или иной вид генетического анализа, исходя из минимальных диагностических критериев известных синдромальных форм МБ, существенно повышает информативность лабораторной диагностики бесплодия у мужчин.
ЛИТЕРАТУРА
- Чалый М.Е., Ахвледиани Н.Д., Харчилава Р.Р. Мужское бесплодие. Урология 2017;(2, приложение 2): 4-19. doi: 10.18565/urol.2017.2-supplement.4-19. [Chalyi M.E., Akhvlediani N.D., Kharchilava R.R. Male infertility. Urologiia =Urology 2017;( 2,suppl):4-19. (In Russian)]
- Kleisch S. Diagnosis of male infertility: diagnostic work-up of the infertile man. Eur Urol Suppl 2014; 13:73-82. doi: 10.1016/j.eursup.2014.08.002.
- Krausz C, Riera-Escamilla A. Genetics of male infertility. Nat Rev Urol 2018; 15(6):369-84. doi: 10.1038/s41585-018-0003-3.
- Shiraishi K, Matsuyama H. Klinefelter syndrome: from pediatrics to geriatrics. Reprod Med Biol 2018;18(2):140-50. doi: 10.1002/rmb2.12261.
- Bonomi M, Rochira V, Pasquali D, Balercia G, Jannini EA, Ferlin A, et al.Klinefelter syndrome (KS): genetics, clinical phenotype and hypogonadism. J Endocrinol Invest 2017;40(2):123-34. doi: 10.1007/s40618-016- 0541-6. PMID: 27644703.
- Hawksworth DJ, Szafran AA, Jordan PW, Dobs AS, Herati AS. Infertility in patients with Klinefelter syndrome: optimal timing for sperm and testicular tissue cryopreservation. Rev Urol 2018;20(2):56-62. doi: 10.3909/ riu0790.
- Nguyen MH, Morel F, Pennamen P, Parent P, Douet-Guilbert N, Le Bris MJ, et al. Balanced complex chromosome rearrangement in male infertility: case report and literature review. Andrologia 2015;47(2):178-85. doi: 10.1111/and.12245.
- Chatziparasidou A, Christoforidis N, Samolada G, Nijs M. Sperm aneuploidy in infertile male patients: a systematic review of the literature. Andrologia 2015;47(8):847-60. doi: 10.1111/and.12362.
- Majzoub A, Arafa M, Starks C, Elbardisi H, Al Said S, Sabanegh E. 46 XX karyotype during male fertility evaluation; case series and literature review. Asian J Androl 2017;19(2):168-72. doi: 10.4103/1008-682X.181224.
- Colaco S, Modi D. Genetics of the human Y chromosome and its association with male infertility. Reprod Biol Endocrinol 2018; 16(1):14. doi: 10.1186/s12958-018-0330-5.
- Liu XG, Hu HY, Guo YH, Sun YP. Correlation between Y chromosome microdeletion and male infertility. Genet Mol Res 2016;15(2):gmr.15028426. doi: 10.4238/gmr.15028426.
- Черных В.Б. AZF делеции – частая генетическая причина бесплодия у мужчин: современное состояние проблемы. Проблемы репродукции 2009;(1):10-15. [Chernykh V.B. AZF deletions are common genetic cause of male infertility: the current state of research. Problemy reproduktsii = Problems of reproduction 2009;(1):10-5. (in Russian)]
- Nailwal M, Chauhan JB. Azoospermia factor C subregion of the Y chromosome. J Hum Reprod Sci 2017;10(4):256-60. doi: 10.4103/ jhrs.JHRS_16_17.
- Сафина Н.Ю., Яманди Т.А., Черных В.Б., Акуленко Л.В., Боголюбов С.В., Витязева И.И. и др. Генетические факторы мужского бесплодия, их сочетания и спермиологическая характеристика мужчин с нарушением фертильности. Андрология и генитальная хирургия 2018;19(2):40- 51. doi: 10.17650/2070-9781-2018-19-2-40-51. [Safina N.Y., Yamandi T.A., Chernykh V.B., Akulenko L.V., Bogolyubov S.V., Vityazeva I.I. et al. Genetic factors of male infertility, their combinations and the spermatological characteristics of men with fertility failures. Andrologiya i genital'naya khirurgiya = Andrology and Genital Surgery 2018; 19(2): 40–51. (In Russian)]
- Михайленко Д.С., Соболь И.Ю., Сафронова Н.Ю., Симонова О.А., Ефремов Е.А., Ефремов Г.Д. и др. Частота выявления делеций AZF, мутаций CFTR и длинных аллелей CAG-повтора AR при первичной лабораторной диагностике в гетерогенной группе пациентов с мужским бесплодием. Урология 2019;(3):101-7. doi: 10.18565/urology.2019.3.101- 107. [Mikhaylenko D.S., Sobol I.Y., Safronova N.Y., Simonova O.A., Efremov E.A., Efremov G.D. et al. The incidence of AZF deletions, CFTR mutations and long alleles of the AR CAG-repeats during the primary laboratory diagnostics in a heterogeneous group of infertility men. Urologiia = Urology 2019; 3:101-7. (In Russian)]
- Делеции локуса AZF. URL: https://www.dna-technology.ru/sites/default/ files/azf_051-3.pdf [AZF deletions. URL: https://www.dna-technology.ru/ sites/default/files/azf_051-3.pdf (in Russian)]
- Aксельрод Э.В., Миронов К.О., Михайленко Д.С., Ефремов Г.Д., Перепечин Д.В., Алексеев Б.Я. и др. Разработка и апробация методики на основе мультиплексной полимеразной цепной реакции в режиме реального времени для определения клинически значимых микроделеций в Y-хромосоме. Клиническая лабораторная диагностика 2018; 63(2): 124-8. doi: 10.18821/0869-2084-2018-63-2-124-128. [Akselrod E.V., Mironov K.O., Mikhailenko D.S., Efremov G.D., Perepechin D.V., Alekseiev B.Y. et al. Development and approbation of methodology on the basis of multiplex polymerase chain reaction in real-time to determine clinically significant microdeletions in the Y-chromosome. Klinicheskaya laboratornaya diagnostika = Clinical laboratory diagnostics 2018; 63(2): 124-8. (In Russian)]
- Набор реагентов для выявления микроделеций в AZF-локусе Y-хромосомы в геноме человека методом ПЦР. URL: http://www.lytech.ru/ product/genetika-cheloveka/mikrodeletsii-azf-lokusa-y-khromosomy/ azf-deletions/. [Kit for detection of Y-chromosome microdeletions in human AZF loci using PCR. URL: http://www.lytech.ru/ product/genetika-cheloveka/mikrodeletsii-azf-lokusa-y-khromosomy/azfdeletions/. (In Russian)]
- Liu XG, Hu HY, Guo YH, Sun YP. Correlation between Y chromosome microdeletion and male infertility. Genet Mol Res 2016;15(2):gmr.15028426. doi: 10.4238/gmr.15028426.
- Никифорова А.И., Абрамов Д.Д., Зобкова Г.Ю., Горяинова А.В., Семыкин С.Ю., Шубина Е. и др. Определение мутаций гена CFTR у детей с муковисцидозом. Вестник РГМУ 2018; 3: 35-41. doi: 10.24075/vrgmu.2018.037. [Nikiforova A.I., Abramov D.D., Zobkova G.Y., Goriainova A.V., Semykin S.Y., Shubina J. et al. Detection of CFTR mutations in children with cystic fibrosis. Vestnik RGMU = Bulletin of RSMU. 2018;3:35-41. (In Russian)]
- Черных В.Б., Степанова А.А., Бескоровайная Т.С., Сорокина Т.М., Шилейко Л.В., Курило Л.Ф. и др. Частота и спектр мутаций и IVS8-T полиморфизма гена CFTR среди российских мужчин с бесплодием. Генетика 2010; 46(6): 844-52. [Chernykh V.B., Stepanova A.A., Beskorovainaya T.S., Sorokina T.M., Shileiko L.V., Kurilo L.F. et al. The frequency and spectrum of mutations and the IVS8-T polymorphism of the CFTR gene in Russian infertile men. Genetika = Genetics 2010;46(6):750-7. (In Russian)]
- Yang X, Sun Q, Yuan P, Liang H, Wu X, Lai L, et al. Novel mutations and polymorphisms in the CFTR gene associated with three subtypes of congenital absence of vas deferens. Fertil Steril 2015;104(5):1268-75.e1-2. doi: 10.1016/j.fertnstert.2015.07.1143.
- Gelfi C, Perego M, Righetti PG, Cainarca S, Firpo S, Ferrari M, et al. Rapid capillary zone electrophoresis in isoelectric histidine buffer: high resolution of the poly-T tract allelic variants in intron 8 of the CFTR gene. Clin Chem 1998;44(5): 906-13.
- Соловьева Е.В., Татару Д.А., Преда О.Г., Артюхова В.Г., Секира А.Г., Деревьева В.Ю. и др. Мутации гена CFTR у мужчин с бесплодием. Медицинская генетика 2018;17(5):28-38. doi: 10.25557/2073-7998.2018.05.28-38. [Solovyova E.V., Tataru D.A., Preda O.G., Artyukhova V.G., Sekira A.G., Derevjeva V.Y. et al. CFTR mutations in male infertility. Meditsinskaya genetika = Medical Genetics 2018;17(5):28-38. (In Russian)]
- Salinas DB, Azen C, Young S, Keens TG, Kharrazi M, Parad RB. Phenotypes of California CF newborn screen-positive children with CFTR 5T allele by TG repeat length. Genet Test Mol Biomarkers 2016;20(9):496-503. doi: 10.1089/gtmb.2016.0102.
- Gottlieb B, Lombroso R, Beitel LK, Trifiro MA. Molecular pathology of the androgen receptor in male infertility. Reprod Biomed Online 2005;10(1):42-8.
- Xiao F, Lan A, Lin Z, Song J, Zhang Y, Li J, et al. Impact of CAG repeat length in the androgen receptor gene on male infertility – a meta-analysis. Reprod BioMed Online 2016; 33 (1), 39-49. doi: 10.1016/j.rbmo.2016.03.012.
- Черных В.Б., Руднева С.А., Сорокина Т.М., Шилейко Л.В., Остроумова Т.В., Ермолаева С.А. и др. Влияние CAG-полиморфизма гена андрогенового рецептора (AR) на сперматогенез у мужчин с бесплодием. Андрология и генитальная хирургия 2015;16(4): 55-61. doi: 10.17650/2070-9781-2015-16-4-55-61. [Chernykh V.B., Rudneva S.A., Sorokina T.M., Shileyko L.V., Ostroumova T.V., Ermolaeva S.A. et al. An influence of androgen receptor (AR) gene СAG-polymorphism on spermatogenesis in infertile men. Andrologiya i genital'naya khirurgiya = Andrology and Genital Surgery 2015;16(4): 55-61. (In Russian)]
- Михайленко Д.С., Бабенко О.В., Кириллова Е.А., Никифорова О.К., Зарецкая Н.В., Курносова Т.Р. и др. Комплексный молекулярно-генетический анализ микроделеций области AZF, мутаций гена CFTR и длины CAG-повтора гена AR у мужчин с бесплодием. Проблемы репродукции 2005;11(6):52-5. [Mikhaylenko D.S., Babenko O.V., Kirillova E.A., Nikiforova O.K., Zaretskaya N.V., Kurnosova T.R. et al. Complex molecular genetic analysis of the AZF microdeletions, CFTR mutations, and CAG-repeat length of the AR gene in infertile men. Problemy reproduktsii = Problems of reproduction 2005;11(6):52-5. (In Russian)]
- Глыбочко П.В., Аляев Ю.Г., Чалый М.Е., Усачёва О.А. Влияние полиморфизма генов глутатионтрансфераз М1 и Т1 на андрогенный статус и качество эякулята после оперативного лечения варикоцеле. Андрология и генитальная хирургия 2013;14(1): 23-26. [Glybochko P.V., Alyaev Y.G., Chalyy M.E., Usacheva O.A. Influence of the glutation S-transferases T1 and M1 gene polymorphisms on androgenic status and semen quality after surgical treatment of varicocele. Andrologiya i genital'naya khirurgiya = Andrology and Genital Surgery 2013;14(1):23-26. (in Russian)]
- Wu W, Lu J, Tang Q, Zhang S, Yuan B, Li J, et al. GSTM1 and GSTT1 null polymorphisms and male infertility risk: an updated meta-analysis encompassing 6934 subjects. Sci Rep 2013;3:2258. doi: 10.1038/srep02258.
- Курашова Н.А., Беляева Е.В., Ершова О.А., Дашиев Б.Г., Баирова Т.А., Колесникова Л.И. Ассоциация полиморфизма генов GSTT1, GSTM1 с бесплодием у мужчин. Урология 2017;(6):38-42. doi: 10.18565/urology.2017.6.38-42. [Kurashova N.A., Belyaeva E.V., Ershova O.A., Dashiev B.G., Bairova T.A., Kolesnikova L.I. Association of polymorphism of GSTT1 and GSTM1 genes with infertility in men. Urologiia = Urology 2017; 6: 38-42. (In Russian)
- Boehm U, Bouloux PM, Dattani MT, de Roux N, Dode C, Dunkel L, et al. European consensus statement on congenital hypogonadotropic hypogonadism – pathogenesis, diagnosis and treatment. Nat Rev Endocrinol 2015;11(9):547-64. doi: 10.1038/nrendo.2015.112.
- Stamou MI, Georgopoulos NA. Kallmann syndrome: phenotype and genotype of hypogonadotropic hypogonadism. Metabolism 2018;86:124-34. doi: 10.1016/j.metabol.2017.10.012.
- Topaloglu AK. Update on the genetics of idiopathic hypoganadotropic hypogonadism. J Clin Res Pediatr Endocrinol 2017;9(Suppl 2):113-22. doi: 10.4274/jcrpe.2017.S010. PMID: 29280744.
- Topaloglu AK, Kotan LD. Genetics of hypogonadotropic hypogonadism. Endocr Dev 2016;29:36-49. doi: 10.1159/000438841.
- Mirra V, Werner C, Santamaria F. Primary ciliary dyskinesia: an update on clinical aspects, genetics, diagnosis, and future treatment strategies. Front Pediatr 2017;5:135. doi: 10.3389/fped.2017.00135.
- Oud MS, Volozonoka L, Smits RM, Vissers LE, Ramos L, Veltman JA. A systematic review and standardized clinical validity assessment of male infertility genes. Hum Reprod 2019;34(5):932-41. doi: 10.1093/humrep/ dez022.
- Hussain HM, Murtaza G, Jiang X, Khan R, Khan M, Kakakhel MB, et al. Whole exome sequencing revealed a novel nonsense variant in the GNRHR gene causing normosmic hypogonadotropic hypogonadism in a Pakistani family. Horm Res Paediatr 2019; 91(1): 9-16. doi: 10.1159/000497114.
- Liu L, Luo H. Whole-Exome sequencing identified a novel compound heterozygous mutation of LRRC6 in a Chinese primary ciliary dyskinesia patient. Biomed Res Int 2018;2018:1854269. doi: 10.1155/2018/1854269.
- Kim JH, Seo GH, Kim GH, Huh J, Hwang IT, Jang JH, et al. Targeted gene panel sequencing for molecular diagnosis of Kallmann syndrome and normosmic idiopathic hypogonadotropic hypogonadism. Exp Clin Endocrinol Diabetes 2019;127(8):538-44. doi: 10.1055/a-0681-6608.
- Takeuchi K, Kitano M, Kiyotoshi H, Ikegami K, Ogawa S, Ikejiri M, et al. A targeted next-generation sequencing panel reveals novel mutations in Japanese patients with primary ciliary dyskinesia. Auris Nasus Larynx 2018;45(3):585-91. doi: 10.1016/j.anl.2017.09.007.
- Boaretto F, Snijders D, Salvoro C, Spalletta A, Mostacciuolo ML, Collura M, et al. Diagnosis of primary ciliary dyskinesia by a targeted next-generation sequencing panel: molecular and clinical findings in Italian patients. J Mol Diagn 2016;18(6):912-22. doi: 10.1016/j.jmoldx.2016.07.002.
- Andjelkovic M, Minic P, Vreca M, Stojiljkovic M, Skakic A, Sovtic A, et al. Genomic profiling supports the diagnosis of primary ciliary dyskinesia and reveals novel candidate genes and genetic variants. PLoS One 2018;13(10):e0205422. doi: 10.1371/journal.pone.0205422.
- Paff T, Kooi IE, Moutaouakil Y, Riesebos E, Sistermans EA, Daniels HJ, et al. Diagnostic yield of a targeted gene panel in primary ciliary dyskinesia patients. Hum Mutat 2018;39(5):653-65. doi: 10.1002/humu.23403.
- Ion AmpliSeq™ Inherited Disease Panel target gene list. URL: https://tools.thermofisher.com/content/sfs/brochures/CO25570_Ion_Inherited_Disease_GeneList_Table_CO25570.pdf
- TruSight Inherited Disease Sequencing Panel. URL: https:// emea.illumina.com/content/dam/illumina-marketing/documents/products/gene_lists/gene_list_trusight_inherited_disease.xlsx
- Robay A, Abbasi S, Akil A, El-Bardisi H, Arafa M, Crystal RG, et al. A systematic review on the genetics of male infertility in the era of next-generation sequencing. Arab J Urol 2018;16:53-64. doi: 10.1016/ j.aju.2017.12.003.
- Laan M. Systematic review of the monogenetic causes of male infertility: the first step towards diagnostic gene panels in the andrology clinic. Hum Reprod 2019;34(5):783-5. doi: 10.1093/humrep/dez024.







