Стандартным методом диагностики рака предстательной железы (РПЖ) являетсябиопсия под трансректальным ультразвуковым наведением (ТРУЗИ),и, несмотря на то, что специалистами предпринимаются попытки повысить ее эффективность, многие проблемы остаются: это и частые ложноотрицательные результаты, и низкий уровень репрезентативности образцов ткани, как с точки зрения величины очага, так и его степени дифференцировки опухоли [1, 2].
Таким образом, биопсия доставляет определенный дискомфорт пациенту, порой вызывая осложнения, но при этом не обладает достаточной точностью, чтобы успокоить человека, который не имеет клинически значимого РПЖ, или же предостеречь его о высоком риске наличия у него этого грозного заболевания. Сегодня существует довольно много неинвазивных методов диагностики РПЖ, но ни один из них не способен поспорить с биопсией под ТРУЗИ-контролем.Сюда входят МРТ, эластография, «фьюжн» технологии (сопоставление МРТ и ТРУЗИ изображений на одном экране), а также внедрение новых онкомаркеров, выделяемых из крови и мочи. Несмотря на значительные успехи последнего времени, ни одна из этих методик не обладает чувствительностью, специфичностью, положительной и отрицательной прогностической ценностью, достаточными, чтобы стать альтернативой биопсии предстательной железы. В настоящее время они служат лишь показанием к проведению биопсии, в некоторых случаях позволяя брать образцы ткани из определенных по до зрительных очагов. Биопсия под МРТ-контролем технически и организационно сложна и затратна, а ТРУЗИ далеко не всегда позволяет дифференцировать подозрительные участки.
В НИИ урологии проходит апробацию компьютер-ассистированная ультразвуковая диагностическая система HistoScanning, предназначенная для обнаружения подозрителных на рак образований в предстательной железе и их одновременной или отложенной биопсии. Система анализирует данные, полученные от ультразвукового сканнера, и показывает расположение, форму и объем предполагаемого опухолевого поражения предстательной железы. Основной функцией системы является дифференцирование злокачественной и доброкачественной ткани.
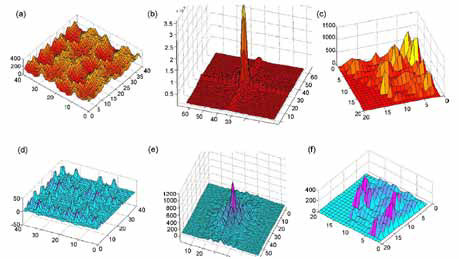 |
| Рисунок 1. Графическое представление трех алгоритмов для выявления злокачественных очагов. Графики (a–c) соответствуют злокачественному новообразованию, а (d–f) доброкачественным изменениям. Хорошо видна разница по оси Y между(a) и (d), (b) и (e), (c) и (f). |
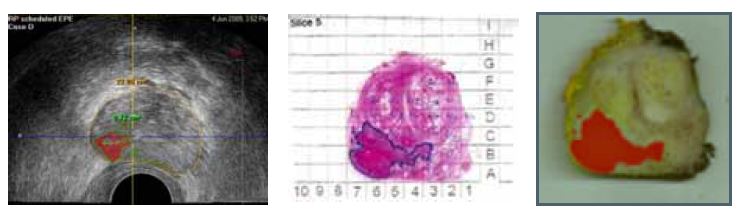 |
| Рисунок 2. Разработка алгоритма HistoScanning: трансректальное ультразвуковое исследование до радикальной простатэктомии (А) и картирование предстательной железы после операции (B и С). |
HISTOSCANNING - ПРИНЦИП ДЕЙСТВИЯ
Алгоритм HistoScanning разработан на основании анализа корреляции необработанного («сырого») эхосигнала с результатами патогистологических исследований после радикальной простатэктомии (РПЭ). Взаимодействия звуковых волн с тканью приводит к изменению физических свойств отраженного сигнала, так называемого обратного рассеивания. В злокачественной опухоли изменены такие характеристики ткани как плотность, упругость и текстура, что проявляется в виде изменения сигнала при обратном рассеивании. В стандартном В-режиме сигнал обратного рассеивания (по существу радиочастотный) проходит многоуровневую обработку для формирования изображения в градациях серой шкалы. Выяснилось, что необработанный сигнал несет гораздо больше информации, существенная часть которой либо отфильтровывается, либо искажается во время обработки изображения. Система HistoScanning использует отраженный «сырой» высокочастотный сигнал, содержащий в себе многочисленные параметры, различные для злокачественных и неизмененных тканей, которые могут быть обработаны инструментами статистики.
Для анализа этих характеристик авторы метода используют три специально разработанные статистические модели или «алгоритмы тканевых характеристик», которые и составляют основу системы HistoScanning (рисунок 1). Эти алгоритмы могут быть применены в «зонах интереса» по всему объему предстательной железы и, таким образом, наличие или отсутствие рака может быть заподозрено в пределах небольшого дискретного объема в 0,04 см3. Эти небольшие объемы или субъединицы не имеют связи со смежными субъединицами и, следовательно, суммирование расположенных рядом «рак-положительных» субъединиц позволяет точно оценить объем опухолевого очага, а также показать его форму и расположение в железе. Данная совокупность алгоритмов была разработана на основании тщательного анализа большого числа «срезов» гистологических препаратов после радикальной простатэктомии и их сопоставления с характеристиками необработанного эхо-сигнала (рисунок 2).
Система HistoScanning состоит из стандартного ультразвукового сканера с каналом вывода «сырого» радиочастотного сигнала и высокопроизводительного компьютера (рисунок 3А).
Исследование выполняется пациенту в положении на левом боку с помощью мультипланов ого трансректального ультразвукового датчика, снабженного моторизированной приставкой, позволяющей осуществлять равномерное сканирование предстательной железы в сагиттальной и поперечной плоскостях (рисунок 3Б). Необработанный радиочастотный сигнал поступает из сканера в компьютерный модуль, анализирующий эти данные на основе «алгоритмов тканевых характеристик» [1]. Система представляет результаты анализа в графическом виде, окрашивая в красный и розовый цвета зоны, подозрительные в отношении РПЖ, на реконструированной трехмерной модели органа (рисунок 4).
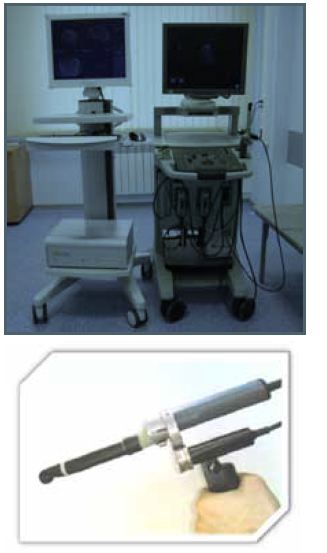 |
| Рисунок 3. Внешний вид диагностического комплекса HistoScanning: специально подготовленный ультразвуковой сканнер Pro Focus (BK medical) и собственно компьютерная система HistoScanning (A), моторизованный трансректальный УЗ-датчик BK medical (Б). |
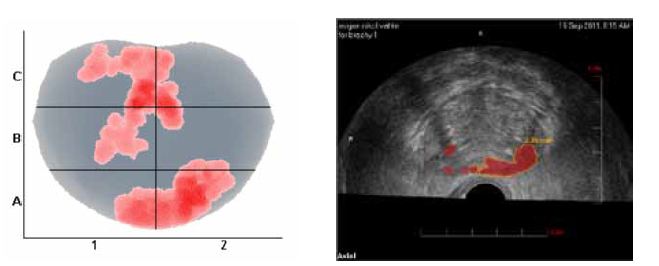 |
| Рисунок 4. Пример предоставляемого системой HistoScanning отчета: подозрительные в отношении РПЖ очаги представлены цветом на генерируемой компьютером модели органа (А) и спроецированы на серошкальное УЗ изображение предстательной железы (Б). |
ЭФФЕКТИВНОСТЬ
Первое исследование по оценки эффективности HistoScanning включало 29 пациентов с подтвержденным РПЖ. HistoScanning выполняли до РПЭ, и его результаты сравнивали с послеоперационными гистологическими препаратами с шагом секции - 5 мм [2]. Исследование было проведено в два этапа. На первом этапе была сформирована группа из 15 пациентов для калибровки и уточнения трех упомянутых выше алгоритмов. На втором - осуществлены проверка алгоритмов и контроль разработанного метода на 14 пациентах. Проверка выполнялась слепым методом: данные HistoScanning анализировались до получения гистологического исследования. Впоследствии было проведено сопоставление и картирование зон, подозрительных в отношении РПЖ, по данным HistoScanning с зонами локализации опухоли в гистологическом материале. Таким образом определили диагностическую точность метода.
Можно утверждать, что описанной работе присуща некоторая предвзятость, так как было достоверно известно, что у всех включенных пациентов имелся РПЖ. Поскольку в исследованиях подобного типа предвзятость неизбежна, авторы также обращали внимание на такие ключевые параметры, как локализация опухоли, максимальный размер основного опухолевого поражения, мультифокальность, сторона поражения и экстрапростатическое распространение. Коэффициент корреляции между HistoScanning и гистологическими данными в определении максимального поперечного размера основной опухоли составил г = 0,95 (р < 0,001). Кроме того, исследователи заявили о 100% совпадении в отношении мультифокальности и стороны расположения опухоли.
При последующем анализе была оценена точность HistoScanning в прогнозировании суммарного объема всех опухолевых очагов в предстательной железе [3]. Авторы использовали пороговый объем > 0,5 см3, обычно применяемый для обозначения клинически-значимых очагов РПЖ [4]. И хотя вопрос о соответствии этого объема клинически значимому РПЖ все еще открыт, у этого параметра есть обоснование - такой объем соответствует опухоли с поперечным сечением 9-10 мм, если исходить из того, что она имеет сферическую форму. В 20-миллиметровом биопсийном столбике это будет составлять 50% его длины, что трактуется как клинически значимый рак [5].
Исходя из этого параметра, HistoScanning обнаружил все 12 фокусов РПЖ объемом более 0,5 см3. Кроме того, он также предсказал объем всех 28 поражений выше > 0,1 см3 в тесной корреляции с гистологической оценкой объема опухоли (коэффициент Пирсона г = 0,99, р < 0,0001). Это подтверждает хорошую корреляцию между HistoScanning и гистологическим исследованием в отношении суммарного объема опухолевого поражения (коэффициент Пирсона г = 0,97, р < 0,0001).
В другом исследовании Van Erps провел оценку эффективности системы HistoScanning на 68 пациентах, обследованных перед РПЭ. «Положительными» считались образования объемом более 0,2мл1. После операции у 27 (52%) пациентов стадия РПЖ была оценена, как pT2, а у 25 (48%) - pT3. HistoScanning показал 75% чувствительность в выявлении РПЖ и определении расположения опухолевых очагов. В 64% наблюдалась хорошая корреляция в отношении объема опухолевого поражения. Показатель чувствительности метода был существенно выше для стадии pT3 (92%), по сравнению с pT2 (59%). Эффективность HistoScanning зависела от степени дифференцировки опухоли: было обнаружено 50% опухолей дифференцировки в 6 баллов по Gleason, 74% - в 7 баллов и 100% > 8 баллов. При этом значение ПСА большой роли не играло. Аналогичная ситуация наблюдалась и в отношении размера опухолей. HistoScanning правильно определил наличие малых (< 1 мл) опухолей в 60%, а новообразований среднего (15мл) и большого (> 5мл) размера - в 87 и 82% соответственно. Совпадение локализации для маленьких (< 0,5 мл), средних (0,5-2мл) и больших (> 2мл) фокусов отмечено в 53%, 86% и 85% соответственно [6].
СОБСТВЕННЫЕ РЕЗУЛЬТАТЫ
В НИИ урологии проводится собственное исследование эффективности методики HistoScanning при РПЖ. Исследованы 52 пациента, разделенных на 2 группы. Средний возраст пациентов составил 64,4 ± 9,85 (44-81) лет, среднее значение ПСА - 7,3 ± 2,1 (3,8 - 11,8) нг/ мл. Средний объем предстательной железы составляет 55,8±22,43 (11,292,4) см3.
В первую группу включено 11 пациентов с гистологически верифицированным РПЖ. Этим пациентам выполнена РПЭ с предварительным исследованием HistoScanning и последующим сопоставлением результатов компьютер-ассистированного ультразвукового и патоморфологического исследований. В результате исследования гистологических препаратов после РПЭ в 7 случаях (63%) мы получили высокий уровень корреляции данных HistoScanning с патогистологическим исследованием в отношении объема и локализации опухолевого поражения для очагов 0,5 см3 и более. В 4 наблюдениях ультразвуковой метод показал больший объем поражения при хорошей корреляции локализации опухоли.
Во вторую группу вошел 41 пациент с показаниями к биопсии предтательной железы в связи с наличием одного или нескольких факторов риска: повышение ПСА более 4нг/ мл, подозрение на новообразование по результатам пальцевого исследования, ТРУЗИ, МРТ. У 21 мужчины (51%) в анамнезе уже была 1 или несколько отрицательный биопсий, а 15 длительно (более 3 месяцев) получали ингибиторы 5а-редуктазы.
Всем этим мужчинам после проведения исследования HistoScanning выполнили биопсию предстательной железы под ультразвуковым наведением, причем 24 из них - прецизионную трансперинеальную template-биопсию через брахитерапевтическую решетку с шагом 5мм, а 17 - трансректальную биопсию. Количество образцов ткани варьировалось в пределах 12-28 столбиков и зависело от объема предстательной железы.
Из 41 пациентов, которым выполнялась биопсия простаты, в результате исследования гистологических препаратов после template-биопсий: у 15 из 24 пациентов был обнаружен рак предстательной железы, еще у 9 - железистая гиперплазия с наличием ПИН высокой или низкой степени.
В результате исследования гистологических препаратов после трансректальных биопсий: у 11 из 17 пациентов был обнаружен рак предстательной железы, у 5 - железистая гиперплазия с наличием ПИН высокой или низкой степени, еще у 1 - железистая гиперплазия с очагами хронического воспаления.
ЗАКЛЮЧЕНИЕ
Очевидно, что первые клинические исследования HistoScanning в выявлении РПЖ обладают рядом методологических недостатков, а также основываются на небольшой выборке. Поэтому в первую очередь важно начать контролируемые многоцентровые исследования по единой и стандартизированной методике для получения высокой воспроизводимости теста. Результаты позволят более достоверно оценить чувствительность и специфичность этого относительно недорогого, неинвазивного теста, потенциально способного улучшить диагностику РПЖ и эффективность биопсий предстательной железы.
Хорошо известно, что частота ложноотрицательных результатов при стандартных ТРУЗИ биопсиях составляет 20-30% [7]. При их выполнении нередко пропускаются опухоли в передней части и апексе предстательной железы. Использование трехмерной модели органа позволяет спланировать выполнение биопсии из конкретных подозрительных участков по расширенной схеме, уменьшить ее инвазивность за счет оптимизации общего числа вколов, снизить число осложнений, повысить результативность гистологических исследований.
Еще одним потенциально-важным аспектом применения Histo- Scanning является планирование малоинвазивных органосохраняющих методик лечения РПЖ, таких как лучевая терапия, брахитерапия, высокоинтенсивный фокусированный ультразвук (HIFU), криоабляция, фотодинамическая терапия (PDT) или радиочастотная абляция (РЧА).
Новые возможности метода при его использовании для биопсии предстательной железы и малоинвазивных технологий лечения РПЖ, связаны с созданием системы Histo-scanning, работающей в режиме реального времени.
Ключевые слова: рак предстательной железы, диагноститка, ТРУЗИ, гистосканирование.
Keywords: prostate cancer, diagnosis, TRUS, HistoScanning.
Литература
- Wise A.M., Stamey T.A., McNeal J.E., Clayton J.L. Morphologic and clinical significance of multifocal prostate cancers in radical prostatectomy specimens // Urology 2002; 60: 264-9.
- Harnden P., Shelley M.D., Naylor B., Coles B., Mason M.D. Does the extent of carcinoma in prostatic biopsies predict prostate-specific antigen recurrence? A systematic review // Eur Urol 2008. Vol. 54, № 4. Р. 728-739.
- Van Erps T., Thйer D., Epplen R., Pfister D., Kn^hel-Clarke R., Heidenreich A. Detection of Prostate Cancer with HistoScanning™. Abstract at European Symposium on Urogenital Radiol-ogy (ESUR) Brugge (B) 2010.
- Presti Jr JC. Prostate biopsy: how many cores are enough? // Urol Oncol 2003. Vol. 21, № 2. Р 135140.
- Tissue characterization in prostate cancer using a novel ultrasound approach Senthil Kumar Govindaraju, Hashim Uddin Ahmed, Mahua Sahu, Mark Emberton // British Journal of Medical and Surgical Urology (2008) 1, 98-106
- Braeckman J., Autier P., Garbar C., Marichal M.P., Soviany C., Nir R. et al. Computer-aided ultrasonography HistoScanning): a novel technology for locating and characterizing prostate cancer. BJU Int 2008;101: 293-8.






