ВВЕДЕНИЕ
Встречаемость варикоцеле в общей мужской популяции составляет около 15% по данным Всемирной организации здравоохранения (ВОЗ) [1]. Варикоцеле является наиболее частой курабельной причиной мужского бесплодия: занимает второе место (15,6%) в структуре этиологии мужского бесплодия после идиопатического (31,1%) [2]. Существует множество вариантов оперативного лечения варикоцеле с различными уровнями доступа к гонадным сосудам: открытая варикоцелэктомия (операции Паломо, Иваниссевича, Бернарди), в том числе микрохирургическая (операции Мармара, Гольдштейна), лапароскопическая варикоцелэктомия, эндоваскулярная эмболизация или склеротерапия (ретроградная/антеградная) [3–10]. Каждый из этих методов применяется и по сей день и обладает своими плюсами и минусами. Золотым стандартом лечения варикоцеле можно считать микрохирургическую операцию подпаховым доступом – операцию Мармара, описанную еще в 1985 году и позволяющую достичь наилучших результатов в сочетании с минимальной частотой осложнений и рецидивов в сравнении с другими методиками [6, 11–13].
Цель исследования. Изучение эффективности микрохирургической подпаховой варикоцелэктомии при первичном лечении: оценка отдаленных результатов лечения, осложнений и частоты развития рецидива варикоцеле.
МАТЕРИАЛЫ И МЕТОДЫ
В университетской клинике урологии РНИМУ им. Н.И. Пирогова на базе урологического отделения ГКБ №1 им Н.И. Пирогова в период с 2019 по 2022 годы проведено обследование и оперативное лечение 325 пациентов с первичным варикоцеле. В исследование было включено 198 пациентов, причиной исключения 127 больных являлась невозможность связи с пациентом для контрольных обследований. В настоящей работе проведен ретроспективный анализ результатов лечения.
Предоперационное обследование включало сбор жалоб, анамнеза, стандартное обследование перед оперативным вмешательством, ультразвуковое исследование (УЗИ) органов мошонки и анализ параметров эякулята (спермограмма). УЗИ проводилось с использованием ультразвукового аппарата EPIQ 7 с линейным датчиком PureWave частотой 18 МГц от фирмы «Philips» (Япония). В процессе исследования оценивался диаметр вен мошонки в клинои ортостазе, скорость сброса в покое и при пробе Вальсальвы, объем яичка. В спермограмме оценивались: показатели концентрации, общее количество, доля прогрессивноподвижных и морфологически нормальных форм сперматозоидов в соответствии с пятой редакцией руководства ВОЗ по исследованию и обработке спермы (2010) [14].
Показанием к операции являлось наличие у пациента варикоцеле, подтвержденное данными УЗИ органов мошонки (расширенные вены гроздьевидного сплетения с изменением их диаметра в ортостазе и ретроградным кровотоком в покое и/или при пробе Вальсальвы) в сочетании со следующими проявлениями:
- болевой синдром в мошонке;
- бесплодный брак (отсутствие наступления беременности у женщины в сексуально активной паре, не использующей противозачаточные средства, в течение одного года);
- патоспермия (олигозооспермия/астенозооспермия/тератозооспермия или их сочетание);
- гипотрофия яичка (объем яичка <12 мл или разница в объеме с контралатеральным яичком >20%).
Лечение пациентов проходило в рамках стационара короткого пребывания: время госпитализации составило 1 койко-день. Всем пациентам проведена микрохирургическая подпаховая варикоцелэктомия (операция Мармара). Операции выполнялись по стандартной методике под спинальной анестезией с использованием микрохирургического инструментария и операционного микроскопа Moller Wedel (2,5-15.5x). Интраоперационно выполнялась перевязка и пересечение всех ветвей внутренней яичковой вены и кремастерных вен с сохранением всех артерий и лимфатических сосудов. Рутинная перевязка вен семявыносящего протока не выполнялась, за исключением единичных случаев выявления расширенных сосудов более 3 мм.
Всем пациентам проводилась стандартная периоперационная антибиотикопрофилактика, согласно локальному протоколу. Через 6-12 месяцев после лечения всем пациентам проведен сбор жалоб, повторное УЗИ органов мошонки и спермограмма. При выявлении УЗпризнаков рецидива варикоцеле (расширение вен гроздьевидного сплетения более 3 мм в ортостазе в сочетании с ретроградным кровотоком в покое или при пробе Вальсальвы) в случае наличия показаний к повторному оперативному вмешательству пациентам проводилась ретроградная флебография гонадной и подвздошных вен. Контрольными точками исследования являлась частота естественного зачатия, уменьшение болевого синдрома, изменение показателей спермограммы и результаты УЗИ органов мошонки.
Статистический анализ данных выполнен на персональном компьютере с помощью программ Microsoft Excel 2016 и IBM SPSS Statistics 26. Все полученные анамнестические, клинические, лабораторные и инструментальные данные вносили в базу данных Microsoft Excel, разработанную авторами, и обрабатывали методом описательной статистики. Для проверки нормальности распределения полученных непрерывных переменных применяли критерий Шапиро-Уилка. При нормальном распределении показателей данные представляли в виде среднего арифметического (M) и стандартного отклонения (s) в формате M±s, в остальных случаях – в виде медианы с указанием интерквартильного размаха (Мe [Q1; Q3]), для качественных данных – указаны частоты (%). Различия считали статистически значимыми при р<0,05 при использовании t-критерия Стьюдента или U-критерия Манна-Уитни соответственно.
РЕЗУЛЬТАТЫ
Средний возраст пациентов составил 28±1 лет (от 18 до 56 лет). В 167 случаях (84,3%) было выявлено левостороннее варикоцеле, у 31 пациентов (15,7%) – двустороннее. Не было ни одного случая обращения пациентов с изолированным правосторонним варикоцеле. Медиана периода наблюдения пациентов составила 22 [14; 41] месяца.
Распределение пациентов по степеням варикоцеле в соответствии с классификацией, одобренной ВОЗ представлено в таблице 1.
Таблица 1. Распределение пациентов по степени варикоцеле
Table 1. Patient distribution accordingly to the varicocele grade
| Степень Grade |
I степень I Grade |
II степень II Grade |
III степень III Grade |
|---|---|---|---|
| Количество пациентов, n (%) Number of patients n (%) |
18 (9%) | 105 (53%) | 75 (38%) |
Показания к оперативному лечению представлены в таблице 2. Изменения спермограммы отмечено у 74,2% больных, бесплодный брак – у 42,4%, болевой синдром в мошонке – у 60,6%. Структура изменений в спермограмме представлена в таблице 3. Наиболее часто (43,9%) отмечена тератозооспермия, у 19,4% больных имелась астенотератозооспермия.
Таблица 2. Показания к оперативному лечению
Table 2. Indications for surgery
| Жалобы Complains |
Количество пациентов, n (%) Number of patients, n (%) |
|---|---|
| Изменения спермограммы Pathospermia |
147 (74,2%) |
| Болевой синдром в мошонке Scrotal pain |
120 (60,6%) |
| Бесплодный брак Infertility |
84 (42,4%) |
| Гипотрофия яичка Testicular hypotrophy |
68 (34,3%) |
Медиана количества перевязанных вен слева составила 8 [5; 10], справа при двусторонних вмешательствах – 8 [6; 10] (p>0,01). Среднее время операции составило 1 час 25 минут при одностороннем вмешательстве (от 35 минут до 2 часов 30 минут), 2 часа 25 минут – при двустороннем (от 1 часа 20 минут до 3 часов 40 минут).p>
Среди пациентов, предъявлявших жалобы на болевой синдром в мошонке (n=120), отмечено купирование болей у 108 пациентов (90%), однако у 12 (10%) сохранялись жалобы на тянущие боли в мошонке. При контрольном УЗИ органов мошонки только у одного из этих пациентов определялись расширенные вены гроздьевидного сплетения в ортостазе до 3,3 мм с постоянным ретроградным кровотоком в покое со скоростью 17 см/сек. В дальнейшем этому пациенту была выполнена эндоваскулярная эмболизация гонадной вены с положительным клиническим эффектом в виде купирования болевого синдрома.
Среди пациентов, оперированных по поводу бесплодного брака (n=84), в течение 6-36 месяцев после операции у 25 человек (29,8%) произошло естественное зачатие. Среди пациентов с патоспермией (n=147) улучшения параметров спермограммы удалось достичь у 104 пациентов (70,8%).
Таблица 3. Показания к оперативному лечению
Table 3. Indications for surgery
|
Характер изменений Type of changes |
Доля от общего числа пациентов с патоспермией, n (%) Proportion of the total number of patients with pathospermia, n (%) |
|---|---|
| Олигозооспермия Oligozoospermia |
3 (2,2%) |
| Астенозооспермия Asthenozoospermia |
14 (10,1%) |
| Тератозооспермия Teratozoospermia |
61 (43,9%) |
| Гипотрофия яичка Testicular hypotrophy |
4 (2,9%) |
| Олигоастенозооспермия Oligoasthenozoospermia |
16 (11,5%) |
| Олиготератозооспермия Oligoteratozoospermia |
27 (19,4%) |
| Олигоастенотератозооспермия Oligoasthenoteratozoospermia |
14 (10,1%) |
Результаты представлены в таблице 4.
При ультразвуковом исследовании органов мошонки до лечения средний диаметр вен в клиностазе составил 3,1±0,1 мм, в ортостазе – 4,0±0,1 мм, у всех пациентов выявлялась положительная проба Вальсальвы с наличием ретроградного кровотока длительностью более 2 секунд. Скорость сброса в покое составила 17,1±1,3 см/сек, на высоте пробы Вальсальвы – 29,7±1,9 см/сек. Объем яичка до операции составил 14,0±0,5 мл. В результате лечения, по данным контрольного УЗИ органов мошонки, через 6-12 месяцев отмечено уменьшение диаметра вен гроздьевидного сплетения в клиностазе до 2,2±0,1 (p=0,01) мм, в ортостазе – до 2,6±0,1 мм (p=0,001). Кроме того, отмечено увеличение объема ипсилатерального яичка с 14,0±0,5 мл до 16,2±0,5 мл (p=0,01).
У 8 пациентов (4%) при контрольном УЗИ органов мошонки были выявлены признаки рецидива. В 3 случаях показаний к повторному оперативному вмешательству не было выявлено, принято решение о динамическом наблюдении. Остальным 5 пациентам была выполнена ретроградная флебография яичковой и подвздошных вен. У одного пациента не было получено флебографических данных за рецидив варикоцеле. В 4 случаях был выявлен рецидив в системе внутренней яичковой вены с реносперматическим рефлюксом. Необходимо отметить, что не было зарегистрировано случаев илеосперматического рефлюкса, а также синдрома Мэя-Тернера. Троим пациентам интраоперационно выполнена эмболизация гонадной вены. У одного пациента ввиду анатомических особенностей не было технической возможности эмболизации, поэтому ему было проведено повторное микро-хирургическое вмешательство, во время которого определялись резидуальные ветви гроздьевидного сплетения. Таким образом, частота рецидива составила 3,5% (n=7).
Таблица 4. Сравнение параметров эякулята до и после операции
Table 4. Comparison of sperm parameters before and after surgery
| Показатель спермограммы Sperm parameter |
До операции Before surgery | После операции After surgery |
p |
|---|---|---|---|
| Концентрация сперматозоидов, млн/мл* Sperm concentration, 106/ml |
5,5 [3,6; 10,0] | 11,5 [7,0; 22,0] | 0,01 |
| Общее количество сперматозоидов, млн* Total sperm number, 106 |
22,5 [10,0; 31,5] | 38,1 [18,9; 77,0] | 0,02 |
| Прогрессивно-подвижные формы, %** Progressive motility, % |
15 [6; 23] | 33 [21; 47] | 0,01 |
| Морфологически нормальные формы, %*** Normal forms, % |
2 [1; 3] | 4 [2; 5] | 0,04 |
Примечание: * учитывались пациенты с исходной олигозооспермией
** учитывались пациенты с исходной астенозооспермией
*** учитывались пациенты с исходной тератозооспермией
Note: * included patients with initial low sperm count
** included patients with initial low sperm motility
*** included patients with initial abnormal sperm morphology
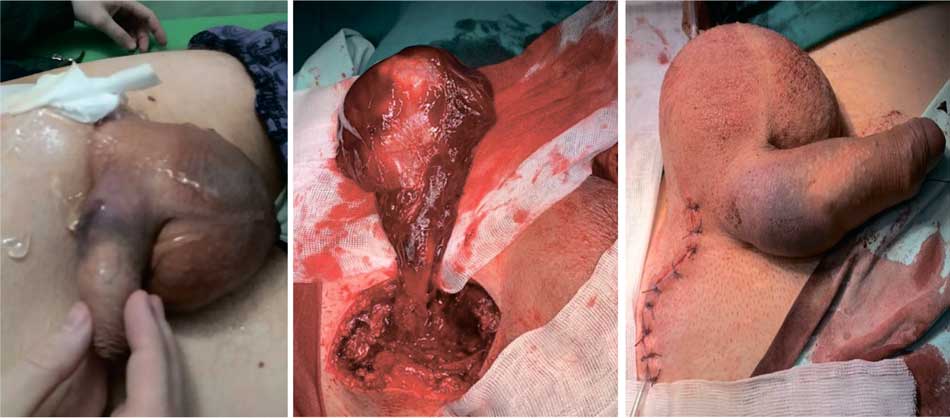
Рис. 1. Ревизия левого яичка после состоявшегося кровотечения спустя сутки после операции.
Fig. 1. Left testicle revision after the bleeding that took place in 24-hours after surgery
Ни одного случая послеоперационной атрофии яичка выявлено не было. У 5 пациентов впоследствии развилось гидроцеле (2,5%), разрешившееся самостоятельно путем ношения суспензория в течение месяца, оперативного вмешательства не потребовалось ни в одном из случаев. У одного пациента (0,5%) через несколько дней после операции произошло нагноение послеоперационной раны, потребовавшее длительного консервативного лечения, заживление происходило вторичным натяжением.
Также у одного из пациентов (0,5%) через сутки после операции развилось кровотечение, потребовавшее хирургического вмешательства. При ревизии раны была опорожнена гематома семенного канатика объемом до 150 мл без признаков продолжающегося кровотечения из структур канатика – источник кровотечения не был идентифицирован (рис. 1). Учитывая УЗ-данные за отсутствие кровотока в яичке, выполнена ревизия левого яичка – кровоток не нарушен. При контрольном УЗИ органов мошонки через 3 месяца после операции патологии не было выявлено, в спермограмме – нормозооспермия.
ОБСУЖДЕНИЕ
История вопроса
Эволюция варикоцелэктомии забрюшинным и паховым доступами привела к разработке Joel L. Marmar микрохирургического подпахового вмешательства [6]. В статье 1985 года он акцентирует внимание на снижении частоты рецидива варикоцеле до 5,4%, объясняя этот факт возможностью ревизии, перевязки и склерозирования всех потенциально расширенных вен, идущих к яичку: как основного венозного коллектора – внутренней яичковой вены (int. testicular vein), так и коллатеральных сосудов из системы подвздошной вены – кремастерных вен (cremasteric vein) и вен семявыносящего протока (vasal/deferential veins). В более поздних работах он описывает частоту рецидива 2,1% [15]. Кроме того, внимание уделяется вопросам предупреждения травмы яичковой артерии и лимфатических сосудов, что позволяет снизить частоту атрофии яичка и развития гидроцеле в послеоперационном периоде. Впоследствии этот вариант хирургического лечения модифицировал M. Goldstein, добавив этап выведения яичка в рану с целью перевязки наружных яичковых вен (ext. spermatic veins), а также вен направляющей связки яичка (gubernacular veins), аргументируя целесообразность этих манипуляций еще более выраженным снижением частоты рецидива до 0,6% [16]. Вопрос рутинного выведения яичка в рану для перевязки этих вен вызывает споры: по мнению одних исследователей, это необходимая и безопасная манипуляция, позволяющая снизить частоту рецидива [16-19]. По мнению других исследователей, различия в результатах и частоте рецидива отсутствуют, а перевязка губернакулярных вен увеличивает время операции и может приводить к отеку мошонки и яичка [20, 21]. Поскольку польза от выведения яичка в рану и перевязки вен gubernaculum является спорной, этот этап необязателен, и его можно полностью исключить или ограничить отдельными случаями варикоцеле III степени или рецидивирующим варикоцеле [22].
Таким образом, с конца XX века микрохирургическая варикоцелэктомия начала повсеместно использоваться урологами, сочетая хороший клинический эффект с минимальной частотой осложнений. Такие варианты хирургического пособия, как операции Иваниссевича, Паломо или лапароскопическая варикоцелэктомия также продолжают широко применяться, хотя и демонстрируют более высокий процент рецидивов. Согласно результатам ретроспективного исследования 19800 пациентов, оперированных по поводу варикоцеле в США в период с 2007 по 2014 годы, на долю микрохирургических вмешательств пришлось всего 3%, в то время как чаще применялись паховые (66%), ретроперитонеальные (19%) и лапароскопические (10%) вмешательства [23].
Техника операции
После пальпации наружного пахового кольца и семенного канатика, отступив 1 см от основания полового члена, выполняется поперечный разрез кожи размером до 2-2,5 см. Рассекается подкожная жировая клетчатка до фасций Кэмпера и Скарпа. Нередко на этом этапе операции визуализируются и отводятся в сторону сосуды, лежащие перпендикулярно ходу семенного канатика – поверхностные наружные половые артерия и вена. Фасция Скарпа вскрывается тупо, семенной канатик выделяется тупфером из окружающих тканей и выводится в операционную рану с помощью дренажа Пенроуза или крючка Фарабефа. Выполняется перевязка расширенных кремастерных вен при их наличии, что позволяет предотвратить возможный илеосперматический рефлюкс. После рассечения наружной и внутренней семенных фасций открывается доступ к гроздьевидному сплетению. Вены выделяются и перевязываются с использованием шовного материала Викрил 4-0, после чего пересекаются. При наличии мелких (менее 1 мм) анастомозирующих между собой коллатералей возможно применение биполярной электрокоагуляции этих сосудов. Кроме того, Мармаром было предложено дополнительное введение склерозанта в подобную сеть мелких коллатералей. Ветви яичковой артерии выделяются, при необходимости берутся на держалки. С целью улучшения идентификации артерий возможно использование микродоплеровского датчика или орошение 2-3 мл папаверина гидрохлорида. При выявлении расширенных более 2 мм вен семявыносящего протока последние также перевязываются и пересекаются.
Контроль гемостаза. Оболочки семенного канатика ушиваются непрерывным швом Викрил 4-0, канатик погружается в рану. Восстанавливается фасция Скарпа, ушивается подкожная жировая клетчатка и кожа.
Клиническая эффективность
Имеются обширные данные по клиническим результатам микрохирургической варикоцелэктомии.
Частота купирования болевого синдрома составила 90%, что сопоставимо с данными литературы (88%) [24, 25]. В метаанализе 2011 года продемонстрировано увеличение концентрации сперматозоидов на 12,3 млн/мл, процента прогрессивно-подвижных форм на 9,7%, что сопоставимо с полученными нами результатами [26]. В нашем исследовании были достигнуты статистически значимые улучшения параметров спермограммы у 70,8% пациентов с исходной патоспермией.
В сравнении с другими методами, микрохирургическая варикоцелэктомия демонстрирует наиболее высокую частоту наступления беременности – 41,9% [12]. По данным другого мета-анализа, также была выявлена более высокая частота естественной беременности после микрохирургической варикоцелэктомии, однако эти изменения не были статистически значимыми [11]. В мета-анализе, выполненном J. Marmar с соавт., наступление беременности отмечалось в 33% случаев после оперативного лечения [27]. В нашем исследовании частота наступления естественной беременности среди пациентов с бесплодным браком оказалась несколько ниже – 29,8%.
Микрохирургическая варикоцелэктомия демонстрирует наименьшее количество осложнений и рецидивов. Использование микрохирургической техники позволяет выполнить операцию максимально качественно и свести к минимуму травму артерии и лимфатических сосудов, а также сохранить ветви гроздьевидного сплетения интактными, что устраняет причины рецидива варикоцеле в большинстве случаев [28]. По данным систематического обзора 2017 года, средний процент рецидива после микрохирургических вмешательств паховым и подпаховым доступом составил около 1% (0-3,6%), при операциях забрюшинным доступом – 15% (7-35%), при лапароскопических операциях – 4,3% (2,2-7,1%) [13]. Эндоваскулярные операции также не могут считаться эталоном ввиду высокой частоты рецидива (12%), стоимости и технической сложности метода, однако могут стать хорошим подспорьем в рамках диагностики и лечения рецидивов. В свою очередь, в нашем исследовании частота рецидива составила 3,5% (n=7), причем почти в половине случаев речь идет о субклиническом рецидиве, не требующим повторного вмешательства. Важным аспектом является корректное выполнение УЗИ органов мошонки, что позволяет избежать гипердиагностики как первичного варикоцеле, так и рецидива после оперативного лечения [29].
ЗАКЛЮЧЕНИЕ
Учитывая анатомические особенности венозного оттока от яичка, микрохирургическая подпаховая варикоцелэктомия является наиболее обоснованным методом лечения варикоцеле, поскольку позволяет выполнять манипуляции со всеми венозными коллекторами, минимизируя тем самым вероятность рецидива и повышая эффективность операции. Имея сравнимые с другими вариантами варикоцелэктомии клинические результаты, операция Мармара сочетает их с наименьшей частотой рецидивов и осложнений, подтвержденной данными мета-анализов. Несомненным плюсом является возможность выполнения операции под местной анестезией. Кроме того, лечение пациентов в рамках хирургии одного дня позволяет снизить сроки госпитализации и реабилитации, что, в свою очередь, уменьшает нагрузку на систему здравоохранения в целом и является экономически целесообразным.
ЛИТЕРАТУРА
- Rowe, Patrick J, Comhaire, Frank H, Hargreave, Timothy B, Mahmoud, Ahmed MA. WHO manual for the standardized investigation, diagnosis and management of the infertile male. World Health Organization 2000. 91 p. URL: https://www.who.int/publications/i/item/9780521774741
- Nieschlag E, Behre HM, Kliesch S., Nieschlag S. Andrology: Male reproductive health and dysfunction, in Male reproductive health and dysfunction. Springer Verlag: Berlin 2010.454 p.
- Palimo A. Radical cure of varicocele by a new technique; preliminary report. J Urol 1949;61(3):604-7. https://doi.org/10.1016/S0022-5347(17)69113-4.
- Ivanissevich O. Left varicocele due to reflux; experience with 4,470 operative cases in forty-two years. J Int Coll Surg 1960;34:742-55.
- Bernardi R. Ivanissevich's anatomical concept of the cure of varicocele: some modifications in its technique. BolInst Clin Quir 1941;13:521.
- Marmar JL, DeBenedictis TJ, Praiss D. The management of varicoceles by microdissection of the spermatic cord at the external inguinal ring. Fertil Steril 1985;43(4):583-8. https://doi.org/10.1016/s0015-0282(16)48501-8.
- Goldstein M, Gilbert BR, Dicker AP, Dwosh J, Gnecco C. Microsurgical inguinal varicocelectomy with delivery of the testis: an artery and lymphatic sparing technique. J Urol 1992;148(6):1808-11. https://doi.org/10.1016/s0022-5347(17)37035-0.
- Aaberg RA, Vancaillie TG, Schuessler WW. Laparoscopic varicocele ligation: a new technique. Fertil Steril 1991;56(4):776-7. https://doi.org/10.1016/s0015-0282(16)54615-9.
- Lima SS, Castro MP, Costa OF. A new method for the treatment of varicocele. Andrologia 1978;10(2):103-6. https://doi.org/10.1111/j.1439-0272.1978.tb01324.x.
- Tauber R, Johnsen N. Antegrade scrotal sclerotherapy for the treatment of varicocele: technique and late results. J Urol 1994;151(2):386-90. https://doi.org/10.1016/s0022-5347(17)34956-x.
- Ding H, Tian J, Du W, Zhang L, Wang H, Wang Z. Open non-microsurgical, laparoscopic or open microsurgical varicocelectomy for male infertility: a meta-analysis of randomized controlled trials. BJU Int 2012;110(10):1536-42. https://doi.org/10.1111/j.1464-410X.2012.11093.x.
- Cayan S, Shavakhabov S, Kadioğlu A. Treatment of palpable varicocele in infertile men: a meta-analysis to define the best technique. J Androl 2009;30(1):33-40. https://doi.org/10.2164/jandrol.108.005967.
- Rotker K, Sigman M. Recurrent varicocele. Asian J Androl 2016;18(2):229-33. https://doi.org/10.4103/1008-682X.171578.
- World Health Organization (WHO). WHO laboratory manual for the examination and processing of human semen. 5th ed. Geneva: WHO 2010.
- Marmar JL, Kim Y. Subinguinal microsurgical varicocelectomy: a technical critique and statistical analysis of semen and pregnancy data. J Urol 1994;152(4):1127-32. https://doi.org/10.1016/s0022-5347(17)32521-1.
- Goldstein M, Gilbert BR, Dicker AP, Dwosh J, Gnecco C. Microsurgicalinguinal varicocelectomy with delivery of the testis: an artery and lymphatic sparing technique. J Urol 1992;148(6):1808-11. https://doi.org/10.1016/0022-5347(17)37035-0.
- Albayrak S, Can C, Sarica K. Extended vein ligation: a new aspect of the surgical treatment of varicocele. Urol Int 1993;51(4):220-4. https://doi.org/10.1159/000282548.
- Cho SJ, Kim SC, Kim KS, Park S. Magnification-assisted subinguinal varicocelectomy with testicular delivery in children: a preliminary report. World J Mens Health 2014;32(2):93-8. https://doi.org/10.5534/wjmh.2014.32.2.93.
- Allameh F, Hasanzadeh Haddad A, Abedi A, Ranjbar A, Qashqai H, Fadavi B, Yousefi M. Varicocelectomy with primary gubernaculum veins closure: A randomised clinical trial. Andrologia 2018. https://doi.org/10.1111/and.12991.
- Ramasamy R, Schlegel P.N. Microsurgical inguinal varicocelectomy with and without testicular delivery. Urology 2006;68:1323-6. https://doi.org/10.1016/j.urology.2006.08.1113.
- Hou Y, Zhang Y, Zhang Y, Huo W, Li H. Comparison between Microsurgical Subinguinal Varicocelectomy with and without Testicular Delivery for Infertile Men: Is Testicular Delivery an Unnecessary Procedure. Urol J 2015;12(4):2261-6.
- Global Andrology Forum. Consensus and Diversity in the Management of Varicocele for Male Infertility: Results of a Global Practice Survey and Comparison with Guidelines and Recommendations. World J Mens Health 2023;41(1):164-97. https://doi.org/10.5534/wjmh.220048.
- Park HK, Min GE, Chung KJ, Li S, Choi WS, Chung BI. Practice Pattern of Redo Varicocelectomy for Recurrent Varicocele according to Type of Initial Treatment: Retrospective Analysis of a United States-Based Insurance Claims Database. World J Mens Health 2021;39(3):559-65. https://doi.org/10.5534/wjmh.190170.
- Elzanaty S, Johansen CE. Microsurgical Varicocele Repair on Men with Grade III Lesions and Chronic Dull Scrotal Pain: A Pilot Study. Curr Urol 2015;8(1):29-31. https://doi.org/10.1159/000365685.
- Yaman O, Ozdiler E, Anafarta K, Göğüş O. Effect of microsurgical subinguinal varicocele ligation to treat pain. Urology 2000;55(1):107-8. https://doi.org/10.1016/s0090-4295(99)00374-x.
- Baazeem A, Belzile E, Ciampi A, Dohle G, Jarvi K, Salonia A, et al. Varicocele and male factor infertility treatment: a new meta-analysis and review of the role of varicocele repair. Eur Urol 2011;60(4):796-808. https://doi.org/10.1016/j.eururo.2011.06.018.
- Marmar JL, Agarwal A, Prabakaran S, Agarwal R, Short RA, Benoff S, Thomas AJ Jr. Reassessing the value of varicocelectomy as a treatment for male subfertility with a new meta-analysis. Fertil Steril 2007;88(3):639-48. https://doi.org/10.1016/j.fertnstert.2006.12.008.
- Котов С.В., Корочкин Н.Д., Клименко А.А. Рецидивное варикоцеле. Вестник урологии 2021;9(2):132-41. [Kotov S.V., Korochkin N.D., Klimenko A.A. Recurrent varicocele. Vestnik urologii = Urology Herald 2021;9(2):132-41. (In Russian)]. https://doi.org/10.21886/2308-6424-2021-9-2-132-141.
- Гамидов С.И., Дружинина Н.К., Шатылко Т.В., Попова А.Ю., Сафиуллин Р.И. Технические аспекты ультразвуковой диагностики варикоцеле и анализ европейских клинических рекомендаций. Экспериментальная и клиническая урология 2022;15(3)102-8. [Gamidov S.I., Druzhinina N.K., Shatylko T.V., Popova A.Yu., Safiullin R.I. Technical aspects of ultrasound diagnostics of varicocele and analysis of European clinical guidelines. Eksperimentalnaya i klinicheskaya urologiya = Experimental and Clinical Urology 2022;15(3)102-8. (In Russian)]. https://doi.org/10.29188/2222-8543-2022-15-3-102-108.







