Хронический простатит (ХП) по данным международной статистики является одним из наиболее распространенных заболеваний мужчин моложе 50 лет [1]. Частота клинических проявлений ХП у мужчин увеличивается с возрастом, составляя 6,3% в 30-летнем возрасте и 12,6% – в 50-летнем [2, 3].
Согласно современной классификации выделяют ХП бактериального (категория II) и небактериального генеза (категория III). ХП категории II сопровождается признаками инфекции, повышением количества лейкоцитов и бактерий в секрете предстательной железы (ПЖ) и моче [4]. ХП категории III – хронический небактериальный простатит или синдром хронической тазовой боли – характеризуется болями в урогенитальной области и учащенным и болезненным мочеиспусканием при отсутствии бактериальной инфекции и в свою очередь подразделяется на воспалительный (категория IIIА) и невоспалительный синдром хронической тазовой боли (категория IIIВ). Для ХП категории IIIA характерны воспалительные процессы, приводящие к нарушению морфологии и нормального функционирования ПЖ, при этом в секрете ПЖ присутствуют лейкоциты. Воспалительный ХП категории IIIВ клинически проявляется отсутствием урогенитального воспаления.
Этиология и патогенез ХП категории II обусловлены грамм-положительными микроорганизмами: E.coli, Klebsiella spp., Proteus spp., En-terobacter spp., и, в меньшей степени, граммотрицательными Staphylococcus spp., Streptococcus spp. [5]. В последние годы большую роль в развитии бактериального ХП отводят хламидийной инфекции [6]. В тоже время, роль микоплазм, уреаплазм, вирусов в этиологии ХП остается до конца не изученной [7, 8].
При доказанности бактериальной природы заболевания (ХП категории II) применяется традиционная антибиотикотерапия. Широко используется антибактериальный препарат левофлоксацин из группы трифторхинолонов, обладающий малой токсичностью. Левофлоксацин влияет на граммположительную и граммотрицательную флору, воздействуя на микрооорганизмы в любой стадии – на растущие, покоящиеся и делящиеся клетки. Эффективность левофлоксацина продемонстрирована в мультицентровом рандомизированном двойном слепом исследовании при лечении бактериального ХП [9].
Альтернативной группой препаратов являются α-адреноблокаторы, ярким представителем которых является один из наиболее селективных препаратов – тамсулозин, который обеспечивает восстановление дисфункционального мочеиспускания. Использование тамсулозина при ХП продемонстрировало положительный клинический эффект как в отечественных, так и зарубежных исследованиях. В ряде работ было зарегистрировано как краткосрочное, так и долгосрочное снижение симптомов по шкалам качества жизни и улучшение показателей уродинамики [10-13].
В настоящее время признано, что терапия больных ХП должна быть комплексной, направленной на все вероятные этиологические и патогенетические факторы заболевания, поэтому поиск новых терапевтических возможностей и подходов весьма актуален.
В состав препарата ИндигалПлюс (ЗАО «МираксБиоФарма») входят три действующих компонента: индол-3-карбинол (I3C), эпигаллокатехин-3-галлат (EGCG) и экстракт плодов пальмы Serenoa repens, которые позволяют влиять на различные звенья патогенеза ХП.
Доказано, что развитие провоспалительной реакции обусловлено в основном рецептор-опосредованной стимуляцией факторов роста [14]. Фактор некроза опухоли TNF-α является основным эффекторным цитокином, секретируемым многими клетками (макрофагами, моноцитами, нейтрофилами и т.д.) в ответ на бактериальные инфекции [15]. TNF-α активирует каскад цитоплазматических и рецепторных тирозин-киназ и, как результат, активирует транскрипционные факторы. В результате активации подобных каскадов, в частности, повышается экспрессия гена, кодирующего циклооксигеназу-2 (COX-2) – фермента, участвующего в биосинтезе простагландинов (PG) PGE2 и PGF2α – основных медиаторов воспаления [16].
Противовоспалительная активность является одним из основных механизмов действия препарата ИндигалПлюс. В основе действия ЕGCG лежит способность блокировать цитокин-зависимые пути стимуляции воспалительного процесса [17]. EGCG напрямую ингибирует TNF-αиндуцируемую активацию ядерного фактора транскрипции NF-kB, активирующего транскрипцию множества генов, ответственных за клеточную выживаемость и воспалительные функции [18]. EGCG также обладает мощным антипролиферативным свойством и оказывает влияние на ряд других молекулярных процессов, а именно, вызывает избирательный апоптоз трансформированных клеток посредством усиления прооксидантной активности, блокирует неоангиогенез, ингибирует инвазивные процессы [19].
I3C также обладает комплексным воздействием на сигнальные воспалительные пути, благодаря блокировке фермента COX-2, участвующего в биосинтезе простагландинов (PGE2) [20]. Более того, I3C, как и EGCG, мешает передаче пролиферативных сигналов в результате ингибирования фактора транскрипции NF-kB, который является основным активатором большого числа генов, вовлеченных в пролиферацию и воспаление [21, 22].
Экстракт плодов пальмы Serenoa repens оказывает противовоспалительное и противоотечное действие, ингибирует синтез простагландинов, снижает проницаемость сосудов предстательной железы [23].
Стоит отдельно отметить, что I3C и EGCG обладают самостоятельной антибактериальной активностью в отношении патогенных для человека антибиотико-резистентных микроорганизмов [24, 25]. Кроме того, I3C и EGCG усиливают действие антибиотиков и повышают чувствительность резистентных микроорганизмов к действию антибактериальных агентов [26, 27].
Цель настоящего исследования – сравнительная оценка эффективности и безопасности комбинации левофлоксацина и тамсулозина с препаратом ИндигалПлюс в терапии хронического простатита.
МАТЕРИАЛЫ И МЕТОДЫ
В открытом рандомизированном сравнительном исследовании принял участие 121 пациент в возрасте 18-60 лет с диагнозом хронический простатит (ХП) категории II или IIIA, верифицированным 4-хстаканной пробой. Исходно пациенты имели объем остаточной мочи ≤ 150 мл и максимальную объемную скорость потока мочи ≥ 5 мл/с.
В исследование не включались пациенты с установленным диагнозом рак ПЖ и другими злокачественными новообразованиями, острой задержкой мочеиспускания, наличием конкрементов в мочевом пузыре, стриктурой уретры, склерозом шейки мочевого пузыря, инфекциями мочеполовой системы в фазе активного воспаления. Критериями невключения в исследование также были: оперативные вмешательства на органах малого таза в анамнезе, терапия гиперплазии ПЖ или ХП в последние 2 недели перед исследованием, тяжелые сопутствующие заболевания сердечно-сосудистой и нервной систем, наличие психиатрического заболевания, клинически значимая почечная и печеночная недостаточность (увеличение показателей в два и более раз), либо иные тяжелые заболевания, которые, которые по мнению исследователя, делают невозможным участие пациента в исследовании. Не допускалось использование других экспериментальных лекарственных препаратов за 3 месяца до начала исследования.
Скрининг проводили за 21 день до начала приема препарата. Обследование проходило с применением клинических, инструментальных и лабораторных методов. В ходе скрининга осуществляли сбор медицинского анамнеза, физикальное обследование, определение основных жизненно важных функций организма (температуры тела, измерение артериального давления, частоты сердечных сокращений, частоты дыхания). В ходе скрининга также проведены: 4-хстаканная проба, урологический осмотр с пальцевым ректальным исследованием и микроскопическим анализом секрета ПЖ, урофлоуметрия (определение максимальной скорости мочеиспускания – Qmax, средней скорости потока мочи (Qave)), трансректальное ультразвуковое исследование (ТРУЗИ) ПЖ с определением объема остаточной мочи (Vres). Лабораторные исследования включали общие анализы крови и мочи, а также биохимический анализ крови (определение уровня общего белка, глюкозы, креатинина, общего билирубина, активности аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ)). Также проводилась диагностика гепатитов В и С, ВИЧ-инфекции, анализ крови на RW.
По окончании скрининга произведена стратификация пациентов по типу ХП и рандомизация в 4 параллельные лечебные группы с равным количеством пациентов. Пациенты рандомизированы в следующие группы наблюдения:
I группа – хронический простатит категории II – прием левофлоксацина по 500 мг 1 раз в сутки перорально 1 месяц и прием ИндигалПлюс по 2 капсулы 2 раза в сутки перорально 3 месяца;
I группа – хронический простатит категории II – прием левофлоксацина по 500 мг 1 раз в сутки перорально 1 месяц и прием ИндигалПлюс по 2 капсулы 2 раза в сутки перорально 3 месяца;
III группа – хронический простатит категории IIIA – прием тамсулозина по 400 мг 1 раз в сутки перорально и прием ИндигалПлюс по 2 капсулы 2 раза в сутки перорально 3 месяца;
IV группа 4 – хронический простатит категории IIIA – прием тамсулозина по 400 мг 1 раз в сутки перорально 3 месяца.
Период лечения пациентов составил 3 месяца. Период отдаленного наблюдения (follow-up) продолжался 3 месяца после окончания лечения. Контрольные визиты, осуществлялись в начале исследования (Визит 1) и через 30 (Визит 2), 90 (Визит 3) и 180 (Визит 4) дней после первого приема препарата.
На контрольных визитах исследователи повторно проводили физикальное обследование и определяли основные жизненно важные функции организма. На всех контрольных визитах пациенты также заполняли опросники для оценки простатических симптомов: IPSS+QoL (междунароная система суммарной оценки симптомов при заболеваниях ПЖ, индекс качества жизни), NIH-CPSI (бальная шкала оценки симптомов хронического простатита) и IIEF (международный индекс эректильной функции). Урологический осмотр с пальцевым ректальным исследованием и микроскопия секрета ПЖ проводились на Визитах 2, 3 и 4. Показатели уродинамики исследователи определяли на Визитах 3 и 4. Для страты с ХП категории II на Визитах 2 и 3 дополнительно проводилась 4-хстаканная проба с количественным микробиологическим исследованием.
Главный критерий эффективности (положительный ответ на лечение) – доля пациентов с увеличением Qmax или Qave не менее чем на 20% к 3 месяцу лечения. Оценка эффективности терапии проводилась также на основании сравнения показателей уродинамики (Qmax, Qave, Vres), изменения объема ПЖ, качества жизни, интенсивности обструктивной и ирритативной симптоматики и состояния сексуальной функции (по данным опросников IPSS, NIH-CPSI и IIEF) у пациентов с ХП категорий II и IIIA, получающих тамсулозин и левофлоксацин в комбинации с ИндигалПлюс в сравнении с применением тамсулозина и левофлоксацина. Кроме того, у пациентов с ХП категории II в группах, получающих левофлоксацин в комбинации с ИндигалПлюс и только левофлоксацин, проводилось сравнение сроков наступления и полноты бактериологической санации секрета ПЖ.
Безопасность и переносимость терапии оценивалась на основании субъективных симптомов и ощущений, сообщаемых пациентом, и объективных данных, полученных в процессе лечения. Учитывалась динамика лабораторных показателей, а также частота возникновения и характер нежелательных явлений.
РЕЗУЛЬТАТЫ
В исследование эффективности и безопасности комбинации левофлоксацина и тамсулозина с препаратом ИндигалПлюс в терапии ХП II и IIIA категории включен 121 пациент (средний возраст 38,2±9, 9 лет).
Пациенты были разделены на 2 страты по 2 группы в каждой: I группа представлена пациентами с ХП категории II, которые в качестве лечения получали левофлоксацин в дозе 500 мг/сутки на протяжении одного месяца и ИндигалПлюс по 2 капсулы 2 раза в сутки три месяца, во II группу вошли пациенты с диагнозом ХП категории II с последующим назначением левофлоксацина в дозе 500 мг/сутки в течение одного месяца, группа III с диагнозом ХП категории IIIA представлена пациентами с ХП категории II, которые в качестве лечения получали тамсулозин в дозе 400 мг/сутки на протяжении одного месяца и ИндигалПлюс по 2 капсулы 2 раза в сутки три месяца, пациенты IV группы с диагнозом ХП категории IIIA получали тамсулозин по 400 мг/сутки в течение трех месяцев. Рандомизацию можно признать проведенной адекватной, так как статистически значимых отличий в исходных данных пациентов обнаружено не было, за исключением объема ПЖ, который был несколько больше в группе I. В исследовании к моменту окончания осталось 115 пациентов (6 выбыло).
По окончании исследования проводилась оценка главного критерия эффективности – доля пациентов с ростом Qmax или Qave не менее чем на 20% к 3-ему месяцу лечения. Для этого проводилось сравнение показателей уродинамики (Qmax, Qave, Vres) у пациентов с хроническим простатитом категорий II и IIIA, получающих тамсулозин и левофлоксацин в комбинации с ИндигалПлюс (группы I и III), в сравнении с применением тамсулозина и левофлоксацина (группы II и IV).
Данные о результатах лечения (прирост Q max или Qave более чем на 20%) представлены в таблице 1.
Таблица 1. Количество больных с изменением результатов урофлоуметрии на визите 4
| Группа | Число пациентов с положительным уродинамическим ответом на лечение | Число пациентов с отрицательным уродинамическим ответом на лечение | Значимость отличий р (по критерию χ2 ) |
|---|---|---|---|
| Группы I, III («ИндигалПлюс и левофлоксацин/тамсулозин») |
33 | 25 | 0,009 |
| Группы II, IV («левофлоксацин /тамсулозин») |
19 | 39 | |
| Группа I («ИндигалПлюс и левофлоксацин») |
20 | 9 | 0,003 |
| Группа II («левофлоксацин») | 9 | 21 | |
| Группа III («ИндигалПлюс и тамсулозин») |
13 | 16 | 0,483 |
| Группа IV («тамсулозин») | 10 | 18 |
Рис. 1. Динамика уродинамических показателей Qmax и Qave (мл/с) и объема остаточной мочи Vres (мл)
у пациентов I группы («ИндигалПлюс и левофлоксацин») в страте ХП категории II (показаны значимые отличия от значений на скрининге)
Таким образом, статистически значимый эффект клинически значимого улучшения уродинамических показателей присутствует в группах I и III – у пациентов с ХП категории II, принимавших ИндигалПлюс в дополнение к антибиотикотерапии.
Дополнительно были проанализированы отличия в показателях уродинамики внутри групп (динамика между визитами). В группе I (прием «ИндигалПлюс и левофлоксацин» в страте ХП категории II) Qmax значимо увеличилась с 19,83±10,52 мл/с на этапе скрининга до 24,71±10,86 мл/с (p=0,02) к моменту окончания исследования. Значимые отличия также выявлены в группе «ИндигалПлюс и левофлоксацин» по среднему показателю Vres: объем остаточной мочи уменьшился с 17,83±12,90 мл до 9,66±10,36 мл (p=0,004) (рис. 1).
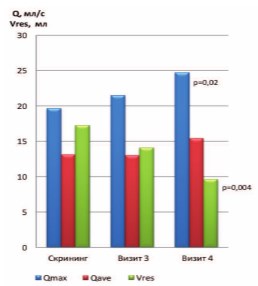
Рис. 1. Динамика уродинамических показателей Qmax и Qave (мл/с) и объема остаточной мочи Vres (мл) у пациентов I группы («ИндигалПлюс и левофлоксацин») в страте ХП категории II (показаны значимые отличия от значений на скрининге)
Также значимые отличия выявлены между Визитом скрининга и Визитом 4 у пациентов III группы («ИндигалПлюс и левофлоксацин») в страте ХП категории IIIA по средним показателям Qave и Vres. Средняя скорость потока мочи Qave увеличилась с 13,52±5,24 мл/с до 16,56±3,37 мл/с (p=0,005), а объем остаточной мочи уменьшился с 15,52±14,24 мл до 4,55±8,55 мл (p=0,001) (рис. 2).
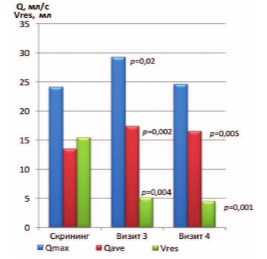
Рис. 2. Динамика уродинамических показателей Qmax и Qave (мл/с) и объема остаточной мочи Vres (мл) у пациентов I группы («ИндигалПлюс и тамсулозин») в страте ХП категории IIIA (показаны значимые отличия от значений на скрининге)
Значимых отличий по средним показателям Qmax, Qave и Vres не наблюдалось в группах, получавших только стандартную терапию.
Оценка противовоспалительного эффекта терапии проводилась на основании данных о межгрупповых отличиях по количеству лейкоцитов в секрете ПЖ и бактериологическим показателям. Сравнение по данным показателям на Визитах 1–4 проводилось у пациентов с ХП категории II, получающих левофлоксацин в комбинации с ИндигалПлюс (группа I), и получающих только левофлоксацин (группа II) (рис. 3). Значимые отличия были обнаружены в уровне числа лейкоцитов и бактериальной обсемененности в секрете ПЖ на Визите 3 (p=0,047 и p=0,046, соответственно).
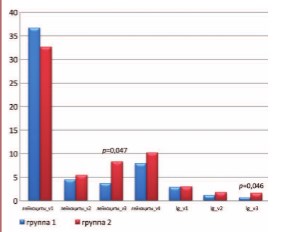
Рис. 3. Число лейкоцитов в секрете ПЖ (штук в поле зрения) на Визитах 1-4 и уровень бактериальной обсемененности (lg(КОЕ/мл)) секрета ПЖ
В ходе исследования проводилось также сравнение сроков наступления и полноты бактериологической санации секрета ПЖ в группах 1 и 2 у пациентов с ХП категории II, получающих левофлоксацин в комбинации с ИндигалПлюс и только левофлоксацин.
По данным бактериологического исследования секрета ПЖ эрадикация возбудителя была достигнута в 96,7% случаев в группе I и в 80,6% в группе II, при этом в группе I приема «ИндигалПлюс и левофлоксацин» эрадикация первоначального возбудителя происходила значимо чаще (p=0,049). Инфекция новым возбудителем в группе «ИндигалПлюс и левофлоксацин» происходила реже, чем в группе приема только левофлоксацина, отличия между группами значимы (p=0,029) (табл. 2).
Таблица 2. Частота эрадикации первоначального возбудителя и инфекции новым возбудителем и значимость их отличий в группах 1 и 2 ( критерий χ2 )
| Группа | Эрадикация (кол-во пациентов) |
Нет эффекта (кол-во пациентов) |
р (группа I /группа II) |
Нет инфекции новым возбудителем (кол-во пациентов) |
Инфекция новым возбудителем (кол-во пациентов) |
p (группа I /группа II) |
|---|---|---|---|---|---|---|
| Группа I (ИндигалПлюс и левофлоксацин) (n=30) |
29 | 1 | 0,049 | 19 | 11 | 0,029 |
| Группа II (левофлоксацин) (n=31) |
25 | 6 | – | 11 | 20 | - |
По результатам исследования также проведено сравнение качества жизни, состояния сексуальной функции и интенсивности обструктивной и ирритативной симптоматики (по данным опросников IPSS, NIH-CPSI и IIEF) с целью объективизации жалоб больных у пациентов с ХП категорий II и IIIA, получающих тамсулозин и левофлоксацин в комбинации с ИндигалПлюс в сравнении с применением тамсулозина и левофлоксацина.
Данные индексов IPSS, QoL, NIH-CPSI и IIEF пациентов первой и второй страт на первом и последнем визите представлены в таблице 3.
Таблица 3. Данные индексов IPSS, QoL, NIH-CPSI и IIEF пациентов первой и второй страт на Визите 1 и Визите 4
| Группа | IPSS_V1 | IPSS_V4 | QoL_V1 | QoL_V4 | NIH-CPSI_V1 | NIH-CPSI_V4 | IIEF_V1 | IIEF_V4 |
|---|---|---|---|---|---|---|---|---|
| I | 7,23±3,38 | 1,28±2,07 | 3,70±0,88 | 0,93±1,19 | 22,17±6,73 | 3,48±5,32 | 57,60±16,04 | 65,07±16,14 |
| II | 7,59±6,45 | 3,5±4,33 | 3,16±1,42 | 1,7±1,29 | 20,40±5,84 | 10,13±6,03 | 59,22±10,04 | 64,63±7,47 |
| III | 6,62±0,81 | 1,38±2,58 | 2,93±0,96 | 0,90±1,18 | 21,59±5,95 | 3,00±4,76 | 63,59±8,44 | 68,72±4,31 |
| IV | 6,18±4,71 | 3,68±3,98 | 2,71±0,98 | 2,11±0,99 | 20,21±6,18 | 11,04±6,23 | 59,57±19,01 | 57,00±19,38 |
Значимые отличия в показателях обнаружены были в страте ХП категории II через 90 дней после начала лечения (Визит 3) в величине индекса IPSS и NIH-CPSI (в целом и по доменам «боль» и «качество жизни»). Тенденция сохранилась и к окончанию отдаленного периода наблюдения (Визит 4) – в индексах IPSS, QoL, NIH-CPSI (в целом и по доменам «боль» и «качество жизни») и IIEF (табл. 3).
Полученные данные позволяют отметить эффективное влияние совместной терапии ИндигалПлюс и левофлоксацина на качество жизни пациентов.
В страте ХП категории IIIA значимые отличия обнаружены были на Визите 2 в величине индекса NIH-CPSI (в целом и по всем доменам), на Визите 3 – в величине индекса QoL и NIH-CPSI (в целом и по доменам «боль» и «качество жизни»), IIEF (в целом и по домену «эректильная функция»), а на Визите 4 – во всех указанных индексах и их доменах.
Наконец было проведено сравнение изменения объема предстательной железы у пациентов с ХП категорий II и IIIA, получающих тамсулозин и левофлоксацин в комбинации с ИндигалПлюс в сравнении с применением тамсулозина и левофлоксацина (рис. 4-5).
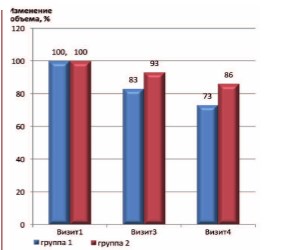
Рис. 4. Динамика объема предстательной железы в страте ХП категории II (исходный объем принят за 100%)
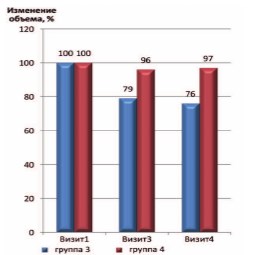
Рис. 5. Динамика объема ПЖ в страте ХП категории IIIA (исходный объем принят за 100%)
Достоверных различий размеров ПЖ до и после лечения выявлено не было, несмотря на некоторую тенденцию к уменьшению размеров ПЖ после лечения. Вероятно, для получения более выраженных положительных изменений необходима более продолжительная терапия комбинацией препаратов.
Необходимо также отметить хорошую переносимость препарата ИндигалПлюс больными. В ходе исследования было зарегистрировано 4 нежелательных явления (НЯ) в обеих стратах (табл. 4) – два в группах I и III, получающих ИндигалПлюс, (частота 3,39%, 95% ДИ 0,41%-11,7%) и два в группах II и IV, получающих только левофлоксацин/тамсулозин (частота 3,33%, 95% ДИ 0,41%-11,5%). Значимых отличий в частоте НЯ между группами не было (p=0,98). Серьезных НЯ зарегистрировано не было. Тяжесть НЯ охарактеризована исследователями в двух случаях как легкая, в одном – как умеренная, и в одном – как тяжелая. Связь НЯ с приемом исследуемых препаратов, по мнению исследователей, отсутствовала во всех случаях. Таким образом, в группе терапии препаратом ИндигалПлюс не отмечалось большее количество НЯ по сравнению с группой, получавшей только стандартную терапию.
Таблица 4. Нежелательные явления
| Группа | Страта | Описание | Тяжесть | Нежелательное явление разрешилось в период участия пациента в исследования? |
|---|---|---|---|---|
| 1 | ХП категории II | травма уздечки полового члена |
легкая | да |
| 3 | ХП категории IIIA | эритроцитурия из-за солевого диатеза |
легкая | да |
| 4 | ХП категории IIIA | боли в промежности. дискомфорт при мочеиспускании |
умеренная | нет |
| 4 | ХП категории IIIA | обострение ХП: боль в промежности, мошонке, внизу живота. дискомфорт при мочеиспускании |
тяжелая | да |
ОБСУЖДЕНИЕ
Наше исследование показало, что терапия препаратом ИндигалПлюс была более эффективна в страте 1 при ХП II категории. К концу исследования в группе I (совместная терапия ИндигалПлюс и левофлоксацин) у пациентов наблюдались наименьшие значения индексов IPSS и NIH-CPSI, лучшие показатели уродинамики и наименьшее количество остаточной мочи. Улучшение субъективной симптоматики и качества жизни, а также значимая клиническая эффективность сохранялись не только на протяжении всего 3-хмесячного курса терапии, но и спустя три месяца после его окончания.
Кроме того, терапия комбинацией препаратов ИндигалПлюс и левофлоксацин снижает бактериальную обсемененность и содержание лейкоцитов в секрете ПЖ, что, вероятно, обусловлено действием активных субстанций препарата ИндигалПлюс, повышающих чувствительности бактерий к антибиотикам, а также снимающих воспаление предстательной железы.
Монотерапия пациентов с ХП II тамсулозином и левофлоксацином носила в основном симптоматический характер, так как, возможно, не устраняла причину морфологических и микроциркуляторных изменений ПЖ.
ВЫВОДЫ
Препарат ИндигалПлюс является эффективным средством для лечения ХП и хорошо переносится пациентами. Отсутствие серьезных побочных эффектов является значительным преимуществом препарата. Полученные результаты позволяют рекомендовать комбинацию препарата ИндигалПлюс и левофлоксацина/тамсулозина для терапевтического лечения хронического простатита.
ЛИТЕРАТУРА
1. McRae SN, Dairiki Shortlliffe. Bacterial Infections of the Genitourinary Tract. In: Smith’s General Urology. (eds. Tanago E.A., McAninch J.W.) 15th edition. Lange Medical Book, San Francisco: 2000.
2. Dainel A, Shoskes G. Use of antibiotics in chronic prostatitis syndromes. Canadian J Urol 2001;8(1):24-28.
3. Jeannette M, Potts F. ?e four categories of prostatitis: Practical approach to treatment. Clev Clin J Med 2001;61:389-397.
4. Krieger JN, Nyberg L, Nickel JC NIH consensus definition and classification of prostatitis. JAMA 1999; 282 (3):236–237.
5. Gurunadha Rao Tunuguntla HS, Evans CP. Management of prostatitis. Prostate Cancer Prostatic Dis. 2002;5(3):172-179.
6. Weidner W, Diemer T, Huwe P, Rainer H, Ludwig M. The role of Chlamydia trachomatis in prostatitis. Int J Antimicrob Agents 2002;19:466–470.
7. Mander R, Raukas E, Turk S, Korrovits P, Punab M. Mycoplasmas in semen of chronic prostatistis patients. Scand J Urol Nephrol 2005;39(6):479-482.
8. Weidner W, Anderson RU. Evaluation of acute and chronic bacterial prostatitis and diagnostic management of chronic prostatitis/chronic pelvic pain syndrome with special reference to infection/inflammation. Int J Antimicrob Agents 2008;31(Suppl 1):91-95.
9. Richard G, DeAbate C, Ruoff G. et.al. Short-course levofloxacin (250 mg qd) vs ofloxacin (200 mg bid) in uncomplicated UTI: a double-blind, randomized trial. 6th Int. Symp. on new Quinolones. Denver (Nov 1998) In: Abstracts, 1998: abs 126.
10. Chen XS, Ye ZQ, Zeng XY. Tamsulosin for the treatment of chronic abacterial prostatitis. Zhonghua Nan Ke Xue 2002;8(1):51-53.
11. Narayan P, Evans CP, Moon T. Long-term safety and efficacy of Tamsulosin for the treatment of lower urinary tract symptoms associated with benign prostatic hyperplasia. J Urol 2003;170:498–502.
12. Горпинченко И.И., Гурженко Ю.Н. Исследование клинической эффективности альфа1-адреноблокатора тамсулозина у мужчин при хроническом абактериальном простатите/синдроме хронической тазовой боли. Здоровье мужчины 2013;(2):43-48
13. Дьяков В.В., Говоров А.В. Опыт длительного применения тамсулозина (омник) у больных хроническим простатитом. Урология 2002;(5):1–4
14. De Marzo AM, Platz EA, Sutcliffe S, Xu J, Grönberg H, Drake CG, et al. Inflammation in prostate carcinogenesis. Nat Rev Cancer 2007;7(4):256–269.
15. Parameswaran N, Patial S. Tumor necrosis factor-α signaling in macrophages. Crit Rev Eukaryot Gene Expr 2010;20(2):87-103.
16. Kundu JK, Na HK., Chun KS, Kim YK, Lee SJ, Lee SS, et al. Inhibition of phorbol ester-induced COX-2 expression by epigallocatechin gallate in mouse skin and cultured human mammary epithelial cells. J Nutr 2003;133(11Supl.1):3805–3810.
17. Wheeler DS, Catravas JD, Odoms K, Denenberg A, Malhotra V, Wong HR. Epigallocatechin-3-gallate, a green tea-derived polyphenol, inhibits IL-1-betadependent proinflammatory signal transduction in cultured respiratory epithelial cells J Nutr 2004;134(5):1039– 1044.
18. Singh BN, Shankar S, Srivastava RK. Green tea catechin, epigallocatechin3-gallate (EGCG): mechanisms, perspectives and clinical applications. Biochemical pharmacology 2011;82(12):1807-1821.
19. Vayalil PK, Katiyar SK. Treatment of epigallocatechin-3-gallate inhibits matrix metalloproteinases-2 and -9 via inhibition of activation of mitogen-activated protein kinases, c-jun and NFkappaB in human prostate carcinoma DU-145 cells. Prostate 2004;59(1):33–42.
20. Aggarwal BB, Ichikawa H. Molecular targets and anticancer potential of indole-3carbinol and its derivatives. Cell Cycle 2005;4(9):1201-1215.
21. Takada Y, Andreeff M, Aggarwal BB. Indole-3-carbinol suppresses NF-κB and IκBα kinase activation, causing inhibition of expression of NF-κB-regulated antiapoptotic and metastatic gene products and enhancement of apoptosis in myeloid and leukemia cells. Blood 2005;106(2):641-649.
22. Jeong WS, Kim IW, Hu R, Kong AN. Modulatory properties of various natural chemopreventive agents on the activation of NF-kappaB signaling pathway. Pharm Res 2004;21(4):661–670.
23. Sirab N, Robert G, Fasolo V, Descazeaud A, Vacherot F, de la Taille A, et al. Lipidosterolic extract of serenoa repens modulates the expression of inflammation related-genes in benign prostatic hyperplasia epithelial and stromal cells. Int J Mol Sci 2013;14(7):14301-14320.
24. Sung WS, Lee DG. In vitro antimicrobial activity and the mode of action of indole-3carbinol against human pathogenic microorganisms. Biol Pharm Bull 2007;30(10):1865-1869.
25. Steinmann J, Buer J, Pietschmann T, Steinmann E. Anti-infective properties of epigallocatechin-3-gallate (EGCG), a component of green tea. Br J Pharmacol 2013;168(5):1059-1073.
26. Zhao WH, Hu ZQ, Okubo S, Hara Y, Shimamura T. Mechanism of synergy between epigallocatechin gallate and beta-lactams against methicillin-resistant Staphylococcus aureus. Antimicrob Agents Chemother 2001;45(6):1737-42.
27. Sung WS, Lee DG. Mechanism of decreased susceptibility for Gram-negative bacteria and synergistic effect with ampicillin of indole-3-carbinol. Biol Pharm Bull 2008;31(9):1798-1801.







