Доброкачественная гиперплазия предстательной железы (ДГПЖ) является наиболее распространенным заболеванием у мужчин пожилого и старческого возраста [1]. Согласно современным исследованиям частота встречаемости ДГПЖ составляет в среднем 80% у мужчин старше 60 лет [2].
У 15-32 % пациентов с ДГПЖ возникает декомпенсация функции мочевого пузыря с развитием хронической задержки мочи, двустороннего уретерогидронефроза и хронической почечной недостаточности [3].
В патогенезе этих осложнений инфравезикальная обструкция играет лишь инициальную роль, приводя в конечном итоге к нарушению гемодинамики мочевoго пузыря и почек и закономерно развивающейся вслед за ней тканевой гипоксии [4]. Гипоксия детрузора при ДГПЖ является не только следствием относительной недостаточности кровообращения в гипертрофированной стенке мочевого пузыря и сдавления аденоматозными узлами нижнепузырных артерий, но и следствием возрастного атеросклеротического поражения артерий («сенильный детрузор») [5]. Выраженная инфравезикальная обструкция приводит к повышению давления в мочевом пузыре, нарушению оттока мочи из почек и возникновению пузырномочеточниковых и почечных рефлюксов. Эти явления запускают ишемические процессы в почечной ткани, которые являются важным патогенетическим звеном в развитии воспаления и ХПН [6].
У данной категории пациентов в качестве первого этапа оперативного лечения выполняется цистостомия [7]. Подобная тактика позволяет восстановить уродинамику мочевых путей, приводя таким образом к стойкой нормализации органной гемодинамики, инициирует начало процесса «обратного» развития ранее возникших структурных изменений ткани мочевого пузыря и почек, приводит к восстановлению сократительной способности мочевого пузыря и азотовыделительной функции почек [8]. Однако, полноценность подобной «обратимости» определяется фактором времени и степенью «запущенности» склеротических изменений в данных органах [9].
Среди инфекционных осложнений ДГПЖ 3 стадии (классификация Guyon 1881) хронический простатит диагностируется в 37,5% случаев, хронический пиелонефрит в стадии ремиссии с развитием почечной недостаточности – в 69%, хронический цистит и уретрит – в 30,3%, острый и хронический эпидидимит выявляется у 1,7% больных [3].
Инфекционно-воспалительные процессы, осложняющие течение ДГПЖ наряду с морфофункциональными изменениями мочевого пузыря и почек, возникающими на фоне их циркуляторной гипоксии, являются одной из причин неудовлетворительных результатов и осложнений радикального хирургического лечения ДГПЖ, выполненного у пациентов с эпицистостомой, наложенной по поводу хронической задержки мочи [10, 11]. Кроме того, бактериурия, имеющаяся у больных с цистостомическим дренажом увеличивает риск послеоперационных осложнений в 2,5 раза [12].
Сегодня трансуретральная резекция является «золотым стандартом» в оперативном лечении доброкачественной гиперплазии предстательной железы [13, 14]. Однако, сама по себе ТУР ПЖ является стрессовой ситуацией, вызывая значительные изменения микроциркуляции в почках и приводя к функциональному подавлению интенсивности перфузии. Данные нарушения сохраняются и на 8-е сутки после операции [15]. Это обстоятельство вносит дополнительный вклад в возникновение инфекционно-воспалительных осложнений и функциональных нарушений со стороны почек в послеоперационном периоде после ТУР ПЖ.
Острая и хроническая задержка мочи в послеоперационном периоде встречается у 3-9% пациентов, перенесших ТУР ПЖ, при этом, данные осложнения связаны не с неполноценностью резекции, а с дисфункцией детрузора, имевшейся до операции [16, 17]. Обострение хронического пиелонефрита отмечено у 7,2% пациентов после аденомэктомии [18]. Азотемия наблюдается у 15–30% больных, перенесших радикальное оперативное вмешательство по поводу ДГПЖ [19]. Кроме того, остаточная симптоматика после ТУР ПЖ наблюдается у 5-35% пациентов [5, 20].
Ишемическая и инфекционная природа повреждений мочевого пузыря и почек и связанные с этим неудовлетворительные результаты радикального хирургического лечения ДГПЖ, осложненной хронической задержкой мочи, ХПН и азотемией, диктуют необходимость применения на этапах оперативного лечения ДГПЖ, наряду с эпицистостомией, средств, улучшающих органный кровоток и оксигенацию тканей, а также обладающих иммунной активностью. В этой связи, патогенетически обоснованным может быть применение метода гипербарической оксигенации (ГБО), заключающегося во вдыхании 100% кислорода под давлением, превышающим одну абсолютную атмосферу. Благодаря гипербаротерапии происходит повышение растворимости, а, следовательно, и парциального давление кислорода в крови и периферических тканях. Растворенный в плазме кислород за счет диффузии из капиллярного русла попадает в межклеточную жидкость, а затем и в клетки, улучшая клеточную оксигенацию. Адекватная оксигенация обеспечивает получение митохондриями эффективной продукции аденозинтрифосфорной кислоты (АТФ), а также других компонентов, необходимых для клеточного функционирования [21, 22]. Кислород под повышенным давлением оказывает бактерицидное (в отношении анаэробов) и бактериостатическое (в отношении некоторых видов аэробных микроорганизмов) действие, а также стимулирует систему антиоксидантной защиты организма [23]. Кроме того, гипербарическая оксигенация (ГБО) обладает иммунокорригирующим эффектом, который выражается в нормализации показателей клеточного иммунитета, снижении уровня провоспалительных цитокинов, IgE, а также в увеличении концентрации сывороточного IgA [24].
Таким образом, можно предположить, что использование ГБО в комплексном лечении пациентов, которым выполнена цистостомия в качестве первого этапа оперативного лечения ДГПЖ, будет положительно влиять на гемодинамику детрузора и почек, улучшит результаты радикального хирургического лечения ДГПЖ и снизит вероятность инфекционно-воспалительных осложнений послеоперационного периода.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование вошли 69 пациентов в возрасте от 59 до 80 лет (средний возраст 69,86±6,1 года) с установленным диагнозом ДГПЖ, осложненной хронической задержкой мочи и признаками хронической почечной недостаточности, находящиеся на лечении в 1-м урологическом отделении ГБКУЗ ЯО МСЧ ОАО «Автодизель» г. Ярославля в период с 2008 по 2013 гг. Объем предстательной железы варьировал от 38,8 см³ до 76,4 см³(в среднем 57 ± 5,7 см³). Объем остаточной мочи в среднем составил– 498,5 ± 97,4 см³. Уровень мочевины крови составлял в среднем 16,89 ± 3,07 ммоль/л, креатинина крови – 192,96 ± 36,03 мкмоль/л, СКФ – 35 ±4,8 мл/мин.
В качестве первого этапа лечения ДГПЖ всем пациентам была выполнена эпицистостомия. В дальнейшем пациенты были разделены на две группы. Группу контроля (n=36) составили пациенты, получавшие после цистостомии стандартную антибактериальную терапию, средства для коррекции метаболического ацидоза и альфа-адреноблокаторы (тамсулозин). В группу исследования (n=33) вошли пациенты, получавшие с первых суток после наложения цистостомы помимо стандартной терапии 10 сеансов ГБО с экспозицией 45 минут, под давлением 1,5 АТА в камере БЛКС-301М. В дальнейшем пациентам обеих групп выполнена плановая ТУР ПЖ в сроки от 30 до 35 дней после наложения эпицистостомы. В послеоперационном периоде после ТУР ПЖ пациенты обеих групп получали стандартную терапию в виде альфа-адреноблокаторов (тамсулозин), гемостатической и антибактериальной терапии. Уретральный катетер удаляли на третьи сутки после трансуретральной резекции предстательной железы.
Объем остаточной мочи оценивался у всех пациентов до выполнения цистостомии, а также на 7-е и 15-е сутки после выполнения ТУР ПЖ.
Уровень мочевины и скорость клубочковой фильтрации определялись до наложения цистостомического дренажа а также на 3-и, 7-е, и 10-е сутки после цистостомии и на 1-е, 3-и и 7-е сутки после ТУР ПЖ.
У 20 больных исследуемой группы и 19 больных контрольной, проводилась ультразвуковая допплерография сосудов стенки мочевого пузыря трансректальным датчиком и почек с использованием трансабдоминального датчика. Исследования производились на аппарате Toshiba Xario SSA-660A до наложения цистостомы, а также на 3-и и 10-е сутки после операции. При этом изучались следующие показатели: максимальная систолическая скорость кровотока Vmax, конечная диастолическая скорость кровотока Vmin, индекс резистентности RI и индекс васкуляризации VI. Так как в литературе отсутствуют данные о показателях кровотока в стенке мочевого пузыря и почках у данной группы пациентов нами выполнено исследование аналогичных параметров в группе сравнения, состоящей из 10 человек в возрасте от 65 до 74 лет, у которых, по данным обследования, не было выявлено патологии мочеполовой системы.
С целью субъективной оценки симптоматики всеми пациентами в послеоперационном периоде после ТУР ПЖ заполнялся модифицированный опросник IPSS и опросник QoL [25] на 7-е и 15-е сутки после ТУР ПЖ.
В обеих группах производилось сравнительная оценка ранних послеоперационных осложнений после выполнения трансуретральной резекции предстательной железы.
Всем пациентам выполнялась урофлоуметрия на 7-е и 15-е сутки после восстановления самостоятельного мочеиспускания, при этом оценивали максимальную объемную скорость потока мочи (Qmax).
РЕЗУЛЬТАТЫ
Сравнение результатов исследования произведенных до наложения цистостомы не показало статистически значимых различий результатов в обеих группах (p>0,05).
При исследовании объема остаточной мочи (табл. 1) отмечено достоверное (p>0,05) уменьшение количества остаточной мочи на 7-е сутки после ТУР ПЖ до 121,4 ± 36,2 мл и 88,2±27,7 мл в контрольной и исследуемой группах соответственно. На 15-е сутки после ТУР ПЖ количество остаточной мочи равнялось 89,1±24,4 мл в контрольной группе и 45,7±12,2 мл в исследуемой группе. Таким образом, снижение количества остаточной мочи после выполнения ТУР ПЖ в исследуемой группе более выражено.
Уровень остаточного азота в крови достоверно (p>0,05) снизился в обеих группах после выполнения цистостомии. Уровень мочевины крови в контрольной группе на 3-и сутки после цистостомии составлял 14,67±4,02 ммоль/л, на 7-е – 13,8±3,13 ммоль/л, на 10-е – 11,1 ± 2,24 ммоль/л. Этот же показатель в исследуемой группе составлял 13,6±2,89 ммоль/л, 9,6±2,89 ммоль/л и 7,2± 1,32 ммоль/л на 3-и, 7-е и 10-е сутки соответственно.
После ТУР ПЖ уровень мочевины крови в исследуемой группе составил 10,4±1,47 ммоль/л на 1-е сутки, 8,6±2,12 ммоль/л на 3-и сутки и 7,9±1,56 ммоль/л на 7-е сутки после операции. В контрольной группе данный показатель после выполнения ТУР ПЖ составлял 11,2 ± 3,43 ммоль/л, 10,0 ± 1,98 ммоль/л, и 9,1 ± 2,07 ммоль/л на 1-е, 3-и и 7-е сутки соответственно. Данные об уровне остаточного азота крови в обеих группах (табл. 2).
Скорость клубочковой фильтрации (СКФ) достоверно не различалась (p< 0,05) в обеих группах до операции. После наложения цистостомы СКФ в контрольной группе составила 39±4,45 мл/с на 3-и сутки, 45±6,89 мл/с – на 7-е сутки и 58±4,89 мл/с – на 10-е сутки после цистостомии. В исследуемой группе скорость СКФ на 3-и, 7-е и 10-е сутки после цистостомии составила 42±3,94 мл/с, 54±5,52 мл/с и 79±4,32 мл/с соответственно. После выполнения ТУР ПЖ скорость клубочковой фильтрации в исследуемой группе составила 67±5,22 мл/мин на 1-е сутки, 72±4,45 мл/мин – на 3-и сутки и 77±6,02 мл/мин – на 7-е сутки. В контрольной группе уровень СКФ составлял 53±3,65 мл/мин на 1-е сутки, 62±4,67 мл/мин – на 3-и сутки и 67±5,89 мл/мин – на 7-е сутки после выполнения операции. Данные о скорости клубочковой фильтрации представлены на рисунке 1.
Таким образом, после наложения цистостомы в группе пациентов, где применялось ГБО, снижение уровня остаточного азота происходило в более короткие сроки, а нормализация уровня мочевины и креатинина наблюдалась к 10-м суткам. Кроме того в группе ГБО имел место более выраженный рост скорости клубочковой фильтрации. После выполнения ТУР ПЖ функция почек снижалась в обеих группах, но в исследуемой группе данные изменения были менее выражены, а нормализация показателей наблюдалось уже к 3-м суткам после операции.
По данным допплерографии сосудов шейки мочевого пузыря до выполнения цистостомии систолическая скорость кровотока (Vmax) в среднем у пациентов контрольной и исследуемой групп составляла 10,24±2,17 см/с, диастолическая скорость кровотока (Vmin) – 1,83±0,87 см/с, индекс резистентности (RI) – 0,80±0,02, индекс васкуляризации (VI) – 9,17± 1,59. В группе сравнения, состоящей из здоровых добровольцев, имелись следующие показатели кровотока: Vmax – 6,98±1,34, Vmin – 2,65±1,32, RI – 0,69±0,05, VI -12,97±1,18. Таким образом, видно, что индекс резистентности значительно выше у пациентов с ДГПЖ 3 стадии, по сравнению со здоровыми мужчинами, а индекс васкуляризации наоборот выше у мужчин без урологической патологии. На 3-и сутки после цистостомии показатели кровотока составили в контрольной группе: – Vmax – 10,84±1,17, Vmin – 1,88±0,71, RI – 0,84±0,02, VI -9,66±1,19; в исследуемой группе данные показатели имели следующие значения: Vmax – 9,65±2,01, Vmin – 1,96±0,68, RI – 0,74±0,02, VI – 10,45±1,34 На 10-е сутки после цистостомии: в контрольной группе – Vmax – 11,86±2,13, Vmin – 1,90±0,78, RI – 0,84±0,02, VI – 10,69± 1,23; в исследуемой – Vmax – 8,12±1,74, Vmin – 2,27±0,93, RI -0,72±0,03, VI – 11,53± 1,67.
Таблица 1. Количество остаточной мочи в контрольной и исследуемой группах больных
| Группа | Объем остаточной мочи (мл) | ||
|---|---|---|---|
| До выполнения цистостомии | На 7-е сутки после ТУР ПЖ | На 15-е сутки после ТУР ПЖ | |
| Исследуемая группа | 502,2 ±100,6 | 88,2 ± 27,7 | 45,7 ± 12,2 |
| Контрольная группа | 493,7 ± 92,9 | 121,4 ± 36,2 | 89,1 ± 24,4 |
| P между группами | >0,05 | <0,05 | <0,05 |
Таблица 2. Динамика показателей остаточного азота после наложения цистостомы и после ТУР ПЖ в исследуемой и контрольной группах
| Уровень мочевины крови |
Контрольная группа ммоль/л |
Исследуемая группа ммоль/л |
P между группами |
|---|---|---|---|
| До цистостомии | 16,89 ± 3,07 | 17,05 ± 3,16 | >0.05 |
| На 3-е сутки после цистостостомии |
14,67±4,02 | 13,6±2,89 | >0.05 |
| На 7-е сутки после цистостомии |
13,8±3,13 | 9,6±2,89 | <0.05 |
| На 10-е сутки после цистостомии |
11,1 ± 2,24 | 7,2± 1,32 | <0.05 |
| 1-е сутки после ТУР ПЖ | 11,2 ± 3,43 | 10,4±1,47 | >0.05 |
| 3-и сутки после ТУР ПЖ | 10,0 ± 1,98 | 8,6±2,12 | <0.05 |
| 7-е сутки после ТУР ПЖ | 9,1 ± 2,07 | 7,9±1,56 | <0.05 |
Таблица 3. Динамика показателей кровотока по данным допплерографии сосудов мочевого пузыря в исследуемой и контрольной группах после наложения цистомы
| Показатель | До цистостомии | 3-и сутки после цистостомии | 10-e сутки после цистостомии | Группа сравнения | |||
|---|---|---|---|---|---|---|---|
| Исследуемая группа |
Контрольная группа |
Исследуемая группа |
Контрольная группа |
Исследуемая группа |
Контрольная группа |
||
| Систолическая скорость кровотока (см/с) |
10,24±2,17 | 10,21±2,26 | 9,65±2,01 | 10,84±1,17 | 8,12±1,74 | 11,86±2,13 | 6,98 ±1,34 |
| Диастолическая скорость кровотока (см/с) |
1,83±0,87 | 1,86±0,84 | 1,96±0,68 | 1,88±0,71 | 2,27±0,93 | 1,90±0,78, | 2,65±1,32 |
| Индекс резистентности | 0,80±0,02 | 0,84±0,03 | 0,74±0,02 | 0,84±0,02 | 0,72±0,03 | 0,84±0,02 | 0,69±0,05 |
| Индекс васкуляризации | 9,17± 1,52 | 9,06± 1,57 | 10,45±1,34 | 9,66±1,19 | 11,53± 1,67 | 10,69± 1,23 | 12,97± 1,18 |
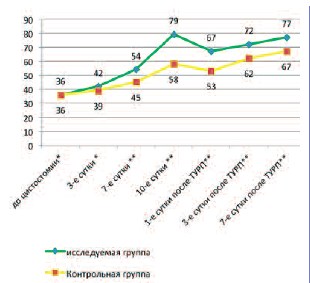
Рис. 1. Скорость клубочковой фильтрации в основной и контрольной группах *исследуемая группа/контрольная группа р>0,05 ** исследуемая группа/контрольная группа р<0,05
Таблица 4. Показатели кровотока по данным допплерографии сосудов почек в группе здоровых мужчин и исследуемой и контрольной группах до цистостомии
| Уровень снятия спектра | V max мм/с | V min мм/с | RI мм/с | VI мм/с | |
|---|---|---|---|---|---|
| Почечные артерии | Исследуемая группа | 61,4 ± 0,22 | 29,4 ± 0,86 | 0,72 ± 0,03 | 0,92± 0,03 |
| Контрольная группа | 60,9 ± 0,23 | 29,3 ± 0,79 | 0,73 ± 0,03 | 0,93± 0,02 | |
| Группа сравнения | 55,7±0,18 | 29,1 ± 0,77 | 0,58±0,02* | 1,13± 0,04 | |
| Сегментарные артерии |
Исследуемая группа | 54,1 ± 1,01 | 26,7 ± 0,37 | 0,85 ± 0,01 | 1,01± 0,02 |
| Контрольная группа | 53,9 ± 0,92 | 26,5 ± 0,32 | 0,86 ± 0,02 | 1,02± 0,03 | |
| Группа сравнения | 47,8 ± 0,88 | 23,9 ± 0,23 | 0,59± 0,02* | 1,32± 0,05* | |
| Артерии паренхимы |
Исследуемая группа | 33,1 ± 0,67 | 13,4 ± 0,36 | 0,91 ± 0,14 | 1,17± 0,03 |
| Контрольная группа | 33,0 ± 0,59 | 13,2 ± 0,35 | 0,92 ± 0,12 | 1,16± 0,04 | |
| Группа сравнения | 31,7± 0,48 | 12,5± 0,26 | 0,55 ± 0,09* | 1,43±0,06* | |
*различия достоверны по отношению к исследуемой и контрольной группам (р<0,05)
Таблица 5. Динамика показателей кровотока по данным допплерографии сосудов почек в исследуемой и контрольной группах после цистомии
| Уровень снятия спектра | V max мм/с | V min мм/с | RI мм/с | VI мм/с | |||||
|---|---|---|---|---|---|---|---|---|---|
| 3-и сутки | 10-е сутки | 3-и сутки | 10-е сутки | 3-и сутки | 10-е сутки | 3-и сутки | 10-е сутки | ||
| Почечные артерии | Исследуемая группа | 60,1 ± 0,18 | 58,7 ± 0,17 | 29,3 ± 0,85 | 29,1 ± 0,77 | 0,7 ± 0,03 | 0,62 ± 0,02 | 1,0 ± 0,04 | 1,1 ± 0,02 |
| Контрольная группа | 60,0 ± 0,21 | 59,3 ± 0,19 | 29,2 ± 0,78 | 29,1 ± 0,78 | 0,71 ± 0,03 | 0,69 ± 0,04 | 0,96± 0,03 | 1,04 ± 0,02 | |
| Сегментарные артерии |
Исследуемая группа | 52,9 ± 0,97 | 49,1 ± 0,62 | 24,7 ± 0,36 | 24,5 ± 0,37 | 0,8 ± 0,01 | 0,64 ± 0,02 | 1,18± 0,03 | 1,3 ± 0,02 |
| Контрольная группа | 51,8 ± 0,86 | 51,0 ± 0,75 | 25,2 ± 0,30 | 25,0 ± 0,27 | 0,82 ± 0,02 | 0,75 ± 0,03* | 1,13± 0,04 | 1,21 ± 0,05* | |
| Артерии паренхимы |
Исследуемая группа | 32,2 ± 0,61 | 32,1 ± 0,58 | 13,3 ± 0,34 | 13,2 ± 0,32 | 0,82 ± 0,11 | 0,60 ± 0,05 | 1,31± 0,05 | 1,42 ± 0,02 |
| Контрольная группа | 32,7 ± 0,65 | 32,7 ± 0,59 | 13,0 ± 0,37 | 12,9 ± 0,41 | 0,87 ± 0,10 | 0,72 ± 0,08* | 1,22 ± 0,03 | 1,34 ± 0,02* | |
*исследуемая группа/контрольная группа р<0,05
При анализе результатов допплерографии сосудов шейки мочевого пузыря после наложения цистостомы на 3-и и 10-е сутки отмечено достоверное снижение систолической скорости кровотока и снижение индекса резистентности в обеих группах, причем на фоне проводимой терапии в основной группе эти изменения более значимы, чем изменения аналогичных показателей в контрольной группе (табл. 4).
При сравнительном анализе показателей гемодинамики в почках до цистостомии отмечено повышение индекса резистентности и снижение индекса васкуляризации в контрольной и исследуемой группах пациентов по сравнению с группой здоровых добровольцев (табл. 4). Это говорит о нарушении гемодинамики в почках на фоне ретенции верхних мочевых путей, вызванных ИВО.
Допплерографические показатели кровотока в артериях почек на 3-и и 10-е сутки после выполнения цистостомии показаны в таблице 5.
Из представленных данных можно сделать вывод о том, что после наложения цистостомического дренажа отмечается снижение показателя IR и увеличение показателя VI у пациентов обеих групп, что говорит об улучшении кровоснабжения органа. Однако в исследуемой группе эти изменения носят более выраженный характер и достигают нормальных значений.
При анкетировании по шкале IPSS/QoL после восстановления самостоятельного мочеиспускания отмечено достоверное снижение количества баллов по шкале IPSS в обеих группах. В исследуемой группе до выполнения цистостомии средний бал по шкале IPSS составлял 28±2, на 7 сутки после ТУР ПЖ 19,30±1,2, а на 15 сутки – снизился до 12,6±1,4. В контрольной группе показатели IPSS полученные в аналогичные временные периоды составили 27,4±2,1, 21,30±1,2, 15,8±2,42 соответственно. Показатель QoL за аналогичный промежуток времени снизился в основной группе с 4,2±0,71 до 2,25±0,31 (P< 0,05), в контрольной – с 4,18±0,35 до 3,2±0,6 (р< 0,05). В обоих случаях различия показателей между группами на 15-е сутки были достоверными (р<0,05).
Среди ранних послеоперационных осложнений после ТУР ПЖ в контрольной группе у двух пациентов (6,9%) отмечалось обострение хронического пиелонефрита, острый эпидидимоорхит имел место у одного пациента (3,4%). Также у одного пациента сохранялся длительно не заживающий цистостомический свищ. В исследуемой группе не отмечено инфекционновоспалительных осложнений в раннем послеоперационном периоде. Данные о структуре и количестве послеоперационных осложнений инфекционно-воспалительного характера приведены в таблице 6.
По данным урофлоуметрии максимальная объемная скорость мочеиспускания на 7-е сутки после ТУР ПЖ составляла 11,2 ± 2,56 мл/с в контрольной группе и 14,3 ±2,12 мл/с в исследуемой группе. На 15-е сутки после ТУР ПЖ Qmax равнялось 13,96 ± 2,25 и 17,51 ± 1,83 мл/с в контрольной и исследуемой группе соответственно.
Таблица 6. Структура послеоперационных осложнений после ТУР ПЖ
| Контрольная группа | Исследуемая группа | |
|---|---|---|
| Обострение хронического пиелонефрита |
2 (6,9%) | 0 (0%) |
| Острый эпидидимоорхит |
1 (3,4%) | 0 (0%) |
| Длительное не заживление цистостомического свища |
1 (3,4%) | 0 (0%) |
ОБСУЖДЕНИЕ
У пациентов с ДГПЖ, сопровождающейся ретенцией верхних мочевых путей, отмечаются расстройства микроциркуляции органов мочевыделительной системы. Нарушение гемодинамики неизбежно приводит к гипоксии ткани шейки мочевого пузыря и почек, что подтверждается данными резкого снижения сатурации кислорода при ишемии ткани [26]. Данное состояние значительно ухудшает результаты оперативного лечения ДГПЖ у пациентов.
С другой стороны, наличие хронических воспалительных процессов в органах мочеполовой системы, ассоциированных с ДГПЖ, является фактором развития инфекции органов мочевыделительной системы в послеоперационном периоде после ТУР ПЖ. Имеющийся у пациентов цистостомический дренаж еще больше увеличивает процент встречаемости бактериурии у пациентов с ДГПЖ и тем самым приводит к неудовлетворительным результатам оперативного лечения.
ГБО характеризуется комплексным воздействием: устраняет практически любую форму гипоксии, создает определенный резерв кислорода в тканях и обеспечивает метаболические потребности организма при снижении объемной скорости кровотока. Кроме того, ГБО нормализует состояние системы гемостаза и деятельность нервной системы. Кислород под повышенным давлением оказывает бактерицидное (в отношении анаэробов) и бактериостатическое (в отношении некоторых видов аэробных микроорга низмов) действие, а также стимулирует систему антиоксидантной защиты организма[23, 27]. ГБО оказывает также противовоспалительное действие – снимает отек, способствуя тем самым полноценной регенерации тканей [28].
Применение ГБО позволяет улучшить гемодинамику детрузора и почек, приводя к «обратному развитию» возникших в них структурных нарушений, что позволяет в более короткие сроки снизить уровень остаточного азота крови, добиться улучшения функции детрузора, выражающееся в снижении количества остаточной мочи и ирритативной симптоматики после выполнения ТУР ПЖ, а также уменьшить количество осложнений после выполнения трансуретральной резекции предстательной железы.
ВЫВОДЫ
Включение ГБО в схему лечебных мероприятий после наложения цистостомы у пациентов с хронической задержкой мочи на фоне ДГПЖ позволяет в более короткие сроки восстановить гемодинамику нижних мочевых путей и почек, и улучшить функциональное состояние последних. Кроме того, предложенный способ положительно влияет на результаты ТУР ПЖ.
ЛИТЕРАТУРА
1. Baazeem A, Elhilali MM. Surgical management of benign prostatic hyperplasia: current evidence. // Nat Clin Pract Urol. 2008. Vol. 5, N 10. P. 540-549.
2. Вишневский А.Е., Лукьянов И.В., А.В. Марков А.В. Предпочтения пациентов в выборе альфа-адреноблокаторов при лечении расстройств мочеиспускания у больных ДГПЖ. // Урология. 2013. № 2. С. 51-55.
3. Коротеев М.А., Кореньков Д.Г., Михайличенко В.В. Ранняя профилактика инфекцонно-воспалительных осложнений трансуретральной резекции доброкачественной гиперплазии предстательной железы. // Андрология и генитальная хирургия. 2008 № 2. С. 55-61.
4. Казихинуров А.А., Казихинуров Р.А. Сафиулин Р.И. Расстройства и методы коррекции микроциркуляции при заболеваниях нижних мочевых путей. // Медицинский вестник Башкортостана. 2010. № 5. С 94-98.
5. Шорманов И.С., Рыжков А.И. Гипербарическая оксигенация в лечении расстройст мочеиспускания после трансуретральной резекции доброкачественной гиперплазии предстательной железы // Фундаментальные исследования. 2011. № 1. С. 205-212.
6. Антонова В.Е., Мартов А.Г., Данилков А.П., Максимов В.А., А.Г. Наумов А.Г. Эфферентная терапия в комплексном лечении острого гнойного пиелонефрита в раннем послеоперационном периоде. // Урология. 2007 № 4. С. 94-99.
7. Аляев Ю.Г., Рапопорт Л.М., Винаров А.З., Цариченко Д.Г., Фиев Д.Н., Бушуев В.О Особенности предоперационной подготовки и лечения при гиперплазии простаты больших размеров. // Андрология и генитальная хирургия. 2009 № 1. С. 50-53.
8. Урология. Национальное руководство [Под ред. Лопаткина Н.А.] М.: ГЭОТАР-Медия, 2009. …. с.
9. Шорманов И.С. Структурно-функциональные изменения почек при пороках развития магистральных сосудов сердца (клинико-экспементальное исследование): Автореф дис. … дра мед. наук. М., 2009. 47с.
10. Rassweiler J, Teber D, Kuntz R, Hofmann R. Complications of transurethral resection of the prostate (TURP)-incidence, management, and prevention. // Eur Urol. 2006. Vol. 50, N 5. P. 969-979.
11. Колбасов Д.Н. Гипербаричеcкая оксигенация в лечении больных доброкачественнной гиперплазии предстательной железы: Автореф. дис. … канд. мед. наук. М., 2009. 23 с.
12. Шакир Фуад, Непрямое электрохимическое окисление крови в профилактике и лечении острого эпидидимита: Автореф. дис. … канд. наук. М., 2004. 36 с.
13. Metcalfe C, Poon KS. Long-term results of surgical techniques and procedures in men with benign prostatic hyperplasia. // Curr Urol Rep. 2011. Vol. 12, N 4. P. 265-273.
14. Болезни предстательной железы. [Под ред. Аляева Ю.Г.] М.: ГЕОТАР-Медиа, 2009. 240 с.
15. Ноздрачев Н.А, Неймарк А.И., Неймарк Б.А. Применение препарата витапрост плюс в профилактике инфекционно-воспалительных осложнений трансуретральной резекции простаты у больных аденомой предстательной железы // Урология. 2011. N 4. С. 55-60.
16. Safarik L, Dvoracek J. Benign hyperplasia of the prostate-a known and unknown disease. // Cas Lek Cesk. 2001. Vol. 140, N 23. P. 717-722.
17. Djavan B, Madersbacher S, Klingler C, Marberger M. Urodynamic assessment of patients with acute urinary retention: is treatment failure after prostatectomy predictable? // J Urol. 1997. Vol. 158, N 5. P. 1829-1833.
18. Бегаев А.И., Трансуретральная резекция предстательной железы при гиперплазии (ошибки, опасности, осложнения): Аавтореф. дис. … канд. мед. наук. М., 2005. 36 с.
19. Чепуров А.В., Школьников М.Е., Буланцев Д.Ю. Доброкачественная гиперплазия предстательной железы: определение показаний к оперативному лечению. // Лечебное дело. 2007. N 2. С. 12-16.
20. Аль-Шукри С.Х., Ткачук И.Н. Профилактика ирритативных расстройств мочеиспускания после трансуретральной резекции простаты у больных доброкачетсвенной гиперплазией предстательной железы. // Нефрология. 2008. N 4. С. 67-71.
21. Daniel RA, Cardoso VK, Góis Jr E, Parra RS, Garcia SB, Rocha JJ, Féres O. Effect of hyperbaric oxygen therapy on the intestinal ischemia reperfusion injury. // Acta Cir Bras. 2011. Vol. 26, N 6. P. 463-469.
22. Гипербарическая медицина: практическое руководство. [Под ред. Д. Матьё ; пер. с англ.] М.: 2009, БИНОМ. Лаборатория знаний – 720 с.
23. Лоран О.Б., Колбасов Д.А., Митрохин А. Применение гипербарической оксигенации в лечении расстройств мочеиспускнаия у мужчин. // Врач. 2009. N 1. С. 30-32.
24. Гринцова А.А., Ладария Е.Г. Изменение цитокинового профиля и покзателей гуморального иммунитета у пациентов с профессиональным хроническим обструктивным заболеванием легких в результате лечения методом гипербарической оксигенации. // Вестник неотложной и восстановительной медицины. 2012. N 2. С. 246-248.
25. Рыжков А.И. Трансуретральная резекция и гипербарическая оксигенация в комплексном лечении доброкачественной гиперплазии предстатательной железы: Дис. … канд. мед. наук. М.. 2012. … с.
26. Нашивочникова Н.А., Крупин В.Н., Ключай В.В. Состояние микроциркуляции шейки мочевого пузыря у больных ДГПЖ. // Медицинский вестник Башкортостана 2011. N 2. С. 267-271.
27. Al-Waili NS, Butler GJ. Effects of hyperbaric oxygen on inflammatory response to wound and trauma: possible mechanism of action. // The Scientific World Journal. 2006. N 6. P. 425-441.
28. Девятова Н.В., Буравкова Л.Б., Клинико-биохимические показатели крови после 8 сеансов гипербарической оксигенации. // Материалы докладов IV Всеармейской научно-практической конференции с международным участием "Баротерапия в комплексном лечении и реабилитации раненых, больных и пораженных". ВМедА, 24–25 мая 2000 г. СПб: ВМедА, 2000. С. 18. 2000.







