На сегодняшний день радикальная простатэктомия является основным методом лечения локализованного рака предстательной железы (РПЖ) [1]. Смертность от этого заболевания в течение 15 лет с момента выполнения радикальной простатэктомии составляет 7 – 20%. При этом выживаемость без биохимического рецидива заболевания за аналогичный период наблюдений может достигать 75% [2, 3]. Необходимо отметить, что эти данные были получены в результате наблюдения за пациентами, перенесшими открытую радикальную позадилонную простатэктомию (РПП), выполненную в ряде крупных европейских клиник. Однако сегодня в США и странах Западной Европы большинство таких операций выполняется с помощью роботической системы DaVinci [4].
Радикальная простатэктомия, независимо от техники ее выполнения, преследует цель избавления пациента от злокачественного процесса в предстательной железе и является, по сути, онкологической операций. Именно поэтому анализ онкологических результатов операции представляет наибольший интерес для оценки эффективности различных хирургических методик. Существует несколько формальных критериев оценки онкологической эффективности – фиксация позитивного хирургического края (ПХК), биохимический рецидив, общая и раково-специфическая выживаемость [5].
Мы провели сравнительный анализ эффективности радикальной робот-ассистированной простатэктомии (РАРП) и радикальной позадилонной простатэктомии (РПП) по приведенным выше критериям.
МАТЕРИАЛЫ И МЕТОДЫ
В настоящее ретроспективное исследование вошли две группы пациентов с верифицированным локализованным раком предстательной железы, перенесших хирургическое лечение в период с декабря 2008 по декабрь 2013 года, в клинике урологии МГМСУ им. А.И. Евдокимова. Первую группу составили 512 пациентов, которым была выполнена робот-ассистированная радикальная простатэктомия. Вторую группу составил 71 пациент, перенесший радикальную позадилонную простатэктомию. Подробная характеристика пациентов приводится в таблице 1.
На рисунке 1 представлено распределение пациентов согласно исходному баллу злокачественности по системе градации Глисона.
В обеих группах подавляющее большинство пациентов до операции имело балл Глисона 3+3=6 и лишь у 6% пациентов в каждой группе суммарный балл превышал 8 при различном сочетании первичного и вторичного балла.
Основным онкологическим показателем, отражающим распространенность опухолевого поражения, является стадия заболевания по системе TNM. На рисунке 2 приведено распределение больных согласно дооперационно выставленным стадиям заболевания в процентах в обеих исследуемых группах. Не отмечено статистически достоверной разницы этого показателя между группами (р= 0,013).
Таблица 1. Общая характеристика пациентов групп РАРП и РПП, включенных в исследование
| Параметры | Тип операции | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| РАРП – 512 пациентов | РПП – 71 пациент | p | |||||||
| M | N | σ | m | M | N | σ | m | ||
| Возраст (лет) | 61,2 | 512 | 6,211 | 0,275 | 62,211 | 71 | 5,27 | 0,625 | 0,209 |
| Рост (см) | 175,8 | 443 | 6,19 | 0,294 | 175 | 63 | 6,027 | 0,759 | 0,339 |
| Вес (кг) | 84,4 | 443 | 12,37 | 0,588 | 83,889 | 63 | 14,338 | 1,806 | 0,781 |
| Индекс массы тела | 27,3 | 508 | 3,765 | 0,167 | 27,313 | 63 | 3,943 | 0,497 | 0,951 |
| Сумма баллов по шкале IPSS | 9,3 | 469 | 6,822 | 0,315 | 9,215 | 65 | 6,707 | 0,832 | 0,943 |
| Сумма баллов по опроснику QоL | 3,14 | 465 | 1,619 | 0,075 | 3,273 | 66 | 1,641 | 0,202 | 0,533 |
| IIEF (за 1 мес. до госпитализ.) | 16,441 | 431 | 10,124 | 0,488 | 14,5 | 68 | 11,551 | 1,401 | 0,15 |
| Объем предстательной железы (см3) | 41,5 | 510 | 18,62 | 0,824 | 45,8 | 71 | 30,247 | 3,59 | 0,101 |
| Максимальная скорость потока мочи (мл/с) | 14,9 | 378 | 7,149 | 0,368 | 14,9 | 67 | 7,207 | 0,881 | 0,927 |
| ПСА (нг/мл) | 10,6 | 510 | 8,952 | 0,396 | 10,7 | 71 | 8,776 | 1,042 | 0,917 |
| Индекс коморбидности Чарлсона | 2,428 | 511 | 0,895 | 0,040 | 2,827 | 71 | 0,974 | 0,116 | 0,001 |
| Количество перенесенных биопсий | 1,249 | 510 | 0,722 | 0,032 | 1,338 | 71 | 0,755 | 0,09 | 0,334 |
Таблица 2. Распределение больных групп РАРП и РПП по стадиям заболевания, уточненным после выполнения операции
| Стадия | РАРП | РПП | p |
|---|---|---|---|
| Частота диагностики стадии рТ3 (%) | 35,98 | 43,9 | 0,1311 |
| Частота диагностики стадии pT2 (%) | 63,82 | 56,1 | 0,0948 |
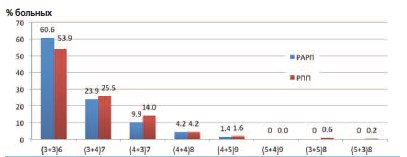
Рис.1. Дооперационные показатели злокачественности рака предстательной железы по шкале Глисона в
группе РАРП и РПП в процентном соотношении
Статистический анализ данных осуществлялся с использованием программы SPSS. С целью проверки корректности применения методов параметрической статистики для всего набора наблюдений рассчитаны коэффициенты ассиметрии и эксцесса. При выполнении условий корректной применимости методов параметрической статистики использовались критерии Пирсона и Стьюдента, в противном случае – критерии Колмагорова-Смирнова и Манна-Уитни. Общая безрецидивная выживаемость пациентов в исследуемых группах вычислялась с применением метода Каплана-Мейера.
РЕЗУЛЬТАТЫ
Распределение больных по стадиям заболевания, уточненным после радикальной простатэктомии, приведено на рисунке 3 и в таблице 2.
Сравнительный анализ послеоперационной стадии заболевания выявил тождественность данных в обеих группах. Это еще раз доказывает тот факт, что не существует формальных онкологических критериев выбора тактики хирургического лечения локализованного РПЖ. Обе сравниваемые хирургические методики могут быть предложены пациенту с раком предстательной железы, признанным локализованным по данным предоперационного обследования. Ограничения касаются лишь пациентов с отягощенным кардиологическим статусом и выраженным спаечным процессом в брюшной полости, при которых имеются противопоказания к выполнению операций трансабдоминальным доступом в условиях пневмоперитонеума.
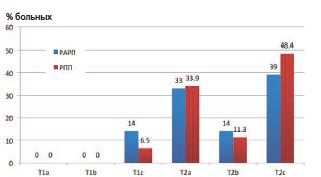
Рис. 2. Дооперационная стадия рака предстательной железы в группах РАРП и РПП в процентном соотношении
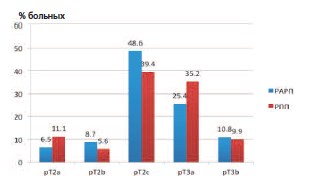
Рис. 3. Распределение больных групп РАРП и РПП по стадиям заболевания, уточненным после выполнения операции
Тазовая лимфаденэктомия (ТЛАЭ) была выполнена примерно трети пациентам независимо от использованной методики операции, т.к. показания к выполнению ТЛАЭ универсальны (табл. 3). Мы выставляем показания к этой операции на основании данных номограммы Партина. Если по данным номограммы вероятность поражения лимфатических менее 2% и признаки тазовой лимфаденопатии при МРТ отсутствуют, лимфаденэктомия не выполнялась. Модифицированная лимфаденэктомия (зона запирательной ямки) выполнялась всем пациентам с вероятностью поражения лимфатических узлов от 2-х до 10%. Расширенная лимфаденэктомия применялась при вероятности поражения, превышающей 10%. Частота поражения регионарных лимфоузлов ( N1) колебалась в пределах 1% от всех выполненных операций, что ожидаемо у пациентов с исходно локализованной формой заболевания. Статистически значимых различий в частоте поражения лимфоузлов в группах РАРП и РПП не обнаружено (p = 0,33).
Несколько менее оптимистичная картина имела место при анализе частоты наличия экстрапростатической инвазии (ЭПИ) и инвазии в семенные пузырьки. Эти данные становятся доступны только через 3-5 суток после выполнения радикальной простатэктомии. Именно столько времени обычно требуется патоморфологу для формулировки заключения. До операции диагноз основывается на результатах МРТ и мультифокальной биопсии предстательной железы, которая не может ответить на вопрос о распространенности опухолевого процесса – в исследуемом материале не содержатся образцы парапростатической ткани. ЭПИ рака предстательной железы зафиксирована у 25,4% пациентов в группе РАРП и 35,2% в группе РПП. Инвазия в семенные пузырьки зафиксирована у 10,8% и 9,9% пациентов в группах РАРП и РПП, соответственно (табл. 4). Данные показатели сопоставимы, статистически значимой разницы между ними нет.
Следующий показатель, который подвергся сравнительному анализу в ходе данной работы – частота позитивного хирургического края и технических дефектов. Мы предлагаем ввести новый термин – «технический дефект» (ТД) в список стандартно описываемых параметров патоморфологического исследования после радикальной простатэктомии. Под «техническим дефектом» мы предлагаем понимать ситуацию, когда имеет место положительный хирургический край при отсутствии ЭПИ в зоне ПХК. При этом у этого же больного ЭПИ может быть в другом месте, и там может определяться или не определяться ПХК. Само понятие ПХК имеет большое значение для прогноза течения заболевания и определения необходимости последующего раково-специфического лечения. К таким вариантам лечения относится назначение гормональной и/или дистанционной лучевой терапии. Не оспаривая этот термин, мы вводим понятие технического дефекта для выявления «качества работы хирурга». Если ПХК имеет место в зоне ЭПИ – то «вины хирурга» в этом нет, т.к. не имея возможности интраоперационного экспрессопределения характеристик тканей на наличие злокачественности, любой хирург имеет шанс допустить ПХК в зоне ЭПИ. Но если ПХК определяется вне зоны ЭПИ, то это «вина» хирурга. В нашей клинике учет количества «технических дефектов» используется с целью совершенствования собственной хирургической техники каждым отдельным специалистом. Если кто-то в своей практике допускает много технических дефектов (больше других), то он должен пересмотреть свое понимание онкологических принципов операции и более бережно выполнять выделение предстательной железы и сосудистонервного пучка (СНП).
На рисунке 4 представлено сравнение частоты ПХК и ТД группах РАРП и РПП. Очевидна закономерность, согласно которой в группе РАРП частота ПХК превышает таковую в группе РПП в два раза, а частота ТД – в три раза (p = 0,002). Треть ПХК в группе РАРП и четверть ПХК в группе РПП располагались в зоне верхушки предстательной железы. Процент апикального ПХК подсчитан относительного общего количества ПХК в каждой группе, а не относительно числа пациентов в группах.
Одним из основных факторов, существенно увеличивающих риск ПХК при РАРП, является необходимость сохранения анатомической целостности сосудисто-нервного пучка (СНП). Мы провели анализ зависимости частоты встречаемости ПХК и степени сохранности сосудисто-нервных пучков в двух группах больных. Степень сохранности СНП мы оценивали на основании заключения патоморфолога, который описывал «отсутствие», «частичное присутствие» и «полноценное присутствие» структурных элементов СНП в препарате удаленной предстательной железы и семенных пузырьков.
В соответствие с этими формальными критериями мы ввели понятия «частичного» и «полного сохранения» СНП. В таблице 5 приведены сведения о количестве пациентов с признаками наличия ПХК при разной степени сохранности СНП в обеих исследуемых группах в процентах. Необходимо отметить, что общее количество пациентов в этой таблице несколько меньше, чем общее количество больных в каждой из исследуемых групп. Причина этого – отсутствие данных о СНП в заключении патоморфолога у 37 больных группы РАРП и двух больных – группы РПП. Очевидно, что независимо от степени сохранения пучков, ПХК в 2,5 – 4 раза реже определялся в группе РПП. Логично предположить, что более тщательное сохранение СНП может быть фактором риска ПХК. При этом известно, что сохранение СНП является крайне важным позитивным прогностическим фактором и приводит к существенному увеличению доли пациентов с реабилитированной эректильной функцией и быстрым восстановлением удержания мочи.
Таблица 3. Частота выполнения ТЛАЭ и выявления N1 в группах РАРП и РПП
| Операция | Выполнена ТЛАЭ | Имеется N1 |
|---|---|---|
| РАРП | 182 (35,5%) | 5 (0,98%) |
| РПП | 27 (38%) | 1 (1,4%) |
| р | 0,86 | 0,09 |
Таблица 4. Частота с ЭПИ и распространение опухоли на семенные пузырьки в
группах РАРП и РПП
| Степень инвазии | РАРП | РПП | p |
|---|---|---|---|
| Экстрапростатическая инвазия | 130 (25,4%) | 25 (35,2%) | 0,18 |
| Инвазия в семенные пузырьки | 55 (10,8%) | 7 (9,9%) | 0,62 |
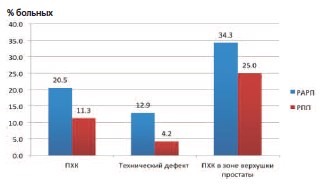
Рис. 4. Частота ПХК и ТД у пациентов в группах РАРП и РПП в процентах
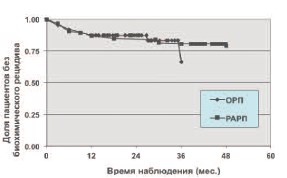
Рис. 5. Кривая Каплана-Мейре, отражающая безрецидивную выживаемость у пациентов после РАРП и РПП
Мы изучали частоту биохимических рецидивов рака предстательной железы, выявленных в результате ежеквартального контроля уровня ПСА сыворотки крови после операции, проводившегося у всех без исключения пациентов. Медиана наблюдения составила в группе РАРП 38,9 мес (max 63,9), в группе РПП – 22,6 мес (max 46). Согласно решению международного консенсуса, биохимическим рецидивом после хирургического лечения считается повышение ПСА ≥ 0,2 нг/мл как минимум в двух последовательно выполненных измерениях. В таблице 6 приведены данные по частоте биохимического рецидива в обеих исследуемых группах.
Последним и наиболее важным критерием, оценивающим эффективность лечения пациентов с локализованным раком предстательной железы, включенным в наше исследование, стал анализ выживаемости. На основании анализа данных общей выживаемости и данных частоты биохимического рецидива построены оценки кривых функций выживаемости в группах РАРП и РПП за 4-летний период (рис. 5).
Визуальный анализ графического представления функций выживаемости, построенных по методу Каплана-Мейера, показывает расположение кривых выживаемости, приближающееся к параллельному, в когортах РАРП и РПП, что свидетельствует о незначимых ежегодных колебаниях уровня смертности в данных группах и идентичности онкологического результата лечения.
Анализируя данные приведенного графика Каплана-Мейера и таблицы 7, следует признать тождественность онкологических результатов у больных, перенесших радикальную робот-ассистированную простатэктомию и радикальную позадилонную простатэктомию.
Таблица 5. Количество пациентов с ПХК в группах РАРП и РПП при разной степени сохранения СНП
| Степень сохранения СНП |
РАРП (n=475) | РПП (n=69) | ||
|---|---|---|---|---|
| Количество пациентов (%) |
ПХК, n(%) |
Количество пациентов (%) |
ПХК, n(%) |
|
| Без сохранения | 187 (39,6%) | 46 (24,6%) | 37 (53,5%) | 5 (13,5%) |
| Частичное | 93 (19,6%) | 16 (17,2%) | 21 (30,4%) | 2 (9,5%) |
| Полное | 195 (41,1%) | 40 (20,5%) | 11 (15,9%) | 1 (9,1%) |
Таблица 6. Характеристики пациентов группы РАРП и РПП, с выявленным биохимическим рецидивом
| РАРП | РПП | |
|---|---|---|
| Медиана наблюдения (мес.) | 38,9 | 22,6 |
| Максимальный период наблюдения (мес.) | 63,9 | 46 |
| Среднее время до развития б/х рецидива (мес.) | 12,0 | 12,0 |
| Медиана времени развития б/х рецидива (мес.) | 9,0 | 9,0 |
| Доля пациентов с б/х рецидивом за период наблюдения | 21,9 % | 15,9 % |
Таблица 7. Данные по БХР и продолжительности жизни после операции в группах РАРП и РПП
| Тип операции | Тип операции | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| РАРП – 512 пациентов | РПП – 71 пациент | p | |||||||
| M | N | σ | m | M | N | σ | m | ||
| Б/х рецидив (мес.) | 2,6 | 204 | 6,86 | 0,48 | 1,85 | 65 | 6,04 | 0,749 | 3,765 |
| Продолжительность жизни после операции (мес.) | 19 | 9 | 11,9 | 3,97 | 14 | 1 | 7,4 | 1,88 | 1,27 |
Общая выживаемость пациентов за период наблюдения составила 98,2% в группе РАРП и 98,6% – в группе РПП. Причины смерти приведены в таблице 8. Обращает на себя внимание, что ни у одного из пациентов причиной смерти не стал рак предстательной железы.
Наиболее частая причина летальных исходов – сердечно-сосудистые заболевания и, в частности, инфаркт миокарда. Нам не удалось выявить связи между баллом по шкале Глисона, стадией заболевания, уровнем ПСА и возрастом с причиной смерти и продолжительности жизни после операции.
С учетом вышеизложенного, раковоспецифическая выживаемость по нозологии «рак предстательной железы» за время наблюдения в обеих группах может быть признана 100%.
ОБСУЖДЕНИЕ
Данные мировой литературы, касающиеся онкологических результатов робот-ассистированной радикальной простатэктомии, крайне скудны. Лишь в нескольких работах представлены данные о 5-летней частоте биохимического рецидива. В двух работах продолжительность периода наблюдений составила более 60 месяцев [6, 7]. В исследование М. Menon и соавт. было включено 1384 пациента. Частота безрецидивной выживаемости спустя 3-5 и 7 лет наблюдения после выполнения РАРП составила 90%, 87% и 81% соответственно. Авторы установили, что уровень ПСА, сумма баллов по шкале Глисона, наличие периневральной инвазии и степень риска по шкале D'Amico являются независимыми прогностическими факторами биохимического рецидива. D.B. Samadi и соавт., и К.С. Zorn и соавт. в своих работах продемонстрировали, что риск биохимического рецидива не меняется в процессе приобретения опыта хирургом [8, 9]. Недостатком обеих работ является небольшой период наблюдения за больными.
Наличие ПХК является известным фактором риска для развития рецидива заболевания [5]. Сторонники роботической хирургии говорят о более качественном онкологическом контроле при выполнении РАРП благодаря улучшенной 3D визуализации [10, 11], что особенно ярко проявляется при апикальной диссекции. Частота позитивного хирургического края варьировала от 6,5% до 32%, со средним значением равным 15%. Следует отметить, что во многих исследованиях не указывается конкретный протокол, согласно которому получают гистологический материал для исследования. Между тем используемая методика изготовления препаратов является одним из тех факторов, которые влияют на частоту выявления позитивного хирургического края. Среднее значение позитивного края для стадии рТ2 равнялось 9% (4-23%), 37% (29%-50%) – для стадии рТ3 и 50% – для стадии рТ4. На долю верхушки предстательной железы пришлось 5% случаев (1-7%), передней поверхность – 0,6% (0,2 – 2%) случаев, шейки мочевого пузыря – 1,6% случаев (1-2%), заднелатеральной поверхности предстательной железы – 2,6% (2 – 21%). Мультифокальный положительный хирургический край встречался в 2,2% случаев (2-9%) [10, 11, 13].
Несколько исследований посвящены предполагаемым факторам риска образования ПХК. В одном из наиболее крупных исследований, проведенном V. Ficcara и соавт., изучались факторы риска позитивного края у группы из 322 пациентов [12]. Единственными клиническими прогностическими факторами любого варианта позитивного хирургического края являлись объем предстательной железы и стадия опухоли. Обширное исследование V.R. Patel и соавт., в которое вошло более 8000 пациентов, в том числе более 1200 пациентов с позитивным хирургическим краем подтверждает полученные V. Ficarra и соавт. данные [12, 14].
A.E. Krambeck и соавт. был оценен риск развития биохимического рецидива после радикальной простатэктомии в течение 1-43 лет после операции. Он составил 83,5-92,2% для РАРП и 84-92,4% для РПП [15]. Это полностью совпадает с полученными нами данными. Единственная работа, в ходе которой было отмечено различие в частоте возникновения биохимического рецидива, было исследование, проведенное K.L. Lo и соавт. [16]. Авторы обнаружили наличие биохимического рецидива в 20% случаев пациентов после РПП (срок наблюдения 42 месяца), по сравнению с отсутствием рецидива в группе РАРП (срок наблюдения 6 месяцев). Однако принимая во внимание различный период наблюдения и столь короткий временной отрезок после РАРП, авторы не смогли выполнить достоверную статистическую обработку результатов. Анализ сравнительных работ, посвященных изучению частоты безрецидивной выживаемости после перенесенных РАРП и РПП не выявил статистически значимых различий между роботической и открытой техниками простатэктомии [13, 15].
Таблица 8. Характеристика пациентов, умерших в группе РАРП и РПП за время наблюдения с указанием причины смерти
| № | Группа | Возраст (операция/ смерть) |
ПСА до операции |
Стадия рТ |
Балл Глисона |
Продолжит. жизни после операции |
Причина смерти |
|---|---|---|---|---|---|---|---|
| 1 | РАРП | 67/68 | 7,25 | Т2с | 3+3=6 | 14 | Инфаркт миокарда |
| 2 | РАРП | 60/62 | 12,19 | Т2с | 3+3=6 | 26 | ССЗ |
| 3 | РАРП | 67/68 | 9,5 | Т3а | 3+4=7 | 12 | ССЗ |
| 4 | РАРП | 55/59 | 7,1 | Т2b | 3+3=6 | 44 | Рак легких |
| 5 | РАРП | 61/62 | 8,2 | Т3а | 3+4=7 | 15 | ТЭЛА на фоне рака прямой кишки |
| 6 | РАРП | 64/64 | 8,1 | Т2с | 3+4=7 | 5 | Инфаркт миокарда |
| 7 | РАРП | 62/63 | 9,43 | Т2с | 4+3=7 | 12 | Рак желудка |
| 8 | РАРП | 64/66 | 9,5 | Т2с | 3+4=7 | 22 | Рак кишечника |
| 9 | РАРП | 67/69 | 7,18 | Т2b | 4+3=7 | 26 | Рак легких |
| 1 | РПП | 63/65 | 6,25 | Т2с | 3+3=6 | 14 | ССЗ |
| 2 | РПП | 67/69 | 7,3 | Т2с | 4+3=7 | 15 | Инфаркт миокарда |
* CCЗ – сердечно-сосудистые заболевания
ВЫВОДЫ
Радикальная простатэктомия была и остается золотым стандартом хирургического лечения локализованного рака предстательной железы. Появление робот-ассистированной методики ее выполнения, существенно улучшившей функциональные результаты этой операции, не оказало значительного влияния на онкологические результаты. По данным анализа современной литературы и нашим собственным данным следует констатировать, что независимо от техники выполнения – позадилонной или робот-ассистированной, радикальная простатэктомия обеспечивает высокий онкологический результат и удовлеторительные показатели безрецидивной и раково-специфической выживаемости.
ЛИТЕРАТУРА
- Heidenreich A, Bellmunt J, Bolla M, Joniau S, Mason M, Matveev V, Mottet N, Schmid HP, van der Kwast T, Wiegel T, Zattoni F EAU guidelines on prostate cancer. Part 1: screening, diagnosis, and treatment of clinically localised disease. // Eur Urol. 2011. Vol. 59. P. 61–71.
- Wilson T, Torrey R. Open versus robotic-assisted radical prostatectomy: which is better? // Curr Opin Urol. 2011. Vol. 21. N. 3. P. 200-205.
- Boorjian SA, Eastham JA, Graefen M, Guillonneau B, Karnes RJ, Moul JW, Schaeffer EM, Stief C, Zorn KC. A critical analysis of the long-term impact of radical prostatectomy on cancer control and function outcomes. // Eur Urol. 2012. Vol. 61. P. 664–675.
- Mottrie A, De Naeyer G, Novara G, Ficarra V. Robotic radical prostatectomy: a critical analysis of the impact on cancer control. // Curr Opin Urol. 2011. Vol. 21. P. 179–184.
- Pfitzenmaier J, Pahernik S, Tremmel T, Haferkamp A, Buse S, Hohenfellner M. Positive surgical margins after radical prostatectomy: do they have an impact on biochemical or clinical progression? // BJU Int. 2008. Vol. 102. P. 1413– 1418.
- Menon M, Bhandari M, Gupta N, Lane Z, Peabody JO, Rogers CG, Sammon J, Siddiqui SA, Diaz M. Biochemical recurrence following robot-assisted radical prostatectomy: analysis of 1384 patients with a median 5-year follow-up. // Eur Urol. 2010. Vol. 58. P. 838–846.
- Suardi N, Ficarra V, Willemsen P, De Wil P, Gallina A, De Naeyer G, Schatteman P, Montorsi F, Carpentier P, Mottrie A. Long-term biochemical recurrence rates after robot-assisted radical prostatectomy: analysis of a single-center series of patients with a minimum followup of 5 years. // Urology. 2012. Vol. 79. P. 133–138.
- Samadi DB, Muntner P, Nabizada-Pace F, Brajtbord JS, Carlucci J, Lavery HJ. Im-provements in robot-assisted prostatectomy: the effect of surgeon experience and tech-nical changes on oncologic and functional outcomes. // J Endourol. 2010. Vol. 24. P. 1105–1110.
- Zorn KC, Wille MA, Thong AE, Katz MH, Shikanov SA, Razmaria A, Gofrit ON, Zagaja GP, Shalhav AL. Continued improvement of perioperative, pathological and continence outcomes during 700 robot-assisted radical prostatectomies. // Can J Urol. 2009. Vol. 16. P. 4742–4749.
- Tewari A, Srivasatava A, Menon M. A prospective comparison of radical retropubic and robot-assisted prostatectomy: experience in one institution. // BJU Int. 2003. Vol. 92. P. 205–210.
- Smith Jr JA, Chan RC, Chang SS, S. D. Herrell, P. E. Clark, R. Baumgartner and M. S. Cookson. A comparison of the incidence and location of positive surgical margins in robotic assisted laparoscopic radical prostatectomy and open retropubic radical prostatectomy. // J Urol. 2007. Vol. 178. P. 2385–2389. discussion 2389–2390.
- Ficarra V, Novara G, Secco S, D'Elia C, Boscolo-Berto R, Gardiman M, Cavalleri S, Artibani W. Predictors of positive surgical margins after laparoscopic robot assisted radical prostatectomy. // J Urol. 2009. Vol. 182. P. 2682–2688.
- Ofer Yossepowitch, Alberto Briganti, James A. Eastham, Jonathan Epstein, Markus Graefen, Rodolfo Montironi, Karim Touijer. Positive Surgical Margins After Radical Prostatectomy: A Systematic Review and Contemporary Update. // Eur Urol. 2014. V. 65. P. 303-313.
- Patel VR, Coelho RF, Rocco B, Orvieto M, Sivaraman A, Palmer KJ, Kameh D, Santoro L, Coughlin GD, Liss M, Jeong W, Malcolm J, Stern JM, Sharma S, Zorn KC, Shikanov S, Shalhav AL, Zagaja GP, Ahlering TE, Rha KH, Albala DM, Fabrizio MD, Lee DI, Chauhan S. Positive surgical margins after robotic assisted radical prostatectomy: a multi-institutional study. // J Urol. 2011. Vol. 186. P. 511–516.
- Krambeck AE, DiMarco DS, Rangel LJ Bergstralh EJ, Myers RP, Blute ML, Gettman MT.. Radical prostatectomy for prostatic adenocarcinoma: a matched comparison of open retropubic and robot-assisted techniques. // BJU Int. 2009. Vol. 103. P. 448–453.
- Lo KL, Ng CF, Lam CN, Hou SS, To KF, Yip SK. Short-term outcome of patients with robot-assisted versus open radical prostatectomy: for localised carcinoma of prostate. // Hong Kong Med J. 2010. Vol. 16. P. 31–35.







