ВВЕДЕНИЕ
Хронические заболевания почек, а также последствия тяжелого острого повреждения почек, в конечном итоге могут привести к развитию хронической почечной недостаточности (ХПН) с прогрессированием до терминальной стадии, требующей органозамещающей терапии (хронический диализ или трансплантация почки). В связи с этим актуальной задачей является изучение возможности остановки или торможения прогрессивной утраты функции почек. Современные возможности терапии ХПН весьма ограничены и, хотя несколько и замедляют, но не позволяют остановить прогрессирование заболевания [1, 2]. Регенеративная медицина предлагает несколько подходов к решению данной задачи, включая терапию с использованием стволовых/прогениторных клеток разного происхождения, в том числе индуцированных плюрипотентных клеток, а также продуктов их секреции (секретома), выделенных из самих клеток или из среды их культивирования. Многими экспериментальными исследованиями на животных показана целесообразность использования низкодифференцированных клеток для терапии острого или хронического повреждения почек [3-5]. Тем не менее, ряд вопросов клинической безопасности этого метода остается открытым, в частности, возможность развития иммунной реакции на аллогенные или ксеногенные клетки, опасность тромбоэмболии легочной артерии при внутривенном введении суспензии клеток, нежелательная дифференцировка мезенхимных клеток в костную, хрящевую или жировую ткань, а также риск развития тератом при использовании плюрипотентных клеток [6-8]. В связи с этим более перспективным направлением в настоящее время может считаться использование продуктов секреции эмбриональных стволовых клеток (cell-free cell therapy), как более безопасного варианта терапии, не имеющего юридических и этических ограничений [9-11].
В ранее проведенных исследованиях нами было показано, что терапия ксеногенным протеомным комплексом (фракционированный секретом ксеногенных эмбриональных стволовых и прогениторных клеток, полученный хроматографическим методом из головного мозга свиней) оказывает выраженный нефропротективный эффект при моделировании острой постишемической почечной недостаточности [12, 13], а также уменьшает риск перехода острого повреждения почек в хроническую болезнь почек [14]. В данном исследовании мы изучили влияние этого комплекса на течение хронической болезни почек на модели пострезекционной ХПН у крыс.
МАТЕРИАЛЫ И МЕТОДЫ
Опыты проведены на 45 аутбредных крысах-самцах массой 200-240 г. Животные содержались в стандартных условиях вивария с неограниченным доступом к полнорационному брикетированному комбикорму для лабораторных грызунов (рецептура ПК-120, ООО «Лабораторкорм», Россия) и питьевой воде. Все манипуляции с животными выполняли в соответствии с Европейской конвенцией о защите животных, используемых для экспериментов или в иных научных целях (ETS N 123) и Директивой Европейского парламента и Совета Европейского Союза 2010/63/ЕС о защите животных, использующихся для научных целей.
У крыс моделировали ХПН путем односторонней нефрэктомии и резекции верхнего и нижнего полюсов оставшейся почки, что приводило к уменьшению массы функционирующей паренхимы почек в среднем на 80%. Анестезию вызывали внутрибрюшинным введением смеси Золетила-100 («Valdefarm», Франция) и Рометара («Биовета», Чешская республика) в соотношении 1:1 при расчетной дозе Золетила 15 мг/кг.
Животных наблюдали в течение 7 дней после операции, после чего брали пробы крови из хвостовой вены и суточной мочи для подтверждения формирования ХПН, что определяли по повышению концентрации креатинина, мочевины и активности ферментов в крови и моче. Значения этих показателей служили ориентиром для определения динамики развития патологического процесса и влияния на него проводимой терапии. После этого животных включали в исследование и начинали отсчет контрольных сроков с 8 дня после моделирования ХПН.
Проведено 5 серий экспериментов. В 1-й серии (контроль, 10 крыс) никакой терапии не проводили. Начиная с 8 дня после моделирования ХПН, во 2-4-й сериях (по 10 крыс в каждой) проводили терапию в различных режимах фракционированным ксеногенным секретомом эмбриональных стволовых и прогениторных клеток (ССПК), представляющим собой протеомный комплекс с молекулярной массой компонентов от 10 до 250 кДа, хроматографически выделенный из головного мозга эмбрионов свиней и являющийся активным компонентом фармакопейного препарата Целлекс (АО «Фарм-Синтез», Россия). Во 2-й серии ССПК вводили внутрибрюшинно курсами (2 курса по 10 дней с 10-дневным перерывом между курсами) с ежедневными инъекциями в дозе 0,1 мл препарата на крысу (0,1 мг действующего компонента). В 3-й серии длительность первого курса увеличили до 20 дней, а второй курс проводили, как и во 2-й серии. В 4-й серии осуществляли непрерывную терапию ССПК в течение 30 дней. Пятую серию составили 5 интактных крыс.
Эффективность различных вариантов терапии ССПК оценивали по биохимическим показателям крови и мочи. С этой целью в начале терапии и через 30 и 60 дней крыс высаживали в обменные клетки для сбора суточной мочи с оценкой диуреза и брали пробы крови из хвостовой вены. Схематически дизайн исследования представлен на рисунке 1.
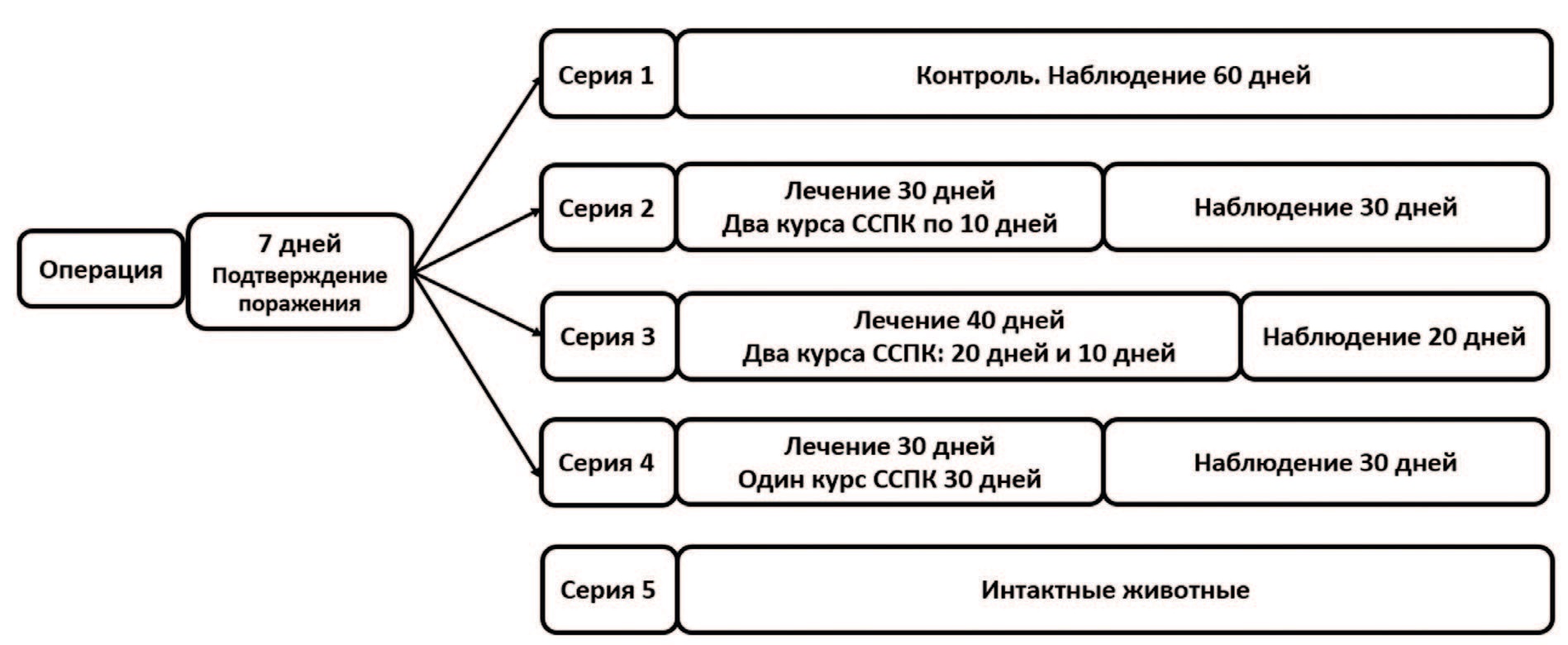
Рис. 1. Схема дизайна исследования
Fig. 1. The design scheme of the study
В крови и моче на автоматическом биохимическом анализаторе ADVIA-2000 (Siemens) с использованием стандартных наборов реактивов определяли следующие показатели: концентрацию мочевины, креатинина, натрия, калия, кальция, а также активность ряда ферментов (aспартатаминотрансфераза – АСТ, aланинаминотрансфераза – АЛТ, лактатдегидрогеназа – ЛДГ, щелочная фосфатаза – ЩФ). Из полученных данных рассчитывали показатели функционального состояния почек: скорость клубочковой фильтрации, канальцевую реабсорбцию натрия и кальция, суточную экскрецию ферментов с мочой по общепринятым формулам расчета.
В пробах крови, взятых через 2 месяца после начала эксперимента, методом сверхпроизводительной жидкостной хроматографии (UPLC) с МС/МС детекцией на аппарате ACQUITY UPLC (Waters) определили концентрацию характерных для ХПН нейротоксических метаболитов: 3-индоксил сульфата и р-толил сульфата.
Через 1 и 2 месяца по 5 животных из каждой группы выводили из эксперимента путем передозировки наркотических веществ. У них удаляли почки и проводили определение их массы взвешиванием на электронных весах Acculab (Sartorius) с целью оценки выраженности компенсаторной гипертрофии органа.
Статистическую обработку цифрового материала провели с помощью программ Excel 2003 и Statistica 10,0 с определением среднегрупповых значений показателей и ошибки средней (M±m) и достоверности различий между сравниваемыми группами по критерию t Стьюдента. Значимыми различия признавали при значениях р<0,05.
РЕЗУЛЬТАТЫ
Для оценки динамики развивающейся компенсаторной гипертрофии единственной резецированной почки сравнивали ее массу через 1 и 2 месяца после моделирования ХПН с массой обеих почек интактных животных, а также с массой, резецированной в аналогичных условиях почки. Средние значения массы обеих почек интактных крыс составили 2,75±0,02 г, а масса почки после резекции ее полюсов – 0,54±0,03 г, что соответствовало 19,6% от массы обеих почек в норме. Через месяц у крыс 1-4 серий отмечен рост массы оставшейся почки, причем у получавших терапию ССПК – достоверно больший, чем в контрольной серии. В процентном отношении от исходного показателя масса почек составила: в 1-й (контрольной) серии – 61,4%; во 2-й серии – 68,7%; в 3-й серии – 71,2% и в 4-й серии – 70,2%, а относительно контрольной группы – увеличение составило 11,8% – 16,0% соответственно. Прирост массы органа в течение первого месяца, отражающий интенсивность процесса компенсаторной гипертрофии, оказался достоверно выше (p<0,05) во всех опытных группах, по сравнению с контрольной серией опытов, тогда как между группами с разными вариантами терапии ССПК достоверных различий не выявили. Это свидетельствует, что терапия ССПК стимулирует регенерационные процессы в органе, способствуя более быстрому восстановлению его паренхимы (табл. 1).
Таблица 1. Влияние разных режимов терапии ССПК на увеличение массы единственной почки (в граммах) через 1 и 2 месяца после ее резекции
Table 1. The effect of SSPC therapy in different modes on the increase in the mass of a single kidney (in grams) 1 and 2 months after its resection
| Серия / Срок Series / Term |
1 месяц 1 month |
2 месяца 2 months |
|---|---|---|
| Серия 1 (контроль) Series 1 (control) |
1,69±0,03 | 1,36±0,09 |
| Серия 2 Series 2 |
1,89±0,06* (+11,8%) | 1,60±0,06* (+17,6%) |
| Серия 3 Series 3 |
1,96±0,04* (+16,0%) | 1,72±0,04* (+26,5%) |
| Серия 4 Series 4 |
1,93±0,03* (+14,2%) | 1,67±0,03* (+22,8%) |
Через 2 месяца во всех сериях (кроме интактной) масса оставшейся почки достоверно уменьшалась по сравнению с первым месяцем, достигнув от нормального уровня 49,5%, 58,2%, 62,5% и 60,7% в 1-4 сериях, соответственно. Уменьшение массы почки в течение второго месяца, отмеченное во всех сериях опытов, может быть связано с процессом склерозирования, что характерно для прогрессирования ХПН. Однако, несмотря на это, масса органа во всех опытных сериях, по-прежнему, оставалась статистически достоверно выше (p<0,05), чем в контроле на 17,6-26,5% (табл. 1).
При оценке динамики показателей, характеризующих выделительную функцию почек, выявили, что через 7 дней после моделирования ХПН у животных наступали характерные для этого состояния изменения в виде полиурии и повышения концентрации мочевины и креатинина в крови. К 30-м суткам наблюдения полиурия и концентрация мочевины продолжали возрастать, а уровень креатинина крови снижался (p<0,05), но оставался достоверно выше нормальных значений, что свидетельствовало об определенной тенденции к компенсации развившихся функциональных нарушений. К 60-м суткам наблюдения все показатели оставались стойко повышенными (табл. 2).
Таблица 2. Показатели функционального состояния почек интактной и опытных серий крыс
Table 2. The effect of SSPC therapy on the indicators of the functional state of the kidneys of rats with CRF
| Показатели Parameters |
Норма Normal | 7 дней ХПН (1-4 серии) 7 days CRF1-4 Series |
Серии опытов Series |
Терапия ССПК / SCS therapy | |
|---|---|---|---|---|---|
| 30 дней 30 days |
60 дней 60 days |
||||
| Диурез, мл/сут Diuresis, ml/day |
11,3±0,2 | 14,3±0,3 | 1-я | 27,5±0,7 | 28,5±0,6 |
| 2-я | 29,5±0,7 | 24,7±0,5* | |||
| 3-я | 25,6±0,5 | 21,4±0,4* | |||
| 4-я | 23,6±0,5 | 22.9±0,5* | |||
| Мочевина крови, ммоль/л Urea, mmol/l |
6,8±0,2 | 8,9±0,3 | 1-я | 13,6±0,7 | 11,5±0,4 |
| 2-я | 13,3±0,4 | 10,5±0,3 | |||
| 3-я | 11.4±0,6 | 9,7±0,3* | |||
| 4-я | 9,8±0,6* | 10.0±0,3* | |||
| Креатинин крови, ммоль/л Creatinine, mmol/l |
60±2 | 112±7 | 1-я | 80±3 | 82±4 |
| 2-я | 81±2 | 73±3 | |||
| 3-я | 76±2 | 71±3 | |||
| 4-я | 71±2 | 74±3 | |||
| СКФ, мл/мин Glomerular filtration rate, ml/min |
1,64±0,07 | 0,73±0,03 | 1-я | 1,11±0,02 | 0,77±0,02 |
| 2-я | 1,12±0,03 | 1,14±0,03*** | |||
| 3-я | 1,36±0,03* | 1,22±0,03*** | |||
| 4-я | 1,48±0,04** | 1,45±0,03*** | |||
| Канальцевая реабсорбция Na+, % Tubular reabsorption of Na+, % |
99,32±0,04 | 98,64±0,21 | 1-я | 98,75±0,14 | 98,82±0,13 |
| 2-я | 99,03±0,05 | 98,89±0,15 | |||
| 3-я | 98,92±0,11 | 99,01±0,11 | |||
| 4-я | 99,14±0,11 | 99,06±0,14 | |||
| Канальцевая реабсорбция Ca++, % Tubular reabsorption of Ca++, % |
99,68±0,04 | 97,19±0,36 | 1-я | 96,19±0,09 | 98,28±0,04 |
| 2-я | 98,51±0,11*** | 98,60±0,05 | |||
| 3-я | 98,35±0,13*** | 98,78±0,09* | |||
| 4-я | 98,67±0,13*** | 98,95±0,11* | |||
Примечание: достоверность различий по сравнению с 1-й серией: *p<0,05, **p<0,01, ***p<0,001
Note: the reliability of the differences compared to the 1-st series: *p<0.05, **p<0.01, ***p<0.001
Терапия ССПК в различных вариантах при сроке 30 суток после начала терапии не привела к достоверным изменениям диуреза и уровня креатинина крови, хотя выявлялась тенденция к уменьшению степени полиурии и гиперкреатининемии в сериях с более длительной терапией ССПК (20-дневный первый курс и непрерывная 30-дневная терапия в 3-й и 4-й сериях). В отношении уровня мочевины крови во 2-й серии изменений не выявили, в 3-й серии обнаружили тенденцию к снижению этого показателя, а у крыс 4-й серии концентрация мочевины достоверно снизилась.
Через 60 дней наблюдения в опытах с терапией ССПК во всех сериях наблюдали достоверное уменьшение выраженности полиурии и достоверное уменьшение уровня мочевины крови в 3-й и 4-й сериях, тогда как средние значения концентрации креатинина в крови во всех опытных группах достоверно не отличались от значений в контрольной серии, хотя тенденция к более низким значениям сохранялась (табл. 2).
Определение расчетных показателей функционального состояния почек показало, что скорость клубочковой фильтрации (СКФ), характеризующая состояние фильтрационной функции, в контрольной серии опытов через 7 дней после резекции единственной почки уменьшалась до 45% от нормальных значений (табл. 2). Через 30 суток отмечено некоторое возрастание СКФ до 67% от нормы, но через 60 дней СКФ вновь снизилась до 47% от нормы. В сериях с терапией ССПК через 30 суток после моделирования ХПН во 2-й серии значения СКФ не отличались от показателей в контрольной серии, тогда как в 3-й и 4-й сериях отмечены достоверно более высокие значения. Через 60 суток во всех опытных сериях значения СКФ были достоверно выше, чем в контроле, оставаясь примерно на том же уровне, что и через 30 суток (рис. 2).
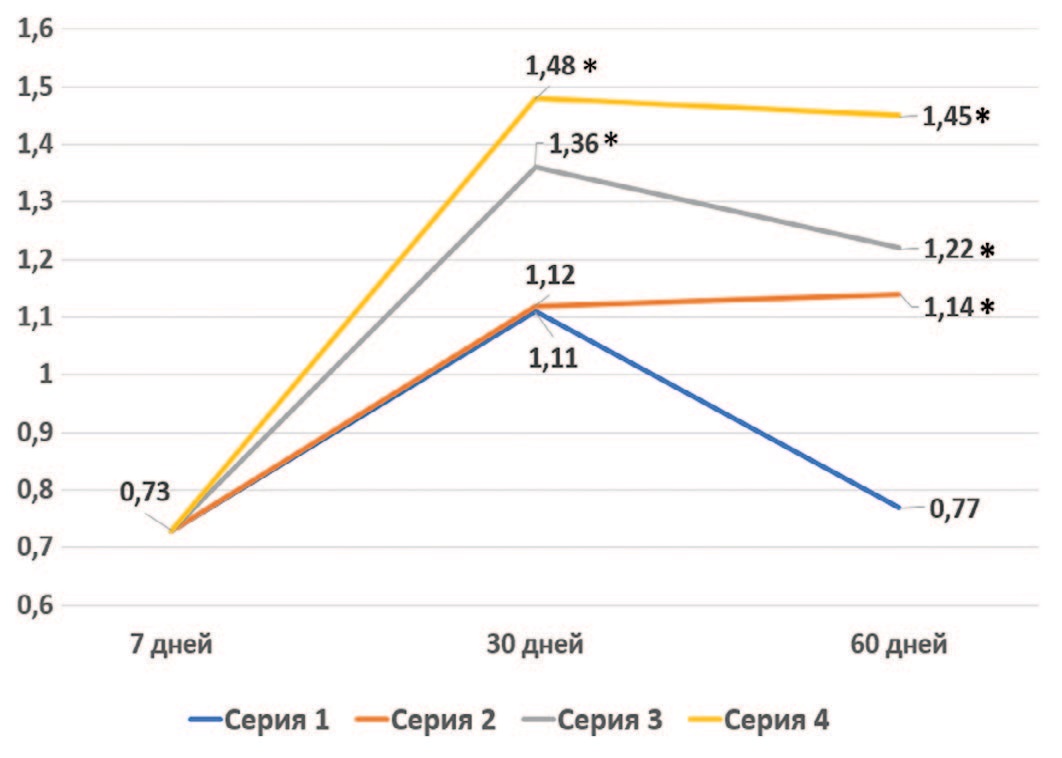
Рис. 2. Динамика СКФ в опытных группах
Fig. 2. Dynamics of glomerular filtration rate in the studied series
Оценка влияния ССПК на состояние канальцевого аппарата почек показала, что все варианты терапии достоверно не изменяли показатели канальцевой реабсорбции натрия. Как в контрольной, так и во всех опытных сериях этот показатель сохранялся на стабильно сниженных значениях, как через 30, так и через 60 суток. В то же время в отношении реабсорбции кальция в почечных канальцах выявили статистически значимое положительное влияние всех вариантов терапии ССПК. Если в контроле отмечали снижение этого показателя через 30 суток после моделирования ХПН с его возрастанием к 60 суткам (но оставаясь ниже нормальных значений), то при терапии ССПК во всех сериях опытов через 30 суток реабсорбция кальция оказалась достоверно выше, чем в контроле, а через 60 суток достоверные различия сохранялись в 3-й и 4-й сериях.
Показателем выраженности повреждения клеток почки может служить активность ферментов в крови и моче. Определение уровня ферментемии показало, что через 7 суток после моделирования ХПН активность всех ферментов, за исключением АЛТ, в среднем по опытным сериям, достоверно возрастала (р<0,05- p<0,01) (табл. 3). В определенной степени это могло быть связано с последствиями операционной травмы (резекция почки), но свой вклад могут также вносить влияния остро возникшей гиперфункции единственной резецированной почки, о чем свидетельствуют данные, полученные в более позднем периоде. В контрольной серии опытов через 30 суток наблюдения ранее повышенная активность ЛДГ и ЩФ снижалась до практически нормальных значений (различия с нормальными показателями статистически недостоверны). При этом активность АСТ сохранялась на повышенных значениях, а ранее нормальная активность АЛТ достоверно возрастала. Через 60 суток наблюдения отмечали возрастание активности в крови ЛДГ и АСТ, тогда как активность АЛТ и ЩФ оставалась на значениях, близких к норме.
Таблица 3. Влияние терапии ССПК на уровень ферментемии у крыс с моделированной ХПН
Table 3. Effect of SSPC therapy on the level of enzymemia in rats with CRF
| Показатели Parameters |
Норма Normal |
7 дней ХПН (1-4 серии) 7 days CRF (1-4 Series) |
Серии опытов Series |
Терапия ССПК / SCS therapy | |
|---|---|---|---|---|---|
| 30 дней 30 days |
60 дней 60 days |
||||
| АСТ, МЕ/л AST, ME/l |
68±2 | 140±28 | 1-я | 85±5 | 90±3 |
| 2-я | 87±8 | 78±5 | |||
| 3-я | 75±7 | 77±6 | |||
| 4-я | 79±8 | 74±5* | |||
| АЛТ, МЕ/л ALT, ME/l |
36±3 | 34±3 | 1-я | 58±4 | 42±3 |
| 2-я | 37±3* | 38±3 | |||
| 3-я | 34±3* | 33±2 | |||
| 4-я | 42±3* | 39±3 | |||
| ЛДГ, МЕ/л LDH, ME/l |
320±22 | 569±35 | 1-я | 378±26 | 928±57 |
| 2-я | 313±18 | 339±29** | |||
| 3-я | 239±17* | 276±23*** | |||
| 4-я | 261±15* | 293±19*** | |||
| ЩФ, МЕ/л Alkaline phosphatase (AF), ME/l |
169±8 | 256±17 | 1-я | 172±15 | 190±13 |
| 2-я | 253±24 | 180±11 | |||
| 3-я | 207±14 | 173±15 | |||
| 4-я | 239±18 | 151±13 | |||
Примечание: достоверность различий по сравнению с 1-й серией: *p<0,05, **p<0,01, ***p<0,001
Note: the reliability of the differences compared to the 1-st series: *p<0.05, **p<0.01, ***p<0.001
В опытах с разными вариантами терапии ССПК через 30 суток активность АСТ и ЛДГ существенно снижалась, как и в контрольной серии, но в отношении ЛДГ в 3-й и 4-й сериях снижение было более выражено, чем в контроле, достигая нормальных значений, а в отношении АСТ различий между контрольной и всеми опытными сериями не получено (табл. 3). Активность АЛТ в крови у крыс всех опытных серий нормализовалась, в отличие от контроля, а активность ЩФ во всех опытах оказалась близкой к норме или нормальной.
Через 60 суток терапия ССПК оказала положительное влияние на активность АСТ, которая оказалась достоверно ниже в 4-й серии опытов, не отличаясь от нормальных значений, а также в отношении активности ЛДГ, которая, в отличие от контрольной серии, нормализовалась во всех опытных группах.
В отличие от уровня ферментемии, повышенного в ранние сроки формирования ХПН, активность всех изучаемых ферментов в моче снижалась в большей или меньшей степени, что, видимо, было связано с уменьшением клеточной массы органа при развитии полиурии. Для объективизации степени повреждения клеток почки мы рассчитывали суточную экскрецию ферментов с мочой, считая этот показатель не связанным с величиной диуреза, а, следовательно, более объективно отражающим выраженность цитолиза.
Полученные данные показали, что суточная экскреция с мочой всех ферментов также снижалась (p<0,05) (табл. 4), что свидетельствовало о преимущественной роли в уменьшении ферментурии снижения клеточной массы.
Таблица 4. Влияние терапии ССПК на суточную экскрецию ферментов у крыс с ХПН
Table 4. The effect of different variants of SSPC therapy on the daily excretion of enzymes in rats with CRF
| Показатели Parameters |
Норма Normal |
7 дней ХПН (1-4 серии) 7 days CRF1-4 Series |
Серии опытов Series |
Терапия ССПК / SCS therapy | |
|---|---|---|---|---|---|
| 30 дней 30 days |
60 дней 60 days |
||||
| Экскреция АСТ, МЕ/сут AST excretion, ME/day |
74±9 | 34±11 | 1-я | 153±26 | 103±20 |
| 2-я | 53±11* | 15±3** | |||
| 3-я | 42±9** | 27±5** | |||
| 4-я | 48±8** | 33±3** | |||
| Экскреция АЛТ, МЕ/сут ALT excretion, ME/day |
45±8 | 25±3 | 1-я | 120±6 | 172±21 |
| 2-я | 66±4** | 67±11** | |||
| 3-я | 62±5** | 53±8** | |||
| 4-я | 58±4** | 56±7** | |||
| Экскреция ЛДГ, МЕ/сут LDH excretion, ME/lday |
116±8 | 90±4 | 1-я | 210±23 | 142 ±16 |
| 2-я | 244±34 | 104±11 | |||
| 3-я | 196±19 | 143±14 | |||
| 4-я | 177±14 | 129±12 | |||
| Экскреция ЩФ, МЕ/сут AF excretion, ME/day |
120±10 | 86±6 | 1-я | 178±13 | 265±18 |
| 2-я | 147±11 | 136±27* | |||
| 3-я | 152±13 | 145±21** | |||
| 4-я | 142±9 | 131±19** | |||
Примечание: достоверность различий по сравнению с 1-й серией: *p<0,05, **p<0,01
Note: the reliability of the differences compared to the 1-st series: *p<0.05, **p<0.01
В более отдаленные сроки в контрольной серии опытов отметили достоверное возрастание экскреции ферментов с мочой как через 30, так и через 60 дней наблюдения. Развитие компенсаторной гипертрофии и увеличение массы органа могут вносить в увеличение ферментурии лишь незначительный вклад, поскольку масса гипертрофированной почки оставалась примерно в 2 раза меньше, чем масса обеих почек, тогда как экскреция ферментов возрастала практически в 2 раза по сравнению с нормой и в 2-5 раз по сравнению со значениями через 7 дней после моделирования ХПН. То есть основной вклад в увеличение ферментурии вносят деструктивные изменения в структурах почки, вызванные стойкой гиперфункцией почечных структур.
Подтверждением этому служат прогрессирующее увеличение экскреции АЛТ и ЩФ с увеличением срока, прошедшего после формирования ХПН при сохраняющейся гиперэкскреции АСТ и ЛДГ, а также данные опытов с терапией ССПК. Через 30 суток терапии достоверное уменьшение степени ферментурии выявлено в отношении АСТ и АЛТ, причем экскреция этих ферментов осталась сниженной и через 60 суток. Экскреция ЩФ через 30 суток достоверно не менялась, но через 60 суток выявлено достоверное уменьшение экскреции этого фермента с мочой. Экскреция ЛДГ с мочой на фоне терапии ССПК не менялась ни через 30, ни через 60 суток.
Таким образом, по данным динамики уровня ферментемии и ферментурии, терапия ССПК оказывает существенный цитопротективный эффект, что может служить основой для сохранения функционального состояния почки и предупреждения прогрессирования ХПН. При этом позитивный эффект оказывали все варианты терапии, но при использовании более длительных курсов (20-дневный первый курс или непрерывный 30-дневный курс) выявлена тенденция к более выраженному эффекту.
Одним из признаков тяжести ХПН является степень накопления в крови уремических токсинов, образование которых в организме превышает их выведение из-за сниженной экскреторной функции почек. К таким токсинам относят мочевую кислоту, 3- индоксил сульфат, р-толил сульфат (паракрезолсульфат), а также ряд цитокинов. Чрезмерное накопление этих соединений оказывает токсический эффект на почки, способствуя дальнейшему прогрессированию ХПН, а также на центральную нервную систему, легкие и сердечно-сосудистую систему [15-18].
В связи с этим, мы провели определение концентрацию 3-индоксил сульфата и р-толил сульфата в крови крыс с ХПН и влияние на их уровень терапии ССПК. При этом, учитывая вышеприведенные данные о большей эффективности длительной терапии ССПК, определение токсинов провели в серии с непрерывной 30-дневной терапией (4-я серия).
Результаты показали, что через 2 месяца после моделирования ХПН в контрольной серии опытов концентрация уремических токсинов достоверно возрастала: для 3-индоксил сульфата в 2,5 раза – с 935±123 нг/мл до 2504±141 нг/мл, а для р-толил сульфата в 10 раз – с 42±4 нг/мл до 426±38 нг/мл (p<0,05 и p<0,001, соответственно). В серии опытов с терапией ССПК повышение уровня токсинов было достоверно меньше: концентрация 3-индоксил сульфата возрастала до 1790±132 нг/мл, а уровень р-толил сульфата – до 173±24 нг/мл (достоверность различий по сравнению с контролем, p<0,01) (рис. 3).
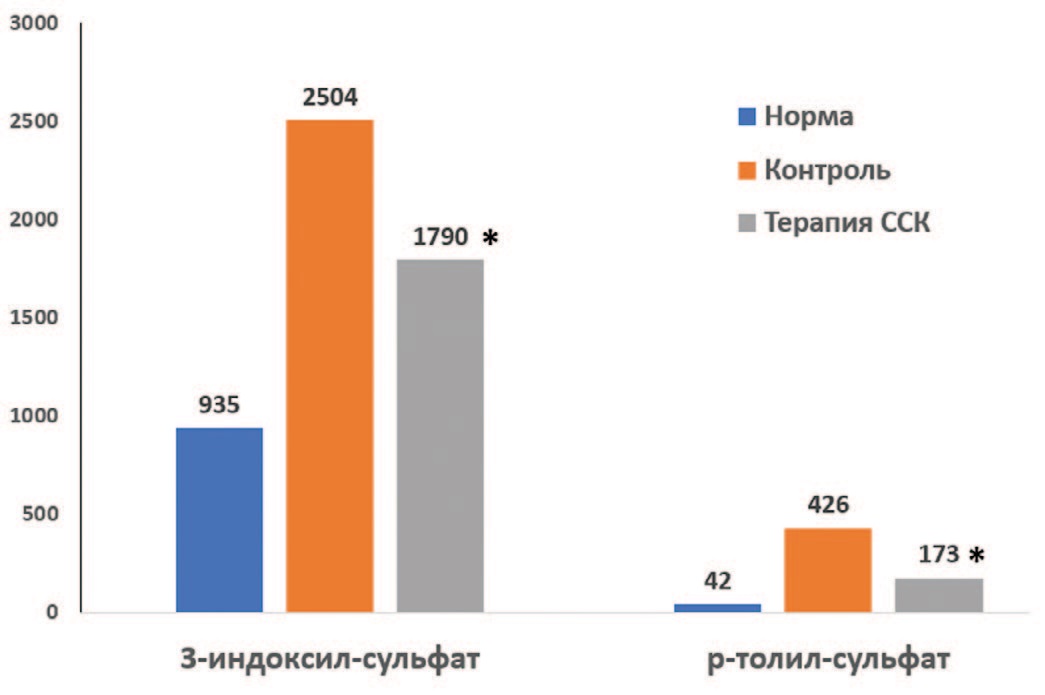
Рис. 3. Влияние терапии ССПК на накопление нейротоксинов в крови крыс с ХПН
Fig. 3. The effect of SSPC therapy on the accumulation of neurotoxins in the blood of rats with CRF
Менее выраженное накопление уремических нейротоксинов при моделировании ХПН в опытах с терапией ССПК свидетельствует о торможении прогрессирования ХПН под действием препарата и об уменьшении потенциальных осложнений ХПН со стороны центральной нервной системы.
ОБСУЖДЕНИЕ
Современной тенденцией в разработке методов лечения хронических заболеваний жизненно важных органов является изучение эффективности разных вариантов «бесклеточной» регенерационной терапии, учитывая сохраняющиеся в настоящее время юридические и этические ограничения использования стволовых/прогениторных клеток различного происхождения. Законодательные акты по биомедицинским клеточным продуктам [19, 20], предписывающие культивирование стволовых клеток на терапевтических клеточных средах, с одной стороны, привели в порядок многочисленные терапевтические эксперименты в этой области, а с другой – существенно осложнили технологию исследований и производства, что повысило себестоимость работ и курса клеточной терапии. В то же время имеются многочисленные данные о том, что продукты секреции стволовых клеток (секретом) обладают не меньшей эффективностью, чем использование самих клеток [21, 22]. Изучают возможность применения с этой целью кондиционированной среды культивирования стволовых/прогениторных клеток [23-25], внеклеточных везикул, микросом, экзосом, секретируемых этими клетками [26-28], а также комплексов биоактивных молекул, выделенных непосредственно из стволовых клеток [29-32].
С появлением новой парадигмы «стволовых ниш» взрослого организма, т.н. тканевых «депо» стволовых и прогениторных клеток, регулирующих популяцию транзиторного клеточного пула каждого органа, стала понятна важная роль внеклеточного матрикса в регуляции процессов дедифференцировки/дифференцировки, как одной из основных составляющих репаративного процесса. Успехи протеомики, липидомики и метаболомики обратили взгляды ученых многих лабораторий мира, занимающихся репаративной клеточной терапией, к новому виду – «клеточной терапии без клеток» (cell-free cell therapy), используя в качестве биологически активных субстанций сигнальные белки внеклеточного матрикса и/или клеточные среды после культивирования стволовых клеток. Наиболее перспективным и экономически выгодным направлением оказалось использование эмбриональных тканей сельскохозяйственных животных, т.к. именно в эмбриогенезе на определенных сроках гестации при мощной стимуляции роста происходит четкая регуляция процессов дифференцировки за счет митогенов и транскипционных белков путей биологии развития, управляющих процессами апоптоза/аутофагии, чего трудно добиться при использовании культивированных пулов стволовых клеток. Именно эмбриональные факторы роста и дифференцировки позволяют управлять репаративными процессами (протекции и репарации) без риска возникновения неопластических процессов. Современные методы фракционирования и очистки биологически активных молекул позволяют решать вопросы вирусной и прионовой безопасности, а также изучать основные фармакокинетические параметры этих сложнокомпонентных препаратов.
К этой категории относится отечественный препарат «Целлекс», представляющий собой фракционированный протеомный секретом стволовых и прогениторных клеток – белково-полипептидный комплекс биологически активных молекул, хроматографически выделенный из мозга эмбрионов свиньи, на сегодня первый представитель новой группы препаратов репаративной медицины – клеточной терапии без клеток (cell-free cell therapy). В ранее проведенных исследованиях нами была доказана его эффективность при терапии крыс с острой постишемической почечной недостаточностью и профилактике перехода острого повреждения почки в хроническую болезнь почек [12-14]. Полученные данные послужили основой для данного исследования с оценкой возможного применения нового репаранта – ксеногенного секретома стволовых и прогениторных клеток при ХПН.
Результаты проведенного исследования показали, что терапия ССПК оказывает достоверный нефропротективный эффект на модели ХПН, полученной путем субтотальной резекции единственной почки. Учитывая хронический характер индуцированной патологии и тенденцию к прогрессированию при увеличении длительности ХПН, мы использовали более длительные протоколы терапии, чем в ранее проведенных опытах с моделированием острой почечной недостаточности (ОПН) [12, 13]. Если в опытах с ОПН проводили 10-дневный курс терапии ССК, то в данном исследовании – в виде 2-х курсов по 10 дней с 10-дневным интервалом или 2-х курсов с первым курсом в 20 дней и вторым – в 10 дней, а также в виде непрерывной терапии в течение 30 дней. При этом во всех 3-х опытных сериях проявилось выраженное нефропротективное действие ССПК с тенденцией к увеличению терапевтического эффекта при более длительной терапии. На фоне лечения улучшались основные показатели функциональных возможностей оставшейся ткани почки, и снижалась активность ряда ферментов в крови и моче, что является отражением менее выраженного повреждения клеток почки. Важно отметить, что в контрольной серии с увеличением длительности наблюдения (с 1 до 2 месяцев) мы отметили усугубление ХПН, что проявилось снижением СКФ и ростом активности ряда ферментов в крови и моче. В то же время, во всех опытных сериях мы не наблюдали прогрессирования ХПН при стабильном уровне всех изучаемых показателей даже в 4-й серии, где после 30 дней терапии ССПК в течение следующего месяца терапии не проводили. То есть была достигнута стабилизация процесса. Улучшение всех показателей на фоне терапии ССПК коррелировало с более выраженной компенсаторной гипертрофией оставшейся почечной ткани: масса органа возрастала достоверно в большей степени во всех опытных сериях по сравнению с контрольными опытами, где терапию не проводили. Некоторое уменьшение массы почки, произошедшее во всех сериях опытов с 30-го по 60-й дни, видимо, обусловлено неизбежно развивающимся склерозом почечной ткани, связанным со стойкой гиперфильтрацией в почечных клубочках, негативное влияние которой на состояние клубочкового аппарата хорошо известно [33, 34]. Но, тем не менее, масса почки во всех опытных сериях оставалась достоверно больше, чем в контроле. Именно с повреждением клубочков связано прогрессивное снижение СКФ, выявленное нами в контрольной серии опытов. Терапия ССПК в разных вариантах способствовала сохранению фильтрационной функции почки, что, видимо, связано со стимуляцией гипертрофии клубочков и уменьшением процесса гломерулосклероза, что мы выявляли в опытах при терапии ССПК крыс с ОПН [12]. Пролиферативный и антисклеротический эффекты секретома стволовых клеток подтверждены в ряде исследований [35-37].
Ухудшение экскреторной функции почек приводит к накоплению ряда токсических метаболитов, называемых «уремическими токсинами», которые негативно влияют как на саму почку, так и на функции других органов. К таким токсическим метаболитам относят сульфатные производные ароматических аминокислот – 3-индоксил сульфат и р-толил сульфат, которые образуются в кишечнике под действием микрофлоры толстой кишки. При этом из-за сниженной экскреторной функции почек они прогрессивно накапливаются в организме, оказывая токсический эффект за счет усиленной продукции активных форм кислорода и оксидантного повреждения клеточных структур, что ведет к развитию асептического воспаления с фиброзированием тканей [17, 38]. Эти токсические метаболиты, попадая в кровь, связываются с альбумином плазмы, что затрудняет их выведение при гемодиализе (удается вывести лишь 29-32% образующихся метаболитов) [39], в результате чего их концентрация у уремических больных возрастает в 11-43 раза [38, 40]. Чрезмерное накопление 3-индоксил сульфата и других сульфатных производных ароматических аминокислот приводит к прогрессированию ХПН за счет токсического поражения почечных канальцев, к выраженным неврологическим и когнитивным расстройствам, прогрессированию кардиомиопатии и атеросклероза [15, 17, 41].
Терапевтические возможности влияния на накопление уремических токсинов в крови больных ХПН крайне ограничены и связаны с использованием энтеросорбентов, назначением пробиотиков и коррекцией диеты [38, 42]. Полученные нами результаты показали, что примененная терапия ССПК, наряду с поддержанием функции почек, существенно тормозит накопление таких уремических токсинов, как 3- индоксил сульфат и р-толил сульфат, что может оказывать значительный эффект в профилактике неврологических и сердечно-сосудистых осложнений, вызванных уремией.
ЗАКЛЮЧЕНИЕ
Разработка новых подходов к терапии острых и хронических заболеваний центральной и периферической нервной системы, поджелудочной железы, паренхиматозных органов – почек, печени, легких, позволяет надеяться на значительные успехи применения терапии с использованием стволовых/прогениторных клеток или продуктов их секреции. Отечественный препарат «Целлекс» – белково-полипептидный комплекс, хроматографически выделенный, фракционированный протеомный ксеногенный секретом – первый представитель новой группы препаратов репаративной медицины – «клеточной терапии без клеток», в состав которого входят белки и полипептиды внеклеточного матрикса, цитозоля и органелл стволовых и прогениторных клеток головного мозга эмбрионов поросят. Результаты настоящего исследования подтвердили, что терапия ССПК не только оказывает достоверный нефропротективный эффект на модели экспериментально вызванной острой постишемической почечной недостаточности, что было показано в ранее проведенных исследованиях, но и позволяет стабилизировать течение ХПН в экспериментальной модели с резекцией 80% ткани почек за счет стимуляции компенсаторной гипертрофии органа и цитопротективного эффекта, а также снизить риск развития осложнений, связанных с накоплением уремических токсинов.







