ВВЕДЕНИЕ
Учитывая снижение рождаемости во многих странах мира, бесплодие в семейных парах является медицинской и социальной проблемой. В настоящее время женский и мужской факторы бесплодия встречаются с одинаковой частотой. Однако причины мужского бесплодия остаются до конца не выясненными. Поэтому в последние годы наблюдается рост интереса к пониманию причин мужского бесплодия, что отражается на методах лечения этой патологии.
Сперматогенез, как репродукция мужских половых клеток, это сложный процесс, в основе которого лежит взаимодействие эндокринной и иммунной систем и микробиоты. Поэтому нарушения согласованности этих процессов отражается как на количестве, так и на качестве сперматозоидов. У человека стенка семенных канальцев образует тестикулярный компартмент, который содержит несколько слоев гладкомышечных, «миоидных», перитубулярных клеток и внеклеточного матрикса. Кроме того, созревающие половые клетки защищены от иммунных клеток интерстиция яичка структурами гемато-тестикулярного барьера, что делает мужскую гонаду иммунно привилегированным органом. Следовательно, изменения архитектуры гемато-тестикулярного барьера и клеточного состава интерстиция яичка отражаются на качестве сперматогенеза, что приводит к мужскому бесплодию.
Среди иммунных клеток в интерстиции яичка в норме присутствуют тучные клетки, количество которых увеличивается при различных патологических ситуациях. Более того, накопление тучных клеток может указывать на продолжающееся воспаление [1]. Тучные клетки наиболее известны своей ролью в патогенезе воспалительных, гиперчувствительных и фиброзных заболеваниях и в норме они встречаются во многих периферических тканях. Известно участие тучных клеток в патогенезе эндометриоза, болезни Крона и воспалительных заболеваний кишечника, а также в развитии легочного и печеночного фиброза. Существует информация, что количество тучных клеток значимо увеличивается в яичке у бесплодных мужчин. Однако до сих пор не известно, что является сигналом для сохранения активности тучных клеток и поддержания воспаления в яичке у бесплодных мужчин.
Наряду с этим, изучение микробиома тестикулярной ткани является одной из самых динамичных областей исследования нашего времени, особенно после усовершенствования в технологии сбора и анализа данных о последовательностях ДНК [2]. Существующий микробиом в яичках может играть определенную роль в регуляции иммунных реакций и поддержании репродуктивного здоровья мужчины [3]. Оценка микробиома яичек все еще находится на стадии изучения.
Точный состав и значение микроорганизмов, которые могут присутствовать в ткани яичек, до конца не изучены. Предполагается, что микробиом в яичке человека менее разнообразен и обилен по сравнению с другими частями тела из-за присутствия гемато-тестикулярного барьера. Однако было установлено, что наиболее распространенными типами микроорганизмов в яичках у мужчин были Actinobacteria, Bacteroidetes, Firmicutes и Proteobacteria [4]. Микробиом яичка может отличаться у разных людей в зависимости от их образа жизни, индивидуальной гигиены, сексуальной практики, сексуальных партнеров и диеты [5].
Поэтому целью данного клинического наблюдения стало изучение связи между таксономическим микробным разнообразием микробиома и активностью тучных клеток в яичке у конкретного мужчины с секреторным бесплодием.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациент А., 34 года состоит в браке 2 года. Контрацептивы не использует. Женский фактор бесплодия исключает. Ранее в браке не состоял. Детей нет. Год назад обращался к андрологу с целью обследования на предмет выявления возможных причин бесплодия. Впервые в жизни проведен анализ спермограммы, раннее по данной проблеме в медицинские учреждения не обращался. На момент обращения в спермограмме была зафиксирована олигоастенозооспермия. На протяжении одного года лечился консервативно, получал антиоксидантную терапию, полиненасыщенные жирные кислоты омега-3, микроэлементы. Однако показатели эякулята не улучшались.
Полгода назад пациент обратился в центр репродуктивной и клеточной медицины, в отделение вспомогательных репродуктивных технологий, где при очередном обследовании была выявлена азооспермия. При осмотре: пациент А. нормостенического типа телосложения, рост 182 см, индекс массы тела 23,64 кг/м², рост волос на теле по мужскому типу. Оба яичка расположены в мошонке. Вены обоих семенных канатиков не расширены. Кариотип 46 XY. Данные спермограммы (ВОЗ, 2010): объем 1,8 мл, цвет серо-желтый, консистенция умеренно-вязкая, разжижение – 40 мин, рН 7,2, сперматозоиды отсутствуют, лейкоциты – 0,2 млн/л, лецитиновые зерна – скудное количество, IgG<22%. По данным ультразвукового исследования (УЗИ), размер и структура обоих яичек не изменены, вены обоих семенных канатиков не расширены. Показатели гормонального профиля пациента представлены в таблице 1.
Таким образом, на основании лабораторно-клинических данных пациенту А. был установлен клинический диагноз: первичное мужское бесплодие, гипергонадотропный гипоганадизм, необструктивная азооспермия.
Учитывая отсутствие половых клеток в эякуляте, пациенту А. была выполнена открытая биопсия яичка/TESE (Testicular Sperm Extraction – тестикулярная экстракция спермы). Материала для криоконсервации не получено. Полученная путем открытой биопсии яичка ткань и материал мазков из уретры, помимо патогистологического и имммуногистохимического исследования, были направлены для проведения метода высокопроизводительного секвенирования (NGS – next generation sequencing). Также биоптаты яичка фиксировали в нейтральном растворе 10% формалина в течение 2-3 сут. с последующей окраской гистологических срезов. Оценка качества сперматогенеза производилась на срезах яичка, окрашенных гематоксилином и эозином, а для детекции тучных клеток применялась иммуногистохимическая окраска с анти-MCT (Anti-Mast Cell Tryptase).
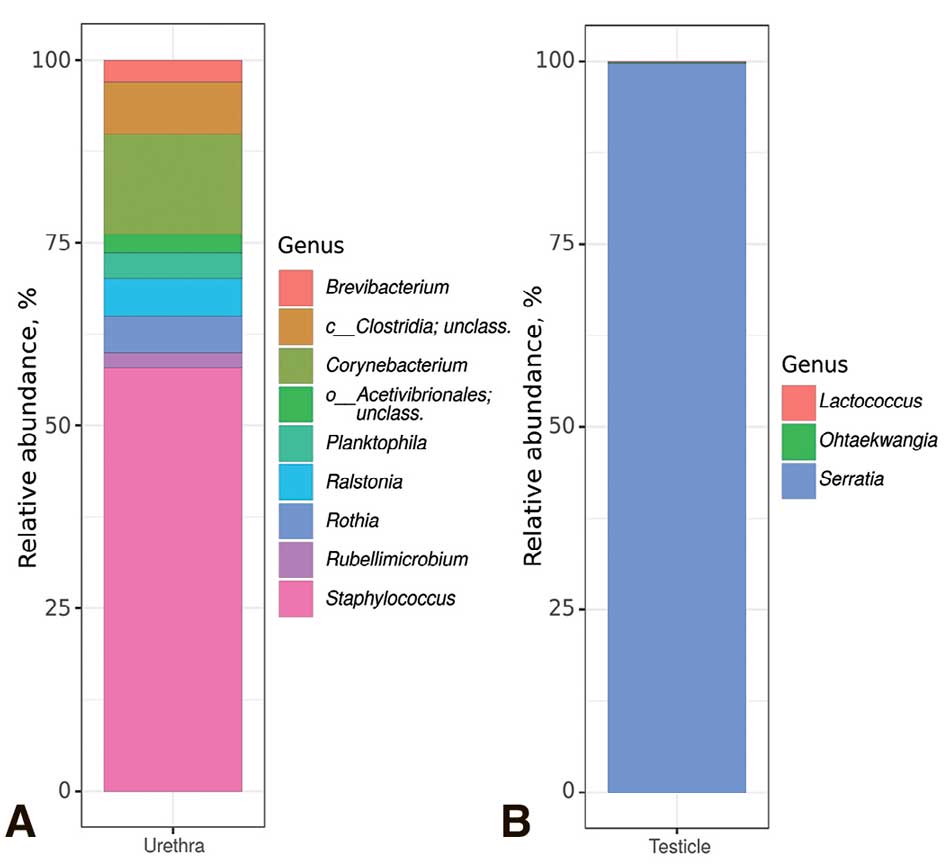
Рис. 1. Таксономический состав бактериального сообщества исследуемых образцов на уровне родов, выявленный методом секвенирования ампликонов гена 16S рРНК. A – Микробиота уретры. B – Микробиота ткани яичка
Fig. 1. Taxonomic composition of the bacterial community of the studied samples at the genus level, revealed by sequencing the 16S rRNA gene amplicons. A – Urethral microbiota. B – Testicular tissue microbiota
С помощью секвенирования ампликонов гена 16S рРНК было проведено исследование таксономического состава микробиоты уретры и ткани яичка. В микробиоте уретры среди классифицированных таксонов наибольшую долю бактериального сообщества составляли представители родов Staphylococcus (57,9%, Firmicutes phylum), Corynebacterium (13,7%, Actinobacteriota phylum) и неопределенный представитель класса Clostridia (7,1%, Firmicutes phylum) (рис. 1А). Микробиота ткани яичка характеризовалась бедностью сообщества с абсолютным предобладанием рода Serratia (99,7%, Proteobacteria phylum). Также были выявлены представители родов Ohtaekwangia (0,2%, Bacteroidota phylum) и Lactococcus (0,1%, Firmicutes phylum) (рис. 1В).
Морфологический анализ среза яичка, окрашенного гематоксилином и эозином, выявил наличие синдрома клеток Сертоли во всех извитых семенных канальцах яичка, базальной мембраны извитых семенных канальцев с очагами фиброза, полнокровия сосудов (рис. 2). В интерстиции яичка присутствуют очаги фиброза и участки с лейкоцитарной инфильтрацией. Количество тучных клеток в 1 мм2 интерстиция яичка было 114,7; при этом доля интерстициальных тучных клеток составила 63,8%, а перитубулярных – 36,2% (рис. 3). Тесный контакт тучных клеток со стенкой извитого семенного канальца, который мы выявили, может быть причиной нарушения гематотестикулярного барьера и сперматогенеза у наблюдаемого пациента.
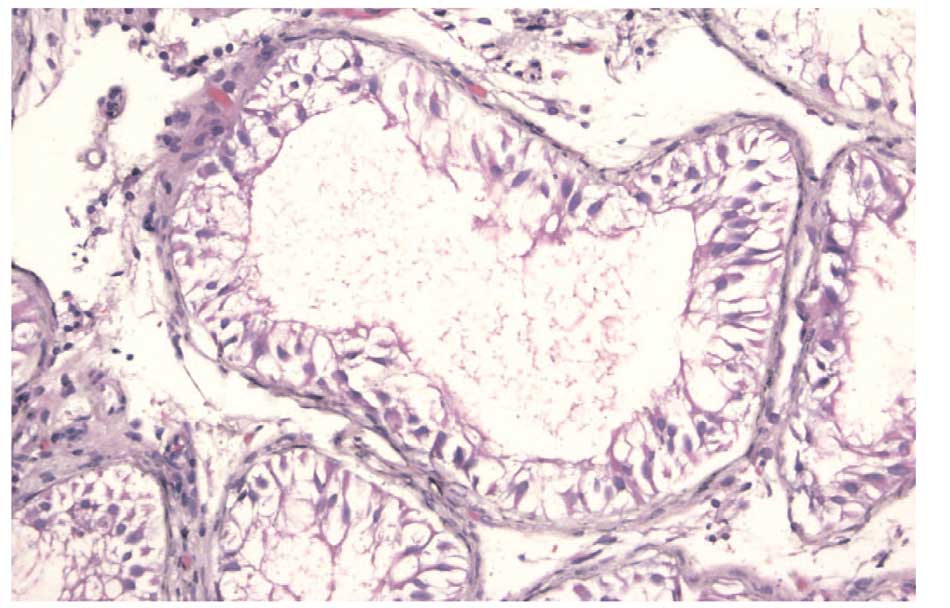
Рис. 2. Яичко пациента A. Окраска гематоксилином и эозином. Увеличение ×20. Нарушение сперматогенеза – синдром клеток Сертоли во всех извитых семенных канальцах яичка, базальная мембрана извитых семенных канальцев с очагами фиброза, полнокровие сосудов
Fig. 2. Testicle of patient A. Hematoxylin and eosin staining. Magnification ×20. Impaired spermatogenesis – Sertoli cell syndrome in all convoluted seminiferous tubules of the testicle, basement membrane of the convoluted seminiferous tubules with foci of fibrosis, vascular congestion
Таблица 1. Показатели уровней гормонов пациента А
Table 1. Hormonal levels of patient A
| Гормоны Hormones |
Результат Result |
Референсный интервал Reference interval |
|---|---|---|
| Фолликулостимулирующий гормон (мМЕ/мл) Follicle-stimulating hormone (mIU/ml) |
19,4* | 1,5-12,4 |
| Лютеинизирующий гормон (мМЕ/мл) Luteinizing hormone (mIU/ml) |
5,14 | 1,7-8,6 |
| Пролактин (мМЕ/мл) Prolactin (mIU/ml) |
273 | 97,0-449,0 |
| Эстрадиол (пг/мл) Estradiol (pg/ml) |
34,4 | 7,6-42,6 |
| Общий тестостерон (нг/мл) Total testosterone (ng/ml) |
3,9 | 2,4-8,3 |
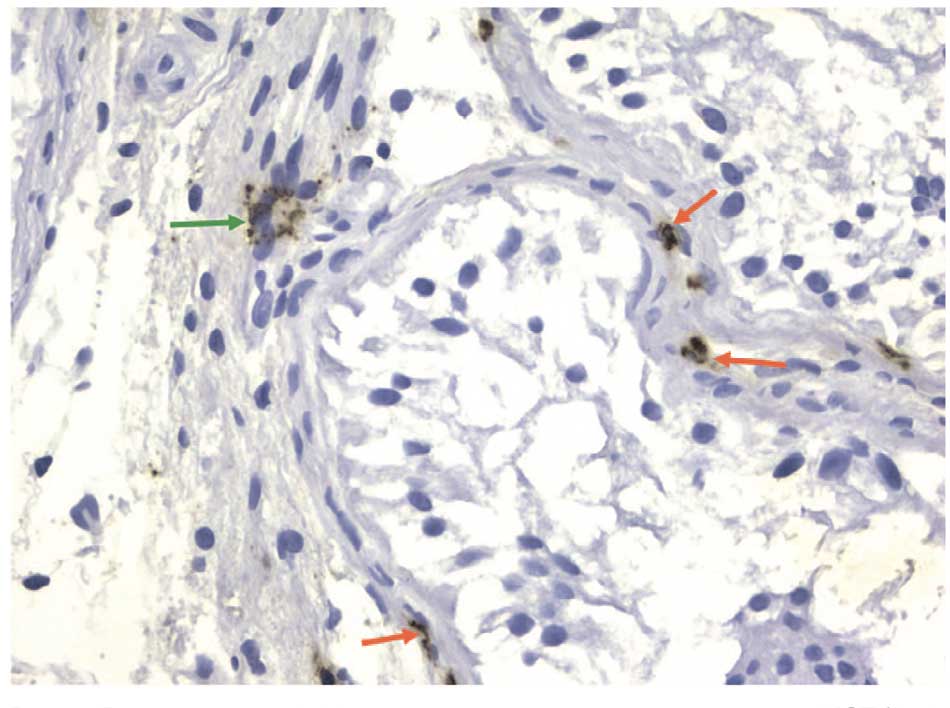
Рис. 3. Яичко пациента A. Иммуногистохимическая окраска с анти-MCT (AntiMast Cell Tryptase). Увеличение ×40. Зеленая стрелка указывает на тучную дегранулированную триптаза-позитивную тучную клетку, которая находится в интерстиции яичка. Красные стрелки указывают на триптазопозитивные тучные клетки, которые находятся перитубулярно
Fig. 3. Testis of patient A. Immunohistochemical staining with anti-MCT (AntiMast Cell Tryptase). Magnification ×40. Green arrow points to mast cell, degranulated tryptase-positive, located in the interstitium of the testis. Red arrows point to tryptase-positive mast cells, which are located peritubularly
Учитывая полученную гистологическую картину в яичке у пациента А., можно сделать вывод, что перспективы консервативного и хирургического лечения мужского бесплодия нет. Паре было предложено выполнение протокола вспомогательных репродуктивных технологий с донацией сперматозоидов.
ОБСУЖДЕНИЕ
Вирусная и бактериальная инфекции являются частыми причинами, вызывающими мужское бесплодие. При хроническом воспалении даже после элиминации бактерий сперматогенный эпителий остается разрушенным, а для восстановления сперматогенеза в яичках требуется более трех месяцев. Однако при хроническом и рецидивирующем воспалении яичек активные иммунные клетки вырабатывают биологически активные вещества, которые могут губительно влиять на сперматогенез. По данным M. Alfano и соавт., у пациентов с идиопатической необструктивной азооспермией преобладали Firmicutes и Actinobacteria, и значительного уменьшалось количество Bacteroidetes и Proteobacteria (p=0,00002) [4]. Результаты исследования N.M. Molina и соавт. обнаружили, что род бактерий Prevotella был наиболее распространенным в ткани яичек у бесплодных мужчин, что может указывать на его негативное влияние на сперматогенез [6].
Тучные клетки – это иммунные клетки, которые играют важнейшую роль в защите организма от патогенов и в различных иммунных реакциях, включая аллергию и воспаление. Одной из важных функций тучных клеток является их способность высвобождать различные биологически активные молекулы при активации, включая протеазы (в частности – триптазу) [7]. Тучные клетки высвобождают протеазы для участия в различных физиологических процессах, но при определенных условиях они также могут способствовать повреждению тканей и воспалению.
Тучные клетки чаще всего находятся в соединительной ткани белочной оболочки яичка и придатка яичка. У человека тучные клетки в изобилии присутствуют как непосредственно под белочной оболочкой яичка, так и в интерстициальной ткани между семенными канальцами. Тучные клетки у человека появляются в семенниках уже в плодном периоде; их количество увеличивается в младенчестве, уменьшается в детстве и снова увеличивается в начале полового созревания [8]. Считается, что в яичках человека увеличение количества интерстициальных тучные клетки приводит к изменениям в морфологии яичка [9], нарушению сперматогенеза [10] и, следовательно, к мужскому бесплодию.
Впервые анализ содержания тучных клеток в яичке был проведен S. Agarwal и соавт. в конце прошлого века. Был выполнен сравнительный подсчет количества тучных клеток в одном мм2 в группе мужчин с бесплодием (олигозооспермия и азооспермия по показателям спермы) и у здоровых мужчин. Авторы заметили нарушение сперматогенеза по мере увеличения количества тучных клеток в интерстиции яичка. Так, у мужчин, имеющих уровень сперматогенеза 1-4 балла по Johnson's количество тучных клеток было значительно больше (57,7 клеток/мм2) по сравнению с здоровыми мужчинами (р<0,001) [11].
В начале 20 века D.D. Apa и соавт. оценивали триптазопозитивные тучные клетки в яичке. Авторы сравнивали активность тучных клеток у здоровых и бесплодных мужчин, кроме того, оценивался фиброз интерстиция и перитубулярной области яичек с помощью анализа содержания виментина и альфа-гладкомышечного актина. Во всех наблюдаемых случаях авторы выявили присутствие тучных клеток в интерстиции яичка. Во всех случаях тучные клетки в основном локализовались в интерстиции. Было выявлено значительное увеличение общего числа и интерстициальных тучных клеток, продуцирующих триптазу, у бесплодных мужчин с выявленным склерозом семенных канальцев по сравнению с контрольной группой (р=0,04 и р=0,024 соответственно). Таким образом, было показано, что триптазаактивные тучные клетки вовлечены в этиологию мужского бесплодия и оказывают повреждающее действие на сперматогенез, особенно на этапе формирования склероза и атрофии извитых семенных канальцев [12].
Таким образом, при морфологическом анализе гонады у бесплодных мужчин актуальным является изучение распределения и миграции тучных клеток в различных отделах яичка. По данным G. Haidl и соавт. в 2011 г., близкое расположение тучных клеток к структурам яичка, особенно к семенным канальцам, имеет большое значение в патологии бесплодия человека. То есть чем ближе тучные клетки к зародышевым клеткам, тем более прямое влияние они могут оказывать на фертильность через секретируемые медиаторы. Из-за этих характеристик необходимо учитывать толщину стенки канальца и состояние гематотестикулярного барьера при обсуждении и анализе влияния тучных клеток на половые клетки и фертильность [13].
Наше исследование показало, что увеличение тучных клеткок в яичке, особенно в состоянии дегрануляции, которые находятся в тесном контакте с семенными канальцами, указывает на связь между пролиферацией тучных клеток и дисфункцией гематотестикулярного барьера. Так же у наблюдаемого пациента было выявлено обеднение палитры микробного пейзажа в яичке с абсолютным преобладанием представителя филы Proteobacteria рода Serratia. Можно предположить, что наличие преобладающего количества триптазаактивных тучных клеток стимулирует деятельность фибробластов и синтез коллагена, что приводит к фиброзу и склерозу тканей. Результаты нашего исследования совпадают с результатами G. Haidl и соавт., которые обратили внимание на то, что активация тучных клеток приводит к фиброзным процессам в яичке, что изменяет проницаемость гематотестикулярного барьера [13].
ЗАКЛЮЧЕНИЕ
Увеличение числа тучных клеток в интерстиции яичка у мужчин может оказывать негативное влияние на сперматогенез. На примере описанного клинического случая мы впервые показываем, что увеличение числа триптазопозитивных клеток в сочетании c обеднением микробиома яичка способствует развитию мужского бесплодия. Однако же вопрос: какие сигнальные механизмы способствуют этому процессу – требует дальнейшего изучения.
ЛИТЕРАТУРА
- Mayerhofer A, Walenta L, Mayer C, Eubler K, Welter H. Human testicular peritubular cells, mast cells and testicular inflammation. Andrologia 2018;50(11):e13055. https://doi.org/10.1111/and.13055.
- MAllen-Vercoe E. Bringing the gut microbiota into focus through microbial culture: recent progress and future perspective. Curr Opin Microbiol 2013;16(5):625-9. https://doi.org/10.1016/j.mib.2013.09.008.
- MLundy SD, Sangwan N, Parekh NV, Selvam MKP, Gupta S, McCaffrey P, et al. Functional and taxonomic dysbiosis of the gut, urine, and semen microbiomes in male infertility. Eur Urol 2021;79(6):826-36. https://doi.org/10.1016/j.eururo.2021.01.014.
- MAlfano M, Ferrarese R, Locatelli I, Ventimiglia E, Ippolito S, Gallina P, et al. Testicular microbiome in azoospermic men-first evidence of the impact of an altered microenvironment. Hum Reprod 2018;33(7):1212-7. https://doi.org/10.1093/humrep/dey116.
- MAltmäe S, Franasiak JM, Mändar R. The seminal microbiome in health and disease. Nat Rev Urol 2019;16(12):703-21. https://doi.org/10.1038/s41585-019-0250-y.
- MMolina NM, Plaza-Díaz J, Vilchez-Vargas R, Sola-Leyva A, Vargas E, Mendoza-Tesarik R, et al. Assessing the testicular sperm microbiome: a low-biomass site with abundant contamination. Reprod Biomed Online 2021;43(3):523-31. https://doi.org/10.1016/j.rbmo.2021.06.021.
- MWelter H, Huber A, Lauf S, Einwang D, Mayer C, Schwarzer JU, Köhn FM, Mayerhofer A. Angiotensin II regulates testicular peritubular cell function via AT1 receptor: a specific situation in male infertility. Mol Cell Endocrinol 2014;393(1-2):171-8. https://doi.org/10.1016/j.mce.2014.06.011.
- MMeineke V, Frungieri MB, Jessberger B, Vogt H, Mayerhofer A. Human testicular mast cells contain tryptase: increased mast cell number and altered distribution in the testes of infertile men. Fertil Steril 2000;74(2):239-44. https://doi.org/10.1016/s0015-0282(00)00626-9.
- MHussein MR, Abou-Deif ES, Bedaiwy MA, Said TM, Mustafa MG, Nada E, et al. Phenotypic characterization of the immune and mast cell infiltrates in the human testis shows normal and abnormal spermatogenesis. Fertil Steril 2005;83(5):1447-53. https://doi.org/10.1016/j.fertnstert.2004.11.062.
- MSchmid N, Stöckl JB, Flenkenthaler F, Dietrich KG, Schwarzer JU, Köhn FM, et al. Characterization of a non-human primate model for the study of testicular peritubular cells-comparison with human testicular peritubular cells. Mol Hum Reprod 2018;24(8):401-10. https://doi.org/10.1093/molehr/gay025.
- MAgarwal S, Choudhury M, Banerjee A. Mast cells and idiopathic male infertility. Int J Fertil 1987;32(4):283-6.
- MApa DD, Cayan S, Polat A, Akbay E. Mast cells and fibrosis on testicular biopsies in male infertility. Arch Androl 2002;48(5):337-44. https://doi.org/10.1080/01485010290099183.
- MHaidl G, Duan YG, Chen SJ, Kohn FM, Schuppe HC, Allam JP. The role of mast cells in male infertility. Expert Rev Clin Immunol 2011;7(5):627-34. https://doi.org/10.1586/eci.11.57.







