И сегодня тест определения ПСА в сыворотке крови является основным инструментом диагностики и наблюдения за течением рака предстательной железы. С учетом того, что среди урологов в последнее время постоянно дискутируется вопрос о недостаточной чувствительности и специфичности ПСА-теста, считаем публикацию данной статьи актуальной, т.к. она демонстрирует, что эффективность диагностики во многом зависит не только от характеристик самого теста, но и от методически правильной работы лабораторной службы. Надеемся, что данная статья окажется полезной не только в клинической практике, но и при организации научных исследований.
Редакция
Начиная с конца 80-х годов прошлого столетия началась эра активного и широкомасштабного использования в урологической практике теста на определение простатспецифического антигена (ПСА) в сыворотке крови мужчин. Первые коммерчески доступные наборы для определения общего и свободного ПСА принадлежали компании Hybritech, которая в 1997 г. стала подразделением американской компании Beckman Coulter. Именно наборы Hybritech были впервые одобрены FDA (Food and Drug Administration, USA) в 1986 г. для использования в качестве инструмента мониторинга при раке предстательной железы, а в 1994 г. - для использования с диагностической целью.
Метод Hybritech для определения свободной фракции ПСА был признан золотым стандартом, достоверно улучшающим дифференциальную диагностику рака предстательной железы. В настоящее время внедряется новый тест Beckman Coulter на определение маркера [-2]проПСА, изоформы свободного ПСА, обладающей более высокой специфичностью при выявлении рака предстательной железы.
Компания Hybritech была первой внедрившей данный метод. Большинство последующих производителей альтернативных тест-систем использовали метод Hybritech в качестве референсного, в том числе внутренний стандарт Hybritech, зачастую не проводя полномасштабных рандомизированных исследований по определению клинически значимых уровней ПСА Это особенно актуально именно для лабораторного метода определения ПСА, так как он имеет ряд особенностей, приведенных ниже.
ОБСУЖДЕНИЕ
Как известно, для определения ПСА в сыворотке крови используется метод иммунохимического анализа, в основе которого лежит реакция высокоспецифического связывания антигена и антитела, протекающая по типу «ключ-замок». Надо отметить, что ПСА является макромолекулой, которая имеет несколько эпитопов, то есть специальных участков в молекуле антигена, с которыми происходит связывание специфических антител [1] (рисунок 1). Например, если в макромолекулярном антигене имеется 4 эпитопа, то теоретически может существовать 4 вида антител соответствующей специфичности, каждое из которых будет связываться только с одним из 4-х эпитопов.
Рисунок 1. 3-D модель ПСА молекулы
На практике производители тест-систем действительно используют антитела различной специфичности. Помимо эпитопов, антитела могут отличаться степенью очистки, избирательностью связывания, степенью перекрестного реагирования с неспецифическими компонентами в сыворотке. Сама реакционная среда, в которой происходит образование комплексов антиген-антитело, может отличаться, создавая эффект матрикса. Это приводит к тому, что тест-системы не являются взаимозаменяемыми. Результат измерения одной и той же сыворотки на разных тест-системах будет отличаться. В связи с этим, при клинической интерпретации результатов должны использоваться разные референсные и пороговые значения, соответствующие конкретной тест-системе.
Ситуация осложняется тем, что метод определения ПСА должен обладать эквимолярностью, то есть используемые специфические антитела должны быть одинаково чувствительны как к ПСА, находящемуся в свободной форме, так и к ПСА, связанному с альфа-1-химотрипсином. В случае эквимолярности метода результат измерения общего ПСА не будет зависеть от процентного соотношения между свободной и связанной формами ПСА. Однако далеко не все используемые методы обладают эквимолярностью. Это, наряду с перечисленными выше причинами, приводило к значительной вариабельности результатов, получению большого количества ложноположительных или ложноотрицательных результатов. Еще в 1995 г. Semjonow с соавторами [2] показали, что разница в уровнях ПСА, определяемых всеми доступными в Германии тест-системами, могла достигать 100% . Такая ситуация неприемлема с клинической точки зрения. Обсуждению данной проблемы были посвящены две специальные международные конференции, результатом которых стало решение о внедрении стандартизации методов определения ПСА, что предусматривает процедуру стандартизации метода.
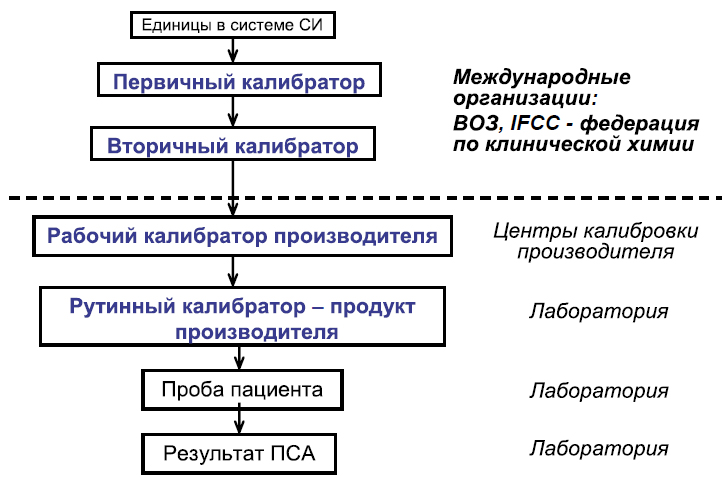
Рисунок 2. Полная цепь прослеживаемости калибраторов и калибровок при стандартизации метода
Отметим, что при иммунохимическом определении ПСА, как и при аналогичном количественном определении других сывороточных маркеров, используется процедура калибровки, которая заключается в фиксации интенсивности сигнала измерительной системой, например, измерении интенсивности свечения люминометром, для ряда растворов с разной известной концентрацией ПСА. Результаты измерений наносятся на график, строится так называемая калибровочная кривая, с помощью которой, измерив интенсивность сигнала для пробы пациента, можно определить концентрацию ПСА.
Важно понимать, что существует иерархия калибровок и калибраторов (рисунок 2). К калибраторам самого высокого уровня относится первичный калибратор, который выполняет функцию эталона. Это международный стандарт, производимый международной организацией, в т. ч. Всемирной организацией здравоохранения (ВОЗ). С первичного калибратора ВОЗ может делать своего рода слепки, копии - вторичные калибраторы, которые передаются в центры калибровки производителя. Так как в процессе производства тест-системы готовится внутренний стандарт, так называемый рабочий калибратор, при стандартизации метода производитель должен провести сличение своего рабочего калибратора с вторичным калибратором, который выступает в роли переданной эталонной единицы . После проведения сопоставления результатов производитель может использовать уже свой рабочий калибратор в качестве эталона для проведения последующих измерений с помощью рутинного калибратора. Рутинный калибратор также является продуктом производителя и поставляется вместе с тест-системой в лабораторию для использования в повседневной работе . Таким образом, при стандартизации производитель обязан обеспечить полную прослеживаемость от результата измерения в сыворотке пациента до первичного калибратора - международного стандарта.
Однако очень часто в иммунных методах анализа цепь прослеживаемости бывает неполной. Это связано с тем, что крайне сложно разработать стандартизованную методику получения первичного калибратора для биологических макромолекулярных соединений. Так было и в ситуации с ПСА, когда до 1999 г. цепочка прослеживаемости обрывалась на рабочем калибраторе производителя (на рисунке 2 отмечено пунктирной линией), а другие производители тест-систем для определения ПСА, появившиеся позднее, использовали внутренний стандарт (рабочий калибратор) Hybritech в качестве отраслевого стандарта. Отметим, что пороговое значение, равное 4 нг/мл, было установлено именно для метода Hy- britech PSA на основе многоцентрового проспективного исследования, включавшего 6374 пациента. Впоследствии производители альтернативных тест-систем, помимо внутреннего стандарта Hybritech, стали также использовать данную пороговую величину как диагностически значимую, несмотря на имевшиеся различия в результатах определения ПСА.
В 1999 г. ВОЗ утвердила в качестве первичного калибратора международный стандарт 96/670. Согласно утвержденной ВОЗ методике, в первичном калибраторе было зафиксировано соотношение между свободной и связанной формами ПСА как 10:90, что было призвано улучшить эквимолярность методов определения ПСА [3]. Для измерения изначального содержания нового стандарта при его получении была утверждена новая, более современная, первичная референсная методика - метод масс-спектрометрии (для внутреннего стандарта Hybritech использовался фотометрический метод Лоури) Оказалось, что коэффициент экстинкции стандарта ВОЗ 96/670 выше, чем у внутреннего стандарта Hybritech, ориентировочно, на 26%.
К чему привели такие различия в используемых стандартах измерений, показано на рисунке 3, где приведены калибровочные кривые для тест-систем Hybritech при использовании традиционного стандарта Hybritech (красная сплошная линия), и стандарта ВОЗ 96/670 (зеленая пунктирная линия) [4]. Кривые отличаются, и одной и той же интенсивности сигнала в измерительной системе будут соответствовать две разные концентрации ПСА в пробе. Например, при сигнале в 6 млн относительных световых единиц при использовании внутреннего стандарта Hybritech на основании калибровочной кривой, маркированной сплошной линией красного цвета, мы получим 4 нг/мл, а при использовании стандарта ВОЗ 96/670 на основании калибровочной кривой, отмеченной зеленой пунктирной линией, получаем концентрацию ПСА около 3,1 нг/мл!
Beckman Coulter на группе свыше 6600 мужчин, провел доскональное сопоставление результатов, получаемых методом Hybritech при использовании разных стандартов. В целом, для тест-систем Hybritech PSA, при использовании в качестве эталона измерения стандарта ВОЗ 96/670, результаты определения ПСА оказались на 22% ниже, чем при использовании внутреннего стандарта Hybritech [4]. Компания Beckman Coulter обеспечивает полную прослеживаемость производимых тест-систем до стандарта ВОЗ 96/670. Лаборатории, работающие с тест-системами Beckman Coulter Hybritech, в любой момент могут выбрать какой стандарт они предпочитают использовать в качестве эталона измерений и, в зависимости от этого, получать результаты определения ПСА по соответствующей шкале.
В таблице 1 представлена краткая выдержка из инструкции к набору Beckman Coulter для определения общего ПСА, где приводится сопоставление основных клинически значимых величин ПСА для разных стандартов. Обратите внимание, если лаборатория калибруется по стандарту ВОЗ 96/670, то вместо принятого ранее порогового значения ПСА, равного 4 нг/мл, необходимо использовать 3,1 нг/мл, а вместо 2,5 нг/мл - 2 нг/ мл. Такая коррекция пороговых значений позволит получить результаты с балансом чувствительности и специфичности метода, заявленными при первоначальной валидации тест-системы Hybritech, а также продемонстрированными в многочисленных работах с использованием метода Hybritech до внедрения международного стандарта ВОЗ 96/670.
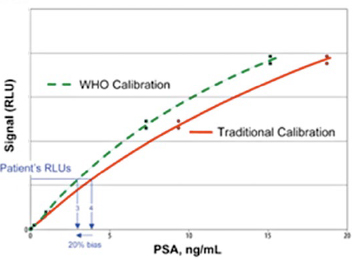
Рисунок 3. Калибровочные кривые при определении ПСА с использованием традиционного калибратора Hybritech и стандарта ВОЗ 96/670 (WHO)
Таблица 1. выдержка из инструкции к набору Beckman Coulter для определения общего ПСА. показатели PSA, полученные при калибровке Hybrtitech и WHO
| Калибровка Hybrtitech значения PSA (ng/mL) | Калибровка WHO значения PSA (ng/mL) | Описание |
| 0,00 | 0,00 | Неприменимо |
| 0,35 | 0,30 | Скорость прироста содержания PSA вызывает необходимость проведения биопсии, если PSA <4ng/ml |
| 0,75 | 0,64 | Скорость прироста содержания PSA указывает на подозрение наличия рака предстательной железы, если PSA 4,0-10,0 ng/ml |
| 2,0 | 1,6 | Скорость прироста PSA для агрессивного рака предстательной железы |
| 2,5 | 2,0 | Суммарный показатель PSA, вызывающий необходимость проведения биопсии |
| 4,0 | 3,1 | Суммарный показатель PSA, вызывающий необходимость проведения биопсии |
| 10,0 | 7,8 | Самое высокое значение пороговой величины для необходимости проведения биопсии |
| 20,0 | 15,6 | Стратификация риска при раке предстательной железы |
Последствия игнорирования изменения пороговых значений можно оценить на примере работы Klee с соавторами [5]. Были проанализированы результаты измерений ПСА у двадцати тысяч мужчин методом Hybritech. Оказалось, что при использовании калибровки по внутреннему стандарту Hybritech, у 176 мужчин из 1000 уровень ПСА был бы выше 4 нг/мл, тогда как при использовании калибровки по стандарту ВОЗ 96/670, мужчин с уровнем ПСА выше 4 нг/мл было бы только 118 . То есть, в случае использования стандарта ВОЗ 96/670, 58 мужчин из 1000 (5,8% от популяции) не попали бы в целевую группу, и, соответственно, увеличилось бы количество пропущенных случаев рака, то есть снизилась бы чувствительность метода.
Как неоднократно отмечалось, приведенные ранее кривые и данные относились к методу Hybritech. Однако, как обстоит дело после внедрения стандартизации с другими тест-системами? Стали ли тест-системы взаимозаменяемыми? В таблице 2 представлен фрагмент одной из работ [6], демонстрирующих, что, несмотря на внедрение стандарта ВОЗ 96/670, взаимозаменяемости тест-систем достичь не удалось . Stephan с соавторами [6] использовались данные для относительно небольшого количества пациентов (около 200), но их вполне достаточно, чтобы заметить существенные отличия в пороговых значениях уровня ПСА, необходимых для достижения 90% чувствительности или 90% специфичности при использовании тест-систем от пяти разных производителей.
Необходимо подчеркнуть, что после внедрения стандарта ВОЗ 96/670, различия в результатах, получаемых на различных тест- системах, уменьшились. Прежде всего, улучшилась эквимолярность методов определения, но другие причины расхождения результатов, такие, как эпитопные различия используемых антител, различия в матриксе, форматах анализа, остались. К сожалению, на сегодняшний день, можно говорить только о движении в направлении гармонизации определения ПСА, но не о полноценной стандартизации методов. Это означает, что нельзя механически переносить на другие тест-системы, переходящие на использование в качестве эталона измерений стандарта ВОЗ 96/670, результаты сопоставления, полученные для метода Hybritech. Другие методы, отличные от Hybritech, должны быть детально исследованы на предмет уточнения клинически значимых уровней ПСА. В противном случае при использовании неизменных пороговых значений будут происходить отклонения от чувствительности и специфичности метода, декларированных производителем. Именно поэтому в рекомендациях европейской группы по онкомаркерам говорится, что «в каждом лабораторном отчете должны содержаться сведения об используемом методе и соответствующие ему референтные значения».
Таблица 2. Пороговые значения общего и свободного ПСА в нг/мл для достижения 90% чувствительности и 90% специфичности для 5 тест-систем (Stephan et all., 2006 [6]).
| Access | AxSYM | Centaur | immullte | Elecsys | |
| tPSA | |||||
| NPCa >4 mg/Lb n | 139 | 117 | 120 | 144 | 139 |
| PCa <4mg/Lc n | 68 | 86 | 93 | 46 | 59 |
| Cutoff at 90% sensitivity, mg/L | 2.82 (2.40-3.40) | 2.60 (2.12-3.04) | 2.52 (2.12-3.07) | 3.1 2 (2.68-3.75) | 3.02 (2.43-3.54) |
| Cutoff at 90% specificity, mg/L | 7.68 (7.21-8-21) | 6.71 (6.20-7.05) | 6.67 (6.26-7.32) | 8.70(8.33-9.1 5) | 8.04 (7.38-8.60) |
| Area under the ROC curve | 0.70 (0.66-0.74) | 0.72 (0.68-0.75) | 0.71 (0.67-0.75) | 0.71 (0.68-0.75) | 0.70 (0.66-0.74) |
| %tPSA | |||||
| Cutoff at 90% sensitivity, % | 18.7 (17.2-20.0) | 24.2 (22.0-25.7) | 24.1d (21.8-25.8) | 15.4 (14.5-17.1) | 17.8 (17.0-19.1) |
| Cutoff at 90% specificity, % | 10.2 (9.39-11.7) | 12.8 (11.5-14.2) | 9.94 (8.73-12.9) | 8.50 (7.53-9.35) | 9.94 (8.80-10.7) |
| Area under the ROC curvec | 0.81 (0.78-0.84) | 0.80 (0.77-0.83) | 0.77 (0.74-0.81 ) | 0.81 (0.77-0.84) | 0.79 (0.75-0.82) |
В заключение хотелось бы отметить, как внедрение стандартизации методов определения ПСА может отразиться на клинической интерпретации результатов при наблюдениях за уровнем ПСА в динамике. Это очень существенный момент, так как почти в половине случаев ПСА используется именно для динамических наблюдений. Ниже приведен достаточно типичный случай, когда в клинику обращается мужчина в возрасте 55 лет. Уровень ПСА при определении составил 4 нг/мл, при осмотре зафиксирован отрицательный результат пальцевого ректального исследования. Биопсия пациенту не назначалась и было рекомендовано повторное обследование через год. При повторном определении в возрасте 56 лет уровень ПСА составил опять 4 нг/мл. Можно ли в данной ситуации с уверенностью заключить, что уровень ПСА за прошедший год действительно не изменился? Чтобы ответить на этот вопрос, в соответствии с рекомендациями европейской группы по онкомаркерам, необходимо получить информацию о том, какие использовались тест-системы. Если тест-системы были разные, то мы однозначно не можем утверждать, что уровень ПСА остался неизменным. А как быть в ситуации, если анализ проводился в одной и той же лаборатории, на одном и том же приборе, с использованием одной и той же тест-системы? В таком случае, возможно ли, что уровень ПСА за год существенно вырос? Ответ положительный. Такая ситуация может сложиться, если при первом измерении в качестве эталона измерений использовался внутренний стандарт Hybritech, а при повторном измерении через год - стандарт ВОЗ 96/670. В этом случае первоначальное значение ПСА, равное 4 нг/мл, для метода Hybritech было бы эквивалентно 3,1 нг/мл по шкале калибровки стандарта ВОЗ 96/670 и за год уровень ПСА возрос на 29%. Пациент с такой скоростью нарастания ПСА требует других назначений и другой тактики ведения, чем пациент со стабильным уровнем ПСА.
ВЫВОДЫ
- Вместе с результатом ПСА врач должен получать информацию об использованном методе определения с указанием названия производителя и стандарта калибровки (прослеживаемости).
- Используя полученную информацию, необходимо принимать обоснованное решение об использовании того или иного порогового значения уровня ПСА, соответствующего использованному методу и стандарту калибровки (ВОЗ 96/670 или Hybritech).
- При динамических наблюдениях за уровнем ПСА необходимо обеспечить постоянство аналитической платформы, а также учет при интерпретации результатов используемого стандарта калибровки.
Ключевые слова: лабораторные методы диагностики, простатспецифический антиген, стандартизация определения ПСА, ВОЗ-стандарт ПСА, стандарт Hybritech ПСА.
Keywords: laboratory diagnosis, prostate-specific antigen, PSA standartization, WHO PSA standards, Hybritech PSA standards.
ЛИТЕРАТУРА
- Pironen T. , Villoutreix B .O . , Becker C . , Hollingsworth K . , Vihinen M . , Bridon D., Qui X., Rapp J. , Dowell B ., Lovgren T., Pettersson T., Lilja H . Determination and analysis antigenic epitopes of prostate-specific antigen (PSA) and human grandular kallikrein 2 (hK2) using synthetic peptides and computer modeling // Protein Sci . 1998. Vol . 7 . P. 259-269.
- Semjonow A ., Brand B ., Oberpenning F, Hertle L . Different determination methods make interpretation of prostate-specific antigen more difficult // Urology. 1995. Vol . 34 . P. 303-315 .
- Rafferty B ., Rigsby B ., Rose M ., Stamey T., Gaines Das R. Reference Reagents for Prostate-specific antigen (PSA): Establishment of the First International Standards for Free PSA and PSA (90:10) // Clin . Chem . 2000. Vol . 46 .№ 9 .P. 1310-1317 .
- Cook B . The Disconnect between Standartization and Interpretive Criteria // Clin . Lab . News . 2008. Vol . 34 . № 6 . P. 10-12 .
- Klee G G , Schryver P G , Kisabeth R M Analytic bias specification based on analysis of effects on performance of medical guidelines // Scan J Clin Lab Invest 1999. Vol. 59 . P. 509-512.
- Stephan C , Klaas M , Muller C , Schnorr D , Loening S , Jung K Interchangeability for Measurements of Total and Free Prostate-specific Antigen In Serum with 5 Frequently Used Assays Combinations: An Update // Clin . Chem. 2006. Vol. 52 . № 1. P. 59-64.






