Бесплодие – это неспособность соматически здоровой семейной пары репродуктивного возраста, не применяющей средства контрацепции, достичь зачатия в течение 12 месяцев регулярной половой жизни [1,2]. Частота бесплодных браков в мире катастрофически растет: в Европе и США она составляет 15%, в Канаде – 17%, а в России приближается к 20% [2,3]. В последнее время мужское бесплодие сравнялось по частоте с женским – частота «мужского» фактора в семейном бесплодии достигает 40-50% [3,4]. Рост бесплодия в индустриально развитых странах связывают с воздействием на репродуктивную систему целого ряда неблагоприятных медикосоциальных, алиментарных и психологических факторов, ведущих к повышению общей морбидности современной популяции, среди которых в настоящее время бесспорным лидером является ожирение, часто приводящее к сахарному диабету 2 типа (СД 2 типа) и андрогенному дефициту у мужчин и, как следствие, существенно повышающее риск развития у них оксидативного спермального стресса [4, 5]. В рутинной андрологической практике не существует стандартных рекомендаций по скрининг-диагностике оксидативного стресса сперматозоидов у бесплодных мужчин, но совершенно очевидно, что чем раньше выявлен и скорректирован оксидативный стресс сперматозоидов, тем меньшие репродуктивные потери несет мужчина [5,6]. При этом крайне важно иметь в виду, что оксидативный стресс сперматозоидов достоверно присутствует не только у мужчин с урологической патологией (например, при варикоцеле или воспалительных заболеваниях предстательной железы), но и практически всегда имеет место при ожирении, сахарном диабете или андрогенном дефиците, независимо от наличия или отсутствия у бесплодного мужчины патологии репродуктивной системы [5]. Ожирение является доказанным системным фактором, негативно влияющим на мужскую репродукцию посредством ранней инициации системного оксидативного стресса, приводящего при избыточном накоплении свободных радикалов кислорода в эякуляте к фрагментации ДНК сперматозоидов (спермальному оксидативному стрессу)[5]. Менее известен урологам-андрологам метаболический феномен инсулинорезистентности (ИР), который закономерно рано или поздно развивается при прогрессировании ожирения и который характеризуется нарушением чувствительности тканей к глюкозе, что приводит к митохондриальной недостаточности сперматозоидов (все тот же спермальный оксидативный стресс)[5]. И если сегодня уже многие врачи связывают репродуктивные потери с ожирением и рекомендуют своим бесплодным пациентам с избыточной массой тела снизить ее, то ранняя диагностика и коррекция ИР пока не стала нормой обследования каждого бесплодного мужчины с ожирением, хотя именно ИР является той самой ранней (доклинической) и потому обратимой стадией сахарного диабета 2 типа, которую можно и нужно активно выявлять у всех мужчин с бесплодием на фоне ожирения. ИР приводит к гликолизному стрессу нервных окончаний, т.е., по сути, инициирует метаболическую урогенитальную нейропатию, приводящую к нарушению эякулятодинамики и фертильных свойств эякулята [2, 5].
БЕСПЛОДИЕ: ОПРЕДЕЛЕНИЕ, ЭПИДЕМИОЛОГИЯ, ПРИЧИНЫ, КЛАССИФИКАЦИЯ, КРИТЕРИИ ПРОГНОЗА
Согласно рекомендациям Европейского общества урологов (2013), причины мужского бесплодия включают в себя следующие патологические синдромы и состояния, связанные с патологией эякулята, выявляемой при лабораторном обследовании мужчины [1, 2]:
- психосексуальные расстройства
- изолированная патология семенной плазмы
- ятрогенные причины
- системные заболевания
- врожденные аномалии
- приобретенное повреждение яичка
- варикоцеле
- инфекции гениталий
- иммунологический фактор
- эндокринные причины
- причин бесплодия не выявлено
- идиопатическая олигозооспермия
- идиопатическая астенозооспермия
- идиопатическая тератозооспермия
- обструктиная азооспермия
- идиопатическая азооспермия
Нозологическая структура причин мужского бесплодия является многофакторной. Среди важнейших заболеваний, приводящих к нарушению мужской фертильности, называются следующие [1, 2]:
- Крипторхизм – 7,8 %
- Урогенитальные инфекции – 8,0 %
- Нарушения эякуляции и сексуальные дисфункции – 5,9 %
- Системные заболевания – 3,1 %
- Варикоцеле – 15,6 %
- Гипогонадизм – 8,9 %
- Иммунные факторы – 4,5 %
- Обструкция семявыносящих путей – 1,7 %
- Другие аномалии – 5,5 %
- Идиопатическое бесплодие (с неуточненной причиной) – 31-44 %.
Таким образом, с клинической точки зрения все причины мужского бесплодия сегодня можно условно разделить на известные (хорошо выявляемые при комплексном обследовании, многие из которых являются устраняемыми при использовании оперативных и (или) консервативных методов лечения) и неизвестные (не диагнострируемые даже в ходе углубленной комплексной диагностики, а потому не устраняемые никакими методами, кроме вспомогательных репродуктивных технологий). Бесплодие с невыявленными (неизвестными) причинами нарушения фертильности называют неуточненным или идиопатическим [1, 2]. Согласно современным данным, частота идиопатического мужского бесплодия в Европе составляет до 31-44% от всех случаев мужского бесплодия, в России она выше, что связано с низким качеством этиологической диагностики мужского бесплодия [1, 2, 4, 6]. Эта категория пациентов является самой сложной с клинической и психологической точки зрения, так как отсутствие видимых причин нарушения сперматогенеза нередко бывают настолько тяжелыми, что мужчина не готов даже к роли донора спермы в протоколе ЭКО [5, 6]. Важными прогностическими факторами при бесплодии являются длительность периода бесплодия, характер нарушения репродуктивной функции (первичное или вторичное бесплодие), результаты спермограммы мужчины и особенно возраст и репродуктивный статус партнерши (жены) [1]. В сравнении с женщинами в возрасте 25 лет, реальная фертильность у женщин к 35 годам снижается на 50%, к 38 годам – до 25%, а фертильность женщин старше 40 лет не превышает 5-10% [1,2]. При диагностике причин мужского бесплодия необходимо всегда проводить всестороннее одновременное обследование супруги, так как не менее, чем в одной из четырех пар, консультирующихся по поводу бесплодия в браке, имеются нарушения одновременно у обоих партнеров [1, 2]. Прогноз в отношении мужского фактора семейного бесплодия сегодня неутешительный, поскольку в популяции здоровых мужчин на протяжении последних 50 лет отмечается прогрессивное снижение количества и качества сперматозоидов, что нашло свое отражение в последнем 5-м пересмотре референтных показателей эякулята репродуктивно здоровых мужчин (WHO, 2010) [1].
СОВРЕМЕННЫЕ ТЕНДЕНЦИИ МУЖСКОЙ ФЕРТИЛЬНОСТИ, ДЕМОГРАФИИ И РЕПРОДУКТИВНОЙ МЕДИЦИНЫ
В России XXI века гендерные демографические процессы применительно к мужской части популяции характеризуются двумя основными негативными тенденциями, действующими как демографические синергисты: высокий показатель бесплодия среди сравнительно молодых семейных пар на фоне резкого ухудшения репродуктивного здоровья подростков и низкие показатели продолжительности и качества жизни российских мужчин старшего возраста [7, 8]. В России первой декады XXI века во всех субъектах Российской Федерации число мужчин в структуре населения в среднем меньше на 16,2%, чем женщин [7, 8]. Демография государства считается проблемной, если уровень семейного бесплодия в стране превышает 15% [8]. Коэффициент рождаемости в России до 2030 года, согласно официальной статистике, ожидается на уровне 1,4 [8]. При этом известно, что воспроизводство населения наблюдается при коэффициенте не менее 2,1, а для прироста населения необходим коэффициент не менее 3,0. Современные демографические тенденции в мире и в России примерно одинаковы, что связано с некоторыми общими закономерностями воспроизводства населения и состояния его здоровья, в том числе, репродуктивного [9, 10]:
- Сложные социально-экономические условия, которые не позволяет парам планировать рождение нескольких детей в браке.
- Неинфекционная эпидемия «болезней цивилизации XXI века» (ожирение, сахарный диабет 2 типа (СД 2 типа), метаболический синдром (МС), депрессии, стрессы, сердечно-сосудистые заболевания, эректильная дисфункция ЭД), поражающая молодых мужчин репродуктивного возраста, которая только в последние годы стала рассматриваться как серьезная угроза мужской репродукции.
- Усиление тенденций гомосексуальности как среди мужчин, так и женщин (не менее 15% населения Земли гомосексуальны) – они не оставят после себя потомства.
- Рост числа асексуалов, для которых сексуальная и репродуктивная стороны жизни вообще не существуют (синдром «выгорания», или синдром менеджера), что привело к формированию поколения free child – отказ в принципе иметь ребенка в браке (дети мешают жить в свое удовольствие и карьерно расти).
- Катастрофическое состояние репродуктивного здоровья подростков, 40% из которых, по заявлению Главного педиатра РФ профессора А.Баранова, сделанного им 8 февраля 2013 года, имеют настолько серьезные проблемы с репродуктивной системой, что это грозит им в ближайшем браке неизлечимым бесплодием.
- В настоящее время увеличивается число пар, которые начинают заниматься вопросами репродукции поздно, после 30-40 лет (а до этого цель жизни – борьба за место под солнцем и карьера). Однако, 30 – 40 лет – возможное время начала возрастного андрогенного дефицита у мужчин, тесно связанного с развитием у них метаболических нарушений (ожирения, инсулинорезистентности, СД 2 типа). При этом в течение последних 20 лет в мировой популяции мужчин вообще прогрессирует снижение уровня тестостерона, находящееся в достоверной взаимосвязи с возрастом, и одной из ведущих причин может быть ожирение (MMAS, 2006) [11].
Таким образом, сегодня проблема нарушений мужской репродукции является одной из самых актуальных медико-социальных и демографических проблем, так как одновременно с ростом частоты семейного бесплодия наблюдается неуклонное и уже вызывающее серьезные опасения за демографические последствия увеличение доли мужского фактора в бесплодной паре.
ИНСУЛИНОРЕЗИСТЕНТНОСТЬ КАК КОМПОНЕНТ МЕТАБОЛИЧЕСКОГО СИНДРОМА (МС)
Согласно определению Международной Федерации Диабета (IDF, 2005), МС – это сочетание ожирения, инсулинорезистентности или гипергликемии, атерогенной дислипидемии, артериальной гипертонии, нарушений системы гемостаза, эндотелиальной дисфункции и хронического субклинического воспаления [12,13]. Снижение уровня тестостерона (андрогенный дефицит) все чаще сегодня рассматривается как возможно новый и патогенетически важный компонент МС у мужчин, так как доказано, что частота и выраженность андрогенного дефицита у мужчин находится в достоверной обратной связи не только с частотой и выраженностью ожирения, но и ИР и СД 2 типа [14,15]. MС – крайне распространенное заболевание в современной популяции людей независимо от пола и возраста с частотой не менее 40% [16,17]. В последние годы растет удельный вес мужского бесплодия, возникающего на фоне ожирения – ключевого компонента МС и ассоциированных с ним гормональных и метаболических нарушений, прежде всего, СД 2 типа и ИР [15]. Несмотря на это, практически никто из урологов не выставляет пациентам с мужским бесплодием диагноз ожирения и, соответственно, не занимается его лечением, хотя при ликвидации ожирения сперматогенез улучшается в большинстве случаев [15, 18, 19]. Не только ожирение (ИМТ >30), но даже просто избыток веса (индекс массы тела ИМТ=25-29) у мужчин достоверно повышают частоту бесплодия по сравнению с мужчинами, имеющими нормальный индекс массы тела (ИМТ=20-22,4) [18, 19]. Ожирение ухудшает качество эякулята за счет уменьшения его объема и повышению частоты повреждения ДНК сперматозоидов [20-22]. СД2 типа – частый спутник ожирения – может приводить к развитию ЭД и эякуляторной дисфункции, что также может вызывать нарушение доставки сперматозоидов в половые пути женщины [15, 23, 24].
В последнее время окислительная теория патогенеза мужского бесплодия становится очень популярной, при этом МС в ней играет одну из главных ролей [5,15,25,26]. Компоненты МС приводят к увеличению свободных радикалов активного кислорода в эякуляте с последующей гиперпероксидацией мембран сперматозоидов и повреждением их ДНК [5, 18, 19-28].
Таким образом, наличие МС у мужчины любого возраста с бесплодием является показанием не только для уточнения причин гормональнометаболических нарушений, но и активного поиска оксидативного стресса сперматозоидов (рис. 1.)
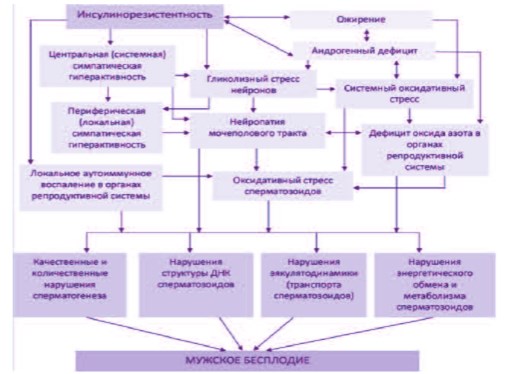
Рис. 1. Взаимосвязь компонентов метаболического синдрома и мужского бесплодия [по 15,18,19-26].
ПАТОФИЗИОЛОГИЧЕСКАЯ РОЛЬ ИНСУЛИНОРЕЗИСТЕНТНОСТИ В ПАТОГЕНЕЗЕ МУЖСКОГО БЕСПЛОДИЯ
Основная физиологическая функция инсулина сводится к поддержанию важной гомеостатической константы метаболизма человека – обеспечению нормального уровня глюкозы в крови и поддержанию адекватного обмена глюкозы как основного источника энергии внутри клетки [29, 30]. ИР, или гиперинсулинемия, являясь ключевым патогенетическим фактором МС, есть комплекс компенсаторно-приспособительных реакций, развивающихся на фоне ожирения, часто ассоциированного с андрогенным дефицитом у мужчин [30]. При развитии и прогрессировании ожирения резко снижается экспрессия гена рецептора инсулина, что ведет к уменьшению плотности рецепторов на поверхности клеток и возникновению резистентности к инсулину, а одновременное повышение уровня основного гормона жировой ткани – лептина – разрушает функциональную связь между гипофизом и гонадами, что является патогенетической основой формирования и прогрессирования андрогенного дефицита у мужчин одновременно с прогрессированием ожирения и ИР [30]. Развивающаяся ИР сопровождается гиперинсулинемией, которая в данном случае обеспечивает поддержание эффективности углеводного обмена, жизнеспособности и деления клеток [29, 30]. ИР – самая ранняя и поэтому потенциально обратимая стадия СД 2 типа, поэтому ее раннее выявление при любых соматических заболеваниях у мужчин с ожирением является важной профилактической мерой в отношении СД 2 типа и андрогенного дефицита. Ранняя диагностика ИР показана всем мужчинам репродуктивного возраста с ожирением и любыми другими компонентами МС, так как мужское бесплодие (особенно так называемое идиопатическое) может быть патогенетически связано с ИР, механизмы которой в данном случае могут сводиться к следующим:
- Раннее нарушение структуры и функции нервной ткани (гликолизный стресс), при этом первоначальные повреждения отмечаются в самых мелких периферических нервных окончаниях органов урогенитальной системы (почки, половой член, предстательная железа, яички) (эффект индукции и прогрессирования урогенитальной метаболической нейропатии)[5, 6, 27, 30].
- Нейропатия ведет к системным и местным реакциям вазоконстрикторного типа и заканчивается развитием эндотелиальной дисфункции вследствие дефицита основного вазодилататора – оксида азота NO (т.к. 90% синтеза оксида азота происходит не в эндотелии, а в терминалях нервных окончаний сосудов) [5, 31].
- Любая нейропатия ассоциируется с активацией системы перекисного окисления липидов – системным оксидативным стрессом, который является мощным повреждающим фактором для паренхимы яичек, что заканчивается нарушениями сперматогенеза (бесплодием) и (или) стероидогенеза (андрогенным дефицитом) [5, 32]. Вариантом данного системного эффекта ИР является окислительный (оксидативный) стресс сперматозоидов [5, 33, 34].
- ИР и ожирение, являясь ключевыми компонентами МС, инициируют системное хроническое воспаление (цитокиновые каскадные реакции), которые активно участвуют в реализации еще одного механизма повреждающего действия на ткань яичек (аналога окислительного стресса) – ренальной липотоксичности, приводящей к нарушению структуры ДНК сперматозоидов [5, 33-36].
Таким образом, у бесплодных молодых мужчин с ожирением при отсутствии у лечащего врача настороженности всегда имеется опасность гиподиагностики ключевого компонента МС – ИР, которая оказывает существенное негативное влияние на сперматогенез. С этой точки зрения, нам представляется, что частота идиопатического бесплодия за счет раннего выявления ИР могла бы оказаться ниже, чем об этом принято говорить. Идиопатическое бесплодие сегодня – это чаще всего бесплодие без явной урологической причины, так как проблемы репродукции у нас в стране традиционно отнесены к компетенции урологов. Наличие любых компонентов МС, эректильной дисфункции или андрогенного дефицита у инфертильного мужчины молодого и среднего возраста при отсутствии урологических причин патоспермии не является поводом для постановки урологом диагноза идиопатического бесплодия и симптоматического эмпирического лечения! С точки зрения междисциплинарного подхода такое бесплодие рассматривается как гормонально-метаболическое, а, значит, курабельное и подлежащее комплексной диагностике и патогенетической терапии, которая улучшает показатели плодовитости, достаточные либо для естественного зачатия, либо как подготовка к программам ЭКО [5, 6, 25].
ИНСУЛИНОРЕЗИСТЕНТНОСТЬ И МУЖСКОЕ БЕСПЛОДИЕ: КТО, КОГДА И КАК ДИАГНОСТИРУЕТ?
Вне всякого сомнения, что первым врачом, которого посетит пациент с бесплодием, будет уролог. Поэтому на урологов сегодня накладываются ответственные профессиональные обязанности, основанные на междисциплинарных знаниях. Урологи должны чаще и полнее использовать набор методик для исследования углеводного обмена у своих пациентов, так как число их неуклонно растет, и они достоверно ассоциируются как с ожирением, так и с андрогенным дефицитом [4-6, 15, 31, 32]. В качестве рутинного скрининга на нарушения углеводного обмена у всех больных с бесплодием следует определять уровень глюкозы и гликированного гемоглобина крови HbA1c (с 2011 года гликированный гемоглобин является стандартным методом не только определения степени компенсации СД, но и его первичной диагностики) [37]. Но при наличии у молодого пациента ожирения (окружность талии ≥94 см), анамнеза и факторов риска по СД, кожных признаков ИР и андрогенного дефицита нужен полный спектр диагностики (глюкоза, инсулин, С-пептид, HbA1c) [5]. Таким образом, задача уролога при обследовании бесплодного мужчины (особенно с ожирением) состоит в проведении максимально полного гормонально-метаболического обследования, которое должно включать не только определение основных репродуктивных гормонов (ЛГ, ФСГ, пролактин, тестостерон, ТТГ), но и скрининг на глюкозу, инсулин и С-пептид крови [38-40]. Выявить признаки индуцированной ИР урогенитальной нейропатии можно на основании простого неврологического обследования, направленного на исследование температурной, вибрационной и тактильной чувствительности полового члена (метод Калинченко-Роживанова, 2004) [41]. Кроме того, ИР имеет характерные клинические кожные проявления (симптом «грязной шеи» и «грязных локтей», папилломатоз кожи и т.д.) [4]. При выявлении соответствующих гормональных нарушений к ведению пациента с бесплодием в обязательном порядке должен быть подключен эндокринолог.
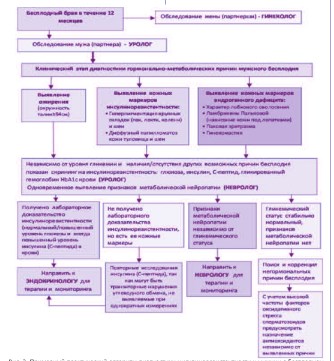
Рис. 2. Примерный практический алгоритм диагностики инсулинорезистентности у мужчин с бесплодием по [5, 6, 25, 38-40, 45].
ИНСУЛИНОРЕЗИСТЕНТНОСТЬ И МУЖСКОЕ БЕСПЛОДИЕ: КТО, КОГДА И КАК ЛЕЧИТ?
Уролог-андролог, занимающийся вопросами мужской репродукции, должен хорошо разбираться в вопросах мужской эндокринологии. Если он при обследовании мужчины с бесплодием из выше описанных групп риска выполнит необходимый лабораторный скрининг нарушений углеводного обмена, то можно считать, что врач качественно выполнил свою профессиональную задачу. Совершенно очевиден факт, что при выявлении клинических и лабораторных признаков ИР у бесплодного мужчины ее медикаментозная коррекция должна безотлагательно начинаться сразу же после постановки диагноза. Лечение таких пациентов проводится несколькими специалистами: эндокринолог проводит коррекцию выявленной ИР, а уролог проводит свой объем терапии в зависимости от наличия/отсутствия у пациента значимых урологических причин снижения фертильности. Если возникают проблемы с выявлением клинических симптомов нейропатии и необходимость ее дальнейшей терапии, то к диагностике должны привлекаться врачи-неврологи. Таким образом, диагностика и коррекция ИР у мужчин с бесплодием становится актуальной междисциплинарной проблемой современной репродуктологии (рис. 2).
Коррекция инсулинорезистентности может рассматриваться как перспективный патогенетический метод повышения эффективности комплексной терапии мужского бесплодия. Для коррекции ИР и индуцируемой ею метаболической нейропатии в настоящее время используется широкий арсенал лекарственных препаратов, среди которых ведущее значение отводится препаратам, нормализующим углеводный обмен, антиоксидантам и нейротропным средствам, причем такая медикаментозная терапия проводится на фоне активного лечения ожирения [42, 43].
Первая группа препаратов для коррекции ИР – инсулиноподобные агенты (производные сульфанилмочевины), которые стимулируют секрецию инсулина в β-клетках островков Лангерганса поджелудочной железы, и вопрос об их воздействии на ИР остается не до конца понятным [43]. Монотерапия этими инсулиновыми секретогенами у больных с МС оказывается неэффективной даже при назначении максимальных доз препаратов – наступает функциональное истощение инкреторного аппарата поджелудочной железы, поэтому в настоящее время эта группа препаратов не рекомендована для стартового лечения пациентов с ИР, так как применение производных сульфанилмочевины замыкает «порочный круг», способствуя прогрессированию как ожирения, так и ИР [43].
Вторая группа препаратов для коррекции ИР – инсулиновые сенситайзеры – представлены тремя классами: ингибиторами α-глюкозидазы (акарбоза, миглитол, воглибоза), бигуанидами (метформин) и тиазолидиндионами (глитазонами) (розиглитазон, пиоглитазон), сравнительная характеристика которых представлена в табл. 1.
Таким образом, одновременной способностью снижать глюконеогенез в печени, тормозить всасывание глюкозы в тонком кишечнике и снижать, таким образом, ИР, а также позитивными эффектами в отношении других компонентов МС (ожирение, дислипидемия, артериальная гипертония) обладают только бигуаниды [29, 30, 42, 43].
В силу своего механизма действия бигуаниды не приводят к функциональному истощению поджелудочной железы, так как действуют на инсулиновые рецепторы мышц – основного локуса метаболизма глюкозы, способствуя, таким образом, ее лучшей утилизации и ликвидации гиперинсулинемии [44]. При использовании бигуанидов не наблюдается гипогликемических эпизодов, ни у больных СД, ни у пациентов с нормогликемией. Результаты исследования DPP (Diabetes Prevention Program) с участием 3234 пациентов с высоким риском развития СД-2 установили, что прием, например, такого бигуанида, как метформин, снижает частоту развития СД2 типа на 31% по сравнению с плацебо [30]. Повышение чувствительности тканей к инсулину в результате такой терапии ведет не только к снижению гиперинсулинемии, но также к снижению массы тела (такой эффект из всех сенситайзеров есть только у метформина), снижению уровня артериального давления, улучшению липидного обмена и улучшению функции эндотелия сосудов у больных ожирением и артериальной гипертензией [30, 42]. Эти механизмы крайне важны и в патогенезе мужского бесплодия. Восстановление чувствительности гепатоцитов к инсулину снижает продукцию в печени наиболее атерогенного класса липопротеинов очень низкой плотности (ЛПОНП), в результате чего уменьшается содержание триглицеридов в крови [29, 30, 42, 43]. Наши собственные клинические наблюдения свидетельствуют не только об эффективности бигуанидов в отношении углеводного обмена, но и о его безопасности при назначении как средства патогенетической коррекции ИР у мужчин с нарушениями сперматогенеза, независимо от наличия или отсутствия других причин патозооспермии [6, 38-40, 45]. Коррекция ИР приводила к достоверному улучшению показателей спермограммы (повышению концентрации и подвижности сперматозоидов), а также к увеличению количества морфологически нормальных форм сперматозоидов, что, очевидно, связано с уменьшением выраженности оксидативного стресса сперматозоидов [40]. Дополнительно к позитивному сперматологическому эффекту происходит снижение массы тела у бесплодных мужчин с ожирением, что в свою очередь приводит у ряда из них к повышению уровня общего тестостерона в среднем на 1,0-1,5 нг/мл от исходных значений без дополнительного назначения соответствующей андрогенофармакотерапии [40]. Это очень важный эффект, так как андрогены являются основными гормонами, поддерживающими сперматогенез. При наличии клинических признаков урогенитальной нейропатии больным целесообразно одновременно с метформином назначать препараты αлипоевой кислоты как одного из наиболее активных и эффективных антиоксидантов и нейропротекторов [4, 46]. Однако, учитывая роль системного и локального (тестикулярного) оксидативного стресса как одного из ведущих этиологических факторов патогенеза бесплодия независимо от его причины, представляется патогенетически оправданным использовать мощные антиоксидантные свойства α-липоевой кислоты во всех случаях нарушения фертильности на фоне ИР, независимо от наличия или отсутствия клинических признаков нейропатии урогенитального тракта, особенно учитывая тот факт, что она развивается медленно, исподволь, не имеет патогномоничных клинических признаков на ранних стадиях, но неуклонно прогрессирует [4, 45, 46].
В настоящее время в клинической практике существует тенденция возвращения к старым и уже забытым методам фармакотерапии различных заболеваний. Такой ренессанс сегодня описан, например, для проверенных тысячелетней практикой восточной медицины адаптогенов, в частности, для красного корейского женьшеня. Осознанный возврат к ним стал возможным благодаря становлению доказательной медицины, позволившей объективно оценить уже известные метаболические эффекты женьшеня. Эффекты женьшеня в отношении психогенного компонента половых нарушений у мужчин сегодня снова стали использоваться в клинической практике, что связано с доказанным эффектом гинзеноидов женьшеня как донаторов оксида азота (NO) – основного вазомодулятора эректильной функции [47]. Данные о влиянии женьшеня на сперматогенез менее определенные, хотя еще в работах конца XX века была показана клиническая эффективность Panax Ginseng при лечении олигоастенозооспермии у мужчин с/без варикоцеле с одновременным повышением уровней тестостерона, ФСГ и 5-αДГТ в крови и одновременном снижении уровня пролактина крови [48]. Позже аналогичные позитивные гормональные изменения со стороны гипофизарно-тестикулярной системы при назначении женьшеня были показаны в других исследованиях [49-52]. Также установлено, что гинзеноиды женьшеня класса Rb2 и Rc обладают дозозависимым и временно-опосредованным эффектом на подвижность сперматозоидов, а гинзеноиды класса Rb1 также дозо-зависимо повышают концентрацию ЛГ в крови за счет прямой стимуляции его секреции в гипофизе [53-55]. Park JS et al. в экспериментальном исследовании показали способность женьшеня частично восстанавливать структуру яичек при их повреждении, и есть предположение, что этот тестикулопротективный эффект опосредован через цАМФ-зависимый механизм [56]. Не лишним эффектом женьшеня при бесплодии на фоне ожирения и ИР может оказаться липолитический и гипогликемический эффекты гинзеноидов женьшеня, установленные в клинико-экспериментальных исследованиях [57-59]. Гипогликемический эффект женьшеня связан со способностью гинзеноидов улучшать утилизацию глюкозы клетками за счет повышения чувствительности инсулиновых рецепторов и рецепторов класса PPAR-γ (ядерных рецепторов-регуляторов клеточной дифференцировки, в основном, адипоцитов), а также ингибировать липогенез, что приводит к нормализации функции инсулиновых рецепторов и снижению массы тела [60-63]. Очевидно, что гипогликемические механизмы гинзеноидов женьшеня могут оказаться аналогичными эффектам бигуанидов и глитазонов. Несмотря на эти благоприятные метаболические эффекты, рекомендовать препараты женьшеня для терапии мужского бесплодия у метаболически декомпенсированных пациентов мы считаем преждевременным – нужны дальнейшие углубленные исследования. Однако, при наличии психогенных наслоений, необходимости терапии психо-астенического синдрома и при легкой степени эректильной дисфункции (которая у 3-9% молодых мужчин с репродуктивными проблемами рассматривается как ее возможная причина) – т.е., при наличии прямых показаний к адаптогенам – назначение препаратов женьшеня можно рассматривать не только как допустимый, но и как репродуктивно безопасный компонент комплексной фармакотерапии мужского бесплодия, сочетающегося с ожирением, ИР и эректильной дисфункцией.
Таблица 1. Метаболические эффекты инсулиновых сенситайзеров [43].
| Ингибиторы α-глюкозидазы | Бигуаниды | Глитазоны | |
|---|---|---|---|
| Механизм действия | Задержка всасывания сложных углеводов в кишечнике, из просвета которого они практически не всасываются | Ингибируют глюконеогенез в печени, тормозят окисление липидов, повышают чувствительность инсулиновых рецепторов, тормозят всасывание глюкозы в кишечнике |
Предположительно, улучшают чувствительность тканей к инсулину за счет активации инсулиновых и PPAR рецепторов |
| Влияние на ИР | Уменьшают | Уменьшают | Уменьшают |
| Влияние на ожирение | Не доказано | Уменьшают | Данные неоднозначные |
| Влияние на артериальное давление |
Не доказано | Снижают | Снижают |
| Влияние на эндотелиальную дисфункцию |
Не доказано | Нормализуют | Нормализуют |
| Липидный обмен | Не доказано | Снижают триглицериды, повышают холестерин и ЛПВП |
Снижают триглицериды, повышают холестерин и ЛПВП |
| Гиперкоагуляция | Не доказано | Уменьшают | Уменьшают |
| Значимые побочные эффекты |
Очень редко (препараты из просвета кишечника практически не всасываются) |
Редко (наиболее значимый – лактозный ацидоз (<0,1%)) | Часто (нарушения функции печени (2%)) |
| Влияние на сперматогенез | Не изучено | Изучено в недоказательных исследованиях | Не изучено |
ЗАКЛЮЧЕНИЕ
Ранняя диагностика и патогенетическая фармакологическая коррекция ИР у мужчин с бесплодием может оказаться одним из эффективных путей решения вопроса идиопатического бесплодия, когда возможности урологов по диагностике и лечению профильных причин бесплодия исчерпаны. Однако независимо от этого, выявление и коррекция ИР должна проводиться у всех бесплодных мужчин, страдающих ожирением. Вот почему диагностика и лечение мужского бесплодия сегодня должны проводиться командой врачей, которая способна обеспечить комплексный подход и сделать диагностику причин бесплодия максимально патогенетической с последующим выходом на такую же патогенетическую фармакотерапию.
Это настоятельные требования XXI века – века патогенетической и профилактической медицины и междисциплинарных взаимодействий. Поэтому современный уролог из хирурга должен превращаться в клинициста и активно взаимодействовать со смежными специалистами (эндокринологами, терапевтами, неврологами). Если этого не произойдет, то имеется большая вероятность того, что при решении мужских репродуктивных проблем в нашей стране уролог скоро будет простым диспетчером, который выписывает семейной паре исключительно направления в клиники репродукции, поскольку мы не в состоянии остановить мировую эпидемию «болезней цивилизации», которые сегодня являются ведущими системными патофизиологическими инициаторами оксидативного стресса сперматозоидов, клинически заканчивающегося мужским бесплодием.
ЛИТЕРАТУРА
1. Examination and processing of human semen. World Health Organization: Geneva, Switzerland, 2010. 286 р.
2. Jungwirth A., Diemer T., Dohle G.R.A. et al. Male Infertility Guideline. European Association of Urology, 2013. 60 р.
3. Сухих Г.Т., Назаренко Т.А. (ред.). Бесплодный брак. Руководство. М.: ГЭОТАРМедиа, 2010. 784 с.
4. Калинченко С.Ю., Тюзиков И.А. Практическая андрология. М.: Практическая медицина, 2009. 400 с.
5. Тюзиков И.А. Метаболический синдром и мужское бесплодие // Андрология и генитальная хирургия. 2013. № 2. С. 5-10.
6. Тюзиков И.А. Скрытые нарушения метаболизма как возможная причина мужской инфертильности // Международная научно-практическая конференция, посвященная 100летию кафедры урологии и андрологии С-ПбМАПО «Актуальные вопросы урологии и андрологии». Сборник материалов. Санкт-Петербург, 2011. С. 227-230.
7. Здравоохранение в России. 2005. Стат. сборник. М: Росстат, 2005.
8. Предположительная численность населения Российской Федерации до 2025 года. Ежегодный справочник. М: Федеральная служба государственной статистики РФ, 2005.
9. World population ageing 1950-2050. Executive Summary. New York: United Nations Population Division, 2001.
10. World Population Prospects: The 2000 revision. New York: United Nations Population Division; 2000.
11. Kupelian V., Shabsigh R., Araujo A.B. Erectile dysfunction as a predictor of the metabolic syndrome in aging men: results from the Massachusetts Male Aging Study // J. Urol. 2006. № 176. Р. 222–226.
12. Alberti G. Introduction to the metabolic syndrome //Eur. Heart J. 2005. № 7, Suppl. D. Р. 3–5.
13. Huang P.L. A comprehensive definition for metabolic syndrome // Dis. Model. Mech. 2009. № 2. Р. 231–237.
14. Kalyani R.R., Dobs A.S. Androgen deficiency, diabetes and the metabolic syndrome in men // Curr. Opin. Endocrinol. Diabetes Obes. 2007. № 14. Р. 226–234.
15. Gorbachinsky I., Akpinar H., Assimos D.G. Metabolic Syndrome and Urological Diseases // Rev. Urol. 2010. № 12(4). Р. 157-180.
16. Flegal K.M., Carroll M.D., Ogden C.L. et al. Prevalence and trends in obesity among US adults, 1999–2000 // JAMA. 2002. № 288. Р. 1723–1727.
17. Geiss L.S., Pan L., Cadwell B. Changes in incidence of diabetes in U.S. adults, 1997–2003 // Am. J. Prev. Med. 2006. № 30. Р. 371–377.
18. Nguyen R.H., Wilcox A.J., Skaerven R. et al. Men’s body mass index and infertility // Hum Reprod. 2007. № 2. Р. 2488–2493.
19. Ohwaki K., Endo F., Yano E. Relationship between body mass index and infertility in healthy male Japanese workers: a pilot study // Andrologia. 2009. №41. Р. 100–104.
20. Chavarro J.E., Toth T.L., Wright D.L. et al. Body mass index in relation to semen quality, sperm DNA integrity, and serum reproductive hormone levels among men attending an infertility clinic // Fertil. Steril. 2010. № 93. Р. 2222–2231.
21. Hammoud A.O., Wilde N., Gibson M. et al. Male obesity and alteration in sperm parameters // Fertil. Steril. 2008. № 90. Р. 2222–2225.
22. Fejes I., Koloszár S., Szöllosi J. et al. Is semen quality affected by male body fat distribution? // Andrologia. 2005. № 37. Р. 155–159.
23. el-Rufaie O.E., Bener A., Abuzeid M.S. et al. Sexual dysfunction among type II diabetic men: a controlled study // J. Psychosom. Res. 1997. № 43. Р. 605–612.
24. Bener A., Al-Ansari A.A., Zirie M. et al. Is male fertility associated with type 2 diabetes mellitus? // Int. Urol. Nephrol. 2009. № 41. Р. 777–784.
25. Тюзиков И.А., Греков Е.А. Новая метаболическая концепция патогенеза идиопатического мужского бесплодия // Здравоохранение Таджикистана. 2011. № 3. С. 392-394.
26. Божедомов В.А., Громенко Д.С., Ушакова И.В. и др. Причины оксидативного стресса сперматозоидов // Материалы IV Конгресса «Мужское здоровье». М., 2008. С. 209.
27. Vinik A.I., Maser R.E., Mitchell B.D. et al. Diabetic autonomic neuropathy // Diabetes Care. 2003. № 26. Р. 1553–1579.
28. Kasturi S.S., Tannir J., Brannigan R.E. The metabolic syndrome and male infertility // J. Androl. 2008. № 29. Р. 251–259.
29. Rustenbeck I. Desensitization of insulin secretion // Biochem Pharmacol. 2002. № 63. Р. 1921–1935.
30. Knowler W.C., Barrett-Connor E., Fowler S.E. Diabetes Prevention Program Research Group. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin // N. Engl. J. Med. 2002. № 346.Р. 393-403.
31. Yassin A.A., El-Sakka A.I., Saad F., Gooren L.J. Metabolic syndrome, testosterone deficiency and erectile dysfunction never come alone // Andrologia. 2008. № 40. Р. 259–264.
32. Blaak E. Gender differences in fat metabolism // Curr. Opin. Clin Nutr. Metab. Care. 2001. № 4. Р. 499–502.
33. Sarkar O., Bahrainwala J., Chandrasekaran S. et al. Impact of inflammation on male fertility // Front. Biosci. (Elite Ed). 2011. № 3. Р. 89–95.
34. Tremellen K. Oxidative stress and male infertility – a clinical perspective // Hum. Reprod. Update 2008. № 14 (3). Р. 243–258.
35. Божедомов В.А., Ушакова И.В., Спориш Е.А. и др. Роль гиперпродукции активных форм кислорода в мужском бесплодии и возможности антиоксидантной терапии (обзор литературы) // Consilium Medicum. 2012. № 7. С. 51-55.
36. Schaffer J.E. Lipotoxicity: when tissues overeat // Curr Opin Lipidol. 2003. № 14. Р. 281–287.
37. Global IDF/ISPAD Guideline for Diabetes in Childhood and Adolescence. International Diabetes Federation, 2011. 131 р.
38. Тюзиков И.А. Инсулинорезистентность и мужское бесплодие: диагностика и возможности медикаментозной коррекции // Материалы Всероссийcкой научно-практической конференции с международным участием «Рациональная фармакотерапия в урологии-2011». М., 2011. С. 148-149.
39. Тюзиков И.А. Возможности метаболической терапии бесплодия у молодых мужчин с ожирением // Материалы VII Всероссийского конгресса «Мужское здоровье». Ростов-на-Дону, 2011. С. 288-290.
40. Тюзиков И.А., Калинченко С.Ю., Мартов А.Г. Роль коррекции метаболического статуса при репродуктивных нарушениях у мужчин // Материалы X Всероссийского Форума с международным участием «Мужское здоровье и долголетие». М., 2012. С. 95-96.
41. Коган М.И., Калинченко С.Ю. Нарушения половой функции у мужчин при сахарном диабете. М., 2005. 224 с.
42. Бернштейн Л.М. Антидиабетический бугуанид метформин и онкологическая заболеваемость // Сахарный диабет. 2010. № 3. С. 3-6.
43. Ройтберг Г.Е. (ред.). Метаболический синдром. М.: МЕДпресс-информ, 2007. 224 с.
44. Perrielo G., Misericordia P., Volpi E. et al. Acute antihyperglycemic mechanism of metformini in NIDDM. Evidence of suppression of lipid oxidation and hepatic glucose production // Diabetes. 1994. № 43. Р. 920-928.
45. Тюзиков И.А. Системная метаболическая терапия мужского бесплодия, ассоциированного с ожирением и инсулинорезистентностью // Материалы Пленума Российского Общества урологов. Кисловодск, 2011. С. 415-416.
46. Ворслов Л.О., Калинченко С.Ю., Гадзиева И.В. «Квартет здоровья» против «смертельного квартета». Часть первая: метаболическая невропатия – легко диагностировать, трудно лечить // Эффективная фармакотерапия. Урология. 2013. № 1. С. 38-47.
47. Тюзиков И.А. Ренессанс фитоадаптогенов в современной терапии эректильной дисфункции: от эмпирического применения до научно обоснованного клинического эффекта // Справочник поликлинического врача. 2012. № 11. С. 68-80.
48. Salvati G., Genovesi G., Marcellini L. et al. Effects of C.A. Meyer saponins on male fertility // Panminerva Med. 1996. № 38(4). Р. 249-254.
49. Chen J.C., Xu M.X., Chen L.D. et al. Effect of Panax notoginseng saponins on sperm motility and progression in vitro // Phytomedicine. 1998. № 5(4). Р. 289-292.
50. Jang M., Min J.W., In J.G., Yang D.C. Effects of red ginseng extract on the epididymal sperm motility of mice exposed to ethanol // Int. J. Toxicol. 2011. №30(4). Р. 435-442.
51. Yang W.M., Park S.Y., Kim H.M. et al. Effects of Panax ginseng on glial cell-derived neurotrophic factor (GDNF) expression and spermatogenesis in rats // Phytother . Res. 2011. № 25(2). Р. 308-311.
52. Sawiress F.A., Ziada M.S., Bebawy W.S., Amer H.A. Effect of ginseng extract supplementation on testicular functions in diabetic rats // Endocr. Regul. 2011. № 45(3). Р. 139-148.
53. Chen J.C., Chen L.D., Tsauer W. et al. Effects of Ginsenoside Rb2 and Rc on inferior human sperm motility in vitro // Am. J. Chin. Med. 2001. № 29(1). Р.155-160.
54. Tsai S.C., Chiao Y.C., Lu C.C., Wang P.S. Stimulation of the secretion of luteinizing hormone by ginsenoside-Rb1 in male rats // Chin. J. Physiol. 2003. №46(1). Р. 1-7.
55. Hwang S.Y., Kim W.J., Wee J.J. et al. Panax ginseng improves survival and sperm quality in guinea pigs exposed to 2,3,7,8-tetrachlorodibenzop-dioxin // BJU Int. 2004. №94(4). Р. 663-668.
56. Park W.S., Shin D.Y., Kim do R. et al. Korean ginseng induces spermatogenesis in rats through the activation of cAMP-responsive element modulator (CREM) // Fertil. Steril. 2007. №88(4). Р. 1000-1002.
57. Jeon W.J., Oh J.S., Park M.S., Ji G.E. Anti-hyperglycemic effect of fermented ginseng in type 2 diabetes mellitus mouse model // Phytother. Res. 2013. № 27(2). Р. 166-172.
58. Liu Z., Li W., Li X. et al. Antidiabetic effects of malonyl ginsenosides from Panax ginseng on type 2 diabetic rats induced by high-fat diet and streptozotocin // J. Ethnopharmacol. 2013. № 145(1). Р. 233-240.
59. Shergis J.L., Zhang A.L., Zhou W., Xue C.C. Panax ginseng in Randomised Controlled Trials: A Systematic Review // Phytother. Res. 2012 Sep 12. doi: 10.1002/ptr.4832. [Epub ahead of print].
60. Hong Y.J., Kim N., Lee K. et al. Korean red ginseng (Panax ginseng) ameliorates type 1 diabetes and restores immune cell compartments // J. Ethnopharmacol. 2012;144(2):225-33.
61. Lee H.M., Lee O.H., Kim K.J., Lee B.Y. Ginsenoside Rg1 promotes glucose uptake through activated AMPK pathway in insulin-resistant muscle cells // Phytother. Res. 2012. № 26(7). Р. 1017-1022.
62. Vuksan V., Sung M.K., Sievenpiper J.L. et al. Korean red ginseng (Panax ginseng) improves glucose and insulin regulation in well-controlled, type 2 diabetes: results of a randomized, double-blind, placebo-controlled study of efficacy and safety // Nutr. Metab. Cardiovasc. Dis. 2008. № 18(1). Р.46-56.
63. Gu W., Kim K.A., Kim D.H. Ginsenoside Rh1 ameliorates high fat diet-induced obesity in mice by inhibiting adipocyte differentiation // Biol. Pharm. Bull. 2013. № 36(1). Р. 102-107.







