При повреждении семенников, как и любых других органов, ограниченных физиологическими барьерами, происходит стимуляция лимфоидного аппарата, сопровождающаяся образованием специфических аутоантител, направленных против антигенов этого органа [1]. В результате этой аутоагрессии, вызванной антителами, происходит серьезное разрушение органа, останавливающее регенераторные процессы в нем.
Развитие мужского аутоиммунного бесплодия может возникать как следствие механического, инфекционного или иного повреждения яичек, приводящего к нарушению целостности гемато-тестикулярного барьера (ГТБ), который является исключительно важным в процессе протекания нормального сперматогенеза [2, 3, 4]. Важно понимать, что ГТБ включает в себя не только анатомический барьер из тесных контактов, ограничивающий проход молекул и клеток в просвет канальцев, но содержит и другие компоненты. Физиологическая часть барьера состоит из специфических транспортеров в базолатеральной и апикальной мембранах клеток Сертоли, регулирующих движение различных веществ через просвет каждого канальца. В отличие от тесных контактов, это чрезвычайно динамическая структура, в которой транспорт определенных молекул и ионов, соответственно потребностям сперматогенеза, меняется не только от клетки к клетке, но и от переднего конца отдельной клетки к ее окончанию. Его функциональное значение заключается в создании уникального микроокружения, необходимого для обеспечения нормального сперматогенеза [5].
Иммунологическая составляющая барьера ограничивает доступ иммунной системы в орган и изолирует большую часть аутоантигенных половых клеток, поддерживая иммунологическую привилегированность яичка. Так, на развивающихся сперматогенных клетках и зрелых сперматозоидах отсутствуют антигены MHC-комплекса, что снижает вероятность их атаки иммунной системой. Кроме того, клетки Сертоли вырабатывают Fas-лиганд, который, связываясь с Fas-рецептором на поверхности лимфоцитов, запускает сигнал апоптоза лимфоцитов, проникших в паренхиму яичка. Также семенная жидкость обладает иммуносупрессивным эффектом, который обусловлен ее компонентами, в частности трансформирующим фактором роста-β (TGFB3) [6]. В обеспечении иммуносупрессии участвуют и клетки Лейдига, продуцирующие тестостерон. Известно, что андрогены, как и другие стероидные гормоны, способны ослаблять иммунный ответ [7,8]. Таким образом, можно говорить о том, что иммунологическая толерантность к семеннику – это не пассивно существующий феномен, а процесс активного взаимодействия клеток семенника и иммунной системы.
Исследования нарушений сперматогенеза в результате изменения проницаемости ГТБ, а также моделирование повреждения барьера в эксперименте, могут прояснить его роль в процессах поддержания нормальной физиологической регенерации. Кроме того, это поможет определить влияние степени нарушения ГТБ на динамику репаративных регенераторных процессов.
В связи с этим, целью настоящей работы явилось изучение репаративной регенерации семенников при различных повреждениях гемато-тестикулярного барьера.
МАТЕРИАЛ И МЕТОДЫ
Исследование проведено на 45-ти беспородных половозрелых крысахсамцах массой от 200-250 гр. Условия содержания и обращение с используемыми в эксперименте животными соответствовали Директиве Совета ЕС от 24 ноября 1986 г. «О сближении законов, постановлений и административных положений государств ЕС по вопросам защиты животных, используемых для экспериментальных и других научных целей» (86/609ЕЕС). Животных содержали по 5-7 в клетке, при температуре 20-22°С и в свободном доступе к воде и пище.
Экспериментальные животные в условиях опыта были распределены на 3 основные группы. Первая группа: интактные животные (n=5). Вторая группа: 1-я экспериментальная группа (n=15) – крысы, которым было проведено локальное разрушение всех отделов ГТБ путем прокола одного из семенников иглой диаметром 3 мм с последующим наложением шва на поврежденный участок. Операцию проводили под общим эфирным наркозом. Третья группа: экспериментальная группа (n=15) – крысы, которым было проведено тотальное разрушение одного из отделов ГТБ, контактов между клетками Сертоли, путем введения в бедренную мышцу раствора CdCl₂ в концентрации 1,75 мг/кг. Разведение осуществляли в 0,9% растворе NaCl. Выбор концентрации CdCl₂ осуществляли на основании литературных данных [9, 10, 11] и предварительных экспериментов. Подбор концентрации хлорида кадмия в 0,01мг/кг, 0,1мг/кг 0,5мг/кг, 1мг/кг и 1,75мг/кг проводился на группе из 10 крыс. Реакция проверялась на первые сутки после инъекции.
Забор семенников проводили на 1-е, 7-е и 14-е сутки после воздействия. Животных выводили из эксперимента путем передозировки наркоза (эфиром). Семенники фиксировали в 10%-ном формалине. Далее органы промывали, обезвоживали в спиртах возрастающей концентрации и в хлороформе, затем пропитывали парафином и готовили парафиновые блоки. Полученные срезы толщиной 5 мкм окрашивали гематоксилином и эозином.
Оценку различных показателей проводили на световом микроскопе Leica DM 5000 B, оснащенном камерой Leica DFC 490 с помощью программы SIAMS MesoPlant. На препаратах измеряли показатели, свидетельствующие о ходе репарации в семенной железе: 1) диаметр семявыносящего канальца; 2) площадь поперечного сечения семенного канальца; 3) средний индекс сперматогенеза, который рассчитывали на поперечном срезе семенника по 4-балльной системе (с учетом количества слоев эпителиальных клеток в каждом канальце). Если в канальце имеется 4 слоя сперматогенного эпителия: сперматогонии, сперматoциты 1-го и 2-го порядка, сперматиды и сперматозоиды, то этот каналец получает оценку 4 балла, если в канальце присутствуют первые 3 слоя – 3 балла, если 2 слоя – 2 балла, и т.д. Средний индекс сперматогенеза определяли по формуле J=Ʃa/А, где J-индекс сперматогенеза, а-количество слоев сперматогенного эпителия, А-количество подсчитанных канальцев; 4) среднее число сперматогониев в канальце; 5) сперматоцитограмма, подсчет которой производили путем деления общего числа зародышевых клеток различных типов (сперматогонии, сперматоциты, сперматиды) на общее число клеток Сертоли; 6) количество нефункционирующих канальцев.
Кроме этого, изучали состояние лимфоидных органов и периферической крови. Анализ периферической крови проводили на гематологическом анализаторе «Celly 70 Biocode Hycel». Подсчет лейкограммы производили в мазках крови. Оценивали массу и клеточность селезенки и тимуса. На гистологических срезах в селезенке оценивали: процентное содержание белой и красной пульпы, толщину капсулы. В тимусе: процентное содержание коркового и мозгового вещества, толщину капсулы.
Статистическую обработку данных проводили с использованием непараметрических методов статистики («Statistica 7.1»). Сравнение групп выполняли с использованием критерия Манна-Уитни. Различия считали достоверными при p<0,05.
РЕЗУЛЬТАТЫ
Для изучения репаративной регенерации семенников при локальном разрушении ГТБ были проведены эксперименты с проколом одного из семенников и получены следующие результаты.
При проколе одного из семенников не наблюдается достоверных изменений веса как оперированного, так и неповрежденного органа по сравнению с группой интактных животных на все сроки эксперимента. Мы не получили достоверных данных об изменении веса поврежденного органа, в отличие от литературных данных, где этот показатель достоверно снижается в опытной группе[12].
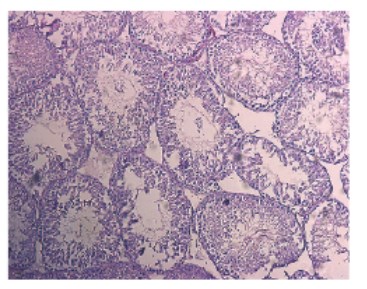
Рис. 1. Срез семенника крысы на 1-е сутки после прокола. Окраска гематоксилином и эозином. Увеличение x100
В результате механического разрушения структуры семенников происходит нарушение архитектоники (рис. 1) и достоверное уменьшение диаметра и площади семенных канальцев на 1-е сутки после эксперимента. Достоверно снижается индекс сперматогенеза и возрастает число слущенных канальцев (табл. 1). На 7-е сутки сперматогенез еще больше ухудшается (рис. 2), возрастает число нефункционирующих канальцев по сравнению с ранним сроком. В несколько раз падает число сперматогониев – полипотентных стволовых клеток сперматогенного эпителия, что говорит об угнетении сперматогенеза. Через две недели после повреждения (рис. 3) еще больше канальцев не осуществляют сперматогенез, значение индекса сперматогенеза также достоверно ниже показателя интактной группы. В то же время показатели диаметра и площади канальцев возвращаются к норме, а число сперматогониев хоть и снижено, но достоверно больше значения на 7-е сутки после эксперимента, что, по-видимому, свидетельствует о возрастающей регенераторной активности ткани (табл. 1). Сперматоцитограмма на 1-е сутки достоверно снижается, что связано с выходом половых клеток из канальцев при их повреждении. Увеличение показателя сперматоцитограммы через неделю относительно интактной группы и раннего срока, скорее всего, связано с падением числа клеток Сертоли. На 14-е сутки значение сперматоцитограммы также достоверно ниже показателя интактной группы, однако уже находится на уровне значения прокола 1-х суток с тенденцией к возрастанию, что может являться началом восстановительной активности (рис. 4).
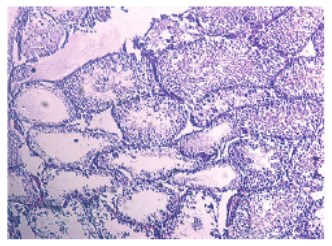
Рис. 2. Срез семенника крысы на 7-е сутки после прокола. Окраска гематоксилином и эозином. Увеличение x100
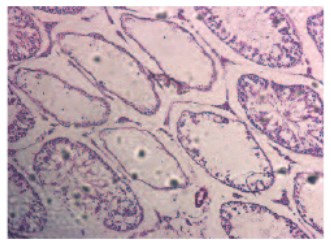
Рис. 3. Срез семенника крысы на 14-е сутки после прокола. Окраска гематоксилином и эозином. Увеличение x100
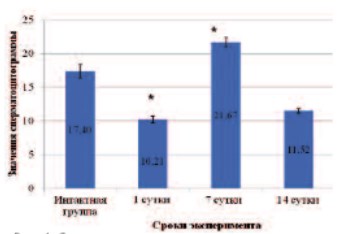
Рис. 4. Спермацитограмма крыс на различных сроках после прокола *данные достоверны по сравнению с интактной группой при p<0,05; #данные достоверны по сравнению с Проколом 1 сутки при p<0,05
Таблица 1. Гистологические показатели семенников крыс после прокола
| Показатели | Интактная группа |
Прокол семенника | ||
|---|---|---|---|---|
| 1 сутки | 7 сутки | 14 сутки | ||
| Средний диаметр канальцев, мкм | 307±12 | 244±7,5* | 232±6,64* | 296±14,5# |
| Средняя площадь канальцев, мкм2 | 74450±5800 | 46912±2932* | 42521±2424* | 69276±6767# |
| Средний индекс сперматогенеза | 3,6±0,07 | 3,12±0,10* | 3,26±0,09* | 3,14±0,1* |
| Среднее количество нормальных сперматогониев |
45,4±7 | 61,22±5,69 | 15±0,41* | 24,72±1,16* |
| Число нефункционирующих канальцев, % |
0 | 1,4±0,24* | 4±1,26*# | 9±3,67*# |
* данные достоверны по сравнению с интактной группой при p<0,05;
#данные достоверны по сравнению с проколом 1 сутки при p<0,05
Для изучения репаративной регенерации семенников при тотальном разрушении только одного компонента ГТБ, а именно контактов между клетками Сертоли, были проведены эксперименты с введением кадмия.
Ранее проведенные исследования токсичности кадмия показали, что под его действием происходит повреждение эндотелия в семенниках. Причиной тому является утрата тесных контактов эндотелиального барьера. В результате развивается отек, сопровождающийся увеличением давления жидкости в ткани, возникает ишемия, и, в итоге, некроз ткани [13]. Подобным образом кадмий воздействует и на тесные контакты клеток Сертоли. Небольшая доза кадмия теоретически не должна повредить эндотелию сосудов семенников, но при этом разрушит тесные контакты, путем нарушения организации пучков микрофиламентов клеток Сертоли в базальном слое [9]. Поэтому очень важен подбор нужной дозировки инъекции. В экспериментальном нарушении целостности ГТБ in vivo разными исследователями использовались различные дозы CdCl2: от 1мг/кг до 3мг/кг [9, 10, 11]. Для своей работы мы пробовали вводить различную дозировку CdCl2 беспородным крысам самцам от 0,001мг/кг до 1,75мг/мл. Целью этого было выявить пороговую дозу, вызывающую заметные гистологические изменения в семенных канальцах сравнению с интактным органом (нарушение архитектоники, сдвиг соотношения половых клеток разных стадий созревания). Несмотря на то, что при введении 1мг/кг CdCl2 изменяется организация пучков микрофиламентов клеток Сертоли базального слоя, на первые сутки после введения CdCl2 никаких гистологических нарушений выявить не удалось. Тем самым было принято решение попробовать увеличить дозу внутримышечной инъекции СdCl2 до 1,75мг/кг. Также как и в работе Naomi ED, Piner JA, Sharpe RM с использованием разных концентраций кадмия [10] через сутки после введения гистологическая картина свидетельствовала о нарушении тканей семенников, а показатели крови и лимфоидных органов указывали на развитие аутоиммунной реакции. В связи с этим данная концентрация была принята в качестве рабочей.
На 7-е и 14-е сутки при введении CdCl₂ масса семенников на 100 г массы тела падает практически в 2 раза по сравнению с группой интактных животных. Это свидетельствует о серьезной потере структурно-функциональной активности семенника, а также о некротических процессах в тканях.
На гистологических препаратах при введении CdCl₂ отмечается достоверное увеличение диаметра и площади семенных канальцев на первые сутки, что можно отнести к реакции соединительной ткани на повышенную проницаемость для различных веществ и иммунокомпетентных клеток (табл. 2). Из-за нарушения целостности стенок семенных канальцев достоверно снижается индекс сперматогенеза, то есть стадии образования и созревания половых клеток.
Через 7 суток после введения CdCl₂ разрушение ГТБ вызывает некроз большей части канальцев и нарушение их архитектоники, диаметр и площадь канальцев достоверно снижается ниже нормы. Также еще больше снижается индекс сперматогенеза, что указывает на развивающейся иммунный ответ на повреждение. Падает в несколько раз и уровень нормальных сперматогониев – стволового резерва семенного эпителия. Достоверно возрастает число нефункционирующих канальцев. На второй неделе наблюдается полное некротизирование тканей семенника, что свидетельствует о невозможности протекания сперматогенеза (рис. 5-7).
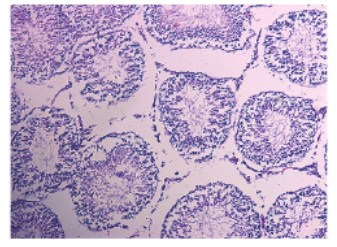
Рис. 5. Срез семенника крысы на 1-е сутки после введения СdCl2 1,75мг/кг. Окраска гематоксилином и эозином. Увеличение x100
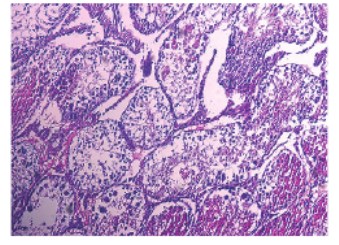
Рис. 6. Срез семенника крысы на 7-е сутки после введения СdCl2 1,75мг/кг. Окраска гематоксилином и эозином. Увеличение x100
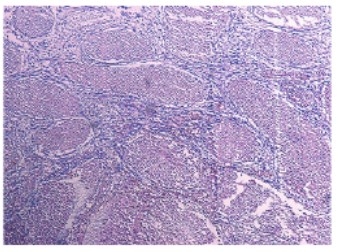
Рис. 7. Срез семенника крысы на 14-е сутки после введения СdCl2 1,75мг/кг. Окраска гематоксилином и эозином. Увеличение x100
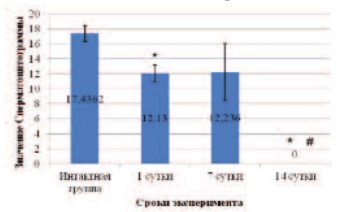
Рис. 8. Спермацитограмма крыс на различных сроках после введения СdCl2 *данные достоверны по сравнению с интактной группой при p< 0,05; # данные достоверны по сравнению с СdCl2 1 сутки при p< 0,05
Морфологические данные, приведенные выше, подтверждаются падением сперматоцитограммы на 1-е и 7-е сутки, а на 14-е сутки подсчет числа половых клеток, приходящихся на 1 клетку Сертоли, уже и вовсе невозможен, что еще раз доказывает нарушение нормальной функциональной активности этих клеток (рис. 8).
На 1-е сутки после одностороннего прокола семенника происходит расширение коркового вещества тимуса и сужение мозгового, которое сохраняется до 14 суток эксперимента, что указывает на развитие специфического иммунного ответа в ответ на повреждение иммунопривилегированного органа. После инъекции хлорида кадмия расширение коркового вещества и сужение мозгового вещества тимуса происходит только на 7-е сутки, а на 14-е сутки происходит небольшое снижение этого показателя, не достигающего нормы. Это указывает на некоторое снижение функциональной активности тимуса, в связи с высоким иммунным напряжением в результате доступа иммунокомпетентных клеток к антигенам сперматогенного эпителия.
На 1-е сутки после прокола одного из семенников происходит расширение белой пульпы селезенки и сужение красной пульпы, что может быть связано с притоком иммунокомпетентных клеток в лимфоидные фолликулы селезенки. Уже на 7-е сутки после воздействия процентное соотношение белой и красной пульпы достигает показателя интактных животных и остается неизменным и на 14-е сутки. На 1-е сутки после нарушения контактов между клетками Сертоли хлоридом кадмия происходит расширение белой пульпы и сужение красной пульпы селезенки, которое сохраняется вплоть до 14 суток. Это говорит о высокой функциональной активности органа на все сроки эксперимента.
При проколе и воздействии хлоридом кадмия отмечается лейкоцитоз, который в большей степени связан с увеличением количества лимфоцитов и моноцитов, но при проколе он развивается только на 7-е сутки в отличие от воздействия кадмием, и сохраняется на высоком уровне до 14 суток. Сохранение лейкоцитоза на поздних сроках указывает на развитие специфического аутоиммунного ответа. Лимфоциты вырабатывают антитела к антигенам половых клеток и, таким образом, обеспечивают хроническое протекание данного процесса.
Таблица 2. Гистологические показатели семенников крыс при введении CdCl₂ (1,75 мг/кг)
| Показатели | Интактная группа | Введение CdCl₂ | ||
|---|---|---|---|---|
| 1 сутки | 7 сутки | CdCl₂ 14 сутки |
||
| Средний диаметр канальцев, мкм | 307±12 | 355±7* | 265±11*# | 344±13,6 |
| Средняя площадь канальцев, мкм2 | 74450±5800 | 99086±3975* | 55526±4493*# | 93845±7563 |
| Средний индекс сперматогенеза | 3,6±0,07 | 2,98±0,13* | 2,5±0,21* | 0,04±0,01*# |
| Среднее количество нормальных сперматогониев |
45,42±7 | 54,8±3,53 | 12,92±4,56*# | 0,75±0,67*# |
| Число нефункционирующих канальцев, % |
0 | 1,6±0,8 | 3±0,4* | 0,5±0,2 |
* данные достоверны по сравнению с интактной группой при p<0,05;
# данные достоверны по сравнению с СdCl2 1 сутки при p<0,05
ОБСУЖДЕНИЕ
При проведении сравнительного анализа полученных данных были выявлены схожие изменения протекания репаративных процессов в семенниках на ранних сроках после различных видов повреждения ГТБ.
Так, в семенниках крыс обеих экспериментальных групп отмечаются нарушения архитектоники канальцев семенника и сперматогенеза: значения массы семенников, диаметра семенных канальцев, индекса сперматогенеза, сперматоцитограммы и числа нормальных сперматогониев достоверно падают.
На более позднем сроке (14-е сутки) при проколе часть показателей сперматогенеза возвращается к значениям интактных животных. Так, восстанавливается сперматоцитограмма, достоверно увеличивается число сперматогоний, что свидетельствует о развитии регенераторной активности в семенной железе. При введении хлорида кадмия отмечается противоположная ситуация. Ввиду практически полного отсутствия как сперматогенных клеток, так и клеток Сертоли, говорить о каких-либо регенераторных процессах нельзя.
При проколе семенника разрушаются все структуры ГТБ, однако это разрушение носит локальный характер и, несмотря на то, что деструктивные процессы распространяются и на неповрежденные иглой семенные канальцы, объем высвободившихся антигенов, а соответственно и иммунный ответ сравнительно не большие. Это оставляет возможность сохранения регенераторноактивных тканевых участков и потенциального восстановления сперматогенеза. Низкая доза хлорида кадмия нарушает лишь структуру тесных контактов между клетками Сертоли, однако это происходит тотально во всем семеннике и обширность этого воздействия ведет к более значительным изменениям по сравнению с проколом. Это может быть связано с более агрессивным ответом иммунной системы, что приводит к необратимому нарушению сперматогенеза, развитию некроза и бесплодию.
ЗАКЛЮЧЕНИЕ
Морфофункциональные особенности семенников после локального разрушения всех структур гемато-тестикулярного барьера путем прокола свидетельствуют о развитии деструктивных процессов семенных канальцев на ранних сроках, сменяющихся на поздних активацией репаративной регенерации органа. При тотальном разрушении тесных контактов клеток Сертоли гемато-тестикулярного барьера хлоридом кадмия в семеннике отмечается развитие деструктивных процессов, переходящих в некротические, что свидетельствует о невозможности восстановления семенников после данного воздействия. Степень разрушения гемато-тестикулярного барьера оказывает существенное влияние на ход репаративных процессов в поврежденных семенниках, причем при разрушении контактов между клетками Сертоли возможность этого процесса весьма затруднительна.
ЛИТЕРАТУРА
1. Черешнев В.А., Юшков Б.Г., Климин В.Г. Иммунофизиология. Екатеринбург: УрО РАН, 2002. 260 с.
2. Божедомов В.А., Теодорович О. В. Эпидемиология и причины аутоиммунного мужского бесплодия. // Урология. 2005. №1. С. 35–44.
3. Cheng CY, Mruk DD. Cell junction dynamics in the testis: Sertoli germ cell interactions and male contraceptive development. // Physiol Rev. 2002. Vol. 82. P. 825–874.
4. Mazumdar S, Levine AS. Antisperm antibodies: etiology, pathogenesis, diagnosis, and treatment. // Fertil Steril. 1998. Vol. 70. P. 799-810.
5. Setchell BP. Blood-testis barrier, junctional and transport proteins and Spermatogenesis. // Adv Exp Med Biol. 2008. Vol. 636. P. 212–233.
6. Lee J, Richburg JH, Younkin SC, Boekelheide K. The Fas system is a key regulator of germ cell apoptosis in the testis. // Endocrinology. 1997. Vol. 138. P. 2081–2088.
7. Fijak M, Meinhardt A. The testis in immune privilege. // Immunol Rev. 2006. Vol. 213. P. 66–81.
8. Lu T, Tian L, Han Y, Vogelbaum M, Stark GR. Dose-dependent cross-talk between the transforming growth factor-b and interleukin-1 signaling pathways. // Proc Natl Acad Sci USA. 2007. Vol. 104. P. 4365–4370.
9. Hew KW, Heath GL, Jiwa AH, Welsh MJ. Cadmium in vivo causes disruption of tight junction-associated microfilamentsin rat sertoli cells. // Biol Reprod. 1993. Vol. 49. P. 840–849.
10. Elkin ND, Piner JA, Sharpe RM. Toxicant-induced leakage of germ cell–specific proteins from seminiferous tubules in the rat: relationship to blood-testis barrier integrity and prospects for biomonitoring. // Toxicol Sci. 2010. Vol. 117, № 2. P. 439–448.
11. Cheng CY, Mruk DD. The blood-testis barrier and its implications for male contraception. // Pharmacol Rev. 2012. Vol. 64. P. 16 – 64.
12. Райцина С.С. Сперматогенез и структурные основы его регуляции. М.: Наука, 1985. 207 с.
13. Gazdik T, Kaminski M. Ultrastructural study of development of the rat testis after injecting CdCI2. // Folia Morphol. 1984. Vol. 32. P. 218-222.







