Несмотря на значительный прогресс в области иммунологии и иммуносупрессии, острое и хроническое отторжение является важнейшей причиной потери функции пересаженных органов. Актуальность адекватной профилактики данного явления не вызывает сомнения.
Лечебные антитела являются одной из наиболее динамично развивающихся фармакологических групп. Антитела, относящиеся биотерапевтическим средствам, имеют существенные отличия от классических иммуносупрессантов. Антителам свойственна высокая избирательность действия и сравнительно низкая токсичность. Эффект антител, как правило, развивается очень быстро - в течение суток, а иногда и за несколько часов, при этом основной проблемой является не риск побочных действий, а чрезмерное подавление иммунитета («гиперсупрессия»), которое может сопровождаться активизацией возбудителей всевозможных инфекционно-воспалительных осложнений [1]. Попытки управлять терапией посредством уменьшения дозировки антител в большинстве случаев сопровождались непредсказуемым снижением эффективности. Таким образом, можно отметить, что второй проблемой лечебных антител является нелинейная зависимость дозировка/эффективность, что сильно затрудняет лечебный процесс [2]. Побочные действия антител в большинстве своем связаны с разрушением большого количества клеток (синдром выброса цитокинов). Изредка имеют место реакции по типу сывороточной болезни, в основе которой лежит иммунизация чужеродным белком.
Многочисленные следствия чрезмерного угнетения иммунитета, такие как рецидивирующие бактериальные и вирусные инфекции, поверхностные и глубокие микозы, злокачественные новообразования, отраженные инструкциях по применению лекарственных средств изучаемой группы, а также в специализированной литературе, не могут расцениваться как побочные действия, так как в их основе лежит прямое и желательное действие препарата - избирательное и практически тотальное подавление клеток, несущих соответствующий антиген [2].
Другой особенностью не только антител, но и вообще всех биотерапевтических средств является размытость понятия действующего начала, как вещества с определенной химической структурой и обладающего определенным фармакологическим эффектом. Очень часто действие биопрепарата зависит от особенностей методики его получения, поэтому несмотря на регистрационные документы, антитела, например, антитимоцитарные, различных производителей отнюдь не являются «воспроизведенными аналогами». Если в отношении химиотерапевтических средств фирма может воспроизвести конкретную молекулу и тем самым заявить о воспроизведенном аналоге, то в отношении биопрепаратов воспроизводится не молекула и даже не технология изготовления, а конечный результат, может быть с некоторыми ограничениями по механизму действия препарата. Вполне очевидно, что антитела в CD3+ лимфоцитам человека, к примеру, мышиные и кроличьи, несмотря на заявленный одинаковый терапевтический эффект, с точки зрения фармакологии будут иметь существенные различия. Поэтому оценка биопрепаратов разных производителей в современных условиях более чем актуальна.
Трансплантология является одной из первых областей клинической медицины, в которой стали применяться антитела для лечения пациентов. Это произошло в середине 80-х годов прошлого века. Разработанный в США миннесотский антилимфоцитарный иммуноглобулин (MALG) явился прорывом в области иммуносупрессивной терапии, по значимости соизмеримым с внедрением первого ингибитора кальцинейрина циклоспорина А. Первоначально антилимфоцитарные антитела применялись для лечения кризов отторжения, однако в дальнейшем эти препараты стали применяться и с профилактической целью [3].
Как показали лабораторные исследования и клиническая практика, индукционная терапия с помощью антител к лимфоцитам человека позволяет значительно снизить тяжесть ишемического консервационно-реперфузионного повреждения почечного трансплантата и трансплантата поджелудочной железы, уменьшая, таким образом, вероятность развития дистрофии и некроза канальцев трансплантированной почки и развитие тяжелого деструктивного панкреатита пересаженной поджелудочной железы, что может привести к потере трансплантатов в раннем послеоперационном периоде [4,5]. Такой положительный эффект на первичную функцию почечного и панкреатодуоденального трансплантатов достигается благодаря тому, что антитела к лимфоцитам человека вызывают апоптоз периферических Т-лимфоцитов, ингибируя их адгезию к экспрессированным антигенам главного комплекса гистосовместимости, и снижая выработку цитоки-нов, ответственных за повреждение трансплантата [6].
Высокая эффективность поликлональных антител в профилактике острого отторжения позволяет применять схемы поддерживающей иммуносупрессивной терапии, исключающие глюкортикоиды, и назначать ингибиторы кальцинейрина отсрочено и в более низких дозировках. Эти группы препаратов обладают высокой дозозависимой диабетогенностью. Таким образом, снижение дозировок этих препаратов позволяет продлить функционирование эндокринного аппарата трансплантированной поджелудочной железы. С другой стороны, более низкие концентрации ингибиторов кальцинейрина в крови позволяют получить лучшие показатели скорости клубочковой фильтрации у компрометированных почечных трансплантатов, что связано со снижением их нефротоксического воздействия.
Однако, несмотря на все усовершенствования иммуносупрессивной терапии, разработку новых препаратов антител, основные проблемы этой фармакологической группы по-прежнему актуальны - плохая управляемость эффектом и инфекционно-воспалительные осложнения, проистекающие от «гиперсупрессии». Одним из путей минимизации этих рисков является разработка комбинированных протоколов иммуносупрессии, в которых конкретный препарат антител привязывается к конкретному ингибитору кальцинейрина (в настоящем исследовании такролимус) и конкретной клинической ситуации, в данном случае к профилактике острого отторжения после родственной трансплантации почки.
МАТЕРИАЛЫ И МЕТОДЫ
В основе исследования лежат результаты 107 первичных родственных трансплантаций почки, выполненных с января 2012 по март 2015 гг. в НИИ урологии и интервенционной радиологии Минздрава России. Среди реципиентов мужчины составили 63%, женщины - 37%. Основной причиной терминальной хронической почечной недостаточности у включенных в исследование пациентов был хронический гломерулонефрит (84%), реже - диабетическая нефропатия (8%), рефлюкс-нефропатия (2%), поликистоз почек (6%).
Средний возраст живых родственных доноров составил 56,2 года. Средняя скорость клубочковой фильтрации у живых родственных доноров до момента изъятия органа -82,4 мл/мин по формуле MDRD (Modification of diet in renal disease).
Все реципиенты получали базовую трехкомпонентную иммуносупрессивную терапию. Такролимус назначался в стартовой дозе 2 мг/кг/сутки. Целевой сывороточной концентрацией такролимуса в первый месяц после трансплантации почки было 8-12 нг/мл крови. Мико-феноловая кислота назначалась в дозировке 1440 мг/сутки в течение двух недель, с последующим снижением до 720 мг/сутки. Метилпреднизолон назначался независимо от веса в стартовой дозировке 16 мг/сут с последующим постепенным снижением до 4 мг/сут ко второму месяцу после трансплантации почки.
Всем ключенным в исследование пациентам проводилась профилактика острого отторжения с помощью антител к лимфоцитам человека. Первое введение антител осуществлялось интраоперационно, до начала реперфузии органа.
Реципиенты были рандомизированы на группы, согласно назначенным препаратам антител:
I группа - иммуноглобулин антитимоцитарный (Атгам, Фармация и Апджон Кампани, США) 10 мг/кг, 7 суток (n=67);
II группа - иммуноглобулин антитимоцитарный (Тимоглобулин, Имтикс-Сангстат, Франция) в дозировке 1 мг/кг, 7 сут. (n=30);
III группа - иммуноглобулин антитимоцитарный (Атгам, Фармация и Апджон Кампани, США) 250 мг/сут независимо от массы тела, 4 сут., в сочетании с моноклональными антителами к рецептору интерлейкина-2 (CD25) лимфоцитов человека бази-ликсимабом (Симулект, Новартис Фарма Штейн, Швейцария) 20 мг/сут, 2 сут. (n=10).
Всем реципиентам проводилась антибактериальная профилактика цефалоспорином III поколения цефтриаксоном (1,0 в/в 2 раза/сут. в течение 7 суток). Кроме того, с целью профилактики активизации ВГЧ-5 (цитомегаловируса) назначался валган-цикловир (450 мг 2 раза/сут. в течение 180 суток).
Срок наблюдения за реципиентами составлял 6-26 месяцев после трансплантации.
В случае дисфункции почечного трансплантата выполнялась пункционная биопсия с последующим гистологическим и иммуногистохимическим исследованием биоптата. Все случаи острого отторжения были подтверждены морфологически.
В работе были применены следующие методы статистической обработки данных: критерий с2 для таблиц сопряженности признаков, в том числе с использованием поправки Бонферрони в случае необходимости; критерий согласия Пирсона для проверки на нормальность распределений; сравнительный анализ переменных с помощью критерия Вилкоксона-Манна-Уитни. Для автоматизации статистической обработки использовали статистический пакет БИОСТАТИСТИКА (BIOSTAT.EXE).
РЕЗУЛЬТАТЫ
Частота кризов отторжения
Среди 107 включенных в исследование реципиентов почечных трансплантатов от живого родственного донора наблюдалось 5 случаев острого криза отторжения (4,7%). Все они отмечены в группе пациентов, получавших Атгам (7,5%). Из них 4 эпизода острого отторжения развились в течение трех недель после трансплантации.
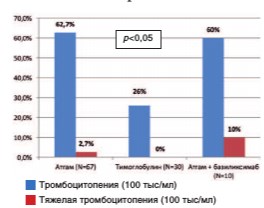
Рис. 1. Частота развития тромбоцитопении при различных видах иммуносупрессивной терапии
В группах реципиентов, получавших Тимоглобулин, а также комбинированную терапию, включавшую Атгам и Симулект, острых кризов отторжения трансплантата не было.
Отсроченная функция трансплантата наблюдалось у двух (1,8%) реципиентов - по одному пациенту в группах, получавших Атгам и Тимоглобулин.
Побочные действия
В I группе реципиентов, получавших Атгам, отмечена высокая частота развития тромбоцитопении (<100х109/л) - 65,4%. У 2,7% пациентов тромбоцитопения достигла критического уровня (<30х109/л), что сопровождалось угрозой спонтанных кровотечений. В гематологической практике такой уровень тромбоцитопении расценивается как жизнеугрожающее состояние. В II группе пациентов, которые получавших Тимоглобулин, транзиторная тром-боцитопения (<100х109/л)отмечена у 26% больных. В III группе реципиентов, получавших комбинированную терапию, включавшую Атгам и Симулект частота тромбоцитопении (<100х109/л) составила 60%, включая 10% тяжелой степени (<30х109/л). Частота развития тробоцитопении в группе пациентов, получавших Тимоглобулин, оказалась достоверно меньше по сравнению с аналогичными группами больных, получавших Атгам, а также комбинированную терапию, включавшую Атгам и Симулект (p<0,05).
Содержание тромбоцитов в периферической крови самостоятельно восстанавливалось до исходных цифр в течение 7 суток после отмены препаратов антител, при этом специфической терапии не требовалось.
Инфекционно-воспалительные осложнения
Среди неспецифических инфекционно-воспалительных осложнений наблюдалась раневая инфекция, а также обострение хронического цистита, простатита. Частота развития неспецифических инфекционно-воспалительных осложнений в группах пациентов, получавших Атгам, Тимоглобулин, а также комбинированную терапию, включавшую Атгам и Симулект, составила соответственно 16,7%, 13,3% и 20%. Статистически значимых по частоте развития неспецифических инфекционно-воспалительных осложнений между изучаемыми группами реципиентов не выявлено (p>0,05).
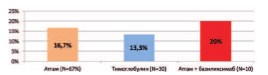
Рис. 2. Частота развития нежизнеугрожающей инфекции при различных типах иммуносупрессивной терапии
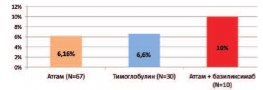
Рис. 3. Число случаев ЦМВ-виремии при различных типах иммуносупрессивной терапии
Всем реципиентам на 14-21 сутки после трансплантации определялось наличие ДНК ВЧГ-5 в крови методом ПЦР. Не смотря на профилактическое назначение валганцикловира, частота выявления бессимптомной ЦМВ-виремии в группах пациентов, получавших Атгам, Тимоглобулин, а также комбинированную терапию, включавшую Атгам и Симулект составила соответственно 6,2%, 6,6% и 10%. Статистически значимых по частоте развития бессимптомной ЦМВ-виремии между изучаемыми группами реципиентов выявлено было (p>0,05).
В группах больных, получавших Тимоглобулин и комбинированную терапию, включавшую Aтгам и Симулект, было отмечено
по одному случаю цитомегаловирусная пневмонии в раннем послеоперационном периоде, которые были успешно пролечены. У одного
пациента, получавшего Атгам, на 4-м месяце после трансплантации развилась рецидивирующая пневмоцистная пневмония с нестойким эффектом от терапии сульфаметоксазолом/триметопримом, приведшая к смерти пациента на 6-м месяце после трансплантации.
Синдром выброса цитокинов, заключающийся в лихорадке до 380С, зарегистрирован у 15,5% реципиентов, получавших Атгам, у 6% пациентов, получавших Тимоглобулин, у 10 % пациентов, получавших комбинацию Атгама и Симулекта. Статистически значимых по частоте развития синдрома выброса цитокинов между изучаемыми группами реципиентов не выявлено (p>0,05).
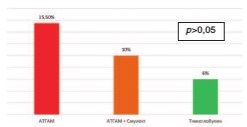
Рис. 4. Число случаев выброса цитокинов при различных типах иммуносупрессивной терапии
ОБСУЖДЕНИЕ
Результаты проведенного исследования демонстрируют высокую эффективность антител к лимфоцитам человека для профилактики острого отторжения после трансплантации. Отсутствие эпизодов острого отторжения при применении Тимоглобулина и комбинированной терапии, включающей Симулект и Атгам, возможно свидетельствует о более высокой эффективности, однако для подтверждения этого предположения требуется специальное исследование с существенно большей выборкой пациентов. В литературе нет данных о существенных преимуществах Тимоглобулина перед Атгамом, однако, в 10-летнем исследовании Университета Миссури, опубликованном в 2008 году при одинаковой выживаемости трансплантатов отмечены более низкая частота реакций отторжения (11%) и заболеваемость всеми видами злокачественных новообразований (8%) при назначении Тимоглобулина, по сравнению с аналогичными реципиентами получавших Атгам - 42% и 21% соответственно [7].
В нашем исследовании Тимо-глобулин продемонстрировал достоверно меньшую склонность вызывать тромбоцитопению по сравнению с Атгамом и комбинацией Атгама и Симулекта. Однако умеренная частота неспецифических инфекционно-воспалительных осложнений и ЦМВ-виремии позволяет сделать заключение об адекватности режимов дозирования изучаемых лекарственных средств и отсутствии «гиперсупрессии».
Создается впечатление о соизмеримой эффективности Атгама и Тимоглобулина в профилактике острого отторжения после пересадки органов и некотором преимуществе Тимоглобулина по безопасности, в частности, по риску развития тромбоцитопении.
Не столь однозначными оказались результаты комбинированного применения Атгама и Симулекта. Данная схема не продемонстрировала преимуществ ни по эффективности, ни по безопасности. Мало того при монотерапии Тимоглобулином частота развития тром-боцитопении была достоверно меньше, чем в других группах. Вероятно, при родственной трансплантации такую комбинацию следует считать избыточной. В других клинических ситуациях, например, при сочетанной трансплантации почки и поджелудочной железы, где есть риск острого отторжения априори выше, комбинированное применение Атгама и Симулекта возможно продемонстрирует преимущества.
ЗАКЛЮЧЕНИЕ
При проведении трансплантации почки несенсибилизированному реципиенту для профилактики острого отторжения целесообразно использовать Тимоглобулин. Данный препарата имеет соизмеримую эффективность и преимущества по безопасности перед Атгамом и комбинированной схемой, включающей Атгам и Симулект.
ЛИТЕРАТУРА
1. Юшков В.В., Миронов А.Н., Меркулов В.А. Иммунофармакология. М., Феникс. 2012. 590 с.
2. Яровой С.К. Применение поли- и моноклональных антител к лимфоцитам человека в лечении и профилактике острого отторжения после пересадки почки: Автореф дисс. к.м.н. М., 2006. 16 с.
3. Готье С.В. Очерки клинической трансплантологии. М., 2009. С.88-93.
4. Goggins WC, Pascual MA, Powelson JA, Magee C, Tolkoff-Rubin N, Farrell ML, et al. A prospective, randomized, clinical trial of intraoperative versus postoperative Thymoglobulin in adult cadaveric renal transplant recipients. Transplantation 2003;76(5):798-802.
5. Cravedi P, Codreanu I, Satta A, Turturro M, Sghirlanzoni M, Remuzzi G, et al. Cy-
closporine prolongs delayed graft function in kidney transplantation: are rabbit anti-human thymocyte globulins the answer? Nephron Clin Pract 2005; 101(2):65-71. DOI: 10.1159/000086224
6. Beiras-Fernandez A, Chappell D, Hammer C, Beiras A, Reichart B, Thein E. Impact of polyclonal anti-thymocyte globulins on the expression of adhesion and inflammation molecules after ischemia-reperfusion injury. Transpl Immunol 2009;20(4):224-228. doi.org/10.1016/j.trim.2008.11.004
7. Hardinger KL, Rhee S, Buchanan P, Koch M, Miller B, Enkvetchakul D, et al. A prospective, randomized, double-blinded comparison of thymoglobulin versus Atgam forinduction immunosuppressive therapy: 10-year results. Transplantation. 2008;86(7):947-952. doi: 10.1097/TP.0b013e318187bc67







