«Что такое болезнь как не стесненная в своей свободе жизнь?» — писал К.Маркс [1]. Это философское определение болезни как нельзя лучше подходит для мочекаменной болезни, отражая полиэтиологичность и сложность патогенеза этого заболевания [2-5]. Образ жизни, социальное положение, диетические пристрастия, жаркий или холодный климат — это одна сторона вопроса [6-8]. Генетическая предрасположенность, метаболические нарушения, системная мембранная патология — еще одна совокупность причин нефролитиаза [2,9,10]. Аномалии развития органов мочевой системы, нарушение пассажа мочи по мочевым путям, инфекция мочевых путей — причины камнеобразования, относящиеся к компетенции врачей урологов. Проксимальный и дистальный почечный канальцевый ацидоз, первичный и вторичный гиперпаратиреоз, хроническая почечная недостаточность, тубулопатии различной природы требуют совместных усилий врачей многих специальностей в лечении мочекаменной болезни [11,12].
Ренин-ангиотензинальдостероновая система, вазопрессин, адренокортикотропный гормон (АКТГ), кортизол, паратиреодный гормон (ПТГ) оказывают существенное воздействие на механизмы клубочковой фильтрации, активной и пассивной реабсорбции катионов и анионов в почечных канальцах, реабсорбцию воды. Альдостерон усиливает экскрецию кислот за счет активации Н+-АТФаз во вставочных клетках дистальных канальцев. Ангиотензин II активирует Na-H+-обмен и (Na+- ЗНСОз-) — котранспорт, что с одной стороны усиливает выведение протонов Н+, а с другой — усиливает реабсорбцию бикарбонатанионов. Подобно ангиотензину II действуют на почечные канальцы катехоламины и адренергическая стимуляция нервных волокон, иннервирующих почки, усиливая №-Н+-обмен. Паратиреоидный гормон оказывает противоположное действие на рН мочи, усиливая продукцию катионов аммония в проксимальных канальцах и угнетая (вследствие ингибирования №-Н+-обмена) реабсорбцию бикарбоната [13,14]. Кортизол увеличивает потерю кальция с мочой и снижает всасывание кальция в кишечнике. АКТГ стимулирует секрецию глюкокортикоидов и в небольшой степени минералокортикоидов и андрогенов клетками пучковой и сетчатой зоны коры надпочечников [15,16].
Оказывая системное адаптогенное действие, гипохлорит натрия (ГН) влияет не только на функцию внутренних органов, но и на характер метаболизма, гормональный статус организма [17]. Все это не может не отражаться на функции почечных нефронов, электролитном составе мочи и изменении ее литогенных свойств [18,19].
Цель — экспериментальное изучение влияния гипохлорита натрия на функциональные способности почек и гормональный статус интактных крыс, оказывающие влияние на качественный состав конечной мочи.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальное исследование выполнили на 35 белых беспородных крысах массой 250-450 грамм. Группу интактных животных составили 5 крыс, их не подвергали никаким воздействиям. Контрольную группу составили 15 крыс (группа №1), им внутрибрюшинно в течение 4 дней вводили 1,5 мл 0,9% раствора хлорида натрия. Экспериментальную группу составили 15 крыс (группа №2), им внутрибрюшинно в течение 4 дней вводили 1,5 мл 0,06% (2,2-2,5 мг/кг/сутки) раствора ГН. На 4-е сутки эксперимента крыс помещали в обменные клетки и собирали мочу в течение 24 часов. Животных контрольной и экспериментальной групп выводили из эксперимента на 5-е, 8-е и 11-е сутки наблюдения. Определяли суточный диурез, массу животного, брали кровь пункционно из нижней полой вены. Кровь центрифугировали, отделяли сыворотку крови. Биохимические исследования крови и мочи проводили на биохимическом анализаторе «ADVIA 1200» (Германия). Изучали динамику показателей: суточный и минутный диурез, осмолярность крови и мочи, клиренс креатинина, клиренс осмолярности и концентрационный коэффициент, клиренс осмотически свободной воды, экскретируемая фракция натрия (EFNa), калия (EF^, кальция №a), фосфора (EFr), магния (EFMg), хлора (EFci), мочевой кислоты (EFмочевой кислоты ). С целью получения объективной оценки изучаемых параметров величину клиренса креатинина, клиренса осмолярности и клиренса воды делили на единицу массы животного. Во всех группах животных изучали уровень гормонов в крови: адренокортикотропный гормон (АКТГ), паратиреоидный гормон (ПТГ), кортизол, альдостерон.
Раствор ГН готовили с помощью аппарата «ДЭО-01-Медек» на основе стерильного физиологического раствора в электрохимической камере согласно методическим рекомендациям по применению ГН и положениям технической документации [20,21]. Статистическую обработку данных производили на персональном компьютере, используя программу «Статистика 6», с расчетом достоверности по непараметрическому U-критерию Манна-Уитни.
Эксперимент проводился в соответствии с «Международными рекомендациями по проведению биомедицинских исследований с использованием животных» принятыми Международным Советом Научных Обществ (CIOMS) в 1985 году, со статьей XI Хельсинской декларации Всемирной медицинской ассоциации (1964 год) и правилами лабораторной практики в РФ (приказ МЗ РФ от 19.06.2003 № 267). Крысы содержались в условиях вивария, имели свободный доступ к пище и воде за исключением времени эксперимента.
РЕЗУЛЬТАТЫ
Результаты эксперимента оценивали на 5-е, 8-е и 11-е сутки исследования. Средние величины данных функциональных показателей почек представлены в таблице 1.
Таблица 1. Биохимические параметры крови крыс
| Показатель | Интактные крысы |
5-е сутки | 8-е сутки | 11-е сутки | |||
|---|---|---|---|---|---|---|---|
| Контрольная группа | Экспериментальная группа | Контрольная группа | Экспериментальная группа | Контрольная группа | Экспериментальная группа | ||
| Вес, грамм | 400+45 | 329+45 | 385+27 | 325+15* | 366+36 | 280+36* | 408+70** |
| Диурез в сутки, мл | 8+3 | 10+5 | 7+1 | 5+1* | 5+1* | 4+1* | 5+2 |
| Диурез в минуту, мл | 0,0057±0,0029 | 0,0070+0,0035 | 0,0050+0,0007 | 0,0036+ 0,0006 | 0,0032+0,0010* | 0,0028+ 0,0007* | 0,0036+ 0,0015 |
| Клиренс креатинина, мл/минуту | 1,09±0,19 | 0,65+0,06* | 1,08+0,12** | 0,9+0,03 | 0,84+0,09* | 0,73+0,20* | 0,86+0,31 |
| Клиренс креатинина, мл/минуту/кг | 2,72±0,17 | 2,03+0,44* | 2,05+0,40* | 2,99+0,19 | 2,32+0,43** | 5,99+0,52 | 2,05+0,46* |
| Осмолярность крови, мосмоль/л | 304+8 | 301+5 | 299+4 | 298+3 | 304+5 | 295+3 | 296+11 |
| Осмолярность мочи, мосмоль/л | 1716±253 | 1459+726 | 1911+541 | 2486+147* | 2810+706* | 1941+794 | 1943+1259 |
| Концентрационный коэффициент | 5,6±0,7 | 4,9+2,5 | 6,4+1,9 | 8,3+0,6* | 9,3+2,4* | 6,6+2,7 | 6,5+4,1 |
| Клиренс осмолярности, мл/минуту | 0,031 ±0,009 | 0,028+0,004 | 0,031+0,004 | 0,030+0,003 | 0,028+0,003 | 0,017+0,003* | 0,020+0,005 |
| Клиренс осмолярности, мл/мин/кг | 0,076±0,013 | 0,087+0,012 | 0,082+0,011 | 0,092+0,009 | 0,078+0,015 | 0,062+0,017 | 0,050+0,016* |
| Клиренс воды, мл/минуту | -0,018 | -0,015 | -0,026+ 0,005** | -0,024 | -0,023 | -0,014+ 0,003* | -0,01 |
| Клиренс воды, мл/минуту/кг | -0,054 | -0,057 | -0,055 | -0,082+ 0,008* | -0,058 | -0,036 | -0,022 |
| EFNa, % | 0,23+0,05 | 0,53+0,15* | 0,5+0,36 | 0,23+0,06 | 0,6+0,1*,** | 0,17+0,12 | 0,27+0,29 |
| EFСa, % | 1,0+0,4 | 1, 1 +0,1 | 0,7+0,6 | 0,9+0,3 | 0,7+0,9 | 0,9+1,1 | 0,4+0,2* |
| EFk, % | 27,4+6,9 | 38,8+4,4* | 24,5+2,1** | 33,4+6,4 | 31,4+5,7 | 25,1+8,8 | 26,1+12,0 |
| EFp, % | 7,1+4,1 | 3,4+3,6 | 5,3+4,6 | 12,5+4,4 | 5,2+3,0** | 12,4+5,0 | 5,9+3,8 |
| EFMg, % | 7,2+1,7 | 0,3+0,1* | 2,7+4,3 | 3,5+1,4* | 0,45+0,6*,** | 1,6+2,6* | 0,2+0,1* |
| EFa, % | 0,27+0,06 | 1,3+0,7* | 0,8+0,4* | 0,5+0,2 | 0,9+02*,** | 0,2+0,1 | 0,5+0,4 |
| EFМочевой к., % | 6,9+1,9 | 3,7+1,4* | 4,3+3,9 | 12,8+6,7 | 2,3+14*,** | 4,2+2,6 | 1,6+0,2*,** |
Масса животных в контрольной группе №1, которых выводили из эксперимента на 8-е и 11-е сутки оказалась самой низкой. Влияние натриевой нагрузки у них было сильнее, чем у крыс других сравниваемых групп. Доза ГН у крыс исследуемой группы равнялась 2,2- 2,5 мг/кг/сутки. В контрольной и экспериментальной группах обнаружили постепенное снижение суточного и минутного диуреза по сравнению с группой интактных крыс на 8-е и 11-е сутки наблюдения.
На 11-е сутки эксперимента клиренс креатинина в контрольной группе крыс увеличивался в 2,2 раза по сравнению с группой интактных крыс, а в исследуемой группе соответственно снижался в 1,3 раза. Осмолярность крови к 11 суткам в группах №1 и №2 снижалась, а осмолярность мочи и концентрационный коэффициент достоверно увеличивались на 8-е сутки контроля по сравнению с группой интактных животных.
Клиренс осмолярности в контрольной и исследуемой группах на 11-е сутки наблюдения был наименьшим, что соответствовало минимальным значениям осмолярности крови в те же сроки. Такая же динамика отмечалась и в отношении клиренса осмотически свободной воды, что, по-видимому, также было связано с низким значением осмолярности крови.
Наиболее интересные данные были получены при исследовании величин экскретируемых фракций основных катионов и анионов мочи. Экскретируемая фракция натрия увеличивалась на 5-е сутки контроля в группах №1 и №2. На 8-е сутки исследования в экспериментальной группе этот показатель был наибольшим и в 2,6 раза превышал аналогичные показатели в других сравниваемых группах. Средняя величина экскретируемой фракции кальция у крыс исследуемой группы достоверно снижалась на 11-е сутки наблюдения по сравнению с группой интактных крыс и была в 2,2раза ниже соответствующего значения в контрольной группе животных. Среднее значение величины экскретируемой фракции калия в группе №1 на 5-е сутки эксперимента имело достоверное различие по сравнению с аналогичным показателем у интактных крыс и в группе №2. Экскретируемая фракция фосфора на 8-е и 11-е сутки наблюдения увеличивалась в контрольной группе крыс и снижалась в исследуемой группе. Экскретируемая фракция магния снижалась в группах №1 и №2, наибольшее снижение обнаружили в группе экспериментальных животных. Подобно динамике экскретируемой фракции натрия изменялась средняя величина экскретируемой фракции хлора. Динамика экскретируемой фракции мочевой кислоты напоминала динамику экскретируемой фракции фосфора, при этом выведение мочевой кислоты в экспериментальной группе животных было достоверно ниже, чем аналогичное значение в контрольной группе и в группе интактных крыс на 8-е и 11-е сутки контроля.
Результаты исследования уровня гормонов у крыс представлены в таблице 2. Изучали динамику гормонов, которые регулируют осмолярность крови, метаболизм катионов и анионов, катаболические процессы в организме (АКТГ, кортизол, альдостерон) и фосфорно-кальциевый обмен (ПТГ) (рис. 1,2,3,4).
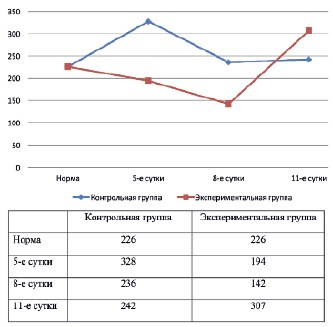
Рис. 1. Динамика АКТГ в контрольной и экспериментальной группах
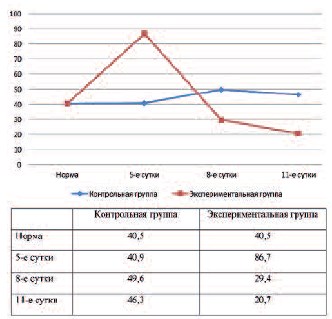
Рис. 2. Динамика кортизола в контрольной и экспериментальной группах
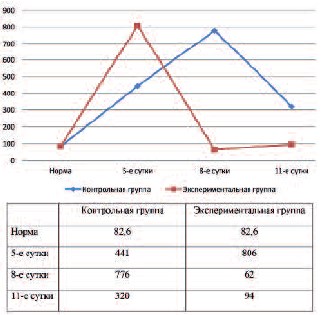
Рис. 3. Динамика альдостерона в контрольной и экспериментальной группах
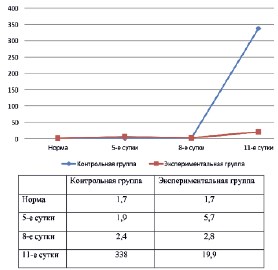
Рис. 4. Динамика ПТГ в контрольной и экспериментальной группах
Таблица 2. Результаты исследования уровня гормонов крови у крыс при парентеральном введении физиологического раствора и 0,06% раствора ГН в дозе 2,2-2,5 мг/кг/сутки (М=М ± σ)
| Показатель | Интактные крысы |
5-е сутки | 8-е сутки | 11-е сутки | |||
|---|---|---|---|---|---|---|---|
| Контрольная группа | Экспериментальная группа | Контрольная группа | Экспериментальная группа | Контрольная группа | Экспериментальная группа | ||
| АКТГ крови, пг/мл | 226,0±79,7 | 328,8± 13,3* | 194,0±34,4** | 236,0±29,3 | 142,6±72,7** | 242,3±133,3 | 307,3±137,1 |
| Кортизол крови, нмоль/л | 40,5±1,4 | 40,9±8,1 | 86,7±82,6 | 49,6±28,9 | 29,4±9,1* | 46,3±3,9* | 20,7±3,1*,** |
| Альдостерон, пг/мл | 82,6±40,7 | 441,4± 346,2* | 806,1 ± 646,3* | 776,6± 440,5* | 62,5±43,1** | 320,1 ±75,5* | 94,1 ±26,1 ** |
| ПТГ, пг/мл | 1,7±0,7 | 1,9±0,4 | 5,7±6,6 | 2,4±0,5 | 2,8±1,1 | 338,8±490,5* | 19,9±37,0*,** |
* различие достоверно по сравнению с группой интактных крыс (p<0,05); **различие достоверно по сравнению с контрольной группой (p<0,05)
Средние значения АКТГ в контрольной группе крыс во все сроки наблюдения превышали уровень АКТГ в группе интактных крыс. В экспериментальной группе на 5-е и 8-е сутки уровень АКТГ был достоверно ниже, чем в контрольной группе. В отличие от крыс контрольной группы величина кортизола в группе №2 имела тенденцию к снижению и на 11-е сутки наблюдения достоверно отличалась от группы №1 и группы интактных животных. Уровень альдостерона в крови в контрольной группе животных был достоверно выше аналогичного показателя в группе интактных крыс во все сроки наблюдения. В экспериментальной группе крыс средняя величина альдостерона на 8-е и 11-е сутки существенно не отличалась от средней величины альдостерона в группе интактных животных и была достоверно ниже, чем у крыс в группе №1. Уровень ПТГ во все сроки наблюдения в группах №1 и №2 был выше аналогичного показателя в группе интактных крыс. Однако, на 11-е сутки эксперимента средняя величина ПТГ в группе №1, несмотря на неоднородность показателей, была достоверно выше, чем в группе интактных животных. В то же время уровень ПТГ в группе №2 был достоверно выше, чем в группе интактных животных и достоверно ниже, чем в группе №1.
Результаты эксперимента показали, что ГН вызывает повышение уровня кортизола и альдостерона на фоне обратной динамики величины АКТГ. Это может свидетельствовать о первичном действии ГН на надпочечники и вторичной активации функции гипофиза в ответ на изменение уровня глюкокортикоидов: снижение уровня АКТГ в ответ на повышение уровня кортизола на 5-е сутки и повышение АКТГ в ответ на снижение уровня кортизола к 11 суткам исследования. Можно предположить, что возможной причиной активации функции надпочечников является изменение антиоксидантного статуса организма на фоне прооксидантного действия ГН. В контрольной группе крыс динамика этих гормонов была незначительной.
ОБСУЖДЕНИЕ
Изучение роли гормонов в формировании окончательного состава мочи требует пристального внимания поскольку эндокринная система активно влияет на метаболизм, образование и выведение его конечных продуктов с мочой. Экскреторная функция почек, в частности, функция клубочкового и канальцевого аппаратов, работает в интересах целостного организма в составе функциональных систем, в которые они включены. «Золотое» правило нормы П.К. Анохина гласит: «чем сильнее отклоняется результат, тем сильнее активируются механизмы, направленные на его возвращение к оптимальному уровню» [22].
АКТГ непосредственно не влияет на состав мочи и не определяет риск нефролитиаза при мочекаменной болезни. Однако этот гормон влияет на синтез и освобождение надпочечниками глюкокортикоидов, гормонов стресса, которые снижают утилизацию глюкозы, стимулируют распад жиров и тормозят их синтез, вызывают высвобождение аминокислот из мышечной и лимфоидной тканей за счет усиления катаболических процессов, увеличивают кальциурию, снижают всасывание кальция в кишечнике, вследствие чего может повышаться уровень ПТГ [3,15]. В высоких концентрациях глюкокортикоиды (кортизол, кортикостерон) обладают альдостероноподобным эффектом, который приводит к задержке в организме натрия и воды, отекам, усилению экскреции калия с мочой. Как и альдостерон глюкокортикоиды способствуют закислению мочи. Что касается ПТГ, то его активность определяет увеличение реабсорбции кальция в почечных канальцах и увеличение выведения фосфатов. Другими почечными эффектами ПТГ являются: угнетение канальцевой реабсорбции натрия, воды, гидрокарбонатов, увеличение реабсорбции магния. Кроме того, кратковременное повышение уровня ПТГ может оказывать анаболический эффект в отношении образования костной ткани и угнетения ее резорбции [13,15,23]. В ответ на системное прооксидантное действие ГН в течение 4-х дней и повышение уровня кортизола в 2,1 раза по сравнению с нормой на 5-е сутки, наблюдали активацию механизмов, стимулирующих репатаривно-анаболические процессы на 8-е и 11-е сутки исследования, которые заключались в стойком снижении уровня кортизола и увеличении уровня ПТГ. Эти эффекты сопровождались гипокальциурией, гипоурикурией, гипофосфатурией и гипомагниурией, наиболее достоверно выраженные на 11-е сутки контроля (рис. 5,6). Для достижения нашей основной цели, снижения литогенных свойств мочи, были использованы законы системной регуляции. Экспериментально было подтверждено, что факторы, восстанавливающие результат, всегда сильнее отклоняющих воздействий.
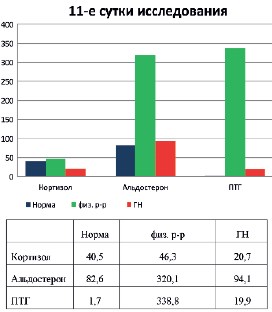
Рис. 5. Уровень кортизола, альдостерона и ПТГ в норме, контрольной и экспериментальной группах на 11 сутки исследования
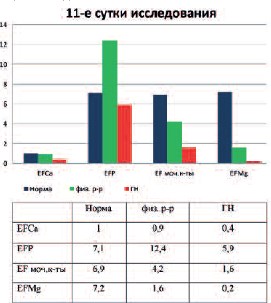
Рис. 6. Уровень экскретируемой фракции кальция (EFСa), фосфора (EFР), мочевой кислоты (EFмоч. к-ты) и магния в норме, контрольной и экспериментальной группах 11 сутки исследования
По-видимому, достоверное снижение диуреза, и концентрирование мочи на 8-е сутки эксперимента в контрольной группе животных связано с действием кортизола и альдостерона, которые вызывают увеличение экскретируемой фракции калия, хлора и мочевой кислоты. Достоверное снижение величины кортизола и альдостерона в исследуемой группе на 8-е сутки контроля сопровождалось достоверным снижение величины экскретируемой фракции мочевой кислоты в моче, нормализацией осмолярности крови и клиренса осмотически свободной воды. Достоверное снижение величины экскретируемой фракции мочевой кислоты определяли в группе №2 и на 11-е сутки исследования. Адаптогенные свойства ГН в отношении нормализации уровня альдостерона в крови ярко проявились в исследуемой группе крыс на 8-е и 11-е сутки эксперимента. В контрольной группе животных подобного эффекта не наблюдали.
Действие ПТГ отчетливо прослеживалось в контрольной группе крыс на 8-е и 11-е сутки наблюдения: гипокальциурия, гиперфосфатурия, гипомагниурия. В отличие от контрольной группы животных в группе №2 обнаружили достоверно более низкое значение экскретируемой фракции кальция, магния и фосфора, которое нельзя объяснить только влиянием ПТГ.
Снижение уровня кортизола и кратковременное повышение величины ПТГ в экспериментальной группе крыс на 11-е сутки исследования благоприятно влияет на качественный состав мочи не только за счет непосредственного действия на канальцевый аппарат почек, но и за счет активации анаболических процессов. Это доказывает результирующее достоверное снижение средней величины экскретируемой фракции кальция, магния и мочевой кислоты в экспериментальной группе животных. В контрольной группе крыс активации пластических процессов не наблюдалось, а действие ПТГ ограничилось классическим эффектом на канальцевый аппарат почек: незначительной гипокальциурией, гипомагниурией и гиперфосфатурией.
Адаптогенное действие 0,06% раствора ГН, которое включает в себя антистрессорное, репаративно-анаболическое действие, повышение эффективности работы почек, в частности процессов реабсорбции электролитов и воды, благоприятно влияет на различные аспекты поддержания оптимального состояния организма в норме и при патологии. В нормальной физиологии системное действие ГН подчиняется законам системной регуляции [22]. В патологической физиологии действие ГН может рассматриваться как один из определяющих факторов саногенеза. Изменения вектора метаболической направленности, эндокринного статуса, эффективности работы почек не могут не отражаться на качественном составе мочи. Результаты эксперимента показали, что эндокринно-опосредованное действие ГН у крыс исследуемой группы носит благоприятный характер с точки зрения снижения литогенных свойств мочи.
ВЫВОДЫ
Эндокринно-опосредованное действие ГН, а именно: стойкое достоверное снижение уровня кортизола и активация ПТГ, изменяет функциональные показатели почек, уменьшая экскрецию кальция, фосфора и мочевой кислоты. ГН может рассматриваться в качестве управляющего воздействия на системообразующий фактор функциональной системы антиоксидантной защиты организма, ведущего в конечном итоге к снижению литогенных свойств мочи, в рамках концепции саногенеза, профилактики и метафилактики МКБ.
ЛИТЕРАТУРА
1. Маркс К. Дебаты о свободе печати и об опубликовании протоколов сословного собрания. В кн.: Маркс К. и Энгельс Ф. Соч. 2-е изд., т. 1, с. 64.
2. Аполихин О.И., Сивков А.В., Константинова О.В., Сломинский П.А., Тупицына Т.В., Калиниченко Д.Н. Генетические факторы риска рецидивного уролитиаза. Экспериментальная и клиническая урология 2016;(3):127-130.
3. Голованов С.А., Сивков А.В., Анохин Н.В. Гиперкальциурия: принципы дифференциальной диагностики. Экспериментальная и клиническая урология 2015;(4):86-92.
4. Srivastava T, Alon US. Pathophysiology of hypercalciuria in children. Pediatr Nephrol 2007;22(10):1659-1673. doi.org/10.1007/s00467-007-0482-6.
5. Aggarwal KP, Narula S, Kakkar M, Tandon C. Nephrolithiasis: molecular mechanism of renal stone formation and the critical role played by modulators. Biomed Res Int 2013;14:1-21. doi.org/10.1155/2013/292953.
6. Имамвердиев С.Б., Гусейнзаде Р.Т. Возможность влияния эпидемиологических факторов риска при формировании мочекаменной болезни. Терапевтический архив 2016;88(3):68-72.
7. Castiglione V, Jouret F, Bruyere O, Dubois B, Thomas A, Waltregny D, et al. Epidemiology of urolithiasis in Belgium on the basis of a morpho-constitutional classification. Nephrol Ther 2015;11(1): 42-49. doi.org/10.1016/j.nephro.2014.08.003.
8. Prezioso D, Illiano E, Piccinocchi G, Cricelli C, Piccinocchi R, Saita A, Micheli C, Trinchieri A. Urolithiasis in Italy: an epidemiological study. Arch Ital Urol Androl 2014;86(2):99-102. doi/ 10.4081/aiua.2014.2.99.
9. Sharma M, Kaur T, Singla SK. Role of mitochondria and NADPH oxidase derived reactive oxygen species in hyperoxaluria induced nephrolithiasis: therapeutic intervention with combinatorial therapy of Nacetyl cysteine and Apocynin. Mitochondrion 2016;27:15-24. doi.org/10.1016/j.mito.2016.01.002.
10. Miyamoto Y, Tiruppathi C, Ganapathy V, Leibach FH. Multiple transport systems for organic cations in renal brush-border membrane vesicles. Am J Physiol 1989;256(4)Pt.2:540-548.
11. Калабеков А.А., Казаченко А.В., Иващенко В.В. Факторы риска кальциевого
и уратного нефролитиаза. Роль канальцевых дисфункций в камнеобразовании. Экспериментальная и клиническая урология 2016;(1):8-14.
12. Fisang C, Anding R, Muller SC. Urolithiasis-an interdisciplinary diagnostic, therapeutic and secondary preventive challenge. Dtsch Arztebl Int 2015;112(6):83-91.
13. О’Каллагхан К.А. Наглядная нефрология: учебное пособие для вузов. [пер. с англ. под ред. Е.М. Шилова]. М.:ГЭОТАР-Медиа, 2009. 128 с.
14. Milicevic S, Bijelic R, Jakovljevic B. Correlation of parathormone and the serum values of acidum uricum with calcium nephrolithiasis examined by three different methods of diagnostics. Acta Inform Med 2015;23(3):132-134. doi.org/10.5455/aim.2015.23.132-134.
15. Верин В.К., Иванов В.В. Гормоны и их эффекты: Справочник. СПб.: ООО «Издательство ФОЛИАНТ», 2011. 136 с.
16. Naghii MR, Babaei M, Hedayati M. Androgens involvement in the pathogenesis of renal stones formation. PLoS One 2014;9(4):e93790. doi.org/10.1371/journal.pone.0093790.
17. Иващенко В.В. Механизм адаптогенного действия гипохлорита натрия при непрямом электрохимическом окислении крови и его применение в урологии. Дис. ... д-ра мед. наук. М. 2016. 361 с.
18. Ott RJ, Hui AC, Yuan G, Giacomini KM. Organic cation transport in human renal brush-border membrane vesicles. Am J Physiol 1991;261(3)Pt.2:443-451.
19. Navanil Roy, Chaitanya S. Kulkarni. Evaluation of calcium creatinine ratio and uric acid creatinine ratioin in patients of urolithiasis. RJPBCS 2016;7(5):2137-2140.
20. Сергиенко В.И., Лопухин Ю.М. Методическое пособие для врачей. Эфферентная терапия 1996;2(4):25-32.
21. Федоровский Н.М. Непрямая электрохимическая детоксикация: Пособие для после дипломной подготовки врачей. М.: «Медицина», 2004. 144 с.
22. Анохин П. К. Теория функциональной системы. Успехи физиологических наук 1970;1(1):19-54.
23. Архипова Н.Н. Роль тиреокальцитонина и паратиреоидного гормона в сохранении фосфатно-кальциевого гомеостаза. URL: http://mfvt.ru/rol-tireokalcitoninaiparatireoidnogo-gormona-v-soxranenii-fosfatno-kalcievogo-gomeostaza/







