Патогенез развития дисфункции мочевого пузыря у больных с доброкачественной гиперплазией предстательной железы (ДГПЖ) в последнее время связывают с ухудшением его кровоснабжения, что подтверждается как данными экспериментальных исследований, так и клиническими наблюдениями [1-6].
Имеется большое количество публикаций, свидетельствующих, что ухудшение кровоснабжения стенки мочевого пузыря приводит к хронической гипоксии детрузора, запускающей каскад патологических метаболических реакций, ведущих к нарушению функции гладкомышечных клеток детрузора и нейрогенной вегетативной регуляции сократительной активности мочевого пузыря [7-11].
Эти нарушения могут приводить к развитию острой задержки мочи, являющейся серьезным осложнением ДГПЖ.
С учетом этих данных ряд исследователей считает целесообразным включение в схему лечения больных ДГПЖ с сопутствующими ирритативными расстройствами мочеиспускания препаратов, обладающих противоишемическим, антигипоксическим и антиоксидантным действием [10-12]. Проведенные нами экспериментальные исследования с моделированием инфравезикальной обструкции у крыс [13,14] свидетельствуют о целесообразности такого подхода. Терапия крыс с ИВО комплексом препаратов, состоящего из жирои водорастворимого антиоксидантов α-то коферола и мексидола, пентоксифиллина, улучшающего реологические свойства крови и блокатора кальциевых каналов дилтиазема способствовала улучшению микроциркуляции в стенке мочевого пузыря, уменьшала выраженность ферментурии, что свидетельствовало о цитопротективном действии препаратов, и в конечном итоге препятствовала развитию детрузорной гиперактивности.
Данное исследование посвящено оценке влияния этого комплекса противоишемических препаратов на возможность уменьшения повреждения мочевого пузыря при таком осложнении ДГПЖ, как острая задержка мочи, что является экстренной ситуацией, и при этом дальнейшая лечебная тактика зависит от того, насколько удастся восстановить функцию мочеиспускания после ликвидации задержки. В экспериментальных исследованиях на крысах изучали протективное действие этих препаратов на состояние микроциркуляции, морфологических, биохимических и функциональных параметров, характеризующих состояние мочевого пузыря, а в клинической части работы оценивали эффективность этого противоишемического комплекса на частоту восстановления самостоятельного мочеиспускания и выраженность ферментурии у больных с ДГПЖ, осложненной острой задержкой мочи.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В экспериментальных исследованиях у 35 самок крыс моделировали острую задержку мочи, вызванную пережатием на 4 часа предпузырного отдела уретры микрососудистым зажимом в условиях предварительного наполнения мочевого пузыря физиологическим раствором (рис. 1).
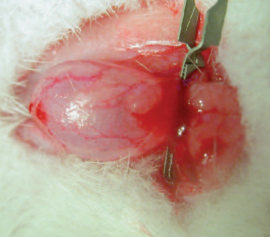
Рис. 1. Моделирование острой задержки мочи у крыс
В 1-й серии (контрольной, 10 крыс) лечебных действий не производили. Во 2-й серии (10 крыс) животным сразу после ликвидации обструкции мочевых путей и на следующий день внутрибрюшинно вводили α-адреноблокатор доксазозин из расчета 40 мкг/кг в сутки, поскольку терапия α-адреноблокаторами считается терапией первой линии при этой ситуации. В 3-й серии (10 животных) крысам вводили α-токоферола ацетат в виде 5% масляного раствора в/м 10 мг/кг в сутки, мексидол 5 мг/кг, пентоксифиллин 4 мг/кг в и дилтиазем 2 мг/кг в/бр 1 раз в сутки в день операции и на следующий день. Пять интактных крыс служили контролем.
Через 1 сутки после восстановления оттока мочи крыс высаживали в обменные клетки для сбора суточной мочи, в которой определяли активность следующих ферментов: трансаминаз (АЛТ и АСТ), щелочной фосфатазы (ЩФ), лактатдегидрогеназы (ЛДГ), гамма-глутамилтранспептидазы (ГГТП), N-ацетилгликозидазы (НАГ), холинэстеразы (ХЭ), общей креатинфосфокиназы (КФК). Рассчитывали удельную активность ферментов в пересчете на 1 мМ креатинина мочи. Уровень ферментурии характеризовал выраженность клеточного повреждения, вызванного ОЗМ [15]. Для подтверждения того, что гиперферментурия обусловлена выходом ферментов из поврежденных клеток мочевого пузыря определяли активность этих же ферментов в стенке органа. Для этого готовили гомогенат удаленного мочевого пузыря в физиологическом растворе при соотношении раствор/ткань 10:1. В нем определяли активность вышеуказанных ферментов в пересчете на 1 мг белка гомогената. Определение активности ферментов в моче и тканевом гомогенате проводили на биохимическом анализаторе «Advia 1200» (Bayer-Simens, ФРГ) с использованием стандартных наборов реактивов.
В части опытов сразу после удаления мочевого пузыря готовили тонкие тканевые срезы и инкубировали их в растворе с флоуресцентными зондами: эфиром тетраметилродамина (TMRE), избирательно накапливающимся в активно функционирующих митохондриях и дихлорфлуоресцеином (DCF), приобретающим способность к флуоресценции после взаимодействия с активными формами кислорода, с последующим определением активности флуоресценции с помощью лазерной конфокальной микроскопии (LSM5, Carl Zeiss, ФРГ). Количественное измерение интенсивности флуоресценции проводили с помощью специальной программы и выражали в условных единицах свечения (усл. ед.) Уменьшение интенсивности флуоресценции TMRE свидетельствовало о повреждении митоходрий преимущественно в гладкомышечных клетках мочевого пузыря, а увеличение интенсивности флуоресценции DCF свидетельствовало об активации продукции активных форм кислорода.
В клинической части работы анализировали истории болезни 60 больных ДГПЖ с острой задержкой мочи, проходивших лечение в ЯрМГУ. У 30 из них с целью попытки восстановления самостоятельного мочеиспускания выполнялась катетеризация мочевого пузыря с терапией α-адреноблокатором тамсулозином (1 капсула 600 мг 1 раз в сутки в течение 5 дней) (группа сравнения). Другие 30 пациентов получали комплекс противоишемических препаратов – α-токоферол 300 мг 1 раз в сутки, мексидол 125 мг 2 раза в сутки, пентоксифиллин 100 мг 2 раза в сутки и дилтиазем 60 мг 2 раз в сутки в течение 5 дней (основная группа). Больным обеих групп выполнялась катетеризация мочевого пузыря уретральным катетером в течение 3-5 суток с назначением соответствующей медикаментозной терапии. После удаления катетера оценивали возможность пациента мочиться самостоятельно. При восстановлении адекватного мочеиспускания медикаментозную терапию продолжали. В случае невозможности больного помочиться выполняли троакарную цистостомию. При частичном восстановлении мочеиспускания прибегали к повторным катетеризациям мочевого пузыря на фоне продолжающейся медикаментозной терапии. Обе группы пациентов были сопоставимы по возрасту, длительности заболевания, предшествующей терапии, длительности ОЗМ и объему предстательной железы (табл. 1).
Таблица 1. Сравнительная характеристика анализируемых групп
| Параметры | Тамсулозин | Противоишемический комплекс |
|---|---|---|
| Возраст (лет) | 64,8±4,9 | 66,4±4,1 |
| Длительность анамнеза (лет) | 4,8±1,6 | 3,0±1,2 |
| Терапия α-блокаторами в анамнезе (% больных) | 65,7% | 60,0% |
| Повторная ОЗМ (% больных) | 26% | 17% |
| Объем предстательной железы (см3) | 86,3±4,3 | 83,6±3,1 |
Больные обеих групп подвергались стандартному урологическому обследованию. Дополнительно проводили определение активности ферментов в моче после ликвидации острой задержки мочи (в первые сутки и через 3-5 дней после ликвидации обструкции), как описано ранее.
Статистическую обработку цифрового материала проводили с помощью компьютерных программ MS Excel 2007 и Statistica 10.0. Групповые значения показателей выражали в виде средней арифметической и ошибки средней (М±m). Значимость различий между средними значениями исследуемых групп оценивали по критерию t Стьюдента. Различия по качественным показателям оценивали по критерию χ2.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Проведенные исследования на крысах, у которых моделировали 4-х часовую задержку мочи, выявили резко выраженное повреждение мочевого пузыря, проявляющееся значительном снижении функциональной активности митохондрий с выраженной активацией продукции активных форм кислорода. Важно отметить, что эти изменения выявлялись в гладкомышечных клетках детрузора, то есть функционально активных элементах, определяющих сократительную активность органа. На следующие сутки после 4-х часовой ОЗМ происходило выраженное уменьшение флуоресценции зонда TMRE в гладкомышечных клетках мочевого пузыря, что свидетельствовало о выраженном повреждении митохондрий и об уменьшении их АТФ-синтезирующей способности, наряду с усилением свечения зонда DCF, указывающим на активацию синтеза активных форм кислорода (рис. 2). Количественное определение интенсивности флуоресценции зондов в интактном и обструктивном мочевом пузыре выявило достоверное различие этих параметров.
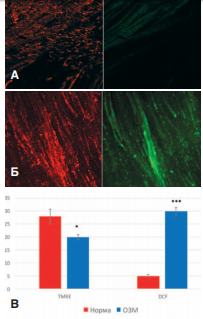
Рис. 2. Влияние ОЗМ на интенсивность флуоресценции зондов TMRE (красное свечение) и DCF (зеленое свечение) в мышечной оболочке мочевого пузыря. А – интактный мочевой пузырь, Б – через сутки после ОЗМ. В – количественный анализ (усл. ед.). Достоверность различий: * p<0,05, *** p<0,001
Эти изменения характерны для состояния ишемии органа, что подтверждено в наших более ранних публикациях [16].
Выраженное повреждение клеток детрузора проявляется в выходе внутриклеточных ферментов в мочу из поврежденных клеток. В моче крыс, перенесших 4-х часовую ОЗМ, резко повышалась активность большинства исследуемых ферментов (p<0,001), за исключением ГГТП и ХЭ, изменения которых оказались статистически недостоверными (рис. 3).
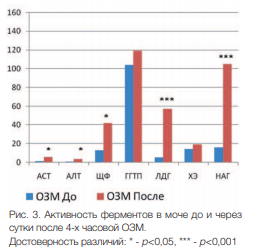
Рис. 3. Активность ферментов в моче до и через сутки после 4-х часовой ОЗМ. Достоверность различий: * p<0,05, *** p<0,001
АЛТ, АСТ и ЛДГ являются цитоплазматическими ферментами и их усиленный выход в мочу свидетельствует о деструкции ряда клеток или о резком повышении проницаемости клеточных мембран, что также указывает на выраженное клеточное повреждение. Резкое увеличение активности НАГ, являющимся лизосомальным ферментом, свидетельствует об активации лизосом и их лабилизации с выходом лизосомальных ферментов за пределы органелл, а затем и клеток.
Соответственно достоверно уменьшалась активность изученных ферментов в стенке обструктивного мочевого пузыря (p<0,05 – p<0,01) (рис. 4), и это подтверждало, что источником ферментурии является именно мочевой пузырь.
Рис. 4. Активность ферментов в стенке мочевого пузыря до и через сутки после 4 часовой ОЗМ. Достоверность различий: * p<0,05, ** p<0,01
Таким образом, 4-х часовая ОЗМ вызывает выраженные нарушения метаболизма клеток детрузора с их массивным повреждением. В дальнейшем мы в сравнительном аспекте оценили защитное действие α-адреноблокатора доксазозина и комплекса противоишемических препаратов на выраженность клеточного повреждения.
Оказалось, что в опытах с терапией противоишемическими средствами степень повреждения митохондрий и активизация продукции активных форм кислорода значительно уменьшались (рис. 5).
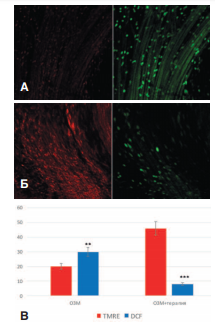
Рис. 5. Влияние терапии комплексом противоишемических препаратов на интенсивность флуоресценции зонда TMRE (красное свечение) и DCF (зеленое свечение) в стенке мочевого пузыря через сутки после ОЗМ. А – контрольный опыт, Б – терапия противоишемическими препаратами. В – количественный анализ (усл. ед.). Достоверность различий: ** p<0,01, *** p<0,001
В опытах с противоишемической терапией флуоресценция зонда TMRE возрастало с 20±2 до 46±3 усл. ед. (p<0,001), что свидетельствовало о сохранении функциональной полноценности митохондриального аппарата гладкомышечных клеток детрузора. При этом значительно ингибировалась продукция активных форм кислорода, о чем свидетельствовала слабая флуоресценция зонда DCF (уменьшение с 30±3 до 8±2 усл. ед.). Эти значения практически соответствуют нормальным показателям интактного мочевого пузыря.
Таким образом, противоишемическая терапия препятствовала активации цитодеструктивных процессов, связанных с нарушением функции митохондрий и с оксидантным повреждением гладкомышечных клеток детрузора, вызванными ОЗМ. Это проявлялось в уменьшении клеточной деструкции, индикатором чего была выраженность ферментурии.
Если в опытах без терапии на следующие сутки после 4-х часовой ОЗМ выявляли резкое увеличение активности большинства ферментов –в 7-15 раз (достоверность различия для всех ферментовp<0,001) (за исключением НАГ и ГГТП), то в условиях медикаментозной терапии выраженность ферментурии существенно снижалась (табл. 2). При этом действие доксазозина и противоишемических препаратов различалось. Если доксазозин уменьшал выход в мочу цитоплазматических ферментов (АСТ, АЛТ, ЛДГ) и ХЭ, попадающей в мочу путем фильтрации в почечных клубочках, то в опытах с противоишемической терапией уменьшалась активность мембраносвязанных ферментов (ГГТП, ЩФ) и лизосомального фермента НАГ, что свидетельствует о выраженном мембранопротективном действии этих препаратов.
Таблица 2. Влияние медикаментозной терапии на активность ферментов в моче крыс, перенесших 4-х часовую ОЗМ (МЕ/моль креатинина)
| Параметры | Контроль | Доксазозин | Противоишемический комплекс | Норма |
|---|---|---|---|---|
| АСТ | 6,2±1,0 | 3,9±0,5* | 4,2±0,4 | 0,6±0,1 |
| АЛТ | 2,9±0,4 | 1,6±0,2* | 2,8±0,4 | 0,2±0,1 |
| ЩФ | 35,8±3,2 | 28,3±2,9 | 17,5±2,1* | 47,9±1,8 |
| ГГТП | 90,0±5,7 | 74,2±5,9 | 24,5±3,8* | 87,4±3,1 |
| ЛДГ | 21,5±1,6 | 9,3±1,4** | 8,1±1,2*** | 2,5±0,2 |
| ХЭ | 7,1±0,5 | 4,5±0,4** | 6,9±0,7 | 1,3±0,2 |
| НАГ | 5,2±0,4 | 5,6±0,4 | 0,7±0,1*** | 3,1±0,2 |
В ткани мочевого пузыря активность ряда ферментов на фоне терапии повышалась, свидетельствуя об уменьшении их потери клетками вследствие их лучшей сохранности, хотя все же во всех группах она оставалась значительно ниже нормы. При этом, если на фоне терапии доксазозином повышалась активность только АСТ и АЛТ, то в опытах с терапией противоишемическим комплексом помимо этих ферментов возрастала тканевая активность ГГТП и, что особенно важно, КФК (табл. 3). То есть защитный эффект противоишемических препаратов при ОЗМ оказался несколько выше, чем протективный эффект доксазозина.
Таблица 3. Влияние медикаментозной терапии на активность ферментов в стенке мочевого пузыря после 4-х часовой ОЗМ (МЕ/мг белка)
| Параметры | Контроль | Доксазозин | Противоишемический комплекс | Норма |
|---|---|---|---|---|
| АСТ | 52,1±7,6 | 91,3±8,2* | 73,3±6,8* | 302±12 |
| АЛТ | 3,6±0,5 | 8,7±1,2* | 15,3±1,6** | 31,6±0,8 |
| ЩФ | 2,7±0,4 | 3,3±0,5 | 4,9±0,5* | 10,2±32 |
| ГГТП | 472±55 | 465±49 | 525±68 | 1481±76 |
| ЛДГ | 17,9±2,4 | 11,7±2,5 | 19,1±1,8 | 41,3±4,8 |
| ХЭ | 299±21 | 262±19 | 401±34* | 6010±997 |
| НАГ | 36,7±3,1 | 25,4±2,6 | 44,8±5,6 | 90,6±8,9 |
Достоверность различий по сравнению с контролем: *p<0,05, ** p<0,01
Таким образом, терапия комплексом препаратов с противоишемическим действием препятствует развитию биохимических нарушений и уменьшения клеточного повреждения. Важно, что все используемые нами противоишемические препараты являются фармакопейными и могут быть использованы в клинике для профилактики расстройств мочеиспускания у больных ДГПЖ. Эффективность противоишемической терапии оказалась сопоставимой с терапией традиционно используемых в клинике α-адреноблокаторов, а по ряду показателей превышала их действие.
Учитывая эти результаты, было проведено клиническое исследование эффективности противоишемической терапии в лечении больных ДГПЖ, осложненной ОЗМ, с оценкой частоты восстановления мочеиспускания и выраженности ферментурии, как маркера клеточного повреждения в сравнении со стандартной терапией α-адреноблокатором тамсулозином.
Самостоятельное мочеиспускание удалось восстановить у 25% больных из группы, получавших тамулозин, и у 48% пациентов из группы с противоишемической терапией. Это различие оказалось статистически значимым (p=0,032). Более того, оказалось, что если при терапии тамсулозином мочеиспускание восстанавливалось преимущественно у больных, у которых объем остаточной мочи не превышал 200 мл, то при назначении противоишемической терапии восстановление мочеиспускания не зависело от объема остаточной мочи. Даже при ее объеме 250-300 мл на фоне терапии восстанавливалось адекватное мочеиспускание (рис. 6). Среди больных с объемом остаточной мочи более 200 мл процент восстановления мочеиспускания составил 9,5% в группе с терапией тамсулозином и 66,7% в группе с противоишемической терапией (p<0,001).
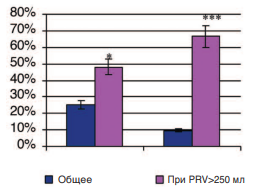
Рис. 6. Влияние терапии тамсулозином и противоишемическими препаратами на частоту восстановления мочеиспускания у больных ДГПЖ с острой задержкой мочи. Достоверность различий: * p<0,05, *** p<0,001
При сравнении взаимосвязи между длительностью анамнеза ДГПЖ и вероятностью восстановления самостоятельного мочеиспускания в исследуемых группах больных оказалось, что у больных, леченых тамсулозином, мочеиспускание восстанавливалось преимущественно у пациентов с относительно коротким анамнезом заболевания (от 1 до 6 лет, в среднем 2,4±0,2 года), тогда как у многих больных, получавших противоишемическую терапию, он был длиннее (от 1 до 10 лет, в среднем 3,1±0,3) (p<0,05). Процент больных с восстановившимся мочеиспусканием и анамнезом более 2 лет составил 26,7% и 41,7%, соответственно (p<0,05). То есть, если α-блокаторы способствовали восстановлению мочеиспускания преимущественно у пациентов с относительно недавно выявленной ДГПЖ, то противоишемические препараты оказались равноэффективными как у пациентов с коротким анамнезом, так и у больных с длительно существующим заболеванием.
Наряду с улучшением восстановления мочеиспускания, противоишемическая терапия больных с ОЗМ уменьшала выраженность цитодеструктивных процессов в мочевом пузыре, что проявлялось в более благоприятной динамике ферментурии. Если в первые сутки в группе больных, леченых тамсулозином повышенная активность ферментов в моче отмечалась лишь у 9 больных, то через 3-5 суток гиперферментурия выявлена у 20 пациентов. Кроме того, у 2 больных через 3-5 дней в моче выявили глюкозурию, чего не было в пробах мочи в 1-е сутки, а количество больных со значимой протеинурией возросло с 2 до 5 (табл. 4)
Таблица 4. Количество больных с нарушенными биохимическими параметрами мочи в исследуемых группах
| Показатель | Тамсулозин | Противоишемический комплекс | ||
|---|---|---|---|---|
| 1 сутки | Через 3-5 сут. | 1 сутки | Через 3-5 сут. | |
| АСТ | 0 | 3 | 1 | 0 |
| АЛТ | 0 | 0 | 0 | 1 |
| ЩФ | 0 | 1 | 1 | 0 |
| ГГТ | 0 | 0 | 3 | 1 |
| ЛДГ | 2 | 4 | 1 | 1 |
| ХЭ | 3 | 6 | 7 | 8 |
| КФК | 4 | 6 | 0 | 3 |
| Глюкоза | 0 | 2 | 1 | 1 |
| Белок | 2 | 5 | 1 | 3 |
| Всего б-ных | 11 | 27 | 15 | 18 |
| Показатель | Тамсулозин | Противоишемический комплекс | ||
| 1 сутки (a) | Через 3-5 сут. (b) | 1 сутки (c) | Через 3-5 сут. (d) | |
| Всего больных с гиперферментурией | 11 | 27 | 15 | 18 |
| критерий χ2 | 18,4 | 0,61 | ||
| P a-b | p < 0,0001 | |||
| P c-d | p = 0,4363 | |||
В группе пациентов, получавших противоишемическую терапию, общее число больных с повышенной активностью ферментов мочи в первые сутки после ликвидации задержки мочеиспускания составило 13 человек, что в целом оказалась сопоставимым с группой пациентов, леченых тамсулозином. Через 3-5 суток общее количество больных с гиперферментурией почти не изменилось, составив 14. При этом у ряда больных ранее повышенная активность нормализовалась или осталась на прежнем уровне. Количество случаев выявления глюкозурии не изменилось, а протеинурии возросло с 1 до 3. Различия между иследуемыми группами по критерию χ2 оказались статистически высокодостоверны (p<0,0001).
Средние значения активности цитоплазматических ферментов мочи (АЛТ, АСТ) и ЛДГ, а также креатинфосфокиназы в первые сутки после дренирования мочевого пузыря в обеих группах существенно не различались (табл. 5). В группе с противоишемической терапией отмечали более высокие средние значения ЩФ, ГГТ и ХЭ, но это происходило, главным образом, за счет высоких значений этого показателя у отдельных больных. Уровень протеинурии в этой группе был ниже, чем в группе пациентов, леченых тамсулозином.
Таблица 5. Средние значения биохимических параметров мочи у больных ДГПЖ после ликвидации ОЗМ
| Тамсулозин 1 сутки | Тамсулозин 3-5 суток | Противоишемический комплекс 1 сутки | Противоишемический комплекс 3-5 суток | Разница Тамсулозин | Разница Противоиш. комплекс | |
|---|---|---|---|---|---|---|
| АСТ | 0,19±0,02 | 0,44±0,04** | 0,14±0,01 | 0,17±0,01### | 0,254 | 0,05*** |
| АЛТ | 0,08±0.01 | 0,12±0,01 | 0,06±0,01 | 0,15±0,02 | 0,03 | 0,05*** |
| ЩФ | 0,11±0,02 | 0,46±0,06** | 0,47±0,11# | 0,41 ±0,13 | 0,346 | 0,06*** |
| ГГТ | 0,04±0.01 | 1,09±0,23*** | 2,33±0,39# | 2,11±0,43 | 1,05 | -0,22*** |
| ЛДГ | 0,08±0.01 | 0,44±0,05*** | 1,0±0,12 | 0,87±0,09# | 0,32 | -0,13*** |
| ХЭ | 2,43±0,32 | 7,07±0,61** | 4,14±0,46# | 3,98±0,48# | 4,64 | -0,16*** |
| КФК | 0,12±0,03 | 1,09±0,14*** | 0,04±0,01 | 0,36±0,06**### | 0,97 | 0,32** |
| Глюкоза | 0,21±0,03 | 3,50±0,43*** | 0,14±0,03 | 0,41±0,06*### | 3,29 | 0,27*** |
| Белок | 72,8±3,8 | 223,3±14,5*** | 38,0±2,1# | 69,2±4,9*### | 150,5 | 81,5** |
Достоверность различий в группах между 1-м и 5-м днями: * p<0,05, ** p<0,01, ***p<0,001; между группами на каждом сроке # p<0,05, ### p<0,001
При исследовании через 3-5 дней в группе больных, леченых тамсулозином, средние значения активности всех ферментов, за исключением АЛТ достоверно возрастала. При этом резко увеличивалась концентрация глюкозы в моче (более, чем в 10 раз) и выраженность протеинурии (в 3 раза). Такие изменения свидетельствовали о нарастании выраженности повреждения как мочевого пузыря, так и почек.
В то же время в группе пациентов, леченых противоишемическими препаратами, активность ферментов достоверно не менялась, за исключением КФК, активность которой возрастала, но в меньшей степени, чем в группе сравнения. Выраженность глюкозурии и протеинурии также увеличивалась в меньшей степени, чем в группе больных, леченых тамсулозином.
Таким образом, если при терапии тамсулозином у ряда больных выраженность клеточного повреждения после ликвидации острой задержки мочи со временем не только не уменьшается, но даже возрастает, то на фоне противоишемической терапии не наблюдается прогрессирования повреждения мочевого пузыря, а в большинстве случаев оно стабилизируется или уменьшается. При этом такие же различия сохраняются и в отношении функции почек. При терапии тамсулозином выявляется тенденция к ухудшению функциональных показателей, тогда как у больных, получавших противоишемическую терапию, существенного ухудшения параметров функции почек не выявлено.
ЗАКЛЮЧЕНИЕ
Представленные в статье результаты экспериментального и клинического исследования свидетельствуют, что противоишемическая терапия может служить эффективным средством профилактики расстройств мочеиспускания у больных ДГПЖ. В ранее опубликованных экспериментальных исследованиях нам удалось показать, что эта терапия способствует нормализации нарушенного кровоснабжения мочевого пузыря и препятствует активации цитодеструктивных процессов при хронической инфравезикальной обструкции, что позволяет в значительной степени сохранить функциональные резервы обструктивного мочевого пузыря. При этом протективные свойства продемонстрировали не только экспериментально созданные препараты с антиоксидантным действием, но и комплекс фармакопейных средств, разрешенных для клинического применения. В данной публикации мы показали, что этот комплекс фармакопейных противоишемических препаратов оказывает защитное действие также при острой задержке мочи, причем, их положительный эффект был установлен и в клиническом исследовании. С нашей точки зрения целесообразно включать противоишемическую терапию в схему лечения больных ДГПЖ с сопутствующими расстройствами мочеиспускания, хотя с точки зрения доказательной медицины, безусловно, нужны дополнительные исследования.
Литература
1. Мудрая И.С., Ибрагимов А.Р., Кирпатовский В.И., Ревенко С.В., Нестеров А.В., Гаврилов И.Ю. Оценка функционального состояния мочевого пузыря крыс методом Фурьеимпедансной цистометрии. Экспериментальная и клиническая урология 2010;(3):21-26.
2. Azadzoi K.M., Heim V.K., Tarkan T., Siroku M.B. Alteration of urothelial-mediated tone in the ischemic bladder: role of eicosanids. Neurourol Urodyn 2004;23 (3): 258-264.
3. Azadzoi K.M., Chen B.G., Radisavljevic Z.M., Siroku M.B. Molecular reactions and ultrastructural damage in the chronically ischemic bladder. J Urol 2011;186(5):2115-2122.
4. Shinbo H, Kurita Y, Nakanishi T, Imanishi T, Otsuka A, Furuse H, Mugiya S, Ozono S. Resistive index: a newly identified predictor of outcome of transurethral prostatectomy in patients with benign prostatic hyperplasia. Urology 2010;75(1):143-147
5. Кирпатовский В.И., Сивков А.В., Федяков Р.П., Хромов Р.А., Баблумян А.Ю., Надточий О.Н.. Роль нарушения кровоснабжения и тканевой гипоксии в развитии дисфункции мочевого пузыря при инфравезикальной обструкции, вызванной аденомой предстательной железы. Урология 2013;(2):123-128.
6. Thurmond P., Yang J., Li Y., Lerner L., Azadzoi K. C. Structural modifications of the prostate in hypoxia, oxidative stress, and chronic ischemia. Korean J Urol 2015;56:187-196.
7. Вишневский А.Е. Нарушение энергетического метаболизма в патогенезе расстройств мочеиспускания у больных доброкачественной гиперплазией простаты и обоснование их медикаментозного лечения: автореф. … дисс. д-ра мед. нНаук. М., 2007. 47 с.
8. Nomiya M., Andersson K., Yamaguchi O. Chronic bladder ischemia and oxidative stress: new pharmacotherapeutic targets for lower urinary tract symptoms. Int J Urol 2015;22:40-46.
9. Andersson KE, Boedtkjer DB, Forman A. The link between vascular dysfunction, bladder ischemia, and aging bladder dysfunction Ther Adv Urol 2017;9(1):11-27. doi: 10.1177/1756287216675778.
10. Azadzoi KM, Radisavljevic ZM, Golabek T, Yalla SV, Siroky MB. Oxidative modification of mitochondrial integrity and nerve fiber density in the ischemic overactive bladder. J Urol 2010;183(1):362-369.
11. Andersson K., Nomiya M., Sawada N., Yamaguchi O. Pharmacological treatment of chronic pelvic ischemia. Ther Adv Urol 2014;6:105-114.
12. Matsumoto S., Hanai T., Shimizu N., Sugimoto K., Uemura H. Effect of edaravon on ischemia-reperfusion injury in rat urinary bladder – changes in smooth muscle cell phenotype and contractile function. Aktuelle Urol 2010;41(Suppl. 1): S46-S49.
13. Кирпатовский В.И., Плотников Е.Ю., Мудрая И.С., Голованов С.А., Дрожжева В.В., Хромов Р.А., Черников Д.Ю., Скулачев В.П., Зоров Д.Б. Роль окислительного стресса и митохондрий в развитии дисфункции мочевого пузыря при острой задержке мочи. Биохимия 2013;78(5):706-713.
14. Кирпатовский В.И., Мудрая И.С., Голованов С.А., Дрожжева В.В., Адамян Н.К., Иванов В.П., Фролова Е.В. Протективное действие противоишемической терапии и α-адреноблокаторов на состояние мочевого пузыря при экспериментально вызванной инфравезикальной обструкции. Экспериментальная и клиническая урология 2015;(4):16-21.
15. Кирпатовский В.И., Мудрая И.С., Федяков Р.П., Голованов С.А., Дрожжева В.В., Черников Д.Ю., Елисеев Д.Э., Надточий О.Н., Сыромятникова Е.В. Ферментурия как маркер повреждения мочевого пузыря при острой задержке мочи. Экспериментальная и клиническая урология 2012;(1):20-23.
16. Кирпатовский В.И., Плотников Е.Ю., Мудрая И.С., Хромов Р.А., Ревенко С.В., Зоров Д.Б. Ишемия мочевого пузыря как причина его дисфункции после острой задержки мочи. Экспериментальная и клиническая урология 2012;(3):9-14.







