По данным ВОЗ частота бесплодия в браке составляет 15% в мире [1,2]. В России один из самых высоких показателей бесплодного брака 19-20% [3]. Роль мужского бесплодия в структуре бесплодного брака значительно переосмыслена в последние десятилетия, что во многом связано с ростом частоты встречаемости «мужского фактора», которая достигает 50% [2]. При этом мужское бесплодие остается малоизученным, а диагностические и лечебные алгоритмы далеки от совершенства, о чем может свидетельствовать высокая встречаемость, так называемой, идиопатической патоспермии 22-30% [2,4-6].
Сложности в диагностике и лечении мужского бесплодия, во многом обусловлены полиэтиологичностью данного состояния. Среди основных причин принято считать инфекционно-воспалительные заболевания органов малого таза и мошонки, варикоцеле, эндокринопатии, травмы, опухоли и аномалии развития мужской репродуктивной системы, генетические синдромы и др. [7].
Ввиду широкой распространенности воспалительные заболевания мужской репродуктивной системы уретрит, орхит, эпидидимит, простатит, везикулит), в том числе обусловленные инфекциями, передающимися половым путем (ИППП), представляют актуальную медико-социальную проблему, являются потенциально устранимой причиной экскреторно-токсической формы мужского бесплодия. Диагноз уретрита устанавливается с учетом картины заболевания и результатов мазка и соскоба из уретры (количество лейкоцитов в мазке >10 в поле зрения), орхита и эпидидимита – по данным УЗИ мошонки и клиническим проявлениям простатита и везикулита – на основании ТРУЗИ и лабораторных данных (количество лейкоцитов в секрете предстательной железы (ПЖ) >10 в поле зрения). Изменения в спермограмме при инфекционно-воспалительных заболеваниях мужских половых органов носят общий характер – содержание лейкоцитов >1 млн/мл, повышение вязкости спермы (вискозипатия), уменьшение количества и активно подвижных форм сперматозоидов (олиго- и астенозооспермия), а также увеличение процента патологических форм сперматозоидов (тератозооспермия) [7-9].
Одну из ведущих ролей в формировании патологических изменений в эякуляте при инфекционно-воспалительных заболеваниях играет такой универсальный патогенетический фактор как окислительный стресс (ОС). Физиологический ОС – это фундаментальное условие функционирования аэробных клеточных систем. Около 95% потребляемого клеткой кислорода восстанавливается до воды в ее митохондриях путем окислительного фосфорилирования и синтеза АТФ. Оставшиеся 5% превращаются в активные формы кислорода или свободные радикалы (СР) [10,11]. Основным источником СР в эякуляте являются сперматозоиды, особенно с нарушенной морфологией, у которых снижен потенциал рождаемости, и продуцирующие больше СР, чем морфологически нормальные формы [12]. Другим мощным источником СР в эякуляте являются лейкоциты, которые продуцируют их до 1000 раз больше, чем сперматозоиды. Такой высокий уровень продукции СР необходим для реализации противомикробной и противовоспалительной функций. Активированные лейкоциты инфильтрируют ткани пораженного органа, продуцируя огромное количество СР, что, в свою очередь, обеспечивает гибель большинства инфекционных агентов. Лейкоцитоспермия на фоне подтвержденной бактериоспермии достоверно сопровождается ухудшением оплодотворяющей способности эякулята, что наблюдается при инфекционно-воспалительных заболеваниях мужской половой системы, в частности при хронических простатитах [8,13,14].
В сперме существует антиоксидантная система защиты, состоящая из трех ключевых ферментов-антиоксидантов (супероксиддисмутаза, каталаза и глутатион-пероксидаза), а также неферментных факторов и низкомолекулярных соединений с антиоксидантным потенциалом (глутатион, пантотеновая кислота, коэнзим Q10, L-карнитин, витамины А, Е, С и В, минералы цинк, селен, хром, медь), которая обеспечивает оксидативный баланс эякулята [15].
При нарушении окислительного баланса, например при гиперпродукции СР, и/или недостаточной скорости их инактивации, а также при дефиците и/или истощении факторов антиоксидантной системы, «физиологический» ОС быстро и незаметно трансформируется в патологический, избыточный ОС – универсальный патогенетический механизм мужского бесплодия независимо от его причины [13,16]. Патологический ОС негативно влияет на все этапы сперматогенеза: от активации сперматогоний до созревания спермиев. Наиболее критические нарушения происходят в мембранах сперматозоидов, в митохондриях (митохондриальная дисфункция и мутации митохондриальной ДНК) и генетическом аппарате сперматозоидов (мутации и фрагментация ядерной ДНК), что значительно снижает мужскую фертильность [17].
Лечение инфекционно-воспалительных заболеваний мужской половой системы, прежде всего, направлено на устранение инфекционного агента и воспаления. Среди микроорганизмов встречаются как передаваемые половым путем (C. trachomatis, U. urealyticum, Mycoplasma sp., M. genitalium, и др.), так и представители условно-патогенной кишечной микрофлоры (E. coli, Klebsiella sp., P. mirabilis, Enterococcus faecalis и др.). Выбор антибиотика обусловлен его способностью проникать в органы мужской репродуктивной системы, спектром активности и чувствительности микроорганизма. В ПЖ и придатки яичек хорошо проникают фторированные хинолоны, тетрациклины и макролиды. Продолжительность курса зависит от локализации воспалительного процесса: при уретрите – 1 нед., орхоэпидидимите – 2 нед., простатите – 4-6 нед. (в особых случаях до 12 недель). При имеющейся возможности лечение проводят в соответствии с результатами микробиологического исследования с определением чувствительности к антибиотикам. Длительность контрольного периода после излечения уретрита и в случае бессимптомного носительства – не менее 3 недель, после терапии орхоэпидидимита – 3 мес. [18].
Следующий этап лечения – назначение антиоксидантов, способных связывать свободные радикалы. Использование антиоксидантов при ОС полезно для улучшения функции сперматозоидов и сохранения целостности ДНК (противодействие фрагментации ДНК) [19]. Антиоксидантными свойствами обладают: витамины А, Е, С, микроэлементы селен и цинк, карнитины, ко-энзим Q10, пентоксифиллин, а также растительные биофлавоноиды. Оптимальное сочетание различных антиоксидантов требует уточнения [18,19].
Цель настоящего исследования – оценить эффективность антиоксидантов в лечении пациентов с воспалительными заболеваниями мужской репродуктивной системы, осложненными экскреторно-токсической формой бесплодия, и оптимизация лечебных алгоритмов при данном состоянии.
МАТЕРИАЛЫ И МЕТОДЫ
В основе данного исследования – результаты обследования и лечения 63 пациентов, обратившихся в урологическую клинику ФГБОУ ВО «Астраханский государственный медицинский университет» на базе ГБУЗ АО «Александро-Мариинская областная клиническая больница» и мужскую консультацию «Доктор – В», за период 2017-2018 гг. Это были мужчины в возрасте от 22 до 48 лет, средний возраст составил 34,0 ± 4,2 года, с хроническим простатитом (n=42), хроническим уретритом (n=12), хроническим везикулитом (n=3), хроническим эпидидимитом (n=6), состоящие в бесплодном браке более 1 года.
Критериями включения пациентов в исследование являлись: наличие воспалительного заболевания репродуктивной системы (уретрит, или простатит, или везикулит, или эпидидимит), а также обнаружение патологических изменений в спермограмме (pH более 7,8, агглютинация сперматозоидов, снижение концентрации и подвижности сперматозоидов, увеличение количества патологических форм, количество лейкоцитов более 1 млн./мл).
При оценке объективного статуса исключались больные с варикоцеле, аномалиями уретры и органов мошонки, с гипогонадизмом и гиперпролактинемией. На основании полученных анамнестических данных и проведенного анкетирования было установлено, что жены всех исследуемых мужчин, признаны фертильными.
Обследование пациентов включало изучение жалоб и анамнестических данных, при этом использовалось тестирование с помощью опросников IPSS и NIH-CPSI. Все больные прошли обследование, включавшее спермограмму в соответствии с протоколом ВОЗ, микробиологическое исследование эякулята, пальцевое ректальное исследование ПЖ, трансректальное ультразвуковое исследование ПЖ (ТРУЗИ) и УЗИ органов мошонки, микроскопическое исследование секрета ПЖ (СПЖ), общий анализ крови и мочи, микроскопическое исследование уретрального мазка и ПЦР-диагностика заболеваний, передающихся половым путем (ИППП).
Больные были разделены на две группы, основная – 39 (61,9%) пациентов, и контрольная – 24 (38,0%) пациента. Хронический простатит диагностирован у 24 (57,1%) больных основной группы, и 18 (28,5%) больных контрольной группы, хронический уретрит у 8 (12,6%) и 4 (6,3%), хронический везикулит у двух (3,1%) и одного (1,5%), хронический эпидидимит у 4 (6,3%) и двух (3,1%) соответственно. При обследовании у 45 (71,4%) пациентов выявлена бактериоспермия в титре 104 КОЕ/мл или более. Среди обнаруженных условно-патогенных микроорганизмов наиболее часто встречались: E. coli – 15 (23,8%), Enterobacter spp. – 12 (19,0%), Enterococcus spp. – 8 (12,6%), Staphilococcus spp. – 6 (9,5%), Enterococcus faecalis – 4 (6,3%). При исследовании на ИППП, инфицирование зафиксировано у 12 (30,7%) пациентов из основной группы и 8 (33,3%) в контрольной. C. trachomatis выявлена у 2 (3,1%) больных, U. Urealyticum – у 8 (12,6%), M. hominis – у 7 (11,1%), M. genitalium – у 3 (4,7%) больных.
Пациенты из контрольной группы (n=24) получали традиционную, этиотропную терапию, в которую входили антибиотики в соответствии с чувствительностью микроорганизмов и локализацией воспалительного процесса. Кроме антибиотиков, у пациентов с хроническим простатитом и везикулитом при наличии болевого синдрома, применялись суппозитории с нестероидными противовоспалительными средствами (индометацин по 100 мг, диклофенак натрия по 100 мг) 1 раз в сутки, продолжительностью 10 дней, а также селективный альфа-1 адреноблокатор по 10 мг в сутки продолжительностью 30 дней. Выбор альфа-1-адреноблокатора был обусловлен снижением вероятности ретроградной эякуляции, что, учитывая репродуктивные задачи пациентов, явилось решающим аргументом в данном исследовании.
Пациенты из основной группы (n=39), помимо вышеуказанной терапии, получали антиоксиданты. В качестве источника антиоксидантов нами был выбран БАД «Андрокомплекс СВ» российской компании ООО «Оптисалт», который применяли по 1 капсуле (по 650 мг) 2 раза в день в течение 90 дней. Выбор данного БАДа обусловлен, на наш взгляд, оптимальным содержанием входящих в его состав компонентов (табл.1).
Таблица 1. Состав биологически активной добавки «Андрокомплекс СВ»
| Активный компонент | Содержание в суточной дозе потребления (2 капсулы по 650 мг) |
|---|---|
| L- карнитин | 350 мг |
| L - аргинин | 260 мг |
| L - карнозин | 114 мг |
| Коэн ЗИМ Q10 | 13 мг |
| Витамин А(ретинол) | 1 мг |
| Витамин Е (альфа-токоферол) | 20 мг |
| Витамин В2 (рибофлавин) | 1,6 мг |
| Витамин D (холекальциферол) | 10 мг |
| Витамин В6 (пиридоксин) | 2 мг |
| Фолиевая кислота | 400 мг |
| Марганец (глюконат) | 2 мг |
| Цинк (цитрат) | 15 мг |
| Селен (селекор С. органическая форма селена) | 70 мг |
В качестве клинико-диагностических критериев улучшения репродуктивной функции мужчин при выявленных инфекционно-воспалительных заболеваниях мочеполовой системы были приняты: элиминация возбудителя ИППП; отсутствие или снижение титра условно-патогенных микроорганизмов в эякуляте менее 103 КОЕ/мл; отсутствие клинических симптомов заболевания; нормализация количества лейкоцитов в сперме, секрете ПЖ и мазке из уретры; восстановление фертильности спермы (количественные и качественные характеристики сперматозоидов); наступление беременности при отсутствии иных причин бесплодия.
Статистическая обработка полученных данных проводилась по методу Стьюдента, различия в показателях считали достоверными при p<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Жалобы на дискомфорт и болезненность в промежности, в области мошонки, в крестце, и при мочеиспускании предъявляли 48 (76,1%) пациентов из обеих групп (26 (41,2%) в основной, и 22 (34,9%) в контрольной). У остальных 15 (23,8%) заболевание протекало бессимптомно. После окончания противовоспалительной терапии у 45 (93,7%) пациентов из обеих групп жалобы полностью отсутствовали. У двух (4,1%) пациентов из основной группы и одного (2,0%) из контрольной отмечено уменьшение выраженности клинических симптомов.
Через месяц после лечения элиминация ИППП была достигнута у 11 (91,6%) пациентов из основной группы и у 8 (100%) – из контрольной. У одного (8,3%) больного в контрольном исследовании методом ПЦР диагностики вновь обнаружены М. genitalium, в связи с чем пациенту проведен повторный курс лечения со сменой антибиотика и с назначением физиотерапевтического лечения.
У 30 (66,6%) пациентов из обоих групп, в повторном бактериологическом исследовании эякулята бактериоспермия не выявлена, у 8 (17,7%) больных из основной группы и 7(15,5%) из контрольной титр условно-патогенных микроорганизмов в эякуляте снизился менее 103 КОЕ/мл.
На фоне проводимого лечения была отмечена следующая динамика результатов спермограмм (табл. 2). У всех пациентов в обеих группах количество лейкоцитов в эякуляте снизилось до <1 млн/мл, нормализовалась вязкость спермы. Однако, у пациентов основной группы, изменение концентрации, подвижности и количества морфологически нормальных форм сперматозоидов отмечено со значительно большей положительной динамикой по сравнению с контрольной группой (рис. 1).
Таблица 2. Динамика основных показателей спермограммы до и после лечения в обеих группах
| Средние показатели | Основная группа | Контрольная группа | ||
|---|---|---|---|---|
| До лечения | После лечения | До лечения | После лечения | |
| Концентрация сперматозоидов, млн/мл | 12.5±4.6 | 25.2±5.2 | 13.2±4.1 | 18.4±4,7 |
| Морфологически нормальные формы. % | 12.1±3.8 | 32.3±4.5 | 13.3i4.2 | 23.1i5.1 |
| Количество лейкоцитов, млн/мл | 3.5±1,5 | 0.5±0.2 | 2.8±1.1 | О.61О.З |
| Вязкость - длина нити, см | 4,5 | 0.7 | 3,8 | 0.6 |
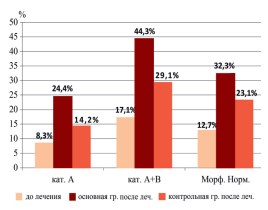
Рис. 1. Изменение подвижности и количества морфологическим нормальных форм сперматозоидов в основной и контрольной группах
Полученные результаты свидетельствуют, что проведение комплексного лечения инфекционно-воспалительных заболеваний мужской репродуктивной системы, направленное, прежде всего, на элиминацию возбудителя, приводит к нормализации показателей спермограммы у пациентов с экскреторнотоксическим бесплодием, как при бактериоспермии обусловленной условно-патогенной микрофлорой, так и при ИППП.
В результате проведенного исследования было установлено, что применение БАД «Андрокомплекс СВ» как источника антиоксидантов у пациентов с воспалительными заболеваниями мужской репродуктивной системы, осложненной экскреторнотоксической формой бесплодия, увеличивает долю морфологически нормальных форм сперматозоидов в полтора раза, при этом концентрация сперматозоидов и доля прогрессивно подвижных форм (А+В) увеличивается более, чем в 2 раза.
По данным телефонного опроса наблюдавшихся мужчин, проведенного через 2-4 месяца после окончания лечения, было установлено, что у партнерш 18 (46,1%) пациентов основной группы наступила беременность. У партнерш пациентов из контрольной группы беременность наступила у 6 (25%).
ЗАКЛЮЧЕНИЕ
Воспалительные заболевания органов репродуктивной системы, в том числе обусловленные ИППП, имеют важное значение в развитии нарушений фертильности у мужчин репродуктивного возраста и являются потенциально исправимой причиной мужского бесплодия. Проведение комплексного обследования пациентов на наличие инфекций мужских половых органов, является неотъемлемой частью мер, направленных на успешное преодоление бесплодного брака. Очевидно, что лечение хронических воспалительных заболеваний мужской репродуктивной системы должно быть комплексным и состоять из этиотропной антибактериальной терапии, направленной на элиминацию возбудителя, и обязательно включать комплексы антиоксидантов, как средств патогенетически обоснованной терапии патологического окислительного стресса, приводящих к нормализации функции мужской половой системы и восстановлению репродуктивного потенциала.
ЛИТЕРАТУРА
- Harton GL, Tempest HG. Chromosomal disorders and male infertility. Asian J Androl 2012;14(1):32-9. doi: 10.1038/aja.2011.66
- Калинченко С.Ю., Тюзиков И.А. Практическая андрология. М.: Практическая медицина. 2009. С. 147-151.
- WHO laboratory manual for the examination and processing of human semen. 5th ed. – Geneva: World Health Organization, 2010, 271 p.
- Виноградов И.В., Капто А.А., Афанасьева Л.М. Опыт применения карнитина у больных идеопатической патоспермией. Проблема репродукции 2009;(1):76-78.
- Полунин А.И., Мирошников В.М., Луцкий Д.Л., Николаев А.А. Хронический неспецифический простатит и уретрит: современные вопросы диагностики и лечения. Руководство для врачей Астрахань. 2001, 194 с.
- Тер-Аванесов Г.В. Проблемы репродуктивного здоровья мужчин. М., 2004. С. 26-31, 69-75.
- ЛуцкийД.Л.,ЛуцкаяА.М., Махмудов Р.М. Исследование эякулята и его компонентов в диагностике воспалительных заболеваний мужской репродуктивной системы: клеточный состав, патогенны. Проблемы репродукции 2011;17(5):77-82.
- ПолунинА.А.,Асфандияров Ф.Р., Мирошников В.М.,Садретдинов Р.А., Браташ В.И., Асфандияров Ф.Р. Сравнительный анализ фертильности у мужчин с хроническим простатитом. Астраханский медицинский журнал. 2014;9(2):59-63
- Сеидов К.С., Асфандияров Ф.Р., Мирошников В.М., Выборнов С.В., Ляшенко В.В., Степанович О.В. Оптимизация лечебных алгоритмов у субфертильныхмужчин с вискозипатией и астенозооспермией, обусловленных хроническим простатитом. Астраханский медицинский журнал 2017;12(2):104-111.
- Baird AN, Bhagooli R, Ralf PJ, Takachashi S. Goral bleaching: the role of the host. Trends Ecol Evol 2009;24(1):16-20. doi: 10.1016/j.tree.2008.09.005.
- Carmeli E., Coleman R., Reznick A.Z., e biochemistry of aging muscle. Exp Gerontol. 2002;37(4):477-89
- Agarwal A, Roychoudhury S, Bjugstad KB, Cho CL.Oxidation-reduction potential of semen: what is its role in the treatment of male infertility? Ther Adv Urol 2016;8(5):302-318.
- Сатретдинов Р. А., Воронина Л. П., Полунин А. А., Мирошников В. М. Роль оксидативного стресса в развитии бесплодия у больных хроническим простатитом. Международный журнал экспериментального образования 2016;(3-1):111-112.
- Shang Y, Liu C, Cui D, Han G, Yi S. e effect of chronic bacterial prostatitis on semen quality in adult men: a meta-analysis of case-control studies. Sci Rep 2014;4:7233. doi: 10.1038/srep07233.
- Agarwal A, Roychoudhury S, Bjugstad KB, Cho CL. Oxidation-reduction potential of semen: what is its role in the treatment of male infertility? Ther Adv Urol 2016;8(5):302-318.
- AgarwalA, NallellaKP,Allamaneni SS, Said TM. Role of antioxidantsin treatment of male infertility: an overview of the literature. Reprod Biomed Online 2004;8(6):616-27.
- AgarwalA,ChoCL, Esteves SC. Shouldwe evaluate and treatsperm DNAfragmentation? Curr Opin Obstet Gynecol. 2016;28(3):164-71. doi: 10.1097/GCO.0000000000000271
- Божедомов В.А.Андрология. Фармакотерапия без ошибок. Руководство для врачей [под ред. Камалова А.А.] .М.: Е-ното, 2017. С. 202-232 19. Showell MG, Mackenzie-Proctor R, Brown J. et al. Antioxidants for male subfertility. Cochran Database Syst. Rev 2014. Vol. 12. CD007411.







