ВВЕДЕНИЕ
Традиционно считают, что «мишенью» гексанового экстракта Serenoa repens (HESR – hexanic extract of Serenoa repens), широко используемого для лечения расстройств мочеиспускания у мужчин с доброкачественной гиперплазией предстательной железы (ДГПЖ) в сочетании с хроническим простатитом, является собственно предстательная железа. Взаимодействие между клетками предстательной железы и HESR реализуется на нескольких уровнях и проявляется антиандрогенным, противовоспалительным и проапоптотическим эффектами [1]. Однако в литературе встречаются данные, свидетельствующие, что терапевтическое действие экстракта Serenoa Repens может также осуществляться на уровне мочевого пузыря, но сведения по этому вопросу крайне ограничены [2, 3]. С учетом этого нами была высказана гипотеза о возможности прямого действия HESR (Пермиксон) на обструктивный мочевой пузырь, препятствующего развитию его дисфункции, не опосредованного, но дополняющего влияние препарата на предстательную железу [4]. Для подтверждения этой гипотезы и было предпринято данное исследование.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на 30 белых беспородных крысах – самках годовалого возраста массой 330-370 г. Специально были отобраны самки достаточно «пожилого» возраста c соответствующими возрастными изменениями мочевого пузыря, не связанными с предстательной железой. Животные были разделены на группы: опытную (n = 10); sham/плацебо (n = 15) и контрольную/интактные крысы (n = 5).
Инфравезикальную обструкцию (ИВО) моделировали у животных основной и sham групп путем наложения лигатуры на предпузырный отдел уретры, которую предварительно катетеризировали кубитальным катетером 18G (диаметр – 1,25 мм), как описано в публикациях [5, 6]. После удаления катетера формировалось выраженное сужение уретры, затрудняющее отток мочи.
Со следующего после операции дня крысы опытной серии ежедневно получали HESR (Пермиксон, Pierre Fabre Medicament, Франция) в виде водно-спиртовой суспензии в дозе 27,6 мг/кг, которую вводили внутрижелудочно через зонд. Дозу рассчитали, исходя из терапевтической дозы препарата, рекомендованной для человека (320 мг в сутки или 5 мг/кг), с учетом межвидового переноса дозы на основе коэффициента различий в площади поверхности тела для мелких лабораторных животных, что составило 30 мг/кг [7]. Непосредственно перед введением животным содержимое капсулы фармакопейного препарата (160 мг препарата) растворяем в 1,6 мл 70% этилового спирта с получением маточного раствора с концентрацией 100 мг/мл. В последующем его смешивали с дистиллированной водой в соотношении 1:20. Итоговая концентрация Пермиксона – 5 мг/мл, а спирта – 3,5%. Объем полученной суспензии, необходимый для введения, определяли исходя из массы каждой крысы (варьировал в пределах 1,5-1,8 мл). Крысам sham группы ежедневно внутрижелудочно вводили аналогичный объем 3,5% спиртового раствора.
Через 2 недели животных обследовали с определением их выживаемости, функционального состояния мочевого пузыря и биохимических изменений крови и мочи, характеризующих функциональное состояние почек. Животных содержали в обменных клетках для определения суточного диуреза, сбора суточной мочи и получения проб для последующего биохимического анализа. Животные всех групп получали стандартный гранулированный корм, рекомендованный для содержания грызунов.
Функцию мочевого пузыря оценивали по данным инфузионной цистометрии. Мочевой пузырь катетеризировали в области верхушки кубитальным катетером 20G, подсоединенным к инфузионной системе для постепенного его наполнения, и через уретру – катетером 18G для регистрации динамики внутрипузырного давления, которую осуществляли на аппаратно-программной комплексе («Биола», Россия), с обработкой полученных данных компьютерной программой А5 170424 [8]. Рассчитывали следующие показатели: максимальный объем наполнения мочевого пузыря до начала мочеиспускания, максимальное внутрипузырное давление в начале мочеиспускания, зависимость «объем/давление» в течение всего процесса цистометрии, амплитуду спонтанных колебаний внутрипузырного давления в процессе цистометрии.
После завершения функциональных исследований брали пробы крови из нижней полой вены для последующих биохимических исследований, животных усыпляли и удаляли мочевой пузырь для определения его массы взвешиванием и для гистологического исследования.
Биохимическое исследование проб крови и мочи выполняли на анализаторе «ADVIA-2000 (Siemens) с определением следующих показателей: концентрации мочевины, креатинина, калия, натрия, белка, активность ферментов аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), лактатдегидрогеназы (ЛДГ), щелочной фосфатазы (ЩФ), креатинфосфокиназы (КФК). Из этих данных рассчитывали величину скорости клубочковой фильтрации, канальцевой реабсорбции натрия, суточную экскрецию с мочой метаболитов и ферментов.
Для проведения патоморфологического исследования готовили гистологические срезы по стандартной методике с их окраской гематоксилином и эозином. Для определения морфометрических параметров изображения отцифровывали и загружали в компьютерную программу «HistoScan» (фирма Biovitrum, Россия, СанктПетербург). Определяли толщину стенки мочевого пузыря, его отдельных слоев и мышечных пучков, а также площадь очагов склероза мышечной оболочки и выраженность воспалительной реакции по степени распространенности воспалительных инфильтратов. Измерения проводили не менее чем в 10 точках в разных участках препарата (рис. 1).
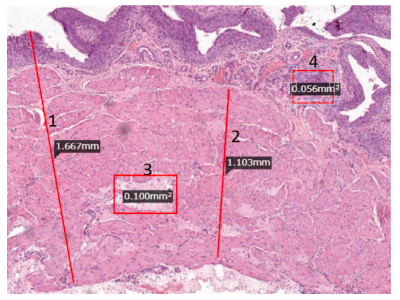
Рис. 1. Пример измерения морфометрических параметров на гистологическом срезе. 1 – общая толщина стенки; 2 – толщина мышечного слоя; 3 – площадь участка склероза; 4 – площадь очага воспалительной инфильтрации
Fig. 1. An example of measuring morphometric parameters on a histological
section. 1 – total wall thickness; 2 – thickness of the muscle layer; 3 – area of
sclerosis; 4 – area of the focus of inflammatory infiltration
Статистическую обработку проводили с использованием программ Excel-2013 и Statistica 6.0 для расчета средних значений и ошибки средней (М±m) и достоверности различий между группами по критерию Стьюдента для количественных показателей или по критерию χ2 для сравнения качественных параметров. Достоверными считали различия при p<0,05.
РЕЗУЛЬТАТЫ
В течение 2 недель после моделирования ИВО в sham группе умерло 10 из 15 крыс (на 3-и сутки – 6 крыс и на 8-е и 11-е сутки – по 2 крысы), летальность – 67%, тогда как в опытной группе за это время умерло 3 крысы (на 3-и, 5-е и 7-е сутки), летальность – 30%. Причиной гибели животных предположительно явилось развитие почечной недостаточности, так как у этих крыс отмечался резко сниженный диурез (табл. 1), а при аутопсии выявляли гидронефротическую трансформацию почек. Хотя летальность оказалась существенно выше в sham группе, статистический анализ с использованием критерия χ2 выявил лишь пограничные со статистической достоверностью значения (р=0,070), что связано с небольшим числом наблюдений в группах.
Таблица 1. Влияние терапии HESR на показатели функционального состояния почек у крыс с выраженной ИВО
Table 1. The effect of HESR therapy on indicators of the functional state of the kidneys in rats with severe IVO
|
Показатели |
Норма |
HESR 2 недели |
Sham 2 недели |
|---|---|---|---|
|
Концентрация мочевины в крови (ммоль/л) |
8,3±0,3 |
13,9±1,1 |
12,2±2,4 |
|
Концентрация креатинина в крови (мкмоль/л) |
60+2 |
126±16 |
101±6 |
|
Суточный диурез (мл) |
13,3+0,5 |
10,4+0,8 |
7,4+0,7* |
|
Клиренс креатинина (мл/мин) |
2,92+0,09 |
0,98±0,10 |
0,58 ± 0,06* |
|
Реабсорбция натрия (%) |
99,5+0,1 |
96,9 ± 0,2 |
93,8 ±0,3** |
|
Абсолютное количество реабсорбированного натрия (мгмоль/ мин) |
199+11 |
137 ± 21 |
80 ± 11* |
Примечание: достоверность различий между опытной и sham группами: *р<0,05, **р<0,01
Note: significance of differences between the experimental and sham groups: *p<0.05, **p<0.01
Таблица 2. Параметры биохимического исследования мочи в опытной и контрольной группах
Table 2. Parameters of the biochemical study of urine in the experimental and control groups
|
Показатели |
Норма |
HESR 2 недели |
Sham 2 недели |
|---|---|---|---|
|
Концентрация мочевины в моче (ммоль/л) |
218 ± 26 |
234 ± 10 |
170 ± 21* |
|
Концентрация креатинина в моче (мкмоль/л) |
10,2 ± 1,2 |
10,1 ± 1,1 |
9,4 ± 1,0 |
|
Суточная экскреция мочевины с мочой (ммоль/л) |
2757 ± 184 |
2882 ± 426 |
1092 ± 218* |
|
Суточная экскреция креатинина с мочой (мкмоль/л) |
135 ± 6 |
131 ± 5 |
78 ± 14* |
Примечание: достоверность различий между опытной и контрольной группами: *р<0,05
Note: significance of differences between the experimental and control groups: *p<0.05
При обследовании выживших крыс через 2 недели после моделирования ИВО в основной и sham группах выявили резкое переполнение и перерастяжение мочевого пузыря, тогда как в норме он, как правило, выглядел спавшимся (рис. 2).
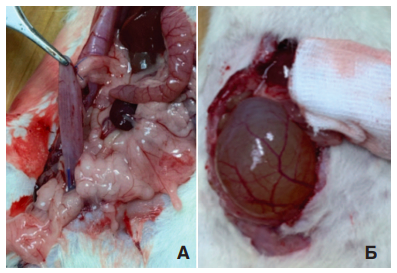
Рис. 2. Внешний вид мочевого пузыря крысы в норме (А) и через 2 недели
после моделирования инфравезикальной обструкции (Б)
Fig. 2. The appearance of the bladder of a rat in the norm (A) and 2 weeks after
the modeling of infravesical obstruction (B)
При этом объем мочи, определенный в обструктивном мочевом пузыре сразу после вскрытия брюшной полости и катетеризации мочевого пузыря, оказался большим в опытной группе по сравнению с sham группой. Если в sham группе он колебался в диапазоне от 3 до 4,8 мл (в среднем 4,0 ± 0,3 мл), то у крыс опытной серии он варьировал от 3 до 15 мл (в среднем, 8,3±1,6 мл). Различия оказались статистически достоверными (р<0,05). У интактных крыс емкость мочевого пузыря составляла 0,6-0,8 мл (в среднем 0,7±0,02 мл).
Несмотря на более значительное растяжение мочевого пузыря у крыс, получавших HESR, он сохранял высокую способность эвакуации мочи, о чем свидетельствовали данные суточного диуреза, которые у выживших животных опытной группы составили 10,4±2,6 мл/сутки (от 4 до 25 мл), а в sham группе – всего 7,4±2,1 мл/сутки (от 0,4 до 14 мл). У интактных животных суточный диурез составляет 13,3±1,6 мл/сутки (от 8,5 до 18 мл). При этом в опытной группе лишь у одной из выживших крыс (15%) суточный диурез был ниже минимальных значений, характерных для интактных животных, тогда как в sham группе – у 4 из 5 крыс (80%) диурез был значительно ниже минимального нормального значения, что также свидетельствует о лучшем функциональном состоянии почек крыс основной группы. При статистическом анализе с использованием критерия Стьюдента различия между опытной и sham группами не достигли достоверной значимости (р=0,11), но степень уменьшения диуреза в sham группе по сравнению с интактными животными оказалось статистически значимой (р=0,045), тогда как значения диуреза при терапии HESR и у контрольных животных статистически значимо не различались. Анализ с использованием критерия χ2 выявил статистически значимые различия между числом животных со снижением диуреза ниже минимального значения в норме в опытной и sham группах (р=0,025).
Цистометрия наполнения
Функциональное состояние мочевого пузыря оценивали методом цистометрии наполнения. Такие показатели цистометрии как максимальная функциональная емкость мочевого пузыря и внутрипузырное давление при начале мочеиспускания в опытной и sham группах существенно не различались и составили: 4,9 ± 0,4 мл и 4,4 ± 0,3 мл и 50,2±4,1 и 49,9±5,6 см H2O, соответственно. В группе контроля эти параметры, в среднем, составили 0,7±0,02 мл и 28,7±1,4 см H2O. Отсутствие различий в значениях внутрипузырного давления при начале мочеиспускания в опытной и sham группах мы связываем с тем, что в эксперименте ИВО была создана суживающей уретру лигатурой и проводимая терапия не могла повлиять на сопротивление уретры, а, следовательно, на то, при каком давлении уретральное сопротивление будет преодолено и начнется мочеиспускание. В отношении максимальной функциональной емкости мочевого пузыря следует отметить, что в sham серии этот показатель оказался практически таким же, как и при измерении внутрипузырного объема мочи при первичной катетеризации мочевого пузыря, тогда как в опытной группе значения, полученные при цистометрии наполнения, оказались существенно ниже. На наш взгляд эти различия могут свидетельствовать о влиянии терапии HESR на способность обструктивного мочевого пузыря восстанавливать тонус детрузора после его деблокирования и нормализации внутрипузырного давления.
При более детальном анализе результатов инфузионной цистометрии выявили существенные различия между группами. В sham группе повышение внутрипузырного давления возникало практически сразу после начала введения физраствора, а его рост сопровождался иррегулярными колебаниями (рис. 3А), тогда как в основной группе наблюдали более плавный рост давления, без колебаний и с его существенным подъемом при введении более значительного объема физраствора (рис. 3Б).
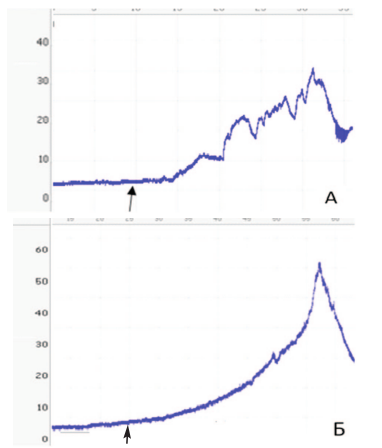
Рис. 3. Результаты цистометрии наполнения. А – Типичный пример динамики
внутрипузырного давления при постепенном инфузионном наполнении мочевого пузыря у крысы sham серии. Б – Типичный пример динамики внутрипузырного давления при постепенном инфузионном наполнении мочевого
пузыря крысы основной группы
Fig. 3. Filling cystometry results. A – A typical example of the dynamics of intravesical pressure during gradual infusion filling of the bladder in a sham series
rat. B – A typical example of the dynamics of intravesical pressure during gradual infusion filling of the bladder of the rats of the main group
Динамическое определение зависимости «объем/ давление» выявило более плавный рост этого показателя в основной группе при введении первых 3 мл физраствора с последующим ускорением его роста и достижением более высоких значений (рис. 4). Такая динамика близка к изменению этого индекса у крыс с нормальным мочевым пузырем и, по нашему мнению, свидетельствует о лучшем сохранении эластичности (комплаентности) стенки гипертрофированного мочевого пузыря при терапии HESR. Это предположение согласуется с данными о возможности накопления большего объема мочи у крыс, получавших HESR. Более «жесткая» стенка мочевого пузыря ведет к более быстрому достижению критического уровня внутрипузырного давления, превышающего возможности сфинктера по удержанию мочи (рис. 4).
Как было указано выше, в sham серии при наполнении мочевого пузыря на фоне прогрессивного роста внутрипузырного давления возникали спонтанные колебания давления амплитудой от 4 до 6,9 см H2O (в среднем 5,3±0,5 см H2O), что можно расценить, как проявление вторичной гиперактивности детрузора, тогда как в основной группе спонтанные колебания давления практически отсутствовали: амплитуда 0-1,6 см H2O (в среднем 1,1±0,3 см H2O). Статистический анализ выявил достоверные различия по этому показателю (р<0,01).
Наличие высокоамплитудных спонтанных колебаний внутрипузырного давления в фазу накоплению мочи свидетельствует о формировании детрузорной гиперактивности, часто развивающейся при инфравезикальной обструкции. Значительное уменьшение частоты развития и амплитуды спонтанных сокращений детрузора на фоне HESR позволяет сделать заключение о прямом влиянии препарата на гладкомышечные клетки мышечной оболочки мочевого пузыря и/или на механизмы регуляции их сократительной активности (в данном случае на порог возбудимости клеток).
Таким образом, исходя из приведенных данных, можно сделать заключение, что лечение HESR способствует лучшему сохранению функциональных параметров мочевого пузыря, а именно, комплаентности стенки мочевого пузыря, эвакуаторной способности детрузора и препятствует развитию гиперактивности детрузора.
Биохимические исследования
Важной задачей нашего исследования, помимо подтверждения прямого действия HESR на мочевой пузырь, было определение, способствует ли это действие сохранению функции почки, поскольку часто при выраженной ИВО наблюдается развитие почечной недостаточности разной степени тяжести.
Проведенные исследования показали, что терапия HESR способствует сохранению ряда показателей, характеризующих функцию почек, на более близких к норме значениях, чем в sham серии. Хотя при биохимических исследованиях не выявили достоверных различий между группами по уровням креатинина и мочевины крови, но по таким важным параметрам, как суточный диурез, скорость клубочковой фильтрации и канальцевая реабсорбция натрия, были установлены достоверные различия.
Показано, что в sham опытах диурез снижался почти в 2 раза, тогда как терапия HESR приводила к сохранению диуреза на более близких к норме значениях, что, с одной стороны, может быть следствием лучшей сохранности эвакуаторной функции мочевого пузыря, а с другой – сохранности фильтрационной способности почек. Подтверждением значимости последнего фактора являются данные о достоверно меньшем снижении клиренса креатинина на фоне HESR, по сравнению с sham опытами. Также в меньшей степени ухудшалась канальцевая реабсорбция натрия, как в процентном отношении к объему профильтрованного натрия, так и в абсолютных значениях (табл. 1).
О лучшей сохранности функционального состояния почек при терапии HESR крыс c ИВО свидетельствуют и данные биохимического анализа мочи. В опытах sham серии выявили достоверное снижение концентрации мочевины в моче, а также суточной экскреции мочевины и креатинина с мочой, тогда как в опытной серии все эти показатели не отличались от нормальных значений. То есть, применение HESR препятствует существенному ухудшению азотовыделительной функции почек при ИВО (табл. 2).
Для оценки выраженности повреждения клеток почек и обструктивного мочевого пузыря (цитолиза), вызванного выраженной ИВО, определяли активность ферментов в крови и моче. В обеих группах выявили повышение активности АСТ, ЛДГ и КФК в крови, тогда как активность АЛТ и ЩФ достоверно не менялась. При этом, если повышение активности АСТ и ЩФ в обеих группах было примерно одинаковым, то в отношении КФК отмечен достоверно более выраженный рост активности фермента в sham группе животных по сравнению с HESR группой (табл. 3).
Этот факт заслуживает особого внимания, поскольку повышение активности КФК может быть связано с повреждением гладкомышечных клеток детрузора обструктивного мочевого пузыря, а менее значительный рост активности этого фермента в опытной группе отражает лучшую сохранность гладкомышечных клеток детрузора при терапии HESR.
Патоморфологические исследования
При исследовании удаленного мочевого пузыря выявили, что в обеих сериях происходила его значительная гипертрофия, но ее степень оказалась достоверно более выраженной в группе животных, леченых HESR: масса мочевого пузыря возрастала с 96±4 мг в норме до 547±61 мг в sham серии и до 1004±104 мг в HESR серии (различия между опытной и контрольной группами достоверны при р<0,01).
Более выраженная гипертрофия детрузора в серии с терапией HESR подтвердилась при морфометрическом исследовании срезов обструктивных мочевых пузырей (табл. 4).
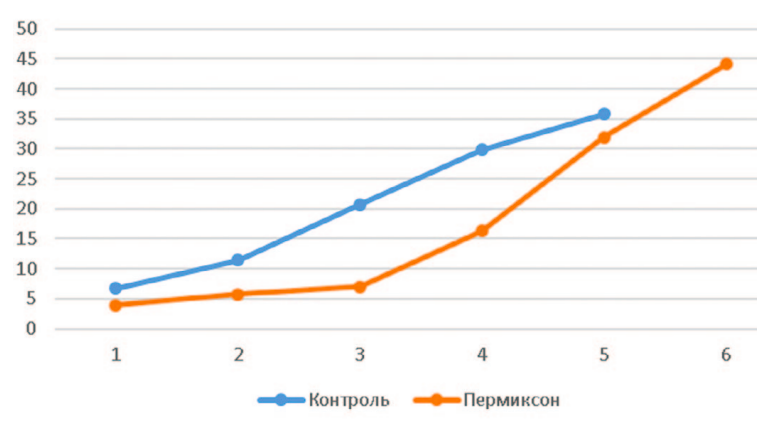
Рис. 4. Сравнительная динамика индекса «объем/давление» в изучаемых
группах (ось абсцисс – давление в см H2O, ось ординат – объем введенного
физраствора в мл)
Fig. 4. Comparative dynamics of the «volume/pressure» index in the studied
groups (abscissa axis – pressure in cm H2O, ordinate axis – volume of injected
saline solution in ml)
Средняя толщина мышечной стенки мочевого пузыря в опытной и sham сериях составила 0,801±0,099 и 0,469±0,32 мм (р<0,001). В опытной серии в большей степени возросла также общая толщина стенки мочевого пузыря, по сравнению с sham: 1,085±0,109 и 0,817±0,011 мм, соответственно (р<0,05). При этом, соотношение толщины детрузора и толщины всей стенки мочевого пузыря составило 73,3±1,7% и 57,4±3,5%, соответственно (р<0,01), что свидетельствует о преобладающем вкладе гипертрофии детрузора в утолщение стенки обструктивного мочевого пузыря.
Утолщение стенки мочевого пузыря происходило также за счет подслизистого слоя, что было более выражено в sham серии опытов: 0,198±0,030 мм по сравнению с 0,134±0,007 мм при терапии HESR (р<0,05), что связано как с наличием более выраженного отека и воспалительного инфильтрата в этой зоне, а в отдельных препаратах – с развивающимся склерозом (рис. 5А, Б). При этом в половине случаев sham серии выявляли наличие деэпителизированных участков слизистой оболочки (рис. 5В), тогда как в группе HESR участков деэпителизации слизистой мочевого пузыря не выявляли, что может быть связано с развитием более выраженного воспаления в sham экспериментах.
При этом в опытной серии во всех образцах выявляли выраженное расширение сосудов подслизистого слоя (рис. 5Б), тогда как в sham серии гиперемию подслизистого слоя выявили лишь в половине опытов, и она была менее выражена.
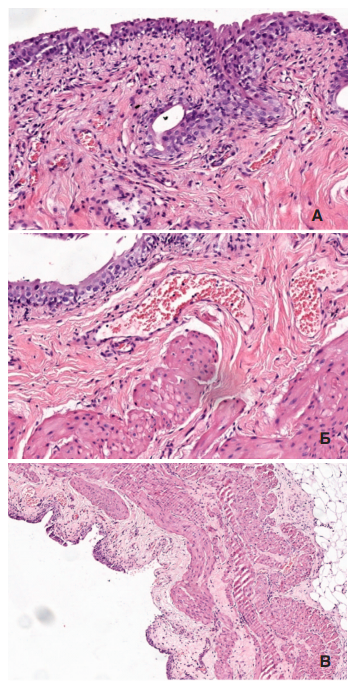
Рис. 5. А – Выраженное утолщение подслизистого слоя с диффузным воспалительным инфильтратом и склерозом в sham группе, окраска гематоксилином и эозином, ув. 200х. Б – умеренный склероз подслизистого слоя с
выраженным расширением кровеносных сосудов и минимальной воспалительной реакцией в HESR группе, окраска гематоксилином и эозином, ув. 200х. В
– участок деэпителизации слизистой мочевого пузыря, утолщение подслизистого слоя в sham группе, окраска гематоксилином и эозином, ув. 100х
Fig. 5. A – Pronounced thickening of the submucosal layer with diffuse inflammatory infiltrate and sclerosis in the sham group, H&E staining, x 200. Б – moderate sclerosis of the submucosal layer with pronounced dilation of blood
vessels and minimal inflammatory response in the HESR group, H&E staining, x
200. В – site of de-epithelialization of the bladder mucosa, thickening of the submucosal layer in the sham group, H&E staining, x 100
Если в опытной группе воспалительную инфильтрацию выявляли только в пределах подслизистого слоя, то в половине случаев sham серии выявляли диффузную инфильтрацию всей стенки мочевого пузыря (рис. 6).
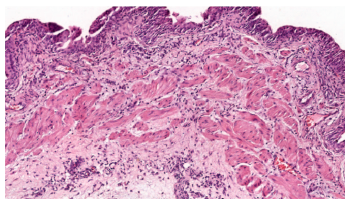
Рис. 6. Выраженный диффузный воспалительный инфильтрат, захватывающий всю стенку мочевого пузыря, sham группа, окраска гематоксилином и
эозином, ув. 100х
Fig. 6. Severe diffuse inflammatory infiltrate involving the entire bladder wall,
sham group, H&E staining, x 100
Последствием длительно текущего воспаления становится активация склеротического процесса. Проявления склеротического процесса во всех слоях стенки мочевого пузыря оказались значительно более выражены в sham серии. В этих опытах в мышечной оболочке выявляли как выраженный диффузный перимускулярный склероз (толстые прослойки соединительной ткани, окружающие пучки гладкомышечных клеток), так и локальные очаги склероза разной площади (рис. 7), тогда как в опытной серии площадь склеротических очагов была достоверно (р<0,05) меньше – 0,026±0,02 по сравнению с 0,051±0,011 мм2 в sham группе (табл. 4).
Таблица 3. Влияние терапии HESR на активность ферментов в крови и моче
Table 3. Effect of HESR therapy on enzyme activity in blood and urine
|
Показатели |
Норма |
HESR 2 недели |
Sham 2 недели |
|---|---|---|---|
|
Активность ферментов в крови / Enzyme activity in the blood |
|||
|
Активность ACT в крови (МЕ/л)/ 1 AST activity in blood (IU/l) |
68 + 2 |
117 ± 16 |
128 ± 10 |
|
Активность АЛТ в крови (МЕ/л) / ALT activity in blood (IU/l) |
36 + 3 |
23 ± 2 |
31 ± 2* |
|
Активность ЛДГ в крови (МЕ/л) / LDH activity in blood (IU/L) |
320 + 22 |
1618 ± 223 |
1692 ± 244 |
|
Активность ЩФ в крови (МЕ/л) / ALP activity in blood (IU/I) |
169 + 8 |
240 ± 29 |
202 ± 34 |
|
Активность КФК в крови (МЕ/л) / СРК activity in blood (IU/I) |
198 + 23 |
499 + 31 |
627 + 39* |
|
Активность ферментов в моче / Enzyme activity in the urine |
|||
|
Активность ACT в моче (МЕ/л) / AST activity in urine (IU/I) |
1,6 ± 0,7 |
9,2 ± 3,8 |
4,8 ± 2,2 |
|
Активность АЛТ в моче (МЕ/л) / ALT activity in urine (IU/I) |
2,6 ± 1,6 |
7,8 ± 3,7 |
5,5 ± 2,5 |
|
Активность ЛДГ в моче (МЕ/л) / LDH activity in urine (IU/L) |
5,2 ± 0,9 |
5,8 ± 0,9 |
4,8 ± 0,8 |
|
Активность ЩФ в моче (МЕ/л) / ALP activity in urine (IU/I) |
4,8 ± 0,6 |
7,4 ± 5,4 |
13,0 ±11,3 |
|
Активность КФК в моче (МЕ/л) / СРК activity in urine (IU/I) |
1,4 ± 0,4 |
17,4 ± 10,3 |
2,8 ± 0,9* |
Примечание: достоверность различий между опытной и контрольной группами: *р<0,05
Note: significance of differences between the experimental and control groups: *p<0.05
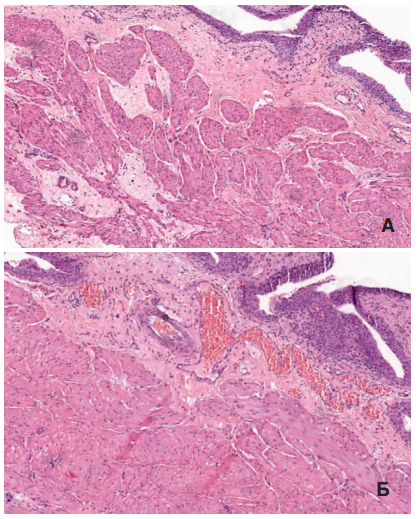
Рис. 7. А – Резко выраженный склероз подслизистого слоя, диффузный перимускулярный крупно- и мелкоочаговый склероз мышечной оболочки, sham
группа. Б – Умеренно выраженный склероз подслизистого слоя с резким полнокровием сосудов, минимальный склероз мышечной оболочки, HESR группа.
Окраска гематоксилином и эозином, ув. 100х.
Fig. 7. A – Pronounced sclerosis of the submucosal layer, diffuse perimuscular largeand small-focal sclerosis of the muscular membrane, sham group. B – Moderately
pronounced sclerosis of the submucosal layer with a sharp plethora of blood vessels,
minimal sclerosis of the muscular membrane, HESR group. H&E staining, x 100
ОБСУЖДЕНИЕ
Большинство исследований демонстрируют, что хроническое воздействие частичной ИВО на мочевой пузырь претерпевает фазы компенсации и декомпенсации. В компенсированной фазе мышца детрузора увеличивает силу, чтобы преодолеть возросшее сопротивление. Благодаря увеличению массы мочевого пузыря, его сократительная функция сохраняется [9].
Типичная гистологическая картина этой фазы – гипертрофия детрузора и существенное увеличение массы мочевого пузыря, что наблюдают и в эксперименте, и у больных ДГПЖ [10].
Электронно-микроскопические исследования показали, что следствием мышечной гипертрофии и гиперплазии при ИВО является увеличение отложения коллагена и потеря парасимпатических нервных окончаний [11]. Это ведет к нестабильному «электрическому статусу» в зоне обструкции и неупорядоченным сокращениям детрузора [12]. Возникшая гиперактивность детрузора характеризуется спонтанными сокращениями, не связанными с мочеиспусканием, с повышенной частотой или без нее и последующим уменьшением объема мочеиспускания и емкости мочевого пузыря. При этом, изменение объема мочеиспускания и емкости мочевого пузыря в значительной степени зависят от продолжительности и тяжести обструкции [13-15]. В декомпенсированной фазе масса мочевого пузыря продолжает какое-то время увеличиваться, но сократимость стенок мочевого пузыря и функция опорожнения ухудшаются. Конец этой фазы характеризуется преобладанием фиброзной ткани в стенке мочевого пузыря, низкой емкостью мочевого пузыря и его плохой податливостью [16].
В экспериментах показано, что через 6 недель экспериментально вызванной умеренной и тяжелой ИВО у крыс, вес мочевого пузыря оказался в 2-2,5 раза больше, по сравнению с контрольной группой [17]. Это сопоставимо с данными C. Liu и соавт об увеличении веса мочевого пузыря крыс после 4х недель выраженной ИВО в 2-2,5 раза [18, 19]. Ранее M. Saito и соавт. доложили, что масса мочевого пузыря после двух недель «жесткой» обструкции выросла более, чем в 4 раза [20]. Результаты настоящего исследования также показали рост веса мочевого пузыря при ИВО, однако они несколько отличаются от приведенных выше данных в сторону большего увеличения веса мочевого пузыря. Если в sham группе такое увеличение превысило средний вес мочевого пузыря контрольной группы в 5,7 раза, что приближается к данным M. Saito и соавт., то в группе HESR – в 10,5 раз.
Проведенные нами гистологические исследования подтвердили развитие гипертрофии мочевого пузыря, статистически достоверно более выраженное в HESR группе: увеличение толщины детрузора и стенки мочевого пузыря. При этом, площадь очагов склероза была значимо больше в sham группе, что свидетельствует о декомпенсации мочевого пузыря.
Таким образом, в настоящем исследовании, в условиях «жесткой» ИВО, наблюдали выраженную гипертрофию детрузора у животных основной группы, что характерно для описанной выше первой стадии патологического процесса – гипертрофии. В то же время, состояние мочевого пузыря у крыс sham группы можно характеризовать, как декомпенсированное. То есть, назначение HESR, вероятно, «затормозило» развитие патологического процесса на этапе гипертрофии – начала фазы декомпенсации, по сравнению с sham группой, где наблюдали выраженную декомпенсацию мочевого пузыря.
Цистометрия является традиционным исследовательским подходом для выявления изменений функции мочевого пузыря, в том числе у грызунов [21]. Наиболее широко используемыми животными для таких экспериментов являются крысы из-за относительной простоты технологии цистометрии. На моделях грызунов обычно исследуют следующие цистометрические параметры: объем мочеиспускания, остаточный объем, емкость мочевого пузыря, пороговое давление (давление в мочевом пузыре в начале сокращения детрузора для мочеиспускания), давление мочеиспускания (максимальное давление мочеиспускания), интервал мочеиспускания и исходное давление. Однако, трудно определить их нормальный диапазон [22]. T. Kitta и соавт. представили облик типичных кривых цистометрии наполнения у крыс в норме (sham) и при искусственно вызванной ИВО (рис. 8) [23, 24].
![Типичные цистометрические кривые крыс в норме и при ИВО в модификации [23, 24]](https://ecuro.ru/sites/default/files/issue/2023_1/2.8.png)
Рис. 8. Типичные цистометрические кривые крыс в норме и при ИВО в модификации [23, 24]
Fig. 8. Typical cystometric curves of normal (sham) and IVO rats in modification [23, 24]
У животных с ИВО, как правило, увеличены: продолжительность цикла мочеиспускания, объем мочеиспускания, остаточный объем мочи и пороговое давление, что отражает увеличение емкости и гипертрофию мочевого пузыря. Во время фазы наполнения мочевого пузыря при ИВО наблюдают непроизвольные сокращения детрузора (в некоторых случаях описываемые как сокращения перед мочеиспусканием), сопровождающиеся повышением давления в мочевом пузыре больше 2,0-4,0 см H2O [25-28].
В настоящем исследовании результаты инфузионной цистометрии выявили существенные различия между группами. В sham группе повышение внутрипузырного давления возникало практически сразу после начала введения физраствора, а его рост сопровождался иррегулярными колебаниями, отражающими возникновение детрузорной гиперактивности (рис. 3А), тогда как в основной группе наблюдали плавный рост давления до более высоких значений без признаков гиперактивности (рис. 3А-Б). При этом, рисунки цистометрических кривых, полученных нами в HESR и sham группах, практически полностью повторяют эталонные варианты, характерные для нормы и ИВО, соответственно (рис. 8). То есть, динамика изменения внутрипузырного давления у крыс, получавших HESR, приближена к таковой у контрольных животных. Кроме того, изменение индекса «объем/давление» в основной группе, по нашему мнению, свидетельствует о лучшем сохранении комплаентности стенки гипертрофированного мочевого пузыря при терапии HESR. Это подтверждают данными о большем объеме накопления мочи у крыс, получавших HESR.
Лучшее функциональное состояние мочевого пузыря у животных основной группы способствовало большей сохранности функции почек, что отразилось в достоверно лучших показателях суточного диуреза, клиренса креатинина и реабсорбции натрия.
В настоящем исследовании была выбрана модель тяжелой ИВО для имитации длительно существующей обструкции мочевых путей, приводящей к выраженными нарушениям функции мочевого пузыря и почек. Эксперименты, проведенные на самках крыс, подтвердили высказанную нами ранее гипотезу о возможном прямом действии гексанового экстракта Serenoa repens (Пермиксон) на мочевой пузырь, помимо влияния на предстательную железу. Это подтверждено рядом фактов на фоне применения HESR:
- сохранение целостности эпителиальной выстилки слизистой оболочки мочевого пузыря, что предотвращает проникновение мочи в интерстиций под действием повышенного внутрипузырного давления и развитие воспаления в стенке мочевого пузыря;
- регуляция процессов гипертрофии, воспаления и склерозирования детрузора на фоне ИВО;
- интенсификация кровоснабжения подслизистого слоя мочевого пузыря;
- предотвращение развития детрузорной гиперактивности;
- улучшение комплаентности и эвакуаторной функции мочевого пузыря.
ЗАКЛЮЧЕНИЕ
Таким образом, исходя из полученных в ходе настоящего исследования, можно сделать заключение, что в условиях тяжелой ИВО на фоне гипертрофии детрузора применение HESR способствует лучшему сохранению функциональных параметров мочевого пузыря, а именно, комплаентности и эвакуаторной способности, также уменьшает степень воспаления и склерозирования стенки мочевого пузыря, препятствует развитию декомпенсации мочевого пузыря и, тем самым, содействует сохранению функции почек. Значительное уменьшение частоты развития и амплитуды спонтанных сокращений детрузора на фоне HESR позволяет сделать заключение о прямом влиянии препарата на гладкомышечные клетки мышечной оболочки мочевого пузыря и/или на механизмы регуляции их сократительной активности.
Механизмы влияния HESR на мочевой пузырь в настоящий момент не ясны. Однако, без сомнения, как и в случае с ДГПЖ, это воздействие носит комплексный характер, где противовоспалительное действие HESR имеет первостепенное значение. Рассмотрению этого будут посвящены дополнительные исследования и публикации.
ЛИТЕРАТУРА
1. Habib FK. Serenoa repens: The scientific basis for the treatment of benign prostatic hyperplasia. Eur Urol Suppl 2009;8(13):887-93. https://doi.org/10.1016/j.eursup.2009.11.005.
2. Suzuki M, Oki T, Sugiyama T, Umegaki K, Uchida S, Yamada S. Muscarinic and alpha 1-adrenergic receptor binding characteristics of Saw Palmetto extract in rat lower urinary tract. Urology 2007;69(6):1216-20. https://doi.org/10.1016/j.urology.2007.02.038
3. Nasrin S, Masuda E, Kugaya Н, Osano A, Ito Y, Yamada S. Effects of Saw Palmetto extract on urodynamic parameters, bladder muscarinic and purinergic receptors and urinary cytokines in rats with cyclophosphamide-induced cystitis. Low Urin Tract Symptoms 2014;6(1):57-63. https://doi.org/10.1111/luts.12015.
4. Сивков А.В. Кирпатовский В.И. Экстракты Serenoa Repens в лечении расстройств мочеиспускания у больных ДГПЖ: дискуссия об эффективности и комплексном механизме действия. Экспериментальная и клиническая урология 2020;(4):96-105. [Sivkov A.V., Kirpatovskiy V.I. Serenoa Repens in the treatment of voiding dysfunction in patients with BPH: discussion of effectiveness and complex mechanism of action. Eksperimentalnaya i Klinicheskaya urologiya = Experimental and Clinical Urology 2020;(4):96-105. (In Russian)]. https://doi.org/10.29188/2222-8543-2020-13-4-96-104.
5. Кирпатовский В.И., Кудрявцев Ю.В., Мудрая И.С., Белик С.М., Хромов Р.А. Гетерогенность морфологических и функциональных изменений разных отделов мочевого пузыря крыс при инфравезикальной обструкции мочевых путей. Бюллетень экспериментальной биологии и медицины 2009;147(1):108-12. [Kirpatovskii V.I., Kudryavtsev Yu.V., Mudraya I.S., Belik S.M., Khromov R.A. Heterogeneity of morphological and functional changes in various compartments of rat urinary bladder in infravesical obstruction of the urinary tract. Byulleten' eksperimental'noy biologii i meditsiny = Bulletin of Experimental Biology and Medicine 2009;147(1):108-12. (In Russian)].
6. Кирпатовский В.И., Мудрая И.С., Голованов С.А., Дрожжева В.В., Адамян Н.К., Иванов В.П., Фролова Е.В. Протективное действие противоишемической терапии и α-адреноблокаторов на состояние мочевого пузыря при экспериментально вызванной инфравезикальной обструкции. Экспериментальная и клиническая урология 2015;(4):16-21. [Kirpatovskiy V.I., Mudrya I.S., Golovanov S.A., Drozhzheva V.V., Adamyan N.K., Ivanov V.P., Frolova E.V. Protective action of the anti-ischemic therapy with alpha-adrenoblockers on experimental infravesicalthe bladder obstruction. Eksperimentalnaya i Klinicheskaya urologiya = Experimental and Clinical Urology 2015;(4):16-21. (In Russian)].
7. Шекунова Е.В., Ковалева М.А., Макарова М.Н., Макаров В.Г. Выбор дозы препарата для доклинического исследования. Межвидовой перенос доз. Ведомости научного центра экспертизы средств медицинского применения 2020;10(1):19-28. [Shekunova E.V., Kovaleva M.A., Makarova M.N., Makarov V.G. Dose selection in preclinical studies: cross-species dose conversion. Vedomosti Naučnogo centra èkspertizy sredstv medicinskogo primeneniâ = Bulletin of the Scientific Centre for Expert Evaluation of Medicinal Products 2020;10(1):19-28. (In Russian)].
8. Кирпатовский В.И., Баблумян А.Ю., Голованов С.А., Дрожжева В.В., Адамян Н.К., Мурадян А.А., и др. Влияние противоишемической терапии на восстановление функции мочевого пузыря после острой задержки мочи. Экспериментальная и клиническая урология 2018;(1):28-35. [Kirpatovskiy V.I. Bablamyan A.Yu., Golovanov S.A., Drozhzheva V.V., Adamyan N.K., Muradyan A.A., et al. The influence of anti-ischemic therapy on the recovery of urinary bladder function after acute urinary retention. Eksperimentalnaya i Klinicheskaya urologiya = Experimental and Clinical Urology 2018;(1):28-35. (In Russian)].
9. Collado A, Batista E, Gelabert-Mas A, Corominas JM, Arano P, Villavicencio H. Detrusor quantitative morphometry in obstructed males and controls. J Urol 2006;176(6 Pt 1):2722–8.
10. Michishita M, Yano K, Kasahara K, Tomita K, Matsuzaki O. Increased expression of 5-HT(2A) and 5-HT(2B) receptors in detrusor muscle after partial bladder outlet obstruction in rats. Biomed Res 2015;36(3):187–94. https://doi.org/10.2220/biomedres.36.187.
11. Dixon JS, Gilpin CJ, Gilpin SA, Gosling JA, Brading AF, Speakman MJ. Sequential morphological changes in the pig detrusor in response to chronic partial urethral obstruction. Br J Urol 1989;64(4):385–90. https://doi.org/10.1111/j.1464-410x.1989.tb06048.x.
12. Seki N, Karim OM, Mostwin JL. Changes in electrical properties of guinea pig smooth muscle membrane by experimental bladder outflow obstruction. Am J Physiol 1992;262(5 Pt 2):F885–91. https://doi.org/10.1152/ajprenal.1992.262.5.F885.
13. Schroder A, Uvelius B, Newgreen D, Andersson K-E. Bladder overactivity in mice after 1 week of outlet obstruction. Mainly afferent dysfunction? J Urol 2003;170(3):1017-21. https://doi.org/10.1097/01.ju.0000070926.39442.4c.
14. Malmgren A. Bladder instability and abnormal micturition patterns in rats with infravesical outflow obstruction. Neurourol Urodyn 1987;6(5):371-380. https://doi.org/10.1002/ nau.1930060504.
15. Mostwin JL, Karim OM, van Koeveringe G, Brooks E L. The guinea pig as a model of gradual urethral obstruction. J Urol 1991;145(4):854-8. https://doi.org/10.1016/s0022-5347(17)38477-x.
16. Gosling JA, Kung LS, Dixon JS, Horan P, Whitbeck C, Levin RM. Correlation between the structure and function of the rabbit urinary bladder following partial outlet obstruction. J Urol 2000;163(4):1349–56.
17. Sezginer EK, Yilmaz-Oral D, Lokman U, Nebioglu S, Aktan F, Gur S. Effects of varying degrees of partial bladder outlet obstruction on urinary bladder function of rats: A novel link to inflammation, oxidative stress and hypoxia. Lower Urinary Tract Symptoms 2019;11(2):O193-O201. https://doi.org/10.1111/luts.12211.
18. Liu C, Xu H, Fu S, Chen Y, Chen Q, Cai Z, et al. Sulforaphane ameliorates bladder dysfunction through activation of the Nrf2–ARE pathway in a rat model of partial bladder outlet obstruction. Oxid Med Cell Longev 2016;2016:7598294. https://doi.org/10.1155/2016/7598294.
19. Shirazi M, Mirkhani H, Monabbati A, Moghtadernejad S, Aminsharifi A. The effect of pentoxifylline on detrusor muscle contractility after partial urethral obstruction in a rat model. Int Urol Nephrol 2015;47(9):1493–7. https://doi.org/10.1007/s11255-015-1049-2.
20. Saito M, Wein AJ, Levin RM. Effect of partial outlet obstruction on contractility: comparison between severe and mild obstruction. Neurourol Urodyn 1993;12(6):573–583. https://doi.org/10.1002/nau.1930120610.
21. Smith PP, Hurtado E, Smith CP, Boone TB, Somogyi GT. Comparison of cystometric methods in female rats. Neurourol Urodyn 2008;27(4):324–9. https://doi.org/10.1002/nau.20512.
22. Andersson KE, Soler R, Fullhase C. Rodent models for urodynamic investigation. Neurourol Urodyn 2011;30(5):636–46. https://doi.org/10.1002/nau.21108.
23. Kitta T, Kakizaki H, Tanaka H, Sano H, Furuno T, Mitsui T, et al. An alpha-amino-3- hydroxy-5-methyl4-isoxazolepropionate glutamate-receptor antagonist can inhibit premicturition contractions in rats with bladder outlet obstruction. BJU Int 2007;100(1):181–6. https://doi.org/10.1111/j.1464-410X.2007.06919.x.
24. Sawada N, Nomiya M, Hood B, Koslov D, Zarifpour M, Andersson KE. Protective effect of a beta3-adrenoceptor agonist on bladder function in a rat model of chronic bladder ischemia. Eur Urol 2013;64(4):664–71. https://doi.org/10.1016/j.eururo.2013.06.043.
25. Levin RM, Saito M, Wein AJ, Packard D, Cohen A, Haugaard N. Effect of partial outlet obstruction on choline acetyltransferase activity in the rat and rabbit. Neurourol Urodyn 1993;12(3):255–61. https://doi.org/10.1002/nau.1930120308.
26. Chai TC, Gemalmaz H, Andersson KE, Tuttle JB, Steers WD. Persistently increased voiding frequency despite relief of bladder outlet obstruction. J Urol 1999;161(5):1689–93.
27. Tanaka H, Kakizaki H, Shibata T, Ameda K, Koyanagi T. Effects of chronic blockade of Nmethyl-D-aspartate receptors by MK-801 on neuroplasticity of the micturition reflex pathway after partial urethral obstruction in the rat. J Urol 2003;170(4 Pt 1):1427-31. https://doi.org/10.1097/01.ju.0000074713.69589.4a 170: 1427–1431.
28. Tanaka H, Kakizaki H, Shibata T, Mitsui T, Koyanagi T. Effect of preemptive treatment of capsaicin or resiniferatoxin on the development of pre-micturition contractions after partial urethral obstruction in the rat. J Urol 2003;170(3):1022-6. https://doi.org/10.1097/01.ju.0000071479.02427.7d.







