ВВЕДЕНИЕ
Метафилактика мочекаменной болезни (МКБ) становится все более востребованной среди пациентов, что подталкивает урологов и врачей других специальностей (нефрологов, эндокринологов) заниматься исследованием возможных первопричин литогенеза [1]. Определение этиологии камнеобразования является краеугольным камнем метафилактики МКБ, без которого невозможно дальнейшее лечение больного [2-4]. Имеющиеся в распоряжении специалистов инструменты для поиска и дифференциальной диагностики метаболических литогенных нарушений при МКБ не обладают 100% эффективностью и не позволяют точно определить патогенетические механизмы уролитиаза. Доказательством этому тезису служит тот факт, что достаточно часто в мировой литературе встречается такой термин, как «идиопатический уролитиаз» [5-7].
Стандартными общепринятыми методами диагностики причин формирования конкрементов являются определение химического состава мочевого камня и биохимический анализ крови и суточной мочи [8-11]. Данные инструменты хорошо зарекомендовали себя и с успехом используются в клинической медицине в течение долгого времени. Ранее мы уже писали, что дополнительным методом диагностики причин литогенеза может стать исследование кислотно-щелочного состава (КЩС) крови [12].
Метод определения КЩС крови известен уже давно, но тем не менее он не нашел широкого применения в урологической практике. По всей видимости, это связано с техническими сложностями выполнения анализа. Известно, что определение КЩС крови необходимо выполнять как можно скорее после забора материала (в течение нескольких минут), что в клинической практике в большинстве случаев неосуществимо по различным причинам. Несмотря на наличие определенных технических проблем при исследовании КЩС крови, решение вопроса о проведении данного анализа пациентам с МКБ возможно на уровне руководства лечебного учреждения и не требует больших финансовых и ресурсных затрат.
В цикле работ, посвященных изучению метаболизма у больных МКБ, мы постараемся показать место анализа КЩС крови при проведении метафилактики уролитиаза и приведем научное обоснование целесообразности выполнения данного исследования [12]. Настоящая работа является продолжением опубликованного ранее материала и посвящена изучению у пациентов с МКБ результатов основных показателей КЩС: pH крови, парциальное давление углекислого газа (pCO2), парциальное давление кислорода (pO2), BE (base excess) крови.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось проспективно на базе НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиала ФГБУ «НМИЦ радиологии» Минздрава России. Материалом для исследования послужила группа больных с диагнозом мочекаменная болезнь. Все пациенты отбирались случайным образом.
Проанализированы данные обследования 83 пациентов: 39 мужчин и 44 женщин. У 40 пациентов выявлены односторонние мочевые камни, у 41 – двусторонние, у 2 больных диагностированы камни единственной почки.
Всем пациентам выполнялся анализ химического состава мочевого камня методом инфракрасной спектроскопии, биохимический анализ крови и суточной мочи на предмет нарушений обмена камнеобразующих веществ, КЩС крови (pH крови, парциальное давление кислорода, парциальное давление углекислого газа, сывороточные концентрации калия, натрия, ионизированного кальция, глюкозы, показатель дефицита либо избытка оснований).
Исследование биохимических показателей суточной экскреции мочи проводили на автоанализаторе ADVIA 1200 (Bayer-Siemens) по стандартным методикам с помощью диагностических наборов реагентов фирмы Siemens (Германия).
Анализ газов и электролитов венозной крови выполняли сразу (в течение 5 минут) после сбора биологического материала на анализаторе газов крови GemPremier 3500 (Испания) по стандартным методикам.
У всех больных определялся уровень паратиреоидного гормона (ПТГ) крови с помощью иммунохимического метода на аппарате Beckman Access 2.
Химический состав мочевых конкрементов выполняли на инфракрасном-Фурье спектрометре Nicolet iS10 (Thermo Scientific, США) с использованием библиотеки спектров мочевых камней известного состава. В случае наличия компонента, составляющего более 50% от всего состава конкремента, химический состав камня относили к группе конкрементов по преобладающему элементу.
Всем пациентам определялся pH утренней мочи. Статистический анализ выполнялся при помощи методов описательной статистики, вычисления t-критерия для независимых групп, корреляционного анализа для двух переменных с расчетом коэффициентов корреляции Спирмена (Spearman) посредством компьютерной программы Statistica 10.0 (StatSoft USA). Результат считался достоверным при p<0,05.
РЕЗУЛЬТАТЫ
Результаты исследования показали, что у большинства больных (30 пациентов (36,1%)) преобладали мочевые камни, состоящие из вевеллита (кальция оксалата моногидрата), у 25 (30,1%) больных выявлены камни из карбонатапатита. Мочекислые мочевые камни выявлены у 13 (15,7%) пациентов. Конкременты, состоящие из цистина и струвита, обнаружены у 3 (3,6%) больных соответственно. У 2 (2,4%) пациентов выявлены аммоний-уратные мочевые камни. Камни, состоящие из брушита, диагностированы у 1 (1,2%) пациента. Смешанные мочевые камни были выявлены у 6 (7,2%) больных (табл.1).
Таблица 1. Химический состав мочевых камней
Table 1. Urinary stones chemical composition
| Химический состав мочевого камня Urinary stone chemical composition |
Кол-во пациентов Patients number |
% |
|---|---|---|
| Вевеллит (кальция оксалат моногидрат) / Wevellite (calcium oxalate monohydrate) | 30 | 36,1% |
| Карбонатапатит / Carbonatapatite | 25 | 30,1% |
| Мочевая кислота / Uric acid | 13 | 15,7% |
| Струвит / Struvite | 3 | 3,6% |
| Цистин / Cystine | 3 | 3,6% |
| Аммония урат / Ammonium urate | 2 | 2,4% |
| Брушит / Brushite | 1 | 1,2% |
| Смешанные / Mixed | 6 | 7,3% |
Анализ данных исследования крови показал, что ацидемия (pH крови <7,32) была выявлена у 38 пациентов (45,8%), нормальный уровень pH крови (7,32< pH крови <7,42) наблюдался у 45 больных (54,2%). Пациентов с алкалемией (pH крови >7,45) диагностировано не было.
По данным проведенного статистического анализа с помощью расчета t-критерия Стьюдента зафиксировано, что у пациентов с ацидемией (pH крови <7,32) концентрации хлора и креатинина в сыворотке крови достоверно выше, чем в группе пациентов с 7,32 <pH крови <7,42. При этом обнаружено, что показатель BE достоверно ниже, чем в группе сравнения. Интересным фактом является то, что у больных с ацидемией статистически достоверно выше уровень ионизированного кальция, чем у пациентов с нормальными значениями pH крови, хотя при этом уровень общего кальция крови и суточной мочи не связан со степенью ацидемии. Также прослеживается тенденция к снижению концентрации оксалатов в суточной моче у пациентов с МКБ при ацидемии (p=0,0753) (табл. 2).
Таблица 2. Показатели крови, суточной мочи, КЩС крови у пациентов с МКБ при различных уровнях pH крови
Table 2. Indicators of blood, daily urine, blood acid-base balance in urolithiasis patients at various levels of blood pH
| Показатель / Indicators | Кровь, ммоль/л / Blood, mmol/l | Моча, ммоль/сут / Urine, mmol/day | ||||
|---|---|---|---|---|---|---|
| Пациенты с pH крови <7,32 (n=38) |
Пациенты с 7,32 ≥pH крови ≤7,42 (n=45) |
P | Пациенты с pH крови <7,32 (n=38) |
Пациенты с 7,32 ≥pH крови ≤7,42 (n=45) |
P | |
| Ca | 2,354±0,194 | 2,365±0,149 | 0,7665 | 4,682±2,685 | 4,246±2,870 | 0,4805 |
| Мочевая к-та / Urinary acid | 340,377±95,617 | 337,478±77,819 | 0,8793 3139,469 | ±1459,153 | 3105,390±1065,550 | 0,9027 |
| P | 1,130±0,184 | 1,186±0,216 | 0,2099 | 23,716±10,806 | 25,127±9,240 | 0,5229 |
| Cre | 110,663±53,086 | 91,002±24,658 | <0,05 | |||
| Мочевина / Urea | 6,486±3,965 | 5,713±1,798 | 0,2438 | |||
| Cl | 106,857±4,117 | 105,289±2,181 | <0,05 | 131,579±54,610 | 138,091±45,614 | 0,5555 |
| Na | 141,543±2,548 | 141,456±1,918 | 0,8593 | 136,921±60,906 | 137,659±49,435 | 0,9516 |
| K | 4,577±0,647 | 4,398±0,586 | 0,1891 | 48,737±16,695 | 49,207±20,237 | 0,9094 |
| Mg | 0,841±0,068 | 0,830±0,077 | 0,4877 | 3,301±1,191 | 3,312±1,375 | 0,9679 |
| AG | 11,023±2,634 | 12,066±2,752 | 0,0834 | 48,568±37,495 | 51,511±30,967 | 0,6963 |
| pH | 7,263±0,046 | 7,357±0,026 | <0,05 | |||
| Цитраты / Citrates | 2,642±1,034 | 2,627±1,140 | 0,9500 | |||
| Оксалаты / Oxalate | 0,126±0,088 | 0,164±0,096 | 0,0753 | |||
| pCO2 | 61,105±11,018 | 52,556±4,966 | <0,05 | |||
| pO2 | 32,211±12,349 | 36,556±14,453 | 0,1489 | |||
| Ca2+ | 1,212±0,092 | 1,170±0,076 | <0,05 | |||
| Глюкоза / Glucose | 5,321±1,556 | 5,207±0,899 | 0,6772 | |||
| BE | -1,661±4,202 | 2,087±2,141 | <0,05 | |||
Проведенный корреляционный анализ с расчетом непараметрического коэффициента корреляции Спирмена для определения связи, силы и направления взаимосвязи между уровнем pH крови и другими показателями крови и мочи показал наличие корреляции между уровнем pH крови и концентрацией общего кальция, креатинина, мочевины, хлора сыворотки крови (табл. 3).
Таблица 3. Коэффициенты корреляции между уровнем pH крови и биохимическими показателями крови и суточной мочи*
Table 3. Correlation coefficients between blood pH and biochemical parameters of blood and daily urine*
|
Среднее Average |
Std.Dv. | R | p | N |
|---|---|---|---|---|---|
| pH крови / blood pH | 7,3096 | 0,06024 | 0,322218 | 0,015442 | 56 |
| Ca крови, ммоль/л / Blood Ca, mmol/l | 2,3713 | 0,18024 | |||
| pH крови / blood pH | 7,3096 | 0,06024 | -0,357754 | 0,006789 | 56 |
| Cre крови, мкмоль/л / Blood Cre, μmol/l | 100,3625 | 39,65376 | |||
| pH крови / blood pH | 7,3096 | 0,06024 | -0,306620 | 0,021536 | 56 |
| Ur крови, ммоль/л / Blood Ur, mmol/l | 6,2036 | 3,40870 | |||
| pH крови / blood pH | 7,3096 | 0,06024 | -0,488342 | 0,000134 | 56 |
| Cl крови, ммоль/л / Blood Cl, mmol/l | 106,0893 | 3,52795 | |||
| pH крови / blood pH | 7,31139 | 0,06005 | -0,340093 | 0,003467 | 72 |
*в таблице приведены только статистически значимые показатели
*the table shows only statistically significant indicators
У пациентов, страдающих МКБ, установлена положительная корреляционная зависимость средней силы между уровнем общего кальция крови и pH крови (r=0,322218, р=0,015442). Установлена отрицательная корреляционная зависимость средней силы между концентрацией креатинина крови и pH крови (r=-0,357754, р=0,006789), мочевины крови и pH крови (r=-0,306620, р=0,021536), хлора крови и pH крови (r=-0,488342, р=0,000134) (табл. 3).
У пациентов с уролитиазом выявлена отрицательная корреляционная зависимость между показателями pH крови и уровнем ПТГ крови (r=-0,340093, р=0,003467) (табл. 3).
Считаем важным подчеркнуть, что также прослеживается тенденция к наличию отрицательной корреляционной зависимости между уровнем pH крови и показателями ионизированного кальция крови (r=-0,209117, р=0,077916) и между pH крови и концентрацией калия крови (r=-0,237439, р=0,078061) (табл. 3).
Учитывая наличие корреляционной зависимости сывороточного уровня ПТГ от pH крови, отдельно был проведен корреляционный анализ между цифрами ПТГ, ионизированного кальция и общего кальция крови.
Установлена хорошо известная ранее тесная взаимосвязь между уровнями ПТГ и ионизированного кальция крови. При этом связи между сывороточной концентрацией паратгормона и общего кальция крови выявлено не было (табл. 4).
Таблица 4. Коэффициенты корреляции между уровнем паратгормона крови и показателями общего и ионизированного кальция крови
Table 4. Correlation coefficients between parathyroid hormone and indicators of total and ionized blood calcium
| Среднее Average |
Std.Dv. | R | p | N | |
|---|---|---|---|---|---|
| Ca крови, ммоль/л / Blood Ca, mmol/l | 2,34957 | 0,17338 | -0,038243 | 0,753281 | 70 |
| ПТГкрови, пг/мл / Blood PTH | 60,13143 | 57,83443 | |||
| Ca2+ крови, ммоль/л / Blood Ca2+, mmol/l | 1,19069 | 0,08149 | 0,556255 | <0,000001 | 72 |
| ПТГкрови, пг/мл / Blood PTH | 59,45278 | 57,16795 |
Вторым этапом работы стало определение pCO2 венозной крови у пациентов с МКБ. Результаты исследования показали, что у 63 (75,9%) больных диагностировали гиперкапнию (уровень pCO2 крови находился на уровне >51 мм рт.ст.), при этом у 20 пациентов (24,1%) pCO2 определялось в пределах нормальных значений (41-51 мм рт.ст.). Больных с гипокапнией (pCO2 <41 мм рт.ст.) выявлено не было.
Сравнение средних величин биохимических показателей крови у больных с различными показателями pCO2 крови показало, что в группе больных с гиперкапнией (pCO2 >51 мм рт.ст.) отмечается более высокий уровень общего кальция (p<0,05) и более низкий уровень сывороточной концентрации креатинина (p<0,05), мочевины (p<0,05) и хлора (p<0,05), чем у пациентов с 41< pCO2 <51 мм рт.ст. (табл. 5).
Таблица 5. Показатели крови, суточной мочи, КЩС крови у пациентов с МКБ при различных уровнях pCO2 крови
Table 5. Indicators of blood and daily urine in urolithiasis patients at various levels of blood pCO2
| Показатель / Indicators | Кровь, ммоль/л / Blood, mmol/l | Моча, ммоль/сут / Urine, mmol/day | ||||
|---|---|---|---|---|---|---|
| Пациенты с pCO2 ≥41 и ≤51 мм.рт.ст (n=19) |
Пациенты с pCO2>51 мм.рт.ст. (n=63) |
P | Пациенты с pCO2 ≥41 и ≤51 мм.рт.ст (n=19) |
Пациенты с pCO2>51 мм.рт.ст. (n=63) | P | |
| Ca | 2,258±0,202 | 2,396±0,143 | <0,05 | 3,847±3,355 | 4,654±2,595 | 0,2717 |
| Мочевая к-та / Urinary acid | 350,147±90,359 | 337,427±84,251 | 0,5721 | 2927,833±1165,045 | 3185,097±1302,732 | 0,4423 |
| P | 1,156±0,243 | 1,163±0,193 | 0,8888 | 22,716±9,152 | 25,158±10,207 | 0,3526 |
| Cre | 125,726±70,122 | 91,737±20,336 | <0,05 | |||
| Мочевина / Urea | 7,389±5,122 | 5,701±1,803 | <0,05 | |||
| Cl | 107,632±4,362 | 105,3±2,367 | <0,05 | 131,526±44,914 | 136,661±51,693 | 0,6972 |
| Na | 140,632±2,241 | 141,758±2,154 | 0,0511 | 128,842±46,737 | 140,419±57,272 | 0,4243 |
| K | 4,447±0,600 | 4,508±0,608 | 0,7013 | 50,789±20,848 | 48,528±18,022 | 0,6453 |
| Mg | 0,830±0,048 | 0,835±0,078 | 0,8097 | 2,801±1,573 | 3,480±1,154 | <0,05 |
| AG | 11,908±1,802 | 11,461±2,939 | 0,5325 | 53,363±44,430 | 49,202±30,745 | 0,6443 |
| Цитраты / Citrates | 2,828±1,219 | 2,542±1,039 | 0,3165 | |||
| Оксалаты / Oxalate | 0,133±0,101 | 0,153±0,091 | 0,4125 | |||
| pH | 7,332±0,087 | 7,309±0,048 | 0,1390 | 6,188±0,704 | 6,175±0,535 | 0,9343 |
| pO2 | 45,421±17,334 | 31,254±10,533 | <0,05 | |||
| Ca2+ | 1,171±0,083 | 1,194±0,087 | 0,3186 | |||
| Глюкоза / Glucose | 5,363±1,321 | 5,249±1,218 | 0,7268 | |||
| BE | -1,900±5,458 | 1,195±2,510 | <0,05 | |||
Сравнение средних показателей биохимического анализа суточной мочи позволило установить, что в группе пациентов с гиперкапнией (pCO2 крови >51 мм рт.ст.) выявлены более высокие цифры экскреции магния, чем у больных с нормальными значениями pCO2 (табл. 5).
Корреляционный анализ продемонстрировал, что прослеживается отрицательная корреляционная связь между уровнем pCO2 крови и значениями креатинина крови (r=-0,270721, p=0,043586), pCO2 крови и хлора крови (r=-0,349051, p=0,008373). Выявлена положительная корреляционная зависимость между показателями pCO2 крови и почечной суточной экскрецией общего кальция (r=0,285676, p=0,029720), pCO2 крови и почечной суточной экскрецией магния (r=0,274368, p=0,037140) (табл. 6).
Таблица 6. Коэффициенты корреляции между уровнем pCO2 крови и биохимическими показателями крови и суточной мочи*
Table 6. Correlation coefficients between blood pCO2 levels and blood and daily urine values*
| Среднее Average |
Std.Dv. | R | p | N | |
| pCO2 крови / Blood pCO2 | 55,9643 | 9,26963 | -0,270721 | 0,043586 | 56 |
| Cre крови, мкмоль/л / Blood Cre, μmol/l | 100,3625 | 39,65376 | |||
| pCO2 крови / Blood pCO2 | 55,9643 | 9,26963 | -0,349051 | 0,008373 | 56 |
| Cl крови, ммоль/л / Blood Cl, mmol/l | 106,0893 | 3,52795 | |||
| pCO2 крови / Blood pCO2 | 55,914 | 9,495 | 0,285676 | 0,029720 | 58 |
| Ca мочи, ммоль/сут / Urine Ca, mmol/day | 4,674 | 2,918 | |||
| pCO2 крови / Blood pCO2 | 55,914 | 9,495 | 0,274368 | 0,037140 | 58 |
| Mg мочи, ммоль/сут / Urine Mg, mol/day | 3,392 | 1,350 |
*в таблице приведены только статистически значимые показатели
*the table shows only statistically significant indicators
Отдельно необходимо подчеркнуть, что у пациентов с МКБ корреляционной зависимости между pCO2 крови и сывороточной концентрацией общего кальция, pCO2 крови и сывороточной концентрацией ионизированного кальция, а также pCO2 крови и уровнем ПТГ крови выявлено не было (табл. 6).
Исследование парциального давления кислорода (pO2) у пациентов, страдающих МКБ, показало, что у большинства больных (51 (61,4%) пациент) выявлена гипоксемия (pO2 <35 мм рт.ст.), при этом у 18 (21,8%) пациентов pO2 находилось в пределах нормальных значений, у 14 (16,8%) больных показатель pO2 ≥ 49 мм рт.ст.
Сравнение средних величин показателей биохимического анализа крови и суточной мочи показало, что у пациентов с pO2 <35 мм рт.ст статистически достоверно был выше уровень глюкозы крови, чем у группы сравнения: 5,551±1,443 и 4,806±0,570 соответственно (p<0,05).
В процессе работы была зафиксирована положительная корреляционная связь между уровнем pO2 крови и почечной суточной экскрецией кальция (r=0,293768, p=0,025208) и магния (r=0,293457, p=0,025370).
Анализ показателя рассчитанного дефицита/избытка оснований продемонстрировал, что у 12 пациентов с МКБ отмечался низкий уровень BE (<-2,5), у 22 больных показатель BE был выше нормы (>2,5). У 49 больных BE был в пределах нормы (-2,5 <BE >2,5).
Проведенный статистический анализ показал, что у пациентов с уровнем BE <-2,5 достоверно выше уро- вень креатинина, мочевины и хлора в сыворотке крови, более высокие показатели pH мочи (p<0,05) по сравнению с больными с BE >2,5. В группе пациентов с BE <-2,5 статистически достоверно ниже показатели pH крови, pCO2 крови, ионизированного кальция крови по сравнению с группой пациентов с BE >2,5 (табл. 7).
Таблица 7. Показатели крови, суточной мочи, КЩС крови у пациентов с МКБ при различных уровнях BE крови*
Table 7. Indicators of blood and daily urine in urolithiasis patients at various levels of BE*
| Показатель / Indicators | Пациенты с BE < -2,5 (n=12) | Пациенты с BE >2,5 (n=22) | р |
|---|---|---|---|
| Cre крови, мкмоль/л / Blood Cre, μmol/l | 158,508 ± 75,433 | 92,152 ± 18,589 | <0,05 |
| Ur крови, ммоль/л / Blood Ur, mmol/l | 9,333 ± 6,055 | 5,886 ± 1,960 | <0,05 |
| Cl крови, ммоль/л / Blood Cl, mmol/l | 108,917 ± 5,567 | 104,696 ± 2,324 | <0,05 |
| pH мочи / Urine pH | 6,750 ± 0,754 | 6,132 ± 0,496 | <0,05 |
| pH крови / Blood pH | 7,250 ± 0,068 | 7,357 ± 0,043 | <0,05 |
| pCO2 крови / Blood pCO2 | 50,083 ± 8,806 | 56,435 ± 7,476 | <0,05 |
| Ca2+ крови / Blood Ca2+ | 1,243 ± 0,106 | 1,171 ± 0,044 | <0,05 |
| BE | -6,550 ± 4,263 | 3,857 ± 1,082 | <0,05 |
*в таблице приведены только статистически значимые показатели
*the table shows only statistically significant indicators
Проведенный корреляционный анализ продемонстрировал, что у пациентов с уролитиазом обнаружена положительная корреляционная зависимость между показателем BE и уровнем общего кальция крови (r=0,359168, p=0,006558) (табл. 8). Также зафиксирована отрицательная корреляционная связь между показателем BE и креатинином крови (r=-0,564518, p=0,000006), показателем BE и концентрацией мочевины в крови (r=-0,413416, p=0,001541), между BE и концентрацией хлора крови (r=-0,744093, p<0,0001), показателем BE и pH мочи (r=-0,266883, p=0,042850), BE и уровнем ионизированного кальция крови (r=-0,232226, p=0,049653), а также между показателем BE и концентрацией ПТГ крови (r=-0,441821, p=0,000102) (табл. 8).
Таблица 8. Коэффициенты корреляции между уровнем BE крови и показателями крови и суточной мочи*
Table 8. Correlation coefficients between BE levels and blood and daily urine values*
|
Среднее Average |
Std.Dv. | R | p | N |
|---|---|---|---|---|---|
| BE | -0,0321 | 4,04718 | 0,359168 | 0,006558 | 56 |
| Ca крови, ммоль/л / Blood Ca, mmol/l | 2,3713 | 0,18024 | |||
| BE | -0,0321 | 4,04718 | -0,564518 | 0,000006 | 56 |
| Cre крови, мкмоль/л / Blood Cre, μmol/l | 100,3625 | 39,65376 | |||
| BE | -0,0321 | 4,04718 | -0,413416 | 0,001541 | 56 |
| Ur крови, ммоль/л / Blood Ur, mmol/l | 6,2036 | 3,40870 | |||
| BE | -0,0321 | 4,04718 | -0,744093 | 0,000000 | 56 |
| Cl крови, ммоль/л / Blood Cl, mmol/l | 106,0893 | 3,52795 | |||
| BE | -0,141 | 4,142 | -0,266883 | 0,042850 | 58 |
| pH мочи / urine pH | 6,224 | 0,579 | |||
| BE | 0,1958 | 3,85539 | -0,232226 | 0,049653 | 72 |
| Ca2+ крови / Blood Ca2+ | 1,1929 | 0,08947 | |||
| BE | 0,39444 | 3,80574 | -0,441821 | 0,000102 | 72 |
| ПТГкрови, пг/мл / Blood parathyroid hormone | 59,45278 | 57,16795 |
*в таблице приведены только статистически значимые показатели
*the table shows only statistically significant indicators
ОБСУЖДЕНИЕ
pH крови является интегральным показателем работы всего организма. Как ацидоз (pH крови <7,32), так и алкалоз (pH крови >7,42) способны привести к дисбалансу работы всех органов и систем, что в конечном счете может повлечь гибель организма [13, 14].
В процессе проведенного исследования у пациентов, страдающих МКБ, ацидемия (pH крови <7,32) была зафиксирована у 45,8% испытуемых, алкалемия не была диагностирована. Таким образом, можно говорить о том, что для специалистов, занимающихся лечением МКБ, изучение ацидемии и ее влияния на организм пациента имеет определенное значение.
Крайне интересным выглядит тот факт, что в процессе работы зафиксирована корреляционная связь между pH крови и уровнем общего кальция крови, а также корреляционная взаимосвязь между pH крови и показателями ионизированного кальция крови.
Для специалистов, занимающихся вопросами мочекаменной болезни, крайне важно понимать метаболизм кальция в организме, поскольку кальций входит в состав бОльшей части мочевых камней, а гиперкальциурия является одним из основных метаболических литогенных нарушений [8-10, 15, 16]. Обнаруженная корреляционная связь концентрации кальция и показателей pH крови может пролить свет на малоизвестные механизмы литогенеза у пациентов с МКБ.
Известно, что кальций в плазме существует в виде трех различных фракций: одна связана с белками, другая часть находится в комплексе с анионами, третий тип – свободный, т.е. ионизированный кальций (Ca2+) [17-19]. Общий кальций крови является суммарной величиной всех фракций кальция, как свободного, так и связанного. Ионизированный кальций крови (Ca2+) представляет собой свободно циркулирующий элемент, который не связан с белками и анионами.
Наличие отрицательной корреляционной связи между показателями ионизированного кальция Са2+ и pH крови обусловлено в первую очередь особенностями гомеостаза. Так как Са2+ является катионом, естественно, в крови он связывается с отрицательно заряженными частицами – анионами (бикарбонатом, лактатом, цитратом, белками). Таким образом, свободный Са2+ конкурирует с H+ за одни и те же анионы. При этом важно помнить, что показатель pH является отрицательным логарифмом концентрации H+, то есть повышение количества H+ приводит к снижению значений pH [19].
Соответственно, увеличение концентрации H+ в крови стимулирует конкуренцию между катионами, в том числе и Са2+, за свободные анионы. Именно с этим процессом связано увеличение концентрации свободного ионизированного кальция при снижении pH крови.
Достаточно сложно объяснить снижение уровня общего кальция крови при снижении значений pH у пациентов с МКБ.
Показательно, что в других работах, носящих экспериментальный характер, получены аналогичные результаты. Так, A.M. Gaiter и соавт. в 1997 году провели серию исследований, где инициировали развитие острого ацидоза и острого алкалоза у здоровых волонтеров при помощи внутривенного введения аммония хлорида NH4Cl и натрия бикарбоната NaHCO3. Коллеги также зафиксировали увеличение уровня ионизированного кальция у волонтеров с острым ацидозом. Исследователи выявили повышение концентрации общего кальция сыворотки крови не только при остром ацидозе, но и при остром алкалозе. Причем увеличение концентрации общего кальция показало гораздо больший рост при алкалозе [18].
Важно помнить, что одни и те же изменения рН крови по-разному влияют на сывороточную концентрацию Са2+: показатели кальция сохраняются практически на одном уровне при остром респираторном кислотно-щелочном дисбалансе, несмотря на значительные изменения pH, тогда как при острых метаболических изменениях даже небольшие изменения pH крови серьезно влияют на уровень Са2+ [18].
Коллеги из НИИ трансплантологии и искусственных органов им. академика В.И. Шумакова показали, что концентрация ионизированного кальция крови Са2+ у здоровых доноров зависит не только от значений pH крови, но и от уровня pCO2 крови [20]. При этом в нашем исследовании подобной связи зафиксировано не было.
Отдельно необходимо остановиться на увеличении уровня ПТГ крови при снижении показателей pH крови (табл. 3, рис. 1). По всей видимости, рост уровня ПТГ в данном случае носит вторичный характер и является компенсаторной реакцией организма.
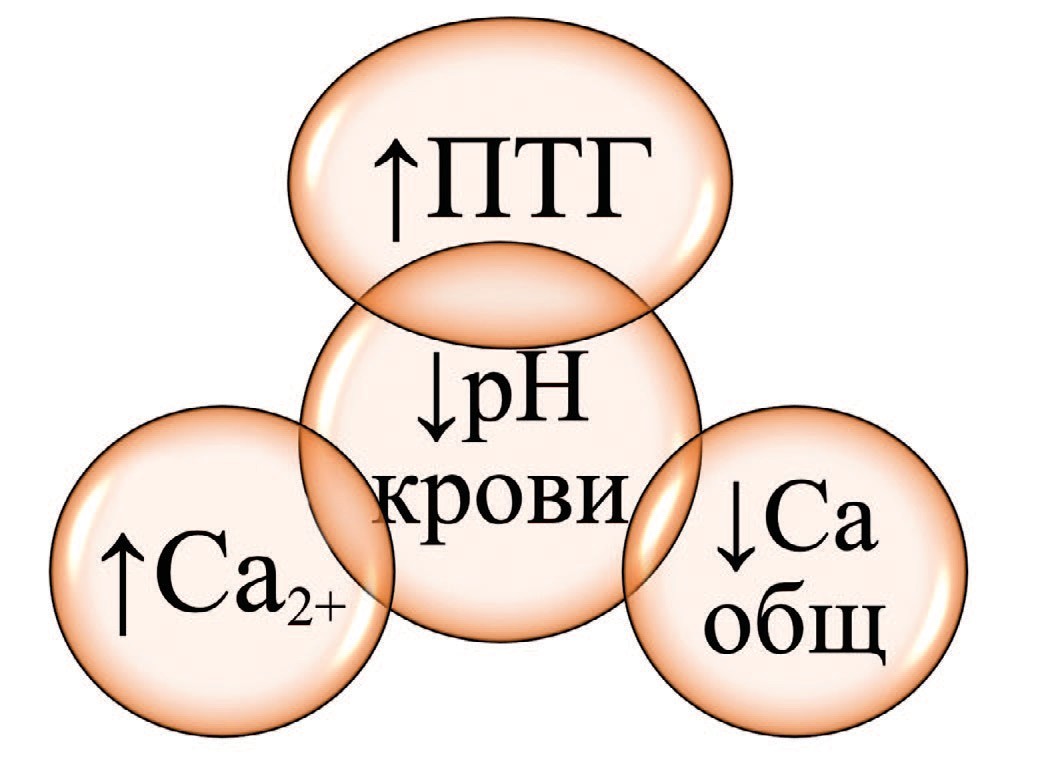
Рис. 1. Зависимость уровней общего, ионизированного кальция крови и уровня паратгормона крови от показателей pH крови у пациентов с МКБ
Fig. 1. Dependence of the levels of total, ionized blood calcium, blood parathyroid hormone levels and blood pH in urolithiasis patients
Статистически достоверное увеличение уровня креатинина крови у больных МКБ с pH крови <7,32 может говорить о повышенной вероятности развития и прогрессирования почечной недостаточности у пациентов с уролитиазом и ацидемией. Вероятно, степень ацидемии может быть прогностическим фактором развития и прогрессирования ХБП при уролитиазе. Доказано, что ацидемия является неблагоприятным прогностическим критерием течения ряда других серьезных заболеваний и состояний, таких как инфаркт миокарда, диабетический кетоацидоз, развивающийся при декомпенсированном течении инсулинозависимого сахарного диабета [21, 22].
Наличие отрицательной корреляционной связи между концентрацией pH крови и показателями хлора крови является физиологическим и связано с особенностями поддержания кислотно-щелочного баланса организма [23]. Учитывая, что к снижению pH крови ведет увеличение количества ионов водорода, H+ связываются со свободными анионами, количество свободных анионов снижается. В связи с этим происходит компенсаторное увеличение концентрации Cl- в крови.
Корреляционную зависимость BE и других показателей крови и суточной мочи можно объяснить тем, что BE является искусственно рассчитываемым коэффициентом, который отражает дефицит или избыток оснований [19, 24, 25]. Фактически BE показывает количество сильного основания или кислоты, которое необходимо добавить, чтобы вернуть pH к значению 7,4 при pCO2=40 мм.рт.ст. и температуре 370С. Таким образом, величина BE напрямую зависит от показателя pH крови. Считаем, что именно с этим фактом связана полученная в процессе работы корреляционная связь индекса BE с другими переменными. Подобная корреляционная зависимость была характерна и для показателя pH крови (табл. 3, 8).
ЗАКЛЮЧЕНИЕ
Полученные результаты исследования показали, что изучение КЩС крови у больных МКБ, в том числе с рецидивирующей формой, дает возможность извлечь дополнительную информацию о состоянии пациента, а также позволяет задуматься о разработке и применении новых подходов к метафилактике уролитиаза.
С помощью нормализации показателей pH крови возможно корректировать метаболизм основных литогенных веществ, в первую очередь кальция, что должно учитываться при разработке схем профилактики и метафилактики МКБ.
ЛИТЕРАТУРА
- Просянников М.Ю., Сивков А.В., Константинова О.В., Войтко Д.А., Анохин Н.В, Голованов С.А., Аполихин О.И., Каприн А.Д. Приверженность пациентов к метафилактике мочекаменной болезни. Экспериментальная и клиническая урология 2022;15(2)54-65. [Prosyannikov M.Yu., Sivkov A.V., Konstantinova O.V., Voytko D.A., Anokhin N.V., Golovanov S.A., Apolikhin O.I., Kaprin A.D. Adherence of patients to metaphylaxis of urolithiasis. Eksperimentalnaya i Klinicheskaya urologiya = Experimental and Clinical Urology 2022;15(2)54-65. (In Russian)]. https://doi.org/10.29188/2222-8543-2022-15-2-54-65.
- Moe OW. Kidney stones: pathophysiology and medical management. Lancet 2006;367(9507):333-44. https://doi.org/10.1016/S0140-6736(06)68071-9.
- Khan SR, Pearle MS, Robertson WG, Gambaro G, Canales BK, Doizi S et al. Kidney stones. Nat Rev Dis Primers 2016;2:16008. https://doi.org/10.1038/nrdp.2016.8.
- Fontenelle LF, Sarti TD. Kidney Stones: Treatment and prevention. Am Fam Physician 2019;99(8):490-6.
- Coe FL, Worcester EM, Evan AP. Idiopathic hypercalciuria and formation of calcium renal stones. Nat Rev Nephrol 2016;12(9):519-33. https://doi.org/10.1038/nrneph.2016.101.
- Lewandowski S, Rodgers AL. Idiopathic calcium oxalate urolithiasis: risk factors and conservative treatment. Clin Chim Acta 2004;345(1-2):17-34. https://doi.org/10.1016/j.cccn.2004.03.009.
- Alaya A, Sakly R, Nouri A, Najjar MF, Belgith M, Jouini R. Idiopathic urolithiasis in Tunisian children: a report of 134 cases. Saudi J Kidney Dis Transpl 2013;24(5):1055-61. https://doi.org/10.4103/1319-2442.118099
- Skolarikos A, Jung H, Neisius A, Petřík A, Somani B, Tailly T et al. EAU Guidelines on Urolithiasis. European Association of Urology 2023, 120 р. URL: https://uroweb.org/guidelines/urolithiasis.
- Мартов А.Г., Харчилава Р.Р. Акопян Г.Н., Гаджиев Н.К. Мазуренко Д.А., Малхасян В.А. Клинические рекомендации. Мочекаменная болезнь 2020. Одобрено Научно-практическим Советом Минздрава РФ. 61 с. [Martov A.G., Kharchilava R.R. Akopyan G.N., Gadzhiev N.K. Mazurenko D.A., Malkhasyan V.A. Clinical recommendations. Urolithiasis disease 2020. Approved by the Scientifi and Practical Council of the Ministry of Health of the Russian Federation. 61 p. (In Russian)]. URL: https://cr.minzdrav.gov.ru/recomend/7_1.
- Pearle MS, Goldfarb DS, Assimos DG, Curhan G, Denu-Ciocca CJ, Matlaga BR, et al.; American Urological Assocation. Medical management of kidney stones: AUA guideline. J Urol 2014;192(2):316-24. https://doi.org/10.1016/j.juro.2014.05.006.
- Williams JC Jr, Gambaro G, Rodgers A, Asplin J, Bonny O, Costa-Bauzá A, et al. Urine and stone analysis for the investigation of the renal stone former: a consensus conference. Urolithiasis 2021;49(1):1-16. https://doi.org/10.1007/s00240-020-01217-3.
- Анохин Н.В., Просянников М.Ю., Константинова О.В., Голованов С.А., Войтко Д.А., Сивков А.В., и др. Кислотно-щелочное состояние крови у пациентов с мочекаменной болезнью. Исследование I. Роль бикарбонатов. Экспериментальная и клиническая урология 2023;16(4):92-101. [Anokhin N.V., Prosyannikov M.Yu., Konstantinova O.V., Golovanov S.A., Voytko D.A., Sivkov A.V, et al. Acid-base balance of blood in urolithiasis patients. Study I: bicarbonates. Eksperimentalnaya i Klinicheskaya urologiya = Experimental and Clinical Urology 2023;16(4):92-101. (In Russian)]. https://doi.org/10.29188/2222-8543-2023-16-4-92-101.
- Rajkumar P, Pluznick JL. Acid-base regulation in the renal proximal tubules
novel pH sensors to maintain homeostasis. Am J Physiol Renal Physiol 2018;315(5):F1187- F1190. https://doi.org/10.1152/ajprenal.00185.2018.
- Seifter JL, Chang HY. Extracellular acid-base balance and ion transport between body fluid compartments. Physiology (Bethesda) 2017;32(5):367-79. https://doi.org/10.1152/physiol.00007.2017.
- Голованов С.А., Сивков А.В., Анохин Н.В. Гиперкальциурия: принципы дифференциальной диагностики. Экспериментальная и клиническая урология 2015;(4):86-92. [Golovanov S.A., Sivkov A.V., Anokhin N.V. Hypercalciuria: principles of differential diagnostics. Eksperimentalnaya i Klinicheskaya urologiya = Experimental and Clinical Urology 2015;(4):86-92. (In Russian)].
- Просянников М.Ю., Анохин Н.В., Голованов С.А., Константинова О.В., Сивков А.В., Аполихин О.И. Влияние кальциурии на генез мочевых камней различного химического состава. Экспериментальная и клиническая урология 2019;(3):100-3. [Prosyannikov M.Yu., Anokhin N.V., Golovanov S.A., Konstantinova O.V., Sivkov A.V., Apolikhin O.I. Influence of calciuria on the urine stones genesis. Eksperimentalnaya i Klinicheskaya urologiya = Experimental and Clinical Urology 2019;(3):100-3. (In Russian)]. https://doi.org/10.29188/2222-8543-2019-11-3-100-103.
- Siggaard-Andersen, Th de J, Fogh-Andersen N. What is «ionized calcium»? Scand J Clin Lab Invest Suppl 1983;165:11-6.
- Gaiter AM, Bonfant G, Manes M, Belfanti P, Alloatti S. Relation between blood pH and ionized calcium during acute metabolic alteration of the acid-base balance in vivo. Scand J Clin Lab Invest 1997;57(4):317-23. https://doi.org/10.3109/00365519709099405
- Торшин В.А. Кислотно-щелочной баланс в интенсивной терапии. Контроль и коррекция нарушений кислотно-основного состояния в практике интенсивной терапии. Медицинский алфавит 2015;2(9):30-32. [Torshin V.A. Control and correction of acid-base disorders in critical care practice. Meditsinskiy alfavit = Medical alphabet 2015;2(9):30-32. (In Russian)
- Левин А.Л., Андрианова М.Ю., Ермакова И.П., Пронченко И.А., Ланская И.М. Дифференцированные влияния pH, pCO2 и концентрации белка на уровень ионизированного кальция в плазме крови и алгоритм расчета его стандартизированного значения. Бюллетень экспериментальной биологии и медицины 1986;100(12):704-6. [Levin A.L., Andrianova M.Yu., Ermakova I.P., Pronchenko I.A., Lanskaia I. M. Differentiated effects of pH, pCO2 and protein concentration on the level of ionized calcium in the blood plasma and a computational algorithm for its standardized value. Byulleten' eksperimental'noy biologii i meditsiny = Bulletin of Experimental Biology and Medicine 1986;100(12):704-6. (In Russian)].
- Зыятдинов К.Ш., Белопухов В.М., Якупов И.Ф., Хакимзянов А.А. Особенности кислотно-щелочного состояния крови у больных инфарктом миокарда в зависимости от количества пораженных коронарных артерий. Практическая медицина 2013;2(1-2(69)):52-5. [Zyiatdinov K.Sh., Belopukhov V.M., Yakupov I.F., Khakimzyanov A.A. Features of acid-base balance of blood in patients with myocardial infarction according to the number of affected coronary arteries. Prakticheskaya meditsina = Practical Medicine 2013;2(1-2(69)):52-5. (In Russian)].
- Шишмарев К.В., Валеева В.А., Ковалёва О.А. Кислотно-щелочное состояние и кетоновые тела как критерии оценки тяжести диабетического кетоацидоза. Вестник Хакасского государственного университета им. Н.Ф. Катанова 2018;(24):145-7. [Shishmarev K.V., Valeeva V.A., Kovaleva O.A. Acid-base status and ketone bodies as criteria for assessing the severity of diabetic ketoacidosis. Vestnik Khakasskogo gosudarstvennogo universiteta im. N.F. Katanova = Bulletin of Khakass State University named after N.F. Katanova 2018;(24):145-7. (In Russian)]
- Powers F. The role of chloride in acid-base balance. J Intraven Nurs 1999;22(5):286-91
- Quade BN, Parker MD, Occhipinti R. The therapeutic importance of acid-base balance. Biochem Pharmacol 2021;183:114278. https://doi.org/10.1016/j.bcp.2020.114278.
- Laski ME, Kurtzman NA. Acid-base disorders in medicine. Dis Mon 1996;42(2):51-125. https://doi.org/10.1016/s0011-5029(96)90004-8.







