ВВЕДЕНИЕ
Перкутанная нефролитотрипсия (ПНЛ) – является наиболее широко применимой техникой в лечении нефролитиаза [1]. При этом, по статистике 40% коечного фонда в урологических отделениях занимают пациенты с мочекаменной болезнью (МКБ) [2]. Пациенты для ПНЛ госпитализируются в плановом порядке и занимают лишь относительно малую долю в отделении стационара. В тоже время, после проведения ПНЛ в ряде случаев может возникать потребность в дополнительных хирургических вмешательствах с целью купирования осложнений или для предотвращения обструкции верхних мочевых путей (ВМП) резидуальными конкрементами методом установки дренажей в чашечно-лоханочную систему (ЧЛС) [3-5]. Послеоперационные дополнительные вмешательства приводят к пролонгированию госпитализации и увеличении стоимости клинического случая. Все это вызывает нагрузку на систему здравоохранения и осложняет логистику плановых госпитализаций [6, 7].
Целью нашего исследования является создание алгоритма принятия решений, способного учитывать множество факторов и достоверно предсказывать вероятность развития осложнений, длительность госпитализации, потребность в дополнительных вмешательствах, вероятность выписки пациента с дренажами и рекомендации о дальнейшей тактике ведения больного.
Планирование тактики послеоперационного ведения больного для максимальной оптимизации должно закладываться на этапе госпитализации, учитывая лишь входные параметры пациента. Данная практика позволит оптимизировать работу стационаров, молодым специалистам поможет ускорить процесс анализа данных и подтвердить их прогнозы, подготовить специалистов к разным исходам событий после хирургического вмешательства [8-10].
С целью персонализированного прогнозирования осложнений и тактики ведения пациента в послеоперационном периоде после ПНЛ нами была разработана и предложена модель алгоритма искусственного интеллекта (ИИ) для применения в клинической работе.
МАТЕРИАЛЫ И МЕТОДЫ
В работе были проанализированы данные 1000 пациентов в возрасте от 18 до 88 лет (52,3±13,47) с нефролитиазом, которым была выполнена ПНЛ. Общее число мужчин – 419 (41,9%), женщин – 581 (58,1%).
Критерии включения:
- возраст пациента от 18 лет;
- первым оперативным вмешательством в госпитализацию проводится ПНЛ;
- показатели свертывающей системы крови без патологических изменений;
- отсутствие злокачественных новообразований ВМП на стороне операции.
Критерии исключения:
- острый воспалительный процесс любой локализации;
- истончение паренхиматозного слоя почки менее 1 см;
- сопутствующие заболевания в стадии декомпенсации.
Обследование пациентов проводилось путем сбора анамнеза, ультразвукового исследования (УЗИ) почек и мочевого пузыря, выполнялась урография или компьютерная томография (КТ) с или без в/в контрастирования мочевыделительной системы, биохимический анализ крови (с определением уровня мочевины и креатинина), общий анализ крови и посев мочи на определение бактериального агента и чувствительности к антибиотикам. Для проведения ПНЛ пациентов планово госпитализировали в стационар.
В течении оперативного вмешательства пациенту однократно вводился антибиотик, при развитии пиелонефрита лечение проводилось длительно, согласно рекомендациям по лечению острого пиелонефрита.
Послеоперационное обследование на наличие резидуальных камней проводилось на 2-3 сутки после вмешательства методом выполнения КТ и УЗИ органов забрюшинного пространства. Конкременты признавались клинически значимыми при размере, превышающем 0,4 см.
Переменные (результаты обследования, методы выполнения ПНЛ, послеоперационная тактика ведения) в исследовании делились на 3 группы. К первой группе отнесли входные переменные, клинические данные, с которыми пациент поступает на хирургическое вмешательство. Ко второй группе отнесли данные метода выполнения операции (которые также поэтапно прогнозировались с применением ИИ) и к третьей группе отнесли прогнозируемые переменные после ПНЛ: осложнения хирургического вмешательства, дополнительные методы оперативного вмешательства, рекомендации дальнейшей тактики лечения. Все 1000 наблюдений в процессе исследования были поделены на обучающую и контрольную выборку (процентное отношение разделения отличалось в зависимости от целевой переменной). Тестовые клинические случаи были добавлены после создания алгоритма и составили 30 случаев.
Таблица 1. Перечень переменных по группам
Table 1. List of groups and variables
| Входные переменные / Input variables |
Прогнозируемые переменные / Predicted variables |
|---|---|
| 1-я группа 1st group |
2-я группа. Тактика хирургического вмешательства 2nd group. Tactics of surgical intervention |
| 1. Пол Gender |
1. Размер нефроскопа Size of nephroscope |
| 2. Возраст Age |
2. Интраоперационная установка стента Intraoperative stent placement |
| 3. ИМТ BMI |
3. Одномоментная уретероскопия/КУЛТ Simultaneous ureteroscopy/ ureterolithotripsy |
| 4. ССЗ Сardiovascular disease |
4. Количество доступов Number of accesses |
| 5. Гипертония Hypertension |
5. Доступ через верхнюю группу Access through the upper pole |
| 6. Сахарный диабет Diabetes mellitus |
6. Доступ через среднюю группу Access through the middle calyx |
| 7. ХБП
CKD |
7. Доступ через нижнюю группу Access through the lower calyx |
| 8. Предварительное дренирование Pre-drainage |
8. Длительность операции (в мин.) Operative time (min.) |
| 9. Рецидивный характер заболевания Recurrence of the disease |
9. Наличие резидуальных конкрементов Presence of residual stones |
| 10. Предыдущее лечение Previous treatment |
3-я группа. Тактика послеоперационного ведения. Цель исследования 3rd group. Postoperative management tactics. Purpose of the study |
| 11. Посев мочи на микрофлору Urine culture for microflore |
1. Пиелонефрит Pyelonephritis |
| 12. Концентрация креатинина в сыворотке крови Blood serum creatinine concentration |
2. Геморрагические осложнения Hemorrhagic complications |
| 13. Концентрация мочевины в сыворотке крови Blood serum urea concentration |
3. Установка/замена/удаление стента Stent installation/replacement/removal |
| 14. Лейкоциты в ОАК Leukocytes in the CBC |
4. Замена/ре-нефростомия Replacement/re-nephrostomy |
| 15. Гидронефроз Hydronephrosis |
5. Гемосорбция Hemosorption |
| 16. Кисты почки Kidney cysts |
6. Дополнительные хирургические вмешательства Additional surgical interventions |
| 17. Нарушение уродинамики (в мес.) Violation of urodynamics |
7. Продолжительность госпитализации Duration of hospitalization |
| 18. Аномалия ВМП Anomaly of the upper urinary tract |
8. Рекомендации по дальнейшей тактике лечения Recommendations for further treatment tactics |
| 19. Стриктура мочеточника Ureteral stricture |
9. Выписка с дренажами Discharge with drainage |
| 20. Визуализация конкремента на урографии Visualization of the stone on X-ray |
|
| 21.Плотность конкремента (по HU) Stone density (according to HU) |
|
| 22. Размер конкремента Stone size |
|
| 23. Локализация Localization |
Поскольку суть исследования заключается в предсказании послеоперационной тактики ведения, алгоритм базируется на поэтапном предсказании с известными только входными данными (те данные, с которыми пациент госпитализируется в стационар). Данные метода хирургического вмешательства
и послеоперационного ведения являются спрогнозированными.
К первой группе мы отнесли входные переменные. Во вторую группу были включены переменные по тактике хирургического вмешательства, точность их прогнозирования мы описывали в нашей предыдущей печатной работе [11]. В данной статье будет рассмотрен прогноз по третьей группе, т.е. по тактике послеоперационного ведения пациента после ПНЛ (табл. 1).К первой группе относятся переменные по 23 параметрам: пол пациента, возраст, индекс массы тела (по стадиям ожирения), наличие в анамнезе заболеваний сердечно-сосудистой системы (ССЗ), стадия артериальной гипертензии, наличие сахарного диабета (СД), наличие и стадия хронической болезни почек (ХБП), присутствие дренирования верхних мочевыводящих путей (ВМП) на стороне операции к моменту госпитализации, частота рецидивов после лечения МКБ, наличие и характер предыдущего лечения на стороне операции (включая операции на мочеточниках, лоханочно-мочеточниковом сегменте, почках и мочевом пузыре), наличие врожденных и/или приобретенных аномалий и патологий ВМП, визуализация конкремента на урографии, тип конкремента (его плотность, форма, размер) и локализация.
Ко второй группе (тактики хирургического вмешательства) отнесли 9 переменных: размер используемого в операции нефроскопа, сочетанное применение уретероскопии или контактной уретеролитотрипсии (КУЛТ), необходимость в конце операции в дренировании внутренним мочеточниковым стентом, количество доступов, локализация доступов по чашечкам (верхняя, средняя и нижняя группа), продолжительность хирургического вмешательства и наличие резидуальных камней.
В третью группу вошли 9 переменных, относящихся к послеоперационной тактике ведения пациентов: геморрагические осложнения, пиелонефрит, установка/замена/удаление стента, замена/ре-нефростомия, продолжительность госпитализации, гемосорбция, дополнительные хирургические вмешательства, рекомендации о тактике ведения пациента после госпитализации, наличие и характер дренирования ВМП при выписке.
Адекватность распределения и достоверность различий выходных результатов проверены с использованием критериев Пирсона и критерия Стьюдента.
Достоверными признавались различия при значении р не менее 0,05. Связь между данными оценивалась с помощью методики парной корреляции и вычислением r – коэффициента. При значении r>0,7 сопряжение признавалось сильным, при значении r от 0,5 до 0,7 корреляции связь была средней, и если значение коэффициента r<0,5, то связь признавалась слабой. Затем, определялись относительные значения важности переменных, их сумма равна 1,0.
Обработка данных проводилась с применением программ IBM SPSS Statistics и Modeler методом моделирования нейронных сетей (многослойного перцептрона).
РЕЗУЛЬТАТЫ
Первым предиктором в данной работе, будет рассматриваться вероятность развития осложнений в раннем послеоперационном периоде. Осложнения были поделены на: пиелонефрит и геморрагические осложнения. Всего гладкий послеоперационный период наблюдался у 737 больных (73,7%). Пиелонефрит был выявлен у 204 (20,4%) больных, геморрагические осложнения у 29 (2,9%), пиелонефрит и геморрагические осложнения у 30 (3,05%).
Точность прогноза по развитию пиелонефрита составила 79%, AUC – 0,747. Наиболее важными предикторами для создания модели являлись (по коэффициенту важности) – концентрация мочевины в сыворотке крови (0,25), длительность операции (0,25), ХБП (0,09), предыдущее лечение (0,08), размер камня (0,06), аномалии ВМП (0,05), гипертония (0,04), сахарный диабет (0,03), возраст пациента (0,03), рентгенположительность конкрементов (0,03) (табл. 2).
Таблица 2. Предсказание развития пиелонефрита в послеоперационном периоде
Table 2. Prognostic factors of acute pyelonephritis in the postoperative period
|
Показатель Indicators |
Предсказание развития пиелонефрита Prognostic factors of acute pyelonephritis |
|---|---|
| Точность/AUC Accuracy/AUC |
79%/0,747 |
| Предикторы Predictor |
Важность предикторов Predictor importance |
| Концентрация мочевины в сыворотке крови Blood serum urea concentration |
0,25 |
| Длительность операции (в мин.) Operative time (min.) |
0,25 |
| ХБП CKD |
0,09 |
| Предыдущее лечение Previous treatment |
0,08 |
| Размер конкремента Stone size |
0,06 |
| Аномалия ВМП Anomaly of the upper urinary tract |
0,05 |
| Артериальная гипертония Arterial hypertension |
0,04 |
| Сахарный диабет Diabetes mellitus |
0,03 |
| Возраст Age |
0,03 |
| Визуализация конкремента на урографии Visualization of the stone on X-ray |
0,03 |
Существует множество исследований, доказывающих связь продолжительности оперативного вмешательства и развития инфекционно-воспалительной реакций. При рассмотрении влияния эндоскопических операций (таких как ПНЛ) отмечено, что на этот показатель влияет увеличение внутрилоханочного давления и работа в водной среде [12-14]. Помимо этого, часть конкрементов является следствием инфекционных заболеваний, и при разрушении камней высвобождаются бактерии в составе биопленок, увеличивая шанс развития пиелонефрита [15].
Вторым по распространенности осложнением ПНЛ являются геморрагические осложнения. Алгоритм способен прогнозировать данный предиктор с точностью 94,7%, AUC – 0,743. Всего было зафиксировано 59 (5,9%) пациентов с геморрагическими осложнениями. К ним можно отнести как менее тяжелые (продолжающиеся кровотечения из нефростомического дренажа, требующие дополнительной коррекции баллона в чашечно-лоханочной системе (ЧЛС) или ввода гемостатиков), так и грозные осложнения (гемотампонада мочевого пузыря или ЧЛС) [16, 17]. В алгоритм были отобраны следующие предикторы: длительность операции (0,14), стриктура мочеточника (0,12), наличие резидуальных камней (0,11), ХБП (0,10), развитие пиелонефрита в послеоперационном периоде (0,10), доступ через верхнюю группу чашечек (0,08), общее количество доступов (0,08), кисты почек (0,08), концентрация креатина в крови до операции (0,06) (табл. 3).
Таблица 3. Предсказание развития геморрагических осложнений в послеоперационном периоде
Table 3. Prognostic factors of hemorrhagic complications in the postoperative period
|
Показатель Indicators |
Предсказание развития геморрагических осложнений Prognostic factors of hemorrhagic complications |
|---|---|
| Точность/AUC Accuracy/AUC |
94,7%/0,743 |
| Предикторы Predictor |
Важность предикторов Predictor importance |
| Длительность операции (в мин.) Operative time (min.) |
0,14 |
| Стриктура мочеточника Ureteral stricture |
0,12 |
| Наличие резидуальных конкрементов Presence of Residual Stones |
0,11 |
| ХБП CKD |
0,10 |
| Пиелонефрит Pyelonephritis |
0,10 |
| Доступ через верхнюю группу чашечек Access through the upper of caliceals |
0,08 |
| Количество доступов Number of accesses |
0,08 |
| Кисты почки Kidney cysts |
0,08 |
| Концентрация креатинина в сыворотке крови Blood serum creatinine concentration |
0,06 |
На развитие геморрагических осложнений в большей степени влияют не литометрические параметры, а соматическое состояние пациента и тактика хирургического вмешательства (табл. 3).
В нашей работе была доказана связь между объемом кист почки и развитием кровотечений после ПНЛ. Размер кист более 2 см увеличивает риск развития кровотечения в послеоперационном периоде более чем в 2 раза. (рис. 1). Во время выполнения хирургического вмешательства, доступ в ЧЛС всегда осуществлялся в обход кист. Всего пациентов без кист почки на стороне операции в исследовании рассматривалось 811. С кистами до 2 см – 69, с кистами более 2 см – 55, с поликистозом– 6. Учитывая малый объем выборки пациентов с поликистозом, необходимо дополнительное исследование.
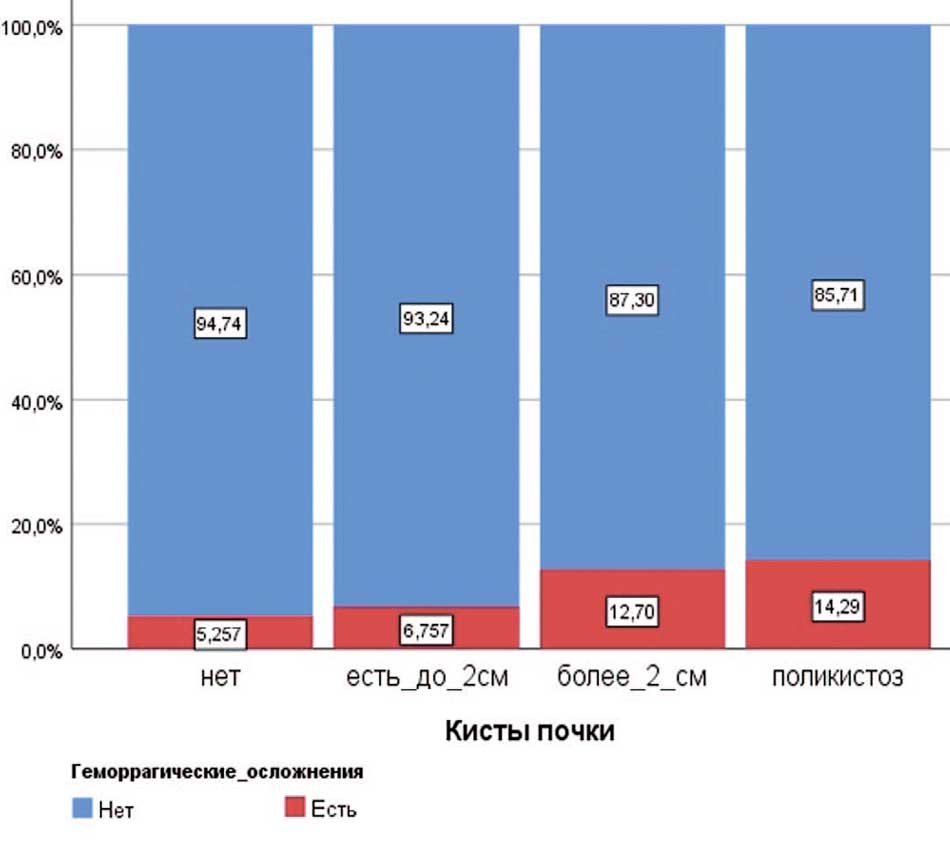
Рис. 1. Связь наличия кист почек на стороне операции и геморрагических осложнений
Fig. 1. Relationship between the presence of kidney cysts on the side of surgery and hemorrhagic complications
Прогноз необходимости в дополнительных вмешательствах влияет не только на увеличение финансовых затрат стационара, но и позволяет спланировать оборот коек в отделении. К дополнительным вмешательствам отнесены те, что были реализованы в единую госпитализацию с ПНЛ. К одному из факторов, приводящих к дополнительным вмешательствам, относится потребность в наличии функционирующего стента в послеоперационном периоде. К этой переменной мы отнесли: установку и удаление стента (установленного на срок ношения от 1-3 месяцев).
Точность прогноза составила 94,77%/AUC 0,958. Наиболее важными предикторами в построении модели явились: наличие резидуальных конкрементов (0,26), уровень креатинина в сыворотке крови до операции (0,20), локализация конкремента (0,14), возраст пациента (0,11), размер камня (0,10), развитие пиелонефрита (0,06), предварительное дренирование (0,06), интраоперационная установка стента (0,06), пол пациента (0,02).
Замена нефростомы или создание нового нефростомического доступа происходили как следствие миграции дренажа или обструкции сгустками/фрагментами. Если происходила замена нефростомы вместе с нефроскопией, то наблюдение относилось к переменной «дополнительные хирургические вмешательства».
Точность прогноза по замене/ре-нефростомии составила 99%/AUC 0,879. Наиболее важным предиктором был выявлен предиктор уровня креатинина в сыворотке крови до операции (0,39), затем длительность операции (0,17), размер конкремента (0,10), ХБП (0,09), развитие пиелонефрита (0,05), возраст пациента (0,05), наличие предварительно дренирования (0,04), наличие гидронефроза до операции (0,03), геморрагические осложнения (0,02).
В исследовании, для упрощения применения алгоритма лечащим врачом, размер конкрементов был разделен по группам, учитывая наибольшую сторону камня (или сумму сторон конкрементов). Вероятность замены/ ре-нефростомии при размере конкремента более чем 6,1 см составляет 5,6%, а при размере 3-6 см – всего 0,57%.
При неэффективности противовоспалительной и антибактериальной терапии в послеоперационном периоде применялась гемосорбция. Точность для предсказания потребности в данном методе лечения составила 99,2%/AUC 0,955. Наиболее важными предикторами в создании модели были выделены: длительность оперативного вмешательства (0,35), возраст пациента (0,17), развитие пиелонефрита в послеоперационном периоде (0,13), размер конкремента (0,09), потребность в интраоперационной установке стента (0,09), гидронефроз (0,07), пол пациента (0,05), результат бактериологического посева мочи (0,05). В 90% случаев в наблюдениях гемосорбция применялась к женщинам и только в 10% – мужчинам.
Точность прогноза по дополнительным хирургическим вмешательствам составила 97,4%/AUC 0,967. К данным предикторам были отнесены: ПНЛ, Мини-ПНЛ, дистанционная литотрипсия (ДЛТ), КУЛТ, отмывание тампонады почки. Наиболее важными предикторами в построении модели стали: наличие резидуальных конкрементов (0,48), локализация конкрементов (0,18), ИМТ пациента (0,12), предварительное (до операции) дренирование ЧЛС на стороне вмешательства (0,12), развитие пиелонефрита в послеоперационном периоде (0,10) (табл. 4).
Таблица 4. Предсказание потребности в дополнительных вмешательствах
Table 4. Predicting the need for additional interventions
|
Показатель Indicators |
Установка/замена/ удаление стента Stent installation/ replacement/removal |
Замена/ре-нефростомия Replacement/ re-nephrostomy |
Гемосорбция Hemosorption |
Дополнительные хирургические вмешательства Additional surgical interventions |
|---|---|---|---|---|
| Точность/AUC Accuracy/AUC |
79%/0,747 | 99%/AUC 0, 879 | 99,2%/AUC 0,955 | 97,4%/AUC 0,967 |
| Предикторы / Predictor |
Важность предикторов / Predictor importance |
|||
| Наличие резидуальных конкрементов Presence of residual stones |
0,26 | – | – | 0,48 |
| Концентрация креатинина Creatinine concentration |
0,20 | 0,39 | – | – |
| Локализация камня Stone localization |
0,14 | – | – | 0,18 |
| Возраст Age |
0,11 | 0,05 | 0,17 | – |
| Размер конкремента Stone size |
0,10 | 0,10 | 0,09 | – |
| Пиелонефрит Pyelonephritis |
0,06 | 0,05 | 0,13 | 0,10 |
| Предварительное дренирование Pre-drainage |
0,06 | 0,04 | 0,12 | |
| Интраоперационная установка стента Intraoperative stent placement |
0,06 | – | 0,09 | – |
| Пол Gender |
0,02 | – | 0,05 | – |
| Длительность операции (в мин.) Operative time (min.) |
– | 0,17 | 0,35 | – |
| ХБП CKD |
– | 0,09 | – | – |
| Гидронефроз Hydronephrosis |
– | 0,03 | 0,07 | – |
| Геморрагические осложнения Hemorrhagic complications |
– | 0,02 | – | |
| Посев мочи Urine culture |
– | – | 0,05 | |
| ИМТ BMI |
– | – | – | 0,12 |
Точность прогноза для продолжительности госпитализации составила 93,4%. При создании алгоритма наиболее важными предикторами были выявлены: наличие дополнительных хирургических вмешательств (0,22), развитие пиелонефрита в послеоперационном периоде (0,15), потребность в установке/ замене внутреннего стента (0,1), наличие резидуальных конкрементов (0,10), потребность в дополнительной установке нефростомы (0,09), потребность в проведении гемосорбции в послеоперационном периоде (0,06), длительность хирургического вмешательства 0,05, геморрагические осложнения в послеоперационном периоде (0,05), размер конкремента (0,04), локализация камней в ЧЛС (0,02).
Пациент госпитализировался за сутки до хирургического вмешательства, средняя продолжительность госпитализации составила 7 суток (включая выходные дни). На 2-е сутки пребывания в стационаре проводилось хирургическое вмешательство, на 3-и сутки проводилось контрольное исследование (общий анализ мочи, биохимические исследование крови, УЗИ), на 4-е сутки, при необходимости, КТ органов забрюшинного пространства, после чего нефростомический дренаж удалялся, и пациент на 5-е сутки выписывался. Такая последовательность связана с необходимостью динамического наблюдения развития не только воспалительных, но и геморрагических осложнений.
При предсказании выписки с дренажами использовались следующие переменные: выписка с 1 нефростомой, выписка с двумя нефростомами, выписка со стентом + нефростомой и выписка со стентом. Точность прогноза составила 93,37%/AUC 0,909.
Наиболее важными предикторами стали: интраоперационная установка стента (0,13), повторная установка мочеточникового стента после хирургического вмешательства (0,10), предыдущее лечение в анамнезе (0,06), наличие резидуальных конкрементов (0,06), уровень креатинина до операции (0,06), размер конкремента (0,05), локализация камня в ЧЛС (0,05), дополнительные хирургические вмешательства после ПНЛ (0,05), наличие предварительного дренирования до госпитализации (0,04), ССЗ (0,04).
Выписка с дренажами после госпитализации имеет важное значение для подсчета суммы страхового случая по отдельной нозологии. Если пациента выписывают с нефростомой, это провоцирует развитие отдаленных осложнений, таких как кровотечение или инфекционно-воспалительный процесс после выписки, требующих экстренного хирургического вмешательства.
Следующим параметром для изучения стала рекомендация лечащего врача о дальнейшей тактики ведения пациента. В эту переменную вошли рекомендации о повторной госпитализации с целью проведения хирургических вмешательств. Точность прогноза составила 91,6%/AUC 0,998. К наиболее важным предикторам применяемых в алгоритме были отнесены: выписка с дренажами (0,17), концентрация креатинина в крови (0,14), наличие резидуальных конкрементов (0,08), длительность операции (0,08), локализация конкремент (0,06), продолжительность госпитализации (0,05), интраоперационная установка внутреннего стента (0,04), предыдущее лечение (0,03), длительность нарушения уродинамики (0,03), стриктура мочеточника (0,03).
ОБСУЖДЕНИЕ
Помимо ПНЛ широко применяются в урологии и другие подходы к хирургическому лечению нефролитиаза, к ним можно отнести ДЛТ, ретроградную интраренальную хирургию (РИРХ) и пиелолитотомию. Исследования для подбора оптимального хирургического лечения МКБ с применением нейронных алгоритмов описывались раннее в литературе [18]. Также существуют работы по применению ИИ для прогнозирования результатов литотрипсии и профилактики камнеобразования [19-21]. Интерес к ИИ в медицинском сообществе последние годы только возрастает, а увеличение печатных работ на данную тему может привести к значительным изменениям в рутинной работе врача.
Основной целью нашего исследования было создать упрощение логистики для госпитализации плановых пациентов, помочь врачу профилактировать развитие ранних послеоперационных осложнений. Для применения данной модели не требуется дополнительная лабораторная или инструментальная диагностика. База данных основана на стандартных обследованиях пациента при подготовке к хирургическому вмешательству.
Общая точность предсказания по каждому предиктору составила от 79% до 99,2%, при подсчете на тестовой выборке точность составила от 74,5% до 98,3%.
Клинические случаи, взятые в работу, не были типичными для большинства урологических отделений. Так большинство конкрементов было локализовано в лоханке (22,2%), а на втором месте были коралловидные конкременты К4 (12,7%).
Помимо этого, в выборку входило 11% аномалий развития ВМП и 13% аномалий и стриктур мочеточника и лоханочно-мочеточникового сегмента (ЛМС) от общего количества наблюдений. Специфика подбора наблюдений не создает сложность при дальнейшем использовании алгоритма на практике, а наоборот, позволяет благодаря сложным и нестандартным случаям точнее формировать прогноз при рутинном использовании.
При планировании госпитализаций в отделение и оборота коек, в расчет не берутся возможные дополнительные вмешательства, что нарушает порядок госпитализации и дает дополнительную нагрузку на систему здравоохранения. Необходимо отметить, что помощью алгоритмов искусственного интеллекта появляется возможность персонализированного прогноза для каждого клинического случая с минимальной затратой времени на обработку информации [22, 23]. Улучшение логистики в плановом стационаре, прогноз развития осложнений и потребности в дополнительных хирургических вмешательствах позволят оптимизировать работу не только лечащего врача, но и всего отделения.
ЗАКЛЮЧЕНИЕ
Дальнейшее развитие технологии ИИ не только даст «второе мнение» и сократит время обработки больших объемов информации, но также стандартизирует подход к лечению сложных клинических случаев и поможет оптимизировать работу урологического отделения.
ЛИТЕРАТУРА
- Türk C, Petřík A, Sarica K, Seitz C, Skolarikos A, Straub M. EAU guidelines on interventional treatment for urolithiasis. Eur Urol 2016;69(3):475-82. https://doi.org/10.1016/j.eururo.2015.07.041.
- Шестаев А.Ю., Протощак В.В., Паронников М.В., Киселев А.О. Комбинированный (цитратный и растительный) препарат уриклар в дистанционной литотрипсии и метафилактике мочекаменной болезни. Урологические ведомости 2018;8(1):19-25. [Shestayev A.YU., Protoshchak V.V., Paronnikov M.V., Kiselev A.O. Combined (citrate and herbal) drug Uriklar in extracorporeal shock wave lithotripsy and metaphylaxis of urolithiasis . Urologicheskie vedomosti = Urology reports 2018;8(1):19-25. (In Russian)]. https://doi.org/10.17816/uroved8119-25.
- Zhou G, Zhou Y, Chen R, Wang D, Zhou S, Zhong J, et al. The influencing factors of infectious complications after percutaneous nephrolithotomy: a systematic review and meta-analysis. Urolithiasis 2022;51(1):17. https://doi.org/10.1007/s00240-022-01376-5.
- Danilovic A, Torricelli FCM, Marchini GS, Batagello C, Vicentini FC, Traxer O, et al. Residual stone fragments after percutaneous nephrolithotomy: shockwave lithotripsy vs retrograde intrarenal surgery. J Endourol 2021;35(5):609-14. https://doi.org/10.1089/end.2020.0868.
- Barba HS, Villeda-Sandoval CI, Mendez-Probst CE. Frequency and risk factors for antegrade ureteral stone migration after percutaneous nephrolithotomy. Cent European J Urol 2020;73(3):355-61. https://doi.org/10.5173/ceju.2020.0023.
- Ziemba JB, Matlaga BR. Epidemiology and economics of nephrolithiasis. Investig Clin Urol 2017;58(5):299-306. https://doi.org/10.4111/icu.2017.58.5.299.
- Roberson D, Sperling C, Shah A, Ziemba J. Economic considerations in the management of nephrolithiasis. Curr Urol Rep 2020;21(5):18. https://doi.org/10.1007/s11934-020-00971-6.
- Loftus TJ, Filiberto AC, Li Y, Balch J, Cook AC, Tighe PJ, et al. Decision analysis and reinforcement learning in surgical decision-making. Surgery 2020;168(2):253-66. https://doi.org/10.1016/j.surg.2020.04.049.
- Henn J, Buness A, Schmid M, Kalff JC, Matthaei H. Machine learning to guide clinical decision-making in abdominal surgery-a systematic literature review. Langenbecks Arch Surg 2022;407(1):51-61. https://doi.org/10.1007/s00423-021-02348-w.
- Zou XC, Luo CW, Yuan RM, Jin MN, Zeng T, Chao HC. Develop a radiomics-based machine learning model to predict the stone-free rate post-percutaneous nephrolithotomy. Urolithiasis 2024;52(1):64. https://doi.org/10.1007/s00240-024-01562-7.
- Щамхалова К.К., Меринов Д.С., Артемов А.В., Гурбанов Ш.Ш., Инамов Р.Р., Аполихин О.И., Каприн А.Д. Искусственный интеллект для персонализированного подхода к перкутанной нефролитотрипсии. Экспериментальная и клиническая урология 2024;17(1):24-34. [Shchamkhalova K.K., Merinov D.S., Artemov A.V., Gurbanov Sh.Sh., Inamov R.R., Apolikhin O.I., Kaprin A.D. Artificial intelligence for a personalized approach to percutaneous nephrolithotripsy. Eksperimentalnaya i Klinicheskaya urologiya = Experimental and Clinical Urology 2024;17(1):24-34. (In Russian)]. https://doi.org/10.29188/2222-8543-2024-17-4-24-34.
- Guo HQ, Shi HL, Li XG, Gan WD, Zeng LQ, Liu GX, et al. Relationship between the intrapelvic perfusion pressure in minimally invasive percutaneous nephrolithotomy and postoperative recovery. ZhonghuaWai Ke Za Zhi 2008;46(1):52-4.
- Guohua Z, Wen Z, Xun L, Wenzhong C, Yongzhong H, Zhaohui H, et al. The influence of minimally invasive percutaneous nephrolithotomy on renal pelvic pressure in vivo. Surg Laparosc Endosc Percutan Tech 2007;17(4)307-10. https://doi.org/10.1097/SLE.0b013e31806e61f4.
- Lorenzo Soriano L, Ordaz Jurado DG, Pérez Ardavín J, Budía Alba A, Bahílo Mateu P, Trassierra Villa M, López Acón D. Predictive factors of infectious complications in the postoperative of percutaneous nephrolithotomy. Actas Urol Esp (Engl Ed) 2019;43(3):131-6. https://doi.org/10.1016/j.acuro.2018.05.009.
- Torricelli FCM, Monga M. Staghorn renal stones: what the urologist needs to know. Int Braz J Urol 2020;46(6):927-33. https://doi.org/10.1590/s1677-5538.ibju.2020.99.07.
- Ganpule AP, Shah DH, Desai MR. Postpercutaneous nephrolithotomy bleeding: aetiology and management. Curr Opin Urol 2014;24(2):189-94. https://doi.org/10.1097/MOU.0000000000000025.
- Poudyal S. Current insights on haemorrhagic complications in percutaneous nephrolithotomy. Asian J Urol 2022;9(1):81-93. https://doi.org/10.1016/j.ajur.2021.05.007.
- Ершов А.В., Неймарк А.И., Капсаргин Ф.П., Бережной А.Г., Винник Ю.Ю. Использование нейронных алгоритмов при выборе метода оперативного лечения мочекаменной болезни. Урология 2021;(4):47-52. [Ershov A.V., Neymark A.I., Kapsargin F.P., Berezhnoy A.G., Vinnik Y.Y. The use of neural algorithms when choosing a method of surgical treatment of urolithiasis. Urologiya = Urologiia 2021;(4):47–52. (In Russian)]. https://doi.org/10.18565/urology.2021.4.47-52.
- Коцарь А.Г., Серёгин С.П., Новиков А.В. Автоматизированная система поддержки принятия решений уролога по прогнозированию и профилактике камнеобразования при мочекаменной болезни. Урология 2013;(5):16-20. [Kotsar A.G., Seregin S.P., Novikov A.V. Automated urologist decision support system for the prediction and prevention of stone formation in urolithiasis. Urologiya = Urologiia 2013;(5):16-20. (In Russian)].
- Zhu XH, Yang MY, Xia HZ, He W, Zhang ZY, Liu YQ, et al. Application of machine learning models in predicting early stone free rate after flexible ureteroscopic lithotripsy for renal stones. Beijing Da Xue Xue Bao Yi Xue Ban 2019;51(4):653-9. https://doi.org/10.19723/j.issn.1671-167X.2019.04.010.
- Seckiner I, Seckiner S, Sen H, Bayrak O, Dogan K, Erturhan S. A neural network – based algorithm for predicting stone-free status after ESWL therapy. Intl Braz J Urol 2017;43(6):1110-4. https://doi.org/10.1590/S1677-5538.
- Ханов А.М., Гусев А.В., Тюрганов А.Г. Искусственный интеллект в здравоохранении России: сбор и подготовка данных для машинного обучения. Российский журнал телемедицины и электронного здравоохранения 2023;9(4):7-13. [Khanov A.M., Gusev A.V., Tyurganov A.G. Artificial intelligence in Russian healthcare: data collection and preparation for machine learning. Rossiyskiy zhurnal telemeditsiny i elektronnogo zdravookhraneniya = Russian Journal of Telemedicine and Electronic Health 2023;9(4):7-13. (In Russian)]. https://doi.org/10.29188/2712-9217-2023-9-4-7-13.
- Пранович А.А., Исмаилов А.К., Карельская Н.А., Костин А.А., Кармазановский Г.Г., Грицкевич А.А. Искусственный интеллект в диагностике и лечении мочекаменной болезни. Российский журнал телемедицины и электронного здравоохранения 2022;8(1)42-57. [Pranovich A.A., Ismailov A.K., Karelskaya N.A., Kostin A.A., Karmazanovsky G.G., Gritskevich A.A. Artificial intelligence in the diagnosis and treatment of urolithiasis. Pranovich A.A., Ismailov A.K., Karelskaya N.A., Kostin A.A., Karmazanovsky G.G., Gritskevich A.A. Artificial intelligence in the diagnosis and treatment of urolithiasis. Russian Journal of Telemedicine and Electronic Health = Russian Journal of Telemedicine and Electronic Health 2022;8(1)42-57. (In Russian)]. https://doi.org/10.29188/2712-9217-2022-8-1-42-57.







