Мочекаменная болезнь (МКБ), или уролитиаз, является одним из наиболее распространенных урологических заболеваний. Уролитиаз относится к полиэтиологичным заболеваниям со сложными физико-химическими процессами, происходящими не только в мочевой системе, но и в целом в организме, как врожденного, так и приобретенного характера. Известно более 200 состояний, которые потенциально могут приводить к образованию камня в мочевой системе. В связи с широкой распространенностью и большой частотой повторного камнеобразования мочекаменную болезнь по праву считают болезнью цивилизации [1].
Современная урология обладает множеством способов лечения больных уролитиазом. Все реже сегодня применяются открытые способы удаления камней. Они уступают место дистанционной ударно-волновой литотрипсии и эндоскопическим методам лечения: контактному эндоскопическому и чрескожному удалению камней почек и мочевых путей.
Внедрение новых малоинвазивных технологий, бесспорно, внесло существенный вклад в эффективность удаления мочевых камней, минимизировав количество травматических осложнений. Однако ни один из этих методов не является методом лечения мочекаменной болезни и не дает гарантии полного выздоровления больного, а нередко привносит дополнительные негативные факторы для развития рецидива заболевания.
В связи с этим вопросы профилактики последующих рецидивов в настоящее время становятся приоритетным направлением в лечении больных мочекаменной болезнью.
Мочевые камни могут иметь различный состав. В табл. 1 приведена их минералогическая классификация. Среди всех видов уролитиаза кальцийоксалатный занимает первое место по частоте встречаемости и обнаруживается в 75-85% случаев болезни.
МЕТАБОЛИЧЕСКИЕ НАРУШЕНИЯ
Развитие МКБ зависит от наличия многих факторов. К ним относятся: нарушение обмена веществ, хронические инфекции верхних мочевых путей и наследственные заболевания. Наиболее часто при нефролитиазе выявляются следующие метаболические нарушения: гиперкальциурия (36,760,9%), гиперурикурия (23-35,8%), гипоцитратурия (28-44,3%), гиперокса-лурия (8,1-32%) и гипомагниурия (6,8-19%) [2-5].
Как правило, гиперкальциурия сочетается с гипероксалурией [6]. Причем последнюю, наряду с гипоцитратурией, некоторые авторы признают более важным метаболическим фактором риска развития кальций-оксалатного уролитиаза, чем гиперкальциурию [7].
Под гипероксалурией понимают повышение экскреции оксалатов с мочой более 40 мг/сут. Различают три механизма развития гипероксалурии:
1. Повышенное потребление продуктов питания, богатых оксалатом и аскорбиновой кислотой, а также низкое потребление кальция (пищевая гипероксалурия).
2. Повышенная экскреция оксалата с мочой у больных с синдромом мальабсорбции, воспалительными заболеваниями кишечника (энтеральная гипероксалурия).
3. Наследственное заболевание, связанное со снижением активности аланил-глиоксилат-аминотрансферазы (первичная гипероксалурия).
После всасывания в кишечнике оксалаты поступают в кровь и затем выводятся почками. В моче они связываются магнием и натрием. Экскреция оксалатов максимальна днем, так как человек в это время потребляет продукты, в составе которых есть эти литогенные вещества. Оксалаты – конечные продукты нормального метаболизма человека, но они также содержатся в различных продуктах (преимущественно в растительных). При соединении аниона щавелевой кислоты с катионом кальция образуется плохо растворимая соль – оксалат кальция, которая существует в виде моногидрата (вевеллит) или дигидрата (ведделлит). Перенасыщение этими солями – важнейшее условие камнеобразования, так как их растворимость не зависит от pH мочи [8].
Условно оксалат в сыворотке крови можно разделить на экзогенный, который абсорбируется в желудочнокишечном тракте, и эндогенный, образованный в результате процессов метаболизма глиоксиловой и аскорбиновой кислот. В организме человека вклад алиментарного оксалата в общую экскрецию мочи составляет 10-15%, остальное количество приходится на эндогенный оксалат (рис. 1).
Воздействие пищевых оксалатов на уровень экскреции щавелевой кислоты с мочой зависит от потребления кальция. В нескольких популяционных исследованиях выявлена обратная зависимость между количеством потребляемого кальция и риском образования камней. Так, по данным проспективного исследования Curhan G. и соавт. [9], включавшего 45000 мужчин, низкое потребление кальция (менее 850 мг/сут) достоверно повышало риск образования камней в почках. Защитный эффект кальция, по мнению авторов, обусловлен тем, что он связывает оксалаты и фосфаты в кишечнике, предотвращая их избыточную экскрецию с мочой, способствующую формированию конкрементов.
Одним из распространенных методов профилактики образования кальций-оксалатных камней является снижение количества оксалата, поступающего с пищей. Однако диетическое ограничение оксалата не может быть надежным методом предупреждения развития кальций-оксалатного уролитиаза. В связи с этим некоторые авторы предложили концепцию, которая за-ключается в снижении абсорбции оксалата в желудочно-кишечном тракте.
В последнее время получены результаты, свидетельствующие о влиянии грамотрицательного облигатного анаэроба Oxalobacter formigenes на концентрацию оксалата в моче. Эта бактерия проявляет симбиотические отношения с организмом человека путем снижения абсорбции оксалатов в просвете кишечника с дальнейшим снижением их концентрации в плазме и моче. Для организма человека характерны две группы штаммов Oxalobacter formigenes: I группа – HC1 и II группа – BA1, OxK, HOxBLS, HOxRW. Данный микроорганизм использует в процессе своей жизнедеятельности экзогенный оксалат в качестве источника энергии для своего выживания. Oxalobacter formigenes имеет два ключевых фермента – оксалил-КоАдекарбоксилаза и формил-КоАтрансфераза. Именно эти ферменты осуществляют метаболические превращения оксалата в просвете толстой кишки (рис. 2).
Первыми исследователями, которым удалось определить O. formigenes, были Dawson K. и Allison M. Они обнаружили штамм OxB, полученный из рубца овцы [11]. В человеческих фекалиях штаммы O. formigenes были впервые идентифицированы и описаны Allison M. в 1985 году [12]. Одним из первых способов определения микроба был культуральный метод, который базировался на измерении зон просветлений в среде, обогащенной оксалатом [12]. Также использовался метод, основанный на фотометрии, позволяющий косвенно судить о наличии бактерии. Этот способ заключался в количественном определении хлорида кальция в селективных средах [13].
Таблица 1. Минералогическая классификация мочевых камней
Химическая формула |
Наименование минералогическое |
Наименование химическое |
Оксалатные камни |
||
| CaC2O4бH2O | Вевеллит | Оксалат кальция моногидрат |
| CaC2O4б2H2O | Ведделлит | Оксалат кальция дигидрат |
Фосфатные камни а) апатиты |
||
| Ca5(PO4)3OH | Гидроксиапатит | Гидроксофосфат кальция |
| Ca5(PO4)3(CO3)0,5 | Карбонатапатит | Карбон-фосфат кальция |
| Ca4H(PO4)3 | Октакальций фосфат | Фосфат кальция-водорода |
б) другие фосфаты |
||
| Ca3(PO4)2 | Витлокит | Фосфат кальция |
| CaHPO4б2H2O | Брушит | Гидрогенфосфат кальция |
| MgHPO4б3H2O | Ньюберит | Гидрогенфосфат магния тригидрат |
| Mg3(PO4)2б8H2O | Бобьеррит | Фосфат магния октагидрат |
| MgNH4PO4б6H2O | Струвит | Фосфат магния-аммония гексагидрат |
| Zn3(PO4)2б4H2O | Гопеит | Тетрагидрат фосфата цинка |
Уратные камни |
||
| C5H4O3N4 | Урикит | Мочевая кислота безводная |
| C5H4O3N4б2H2O | Мочевая кислота дигидрат | |
| NH4C5H3O3N4 | Кислый урат аммония | |
| (NH4)2C5H2O3N4 | Кислый урат диаммония | |
| Na2C5H2O3N4бH2O | Кислый урат натрия моногидрат | |
| NaC5H3O3N4бH2O | Кислый урат натрия моногидрат | |
Другие органические камни |
||
| C5H4O2N4 | Ксантин | |
| C5H4ON4 | Гипоксантин | |
| C6H5O2N5 | 2,8-дигидроксиаденин | |
| SCH2CH(NH2)COOH | Цистин | |
Другие неорганические камни |
||
| CaCO3 | Кальцит, арагонит | Карбонат кальция |
| CaSO4б2H2O | Гипс | Сульфат кальция |
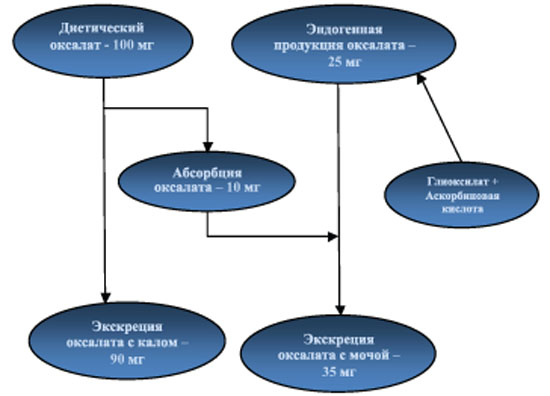
Рис.1. Суточный метаболизм оксалата при ежедневном потреблении 800-1000 мг кальция
На смену культуральному методу пришел новый метод – ПЦР в режиме реального времени, который впервые был оценен Sidhu H. и соавт. при исследовании у здоровых лиц [14]. ПЦР основывается на определении гена фермента оксалил-КоАдекарбоксилазы и формил-КоАтрансферазы в образцах кала. Авторы показали, что данный способ характеризуется большей чувствительностью и специфичностью по сравнению с культуральным методом. Также было отмечено, что ПЦР обеспечивает наиболее быструю идентификацию O. formigenes, выделенных из просвета кишечника.
Местом обитания анаэроба является толстая кишка. Колонизация происходит в течение жизни, а не с самого рождения. До сих пор остается неясным, каким образом происходит заселение кишечника этим микроорганизмом. Анализы кала мальчиков 6-8 лет почти все дают положительные результаты на O. formigenes.Снижение колонизации происходит в зрелом возрасте. У 20-40% здоровых взрослых людей этот микроорганизм не обнаруживается [13]. Мало известно, при каких условиях человек подвергается колонизации данной бактерией. Распространенность O. formigenes колеблется от 46% до 77% среди взрослого населения [15].
Не являясь патогенными для организма человека, О. formigenes устанавливает симбиоз, используя оксалаты в качестве источника питания, вследствие чего у человека снижается абсорбция оксалатов в просвете толстой кишки. O. formigenes отведена уникальная роль, которая заключается в ежедневном катаболизме от 70-100 мг оксалата, поступающего с пищей [16].
Доказано, что именно алиментарный оксалат является субстратом для поддержания колонизации O. formigens в кишечнике при условии соблюдения диеты с пониженным содержанием кальция [17].
Отсутствие или низкая колонизация O. formigenes в составе кишечной флоры способствует повышенной абсорбции алиментарного оксалата в просвете толстого кишечника, тем самым вызывая гипероксалурию, которая является предрасполагающим фактором образования кальций-оксалатных камней.
Данные различных авторов показывают прямую зависимость между уровнем экскреции оксалата с мочой и колонизацией O. formigenes. Так, Gnanandarajah J. и соавт. исследовали образцы кала здоровых и больных кальций-оксалатным уролитиазом собак на предмет колонизации анаэробом [18]. Результаты показали, что колонизация имеется у 25% собак, с МКБ, против 75% у здоровых собак. Авторы предположили, что отсутствие колонизации O. formigenes является предрасполагающим фактором для развития кальций-окслатного уролитиаза.
В эксперименте изучалось влияние микроба на выраженность уровня экскреции оксалата у колонизированных и неколонизированных крыс с учетом кальциевой диеты. Животным назначалась диета, содержащая 1,5% оксалата с различной концентрацией кальция – 0,01%, 0,5%, 1,2%, в течение 30 дней. У крыс, колонизированных O. formigenes, экскреция оксалата с мочой была достоверно ниже, чем у неколонизированных, при диете с 0,5% содержанием кальция. Также было отмечено, что колонизация поддерживалась у крыс только при низко-кальциевой (0,01%) и умеренно-оксалатной диете (0,5%) [19].
В другом исследовании крысы были колонизированы с рождения и им назначалась 1% оксалатная диета [17]. Они показали снижение уровня экскреции оксалата в моче на 35% по сравнению с неколонизированными крысами при той же диете.
Исследование Duncan S. и соавт. на добровольцах показало, что после приема 500 мг O. formigenes уровень экскреции снизился с 3 мг/ч до 1,9 мг/ч при назначении одинаковой оксалатной диеты в количестве 2 ммоль оксалата/70 кг массы тела [20].
Многие исследования показали низкую частоту встречаемости O. formigenes у больных с оксалатным уролитиазом (26-46%), по сравнению со здоровыми (60-77%) [14, 16].
В опытах на крысах M. Hatch и соавт. доказали, что, помимо влияния на абсорбцию оксалата, O. formigenes индуцируют его секрецию в просвете толстой кишки, тем самым вызывая снижение концентрации эндогенного и алиментарного оксалата в моче [17].
У больных с первичной гипероксалурией назначение внутрь O. formigenes в течение одного месяца приводило к снижению экскреции оксалатов в моче. А применение этого микроорганизма у детей с наследственным оксалозом показало, что гипероксалурия значительно уменьшалась [21, 22].
Известно, что прием ряда определенных антибиотиков влияет на сохранность O. formigenes в толстой кишке.
Lange J. и соавт. в своей работе изучали чувствительность штаммов O. formigenes к антибиотикам, которые наиболее часто применяются в лечении различных заболеваний. Были исследованы штаммы: HC1, Va3, CC13 и OxK. Все 4 штамма продемонстрировали равную устойчивость к амоксицилину, цефтриаксону, ванкомицину, а также одинаковую чувствительность к ципрофлоксацину, кларитромицину, азитромицину, клиндамицину, доксицилину, гентамицину, левофлоксацину, метранидазолу и тетрациклину. Авторы отмечают, что попытки повторной колонизации имеют переменный успех [23].
В исследовании Kharlamb V. и соавт. доказано влияние антибактериального лечения на колонизацию O. formigenes у пациентов, имеющих H. pylori-ассоциированную инфекцию. У больных, принимавших комбинацию антибиотиков амоксицилин/кларитромицин двухнедельным курсом, колонизация спустя месяц снизилась со 100% до 37,5% и восстановилась до 43,8% на 6-й месяц. У другой группы пациентов после курса приема метранидазол/тетрациклин через месяц была потеря колонизации порядка 50% и полная утрата к 6-у месяцу, в то время как после назначения комбинации антибиотиков метронидазол/кларитромицин колонизация O. formigenes отсутствовала, спустя 1 и 6 месяцев соответственно [24].
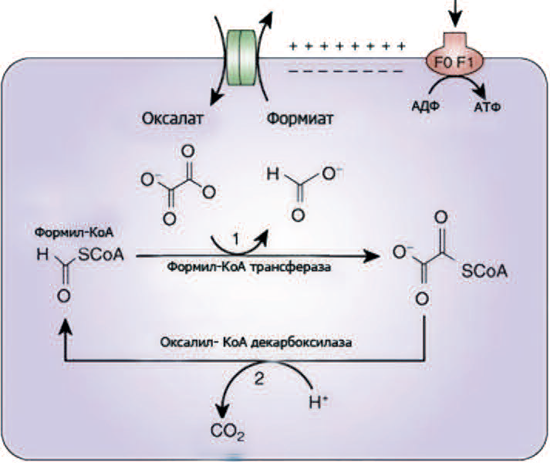
Рис. 2. Метаболизм оксалата бактерией O. Formigenes [10]
Кроме того выяснено, что прием кальция и оксалата с пищей влияет как на колонизацию O. formigenes, так и на выраженность гипероксалурии. Jiang J. и соавт. подтвердили, что при ежедневном потреблении повышенного количества кальция (2 г) достоверно снижался уровень экскреции оксалата с мочой по сравнению с этой же группой, где потребление кальция было меньше (1 г и 0,4 г). Также отмечалось снижение колонизации O. formigenes у пациентов, получавших кальций в повышенном количестве. Однако, при назначении диеты с высоким содержанием оксалата (0,75 г) наблюдался рост O. formigenes. Уровень экскреции оксалата с мочой был ниже у группы пациентов с O. formigenes при низком потреблении кальция (0,4 г) и умеренном потреблении оксалата (0,2 г) [25].
ЗАКЛЮЧЕНИЕ
Таким образом, предварительные результаты применения Oxalobacter formigenes свидетельствуют о снижении гипероксалурии как одного из важных обменных нарушений при кальций-оксалатном уролитиазе. Изучение колонизации толстой кишки этим микрооорганизмом и ее коррекция, возможно, улучшат результаты противорецидивной терапии оксалатного уролитиаза.
ЛИТЕРАТУРА
1. Тиктинский О.Л., Александров В.П. Мочекаменная болезнь. СПб: Питер, 2000. С. 384.
2. Паронников М.В., Протощак В.В. Диагностика метаболических нарушений у больных с мочекаменной болезнью. // Материалы пленума правления Российского общества урологов, 7-9 сентября 2011 г. Москва, 2011. С. 369-370.
3. Levy FL, Adams-Huet B, Pak CY. Ambulatory evaluation of nephrolithiasis: an update of a 1980 protocol. // Am J Med. 1995. Vol. 98. P. 50–59.
4. Hess B, Hasler-Strub U, Ackermann D, Jaeger P. Metabolic evaluation of patients with recurrent idiopathic calcium nephrolithiasis. // Nephrol Dial Transplant. 1997. Vol. 12. P. 1362–1368.
5. Pak CY, Poindexter JR, Adams-Huet B, Pearle MS. Predictive value of kidney stone composition in the detection of metabolic abnormalities. // Am J Med. 2003. Vol. 115. P. 26–32.
6. Neuhaus TJ, Belzer T, Blau N, Hoppe B, Sidhu H, Leumann E. Urinary oxalate excretion in urolithiasis and nephrocalcinosis. // Arch Dis Child. 2000. Vol. 82. P.322–326.
7. Tekin A, Tekgul S, Atsu N. Sahin A, Ozen H, Bakkaloglu M. A study of the etiology of idiopathic calcium urolithiasis in children: hypocitruria is the most important risk factor. // J Urol. 2000. Vol. 164, N 1. P. 162–165
8. Златопольски Э. Патофизиология обмена кальция, магния и фосфора // Почки и гомеостаз в норме и при патологии: Пер. с англ. [Под ред. С. Клара]. М.: Медицина, 1987. С. 217-278.
9. Curhan GC, Willett WC, Rimm EB, Rimm EB, Stampfer MJ. A prospective study of dietary calcium and other nutrients and the risk of symptomatic kidney stones. // N Engl J Med. 1993. Vol. 328, N12. P. 833–838.
10. Siva S, Barrack ER, Reddy GP,Thamilselvan V, Thamilselvan S, Menon M, Bhandari M. A critical analysis of the role of gut Oxalobacter formigenes in oxalate stone disease. // BJU Int. 2009. Vol. 103, N 1. P. 18-21.
11. Dawson KA, Allison MJ, Hartman PA. Isolation and some characteristics of anaerobic oxalate-degrading bacteria from the rumen. // Appl Environ Microbiol. 1980. Vol. 40, N 4. P. 833–839.
12. Allison MJ, Dawson KA, Mayberry WR, Foss JG. Oxalobacter formigenes gen. nov., sp. nov.: oxalate-degrading anaerobes that inhabit the gastrointestinal tract. // Arch Microbiol. 1985. Vol. 141. P. 1–7.
13. Sidhu HL, Enatska L, Ogden S, Williams WN, Allison MJ, Peck AB. Evaluating children in the Ukraine for colonization with the intestinal bacterium Oxalobacter formigenes, using a polymerase chain reaction detection system. // Mol Diagn. 1997. Vol. 2. P. 89–97.
14. Sidhu H, Schmidt ME, Cornelius JG, amilselvan S, Khan SR, Hesse A, Peck AB. Direct correlation between hyperoxaluria/oxalate stone disease and the absence of the gastrointestinal tract-dwelling bacterium Oxalobacterformigenes: possible prevention by gut recolonization or enzyme replacement therapy. // J Am Soc Nephrol. 1999. Vol. 10. P. 334–340.
15. Pearle MS, Calhoun EA, Curhan GC. Urologic diseases in America project: Urolithiasis. // J Urol. 2005. Vol. 173. P. 848–857.
16. Mittal RD, Kumar R. Gut-inhabiting bacterium Oxalobacter formigenes: Role in calcium oxalate urolithiasis. // J Endourol. 2004. Vol. 18, N 5. P. 418–424.
17. Hatch M, Cornelius J. Oxalobacter sp. reduces urinary oxalate excretion by promoting enteric oxalate secretion. // Kidney Internat. 2006. Vol. 69. P. 691–698.
18. Gnanandarajah JS, Abrahante JE, Lulich JP, Murtaugh MP. Presence of Oxalobacter formigenes in the intestinal tract is associated with the absence of calcium oxalate urolith formation in dogs. // Urol Res. 2012. Vol. 113, N 4. P. 745–756.
19. Sidhu H, Allison MJ, Chow JM, Clark A, Peck AB. Rapid reversal of hyperoxaluria in a rat model aer probiotic administration of oxalobacter formigenes. // J Urol. 2001. Vol. 166. P. 1487–1491
20. Duncan SH, Richardson AJ, Kaul P, Holmes RP, Allison MJ, Stewart CS. Oxalobacter formigenes and its potential role in human health. // Appl Environ Microbiol. 2002. Vol. 68. P. 3841–3847.
21. Hoppe B, Dittlich K, Fehrenbach H, Plum G, Beck BB. Reduction of plasma oxalate levels by oral application of Oxalobacter formigenes in 2 patients with infantile oxalosis. // Am J Kidney Dis. 2011. Vol. 58. P. 453-455.
22. Hoppe B, von Unruh G, Laube N, Laube N, Hesse A, Sidhu H. Oxalate degrading bacteria: new treatment option for patients with primary and secondary hyperoxaluria? // Urol Res. 2005. Vol. 33, N 5. P. 372-375.
23. Lange JN, Wood KD, Wong H, Otto R, Mufarrij PW, Knight J, Akpinar H, Holmes RP, Assimos DG. Sensitivity of human strains of Oxalobacter formigenes to commonly prescribed antibiotics. // Urol. 2012. Vol. 79, N 6. P. 1286-1289.
24. Kharlamb V, Schelker J, Francois F, Jiang J, Holmes RP, Goldfarb DS. Oral Antibiotic Treatment of Helicobacter pylori Leads to Persistently Reduced Intestinal Colonization Rates with Oxalobacter formigenes. // J Endourol. 2011. Vol.
25. P. 1781-1785. 25. Jiang J, Knight J, Easter LH, Neiberg R, Holmes RP, Assimos DG. Impact of dietary calcium and oxalate, and oxalobacter formigenes colonization on urinary oxalate excretion. // J Urol. 2011. Vol. 186, N 1. P. 135–139.






